外源物质对油茶花粉萌发和花粉管生长的影响
徐金铭, 常毅洪, 龚 涵, 龚文芳, 袁德义
(中南林业科技大学 林学院,湖南 长沙 410004)
油茶(CamelliaoleiferaAbel.)是山茶科山茶属常绿小乔木,是我国南方特有的重要木本油料树种,与油棕、油橄榄和椰子并称为世界四大木本食用油料植物[1]。在开花植物中,落在柱头上的花粉萌发和花粉管在雌蕊组织中的生长是植物有性繁殖的关键[2]。授粉成功是双受精的先决条件。花粉落到柱头后,花粉会附着、水合并萌发花粉管[3]。花粉管通过柱头细胞和花柱向胚珠生长,来自胚珠的吸引信号引导花粉管沿着株柄生长并进入胚珠的珠孔,最后,花粉管在退化的助细胞中停止生长,然后破裂释放出两个精细胞进行双受精[4]。体外花粉萌发提供了一种新的方法和策略来加速树木育种的遗传改良[5]。据报道,花粉萌发和花粉管生长会受到许多内部和外部因素的影响[6]。影响花粉萌发的外在因素包括培养时间、温度、湿度、培养基成分、pH值等[7-11],蔗糖、硼酸、激素、Ca2+、硝酸钙、硝酸钾和硫酸镁等有机和无机物质对花粉的体外萌发有影响[5,12-13]。此外,一氧化氮(NO)在植物发育过程中的许多生物和非生物胁迫中发挥着重要作用,包括花粉管生长[14]。活性氧(reactive oxygen species,ROS)也调节植物的许多发育过程,如细胞增殖和分化、种子萌发、程序性细胞死亡、向地性、根毛发育、衰老等[15]。上述各物质对油茶花粉萌发的影响鲜见报道。因此,本文探讨了外源激素赤霉素(GA3)、生长素(NAA)、乙烯利(ETH)、矿质元素(Ca2+、Mg2+)、一氧化氮(NO)和活性氧(ROS)对油茶花粉萌发和花粉管生长的影响,研究结果将为调控油茶花粉萌发提供理论依据和实践指导。
1 材料与方法
1.1 试验材料
试验材料采于湖南省长沙市望城区中南林业科技大学油茶试验基地。该地区气候属亚热带季风气候,年平均气温19.3 ℃,年平均降雨量1 380 mm,日照和热量充足,雨量充裕。供试品种为‘华硕’。2020年11月采集花药开裂前1~2 d的带花枝条,置于室内水培待用,含苞欲放时,用消毒的镊子取出新鲜花药置于硫酸纸袋中,放在25 ℃恒温培养箱烘12 h,再将散出的花粉收集起来放入医用的洁净青霉素小瓶中,于4 ℃冰箱保存待用[16-17]。
1.2 试验方法
1.2.1 外源物质浓度配置
采取琼脂培养基萌发法[18],以100 g·L-1蔗糖、10 g·L-1琼脂、0.1 g·L-1H3BO3作为花粉离体培养的基本培养基(对照,CK)。配置不同质量浓度的溶液,GA3、NAA、乙烯利各设置3个质量浓度梯度,分别为0.5、5、50 mg·L-1;MgSO4设置3个质量浓度梯度,分别为10、30、50 mg·L-1;CaCl2·2H2O设置3个质量浓度梯度,分别为50、150、450 mg·L-1;EGTA(乙二醇二乙醚二胺四乙酸)设置4个浓度梯度,分别为200、400、600、800 μmol·L-1;SNP(硝普钠)和L-NNA(N′-硝基-L-精氨酸)设置3个浓度梯度,分别为100、200、300 μmol·L-1;H2O2和NAC(N-乙酰-L-半胱氨酸)设置3个浓度梯度,分别为100、300、500 μmol·L-1。
1.2.2 花粉离体培养
参照文献[19]的方法,在天平上称取所需培养基材料,倒入锥形瓶中并依次标记,然后加入定量蒸馏水,加热煮沸至内容物充分溶解,室温冷却至50 ℃左右后,加入计算好的每种药物母液的体积,用玻璃棒搅拌使药物溶液与培养基充分混合,然后倒入培养皿中。当培养基变成固体后,用干净毛刷蘸取少许花粉均匀撒于培养基表面,然后在25 ℃恒温培养箱中避光培养2 h。每个处理设置3个重复。2 h后,使用BX-53显微镜(Olympus,Tokyo,Japan)监测花粉萌发。每个样品(培养皿)随机选择5个光场,每个光场包含不少于50个花粉粒[16,20]。之后,每隔2 h在显微镜下观察花粉管长度,直至24 h。花粉萌发的标准是花粉管的长度超过花粉粒的直径。
γ=(n/N)×100%。
式中:γ为发芽率,n为花粉萌发数,N为花粉总数。
1.2.3 正交法优化培养基成分
基于单因素试验结果,选取对普通油茶花粉萌发影响较大的处理进行正交试验,试验因素水平见表1。以正交表L10(34)安排试验,来确定花粉萌发培养基中各种组分的最佳浓度组合。
1.3 数据处理
使用图像处理软件Image J来测量花粉管长度;试验数据用Microsoft Excel 2016软件整理,用Origin 2021软件绘制图表。使用SPSS 25.0软件进行单因素方差分析(ANOVA),在P≤ 0.05时使用Duncan的多重比较评估平均值之间的差异显著性。
2 结果与分析
2.1 不同外源物质对花粉萌发和花粉管生长的影响
2.1.1 植物生长调节剂
植物生长调节剂的直接作用对普通油茶的花粉萌发和花粉管生长有影响(表2)。与对照组萌发率(54.78%)相比,随着乙烯利质量浓度的升高,花粉萌发率逐渐降低,50 mg·L-1乙烯利处理的花粉萌发率最低(4.37%)。花粉萌发率随NAA质量浓度升高先升高后下降,0.5 mg·L-1NAA处理的花粉萌发率(71.29%)显著高于对照,50 mg·L-1NAA处理的花粉萌发率(2.86%)显著低于对照。0.5、5 mg·L-1GA3处理的花粉萌发率与对照无显著差异,50 mg·L-1GA3处理的花粉萌发率(4.90%)显著低于对照。
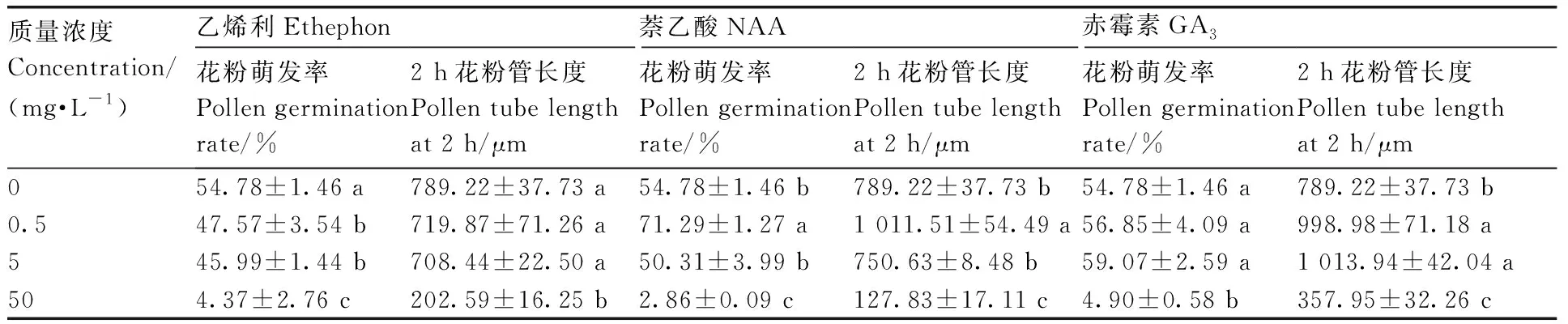
表2 不同植物生长调节剂处理下油茶花粉萌发率与花粉管长度Table 2 Pollen germination rate and pollen tube length of C. oleifera under different plant growth regulator treatments
培养2 h后对照组花粉管长度为789.22 μm,50 mg·L-1乙烯利、NAA和GA3的培养基中,2 h后花粉管的平均长度最小,分别为202.59 μm、127.83 μm和357.95 μm,显著小于对照。0.5、5.0 mg·L-1乙烯利处理的花粉管长度与对照组无显著差异,0.5 mg·L-1NAA处理的花粉管长度显著大于对照组,0.5、5.0 mg·L-1GA3处理的花粉管长度也显著大于对照组。
根据单因素试验的结果,选取每种植物生长调节剂促进或抑制效果最显著的浓度(0.5 mg·L-1NAA、5 mg·L-1GA3和50 mg·L-1乙烯利)进行处理,不同处理的油茶花粉管长度见图1。对照组在0~10 h花粉管生长最快,10 h后开始趋于缓慢,24 h花粉管长度为2 619.61 μm。50 mg·L-1乙烯利处理的花粉管生长十分缓慢,24 h的花粉管长度仅为392.21 μm。0.5 mg·L-1NAA和5 mg·L-1GA3处理的花粉管生长速率相近,0~12 h花粉管生长较快,12 h后开始趋于平缓,24 h花粉管长度分别为2 820.70、2 865.57 μm(图1)。在适当的浓度范围内,低质量浓度的GA3和NAA促进油茶花粉萌发和花粉管生长,而高浓度抑制,乙烯利的质量浓度越高,油茶花粉萌发率越低,花粉管长度越小。

图1 不同植物生长调节剂处理对油茶花粉管生长的影响Fig.1 Effects of different plant growth regulator on pollen tube growth of C. oleifera
2.1.2 矿质元素
外源矿质元素的直接作用对普通油茶的花粉萌发和花粉管生长有影响(表3)。与对照组萌发率(54.78%)相比,随着MgSO4、CaCl2·2H2O和EGTA浓度的升高,花粉萌发率逐渐降低,其中10 mg·L-1MgSO4处理的花粉萌发率显著高于对照组,50 mg·L-1MgSO4处理的花粉萌发率与对照组无显著差异;50 mg·L-1CaCl2·2H2O处理花粉萌发率显著高于对照组,450 mg·L-1CaCl2·2H2O处理的花粉萌发率显著低于对照组;200 μmol·L-1EGTA处理的花粉萌发率与对照组无显著差异,400~800 μmol·L-1EGTA处理的花粉萌发率显著低于对照组。
培养2 h后,对照组花粉管长度为789.22 μm,花粉管长度随着MgSO4、CaCl2·2H2O、EGTA浓度的提高而变小,10 mg·L-1MgSO4处理的花粉管平均长度最大,其次是50 mg·L-1CaCl2·2H2O处理,均显著大于对照组;200~800 μmol·L-1EGTA 处理的花粉管长度显著小于对照组。
根据单因素试验结果,选取每种矿质元素促进或抑制效果最显著的浓度(10 mg·L-1MgSO4、50 mg·L-1CaCl2·2H2O、800 μmol·L-1EGTA、800 μmol·L-1EGTA+50 mg·L-1CaCl2·2H2O共培养)进行处理,花粉管长度见图2。对照组在0~10 h花粉管生长最快,10 h后开始趋于缓慢,24 h花粉管长度为2 619.61 μm。10 mg·L-1MgSO4和50 mg·L-1CaCl2·2H2O处理的花粉管生长速率相近,0~8 h生长速率最快,8 h后趋于缓慢,24 h花粉管长度分别为2 809.56、2 770.11 μm。800 μmol·L-1EGTA 处理的花粉管0~2 h生长最快,但整体速率缓慢,24 h花粉管长度为1 061.06 μm。800 μmol·L-1EGTA+50 mg·L-1CaCl2·2H2O共培养处理在0~8 h花粉管生长速率比800 μmol·L-1EGTA处理的速率快,24 h的花粉管长度为1 311.04 μm,这说明Ca2+可以减轻EGTA对花粉管生长的抑制作用。

图2 不同矿质元素处理对油茶花粉管生长的影响Fig.2 Effects of different mineral elements on pollen tube growth of C. oleifera
综上,一定浓度的Mg2+和Ca2+促进油茶花粉萌发和花粉管生长,但浓度不宜过高,浓度过高反而会抑制。EGTA的浓度越高,油茶花粉萌发率越低,花粉管长度越小。
2.1.3 化合物
SNP、H2O2和NAC处理均能降低花粉萌发率,且随着浓度的升高,花粉萌发率逐渐降低;花粉萌发率随着L-NNA浓度升高先升高后下降,200 μmol·L-1L-NNA萌发率最高,显著大于对照组(表4)。
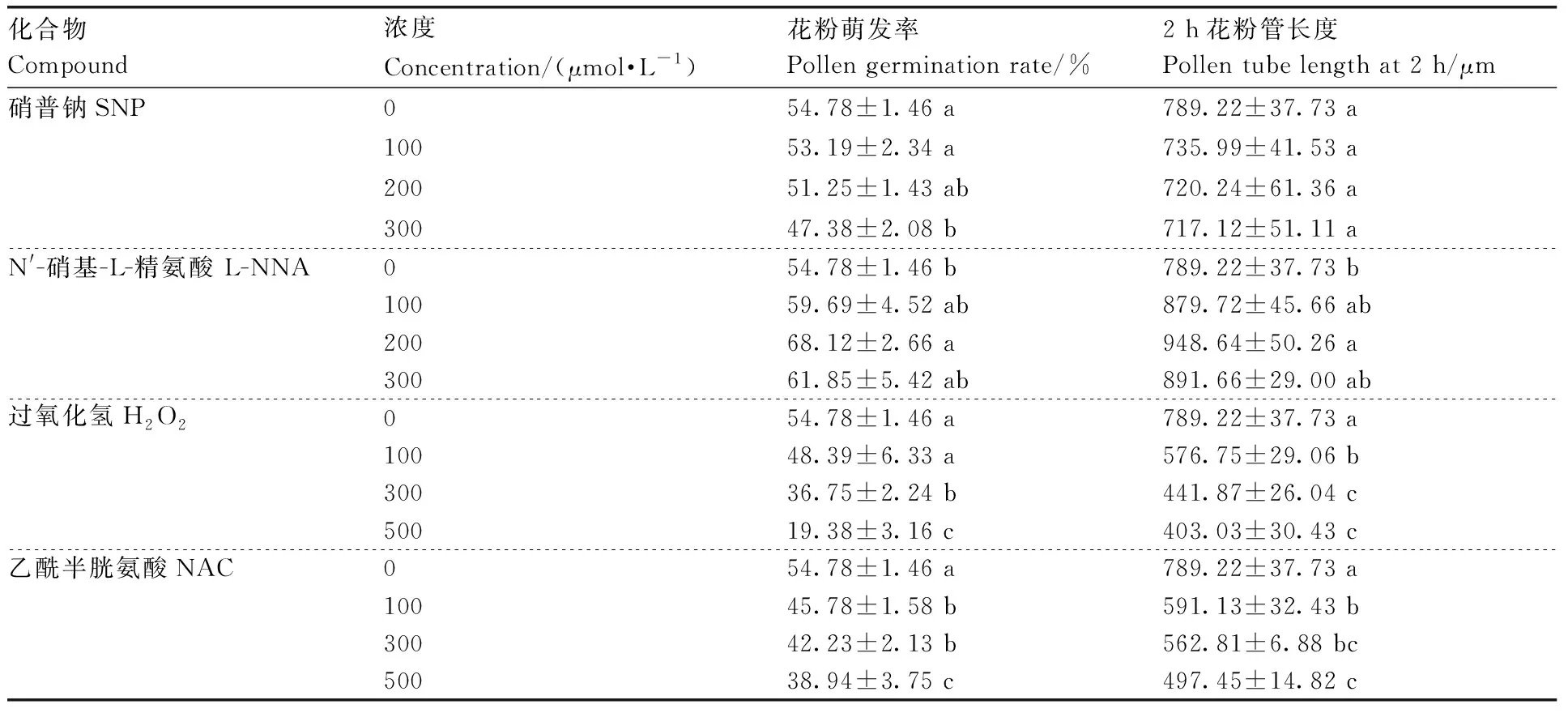
表4 不同化合物处理下油茶花粉萌发率与花粉管长度Table 4 Pollen germination rate and pollen tube length of C. oleifera under different compound treatments
培养2 h后,100~300 μmol·L-1SNP花粉管长度与对照组无显著差异,200 μmol·L-1L-NNA处理的花粉管长度显著大于对照组,100~500 μmol·L-1H2O2和NAC处理的花粉管长度均显著小于对照组。
根据单因素试验结果,选取每种外源化合物促进或抑制效果最显著的浓度(300 μmol·L-1SNP、200 μmol·L-1L-NNA、500 μmol·L-1H2O2和500 μmol·L-1NAC)进行处理,花粉管长度见图3。对照组在0~10 h花粉管生长最快,10 h后开始趋于缓慢,24 h花粉管长度为2 619.61 μm。300 μmol·L-1SNP、200 μmol·L-1L-NNA和500 μmol·L-1NAC处理的花粉管生长速率相近,均在0~6 h最快,之后略有降低,24 h的花粉管长度分别为2 410.99、2 726.66、2 253.19 μm。500 μmol·L-1H2O2处理的花粉管整体生长缓慢,24 h的花粉管长度为仅为878.71 μm,显著低于对照组(图3)。
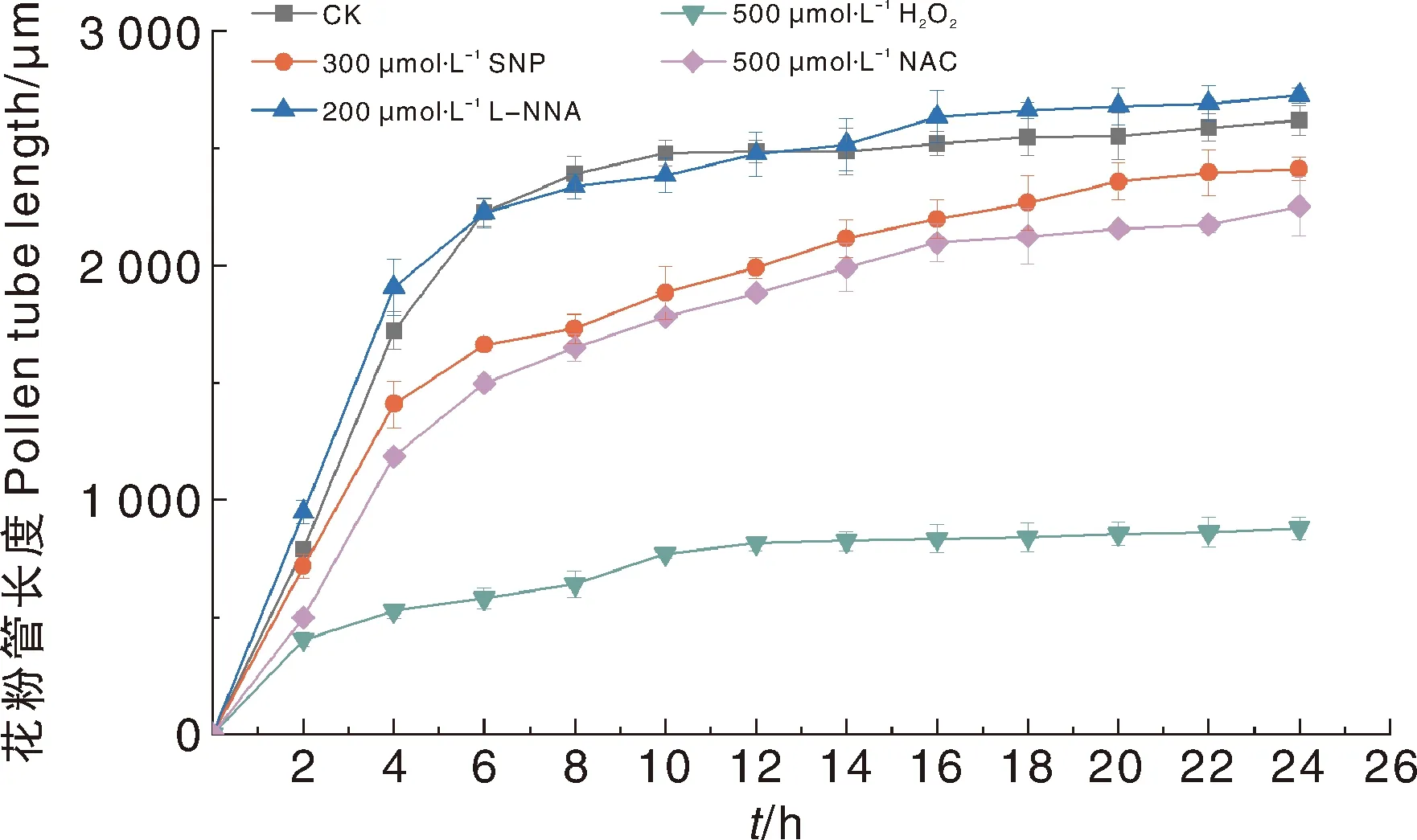
图3 不同化合物处理对油茶花粉管生长的影响Fig.3 Effect of different compounds on the pollen tube growth of C. oleifera
外源NO和ROS均能抑制油茶花粉萌发和花粉管生长,且浓度越高,花粉萌发率越低,花粉管长度越小。这是否由于浓度设置过高,导致内源性ROS的平衡被打破,花粉管生长受到抑制,还有待进一步考究。
从单因素试验结果可以看出促进花粉萌发和花粉管生长的外源物质为NAA、GA3、CaCl2·2H2O、L-NNA、MgSO4,但它们浓度过高会产生抑制作用;抑制花粉萌发和花粉管生长的外源物质(EGTA、SNP、NAC、H2O2)的浓度越高,花粉萌发率和花粉管长度越小;因此,外源物质的浓度对花粉萌发和花粉管生长有非常重要的影响。分析0~24 h 花粉管的长度可知,50 mg·L-1乙烯利、800 μmol·L-1EGTA处理对花粉管生长的抑制作用十分明显,与对照组差异显著。0.5 mg·L-1NAA、5 mg·L-1GA3、10 mg·L-1MgSO4、50 mg·L-1CaCl2·2H2O和200 μmol·L-1L-NNA处理的花粉管长度显著大于对照组。
2.2 正交试验结果
正交试验设计与结果见表5和表6。油茶花粉培养2 h后,各处理组合的花粉萌发率和花粉管长度均大于对照组。由极差分析可知, 参试的4个因素对普通油茶花粉萌发的影响程度从大到小依次是CaCl2·2H2O、MgSO4、NAA、GA3。根据各因素水平均值k的大小,可得最佳萌发培养基组合是A1B1C1D1,即100 g·L-1蔗糖、10 g·L-1琼脂、0.1 g·L-1H3BO3、50 mg·L-1CaCl2·2H2O、10 mg·L-1MgSO4、0.5 mg·L-1NAA、2 mg·L-1GA3,这一组合也存在于9个处理组合中,即处理1,萌发率也达到了最高值(表5)。值得一提的是,在萌发方面,处理1的配方中各种成分浓度都是最小的,因此,处理1还具有经济友好的优势。

表5 油茶花粉萌发的正交试验结果Table 5 Orthogonal test results of pollen germination of C. oleifera
2 h后对照组的花粉管长度最短,为1 056.62 μm,由极差分析可知,参试的4个因素对油茶花粉管生长的影响大小依次为CaCl2·2H2O浓度>NAA浓度>MgSO4浓度>GA3浓度。根据均值k的大小可得,花粉管生长的最佳培养基组合是A1B1C1D3(表6),即100 g·L-1蔗糖、10 g·L-1琼脂、0.1 g·L-1H3BO3、50 mg·L-1CaCl2·2H2O、10 mg·L-1MgSO4、0.5 mg·L-1NAA、8 mg·L-1GA3。
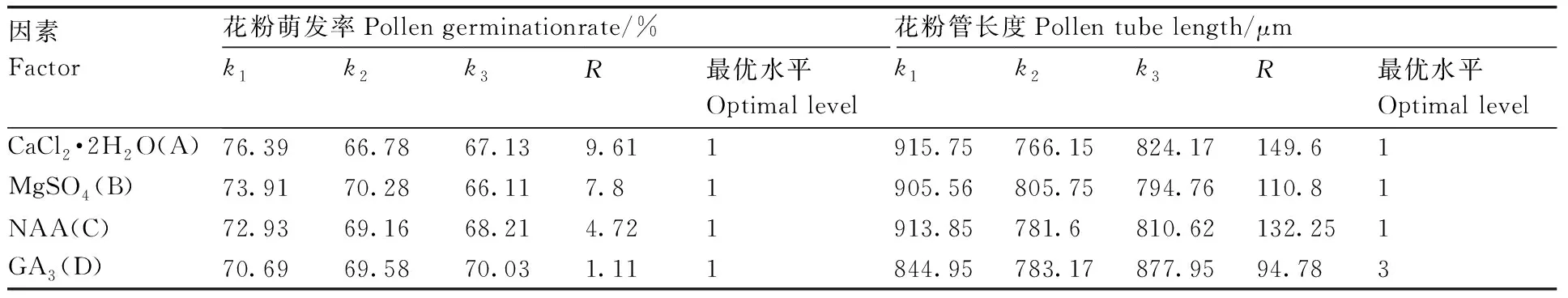
表6 极差分析结果Table 6 Results of range analysis
综上可知,CaCl2·2H2O对油茶花粉萌发和花粉管生长影响最大,GA3对油茶花粉萌发和花粉管生长影响最小。4个因素对花粉萌发与花粉管生长都具有重要的影响,并且油茶花粉萌发的最佳培养基配比和花粉管生长的最佳培养基配比不同。
3 讨论
植物花粉的萌发是一个复杂的生理过程和形态过程,涉及花粉管的极性生长和管壁的构建,有许多因素参与花粉萌发和花粉管的生长过程,包括培养时间、培养基pH值[7]、营养[8]、植物生长调节剂、湿度、温度等[5,9-11,13]。
3.1 植物生长调节剂
许多与植物生长发育相关的生理过程都受到生长调节剂的影响[21]。曾令达等[22]研究表明,0.5~3.0 mg·L-1NAA对荔枝花粉萌发和花粉管生长有促进作用。本研究发现,0.5 mg·L-1NAA促进油茶花粉萌发和花粉管生长,而5 mg·L-1NAA抑制了花粉萌发。低浓度的NAA对植物花粉萌发的促进作用明显,物种不同,NAA的促进作用也相近。Acar等[23]发现,随着GA3浓度的增加,雄性开心果的花粉萌发减少,薛晓敏等[24]研究表明,高浓度的GA3会导致桃花花粉萌发能力丧失。本研究中,50 mg·L-1GA3也表现出非常显著的抑制作用,这与薛晓敏等[24]的研究结果一致。曾令达等[22]认为,20.0 mg·L-1乙烯利对荔枝花粉的萌发和花粉管生长具有抑制作用。刘才宇等[25]发现,乙烯利对番茄和茄子的花粉萌发均有不同的抑制作用。本研究中,不同浓度的乙烯利对油茶花粉萌发和花粉管生长均有抑制作用,且浓度越高抑制作用越明显。说明乙烯利在不同物种上对花粉萌发和花粉管生长都表现出一定的抑制作用,浓度越高,抑制作用越明显,造成花粉管破裂、变形、弯曲,不能正常生长发育。
3.2 矿质元素
镁在10~50 mg·L-1时,对花粉发芽和花粉管生长都有促进作用[26]。硫酸镁为100、300 mg·L-1时甘蔗花粉萌发率较高,0、400 mg·L-1时甘蔗花粉萌发率处于较低水平[27]。本试验中,10~50 mg·L-1MgSO4均可促进油茶花粉萌发,并且10 mg·L-1MgSO4的促进效果最明显,这与韩志强等[26]的研究结果一致。Mg2+对植物花粉萌发和花粉管生长有一定的作用,这与Mg2+的浓度密切相关,浓度的高低在不同物种上的促进作用差异较为明显。
钙是花粉萌发和花粉管生长的核心调节剂,它在花粉管生长的各个方面都发挥着重要作用[28]。EGTA作为钙离子的特异性螯合剂,主要与细胞壁上的细胞外Ca2+螯合,抑制花粉管顶端的Ca2+流入[29]。已有研究表明,Ca2+可以影响许多植物的花粉萌发和花粉管生长[28,30]。适当浓度的Ca2+可促进花粉萌发,EGTA可抑制花粉萌发和花粉管生长,而外源Ca2+可逆转EGTA的抑制作用[31]。Zhan等[32]指出,在一定浓度下,Ca2+可以促进金合欢花粉萌发和花粉管生长,随着浓度的增加,花粉的萌发率、花粉管长度均增加,但随着Ca2+浓度的继续增加,花粉的萌发率下降。本研究中,50、150 mg·L-1CaCl2·2H2O促进了花粉管的生长,而450 mg·L-1CaCl2·2H2O则抑制了花粉的萌发,且CaCl2·2H2O是正交试验4个因素中对油茶花粉萌发和花粉管生长影响最大的因素。EGTA浓度越高,抑制作用越明显,外源Ca2+可减轻EGTA对花粉管生长的抑制作用,这进一步验证了Ca2+对花粉管的重要作用,这些结果与上述其他人的研究结果一致。也有研究表明,不同作物花粉离体萌发所需的Ca2+浓度差异极显著,植物花粉萌发对Ca2+需求的差异可能是植物进化过程中对环境适应的结果,具体原因有待进一步的探究。
3.3 化合物
NO是一种参与生理过程的信号分子[33-34]。常温下,SNP的施用抑制花粉萌发和花粉管生长,随着SNP浓度的增加,抑制作用加强。NO抑制剂L-NNA处理可以减弱SNP处理对花粉萌发率和花粉管生长的抑制作用[35]。使用NO清除剂或NOS抑制剂降低花粉细胞中NO含量,导致花粉萌发和花粉管生长减少,并导致严重的形态异常[36]。Duan等[37]报道了拟南芥中由FERONIA控制的机制,其中第1个花粉管到达胚珠会触发NO在丝状器中的积累,从而改变胚珠的条件并抑制其他花粉管的进入。本研究发现,100、200、300 μmol·L-1SNP抑制花粉管的生长;L-NNA促进花粉管的生长,但浓度应控制在一定范围内,其中200 μmol·L-1L-NNA的促进效果最好,这与李孝诚[35]的试验结果一致,但与Pasqualini等[36]的结果不一致,这可能与物种不同有一定的关系,但NO对植物花粉萌发和花粉管生长的作用是显而易见的。结合Duan等[37]的结果,NO抑制花粉萌发和花粉管生长,可能是因为NO对诱导花粉管进入胚珠的诱饵蛋白进行了亚硝基化修饰,一方面可能会阻止其分泌,另一方面会使其失去诱导花粉管的活性。因此,花粉萌发和花粉管生长受到抑制。
在植物中,ROS作为有氧代谢的正常副产品或在环境压力下产生[38],对多种生理过程很重要,但由于其高反应性,ROS会破坏蛋白质、脂质和DNA[38-40]。当ROS的产生超过其失活时,会导致氧化应激[38,41]。ROS在柏树的花粉萌发和花粉管形成中具有信号传导作用,NAD(P)H氧化酶抑制剂可以降低花粉细胞中的内源性ROS含量,导致花粉萌发和花粉管生长减少[36]。在拟南芥中,来自花粉的不同肽类与柱头肽竞争与柱头受体激酶复合物的相互作用,导致柱头处的ROS减少,从而使花粉水合和萌发[42]。本试验中,添加H2O2和NAC会降低花粉发芽率和花粉管长度,推测适当降低ROS的含量可以促进花粉管的生长,但一旦内源性ROS平衡被打破,花粉萌发和花粉管生长会受到抑制,这值得进一步探讨。
4 结论
油茶花粉萌发和花粉管生长受到激素、矿质元素(Ca2+、Mg2+)、化合物(一氧化氮(NO)、活性氧(ROS)等外源物质的影响。其中,Ca2+、Mg2+与适当浓度的GA3、NAA促进花粉萌发和花粉管生长,而乙烯利、NO和ROS对花粉萌发和花粉管生长起抑制作用。CaCl2对油茶花粉萌发和花粉管生长影响最大,GA3对油茶花粉萌发和花粉管生长影响最小。油茶花粉离体萌发最佳配比为100 g·L-1蔗糖、10 g·L-1琼脂、0.1 g·L-1H3BO3、50 mg·L-1CaCl2·2H2O、10 mg·L-1MgSO4、0.5 mg·L-1NAA和2 mg·L-1GA3,油茶花粉管离体生长的最佳配比为100 g·L-1蔗糖、10 g·L-1琼脂、0.1 g·L-1H3BO3、50 mg·L-1CaCl2·2H2O、10 mg·L-1MgSO4、0.5 mg·L-1NAA和8 mg·L-1GA3。

