青海湖流域原生动物群落结构及影响因素研究
刘瑜 罗帅 张鹏 王雪艳 熊杰 熊雄 吴辰熙 姜传奇 缪炜

摘要:原生动物对环境变化反应敏锐,是水生态系统微生物食物网、物质循环和能量流动中的重要结构和功能组成部分。青海湖作为我国最大的内陆咸水湖,是维系青藏高原生态安全的重要水体,是世界高原内陆湖泊湿地类型的典型代表。为了探究青海湖流域原生动物群落结构及其与环境因子之间的关系,于2020年8月对青海湖流域的入湖河流、湖滨带、主湖区及子湖共32个样点进行水环境样品采集,共获得水体样品95份,利用宏基因组测序技术和生物信息学方法从分子水平开展了该流域原生动物多样性和群落结构及其影响因素研究。主要结果如下:(1)共注释到176个原生动物分类单元(Operational Taxonomic Units,OTU),隶属于12门19纲43目61科72属;(2)青海湖流域原生动物多样性为入湖河流>湖滨带>子湖>主湖区,且4类水体环境原生动物群落结构存在显著差异;(3)原生动物群落受水体酸碱度、盐度、水温、溶解性总固体、浊度、总氮、总磷等环境因子的影响;(4)原生动物与其他浮游生物共现网络从入湖河流、湖滨带、子湖到主湖区,模块性逐渐变低,生物类群间的互作网络逐渐碎片化。青海湖流域原生动物的调查结果可为将来该流域的水生态环境健康评估提供依据。
关键词:原生动物;宏基因组;多样性;群落结构;青海湖流域
中图分类号:X173 文献标志码:A 文章编号:1674-3075(2023)04-0001-09
原生动物是一类单细胞真核生物(Pawlowski et al,2014),是水生态系统物质循环和能量流动的重要结构和功能组成部分(沈韫芬等,1994;许木启和Kasprzar,2001)。原生动物种类繁多,目前已经记录的原生动物有60 000多种,广泛分布于海水、淡水以及土壤等环境中。同时,原生动物对环境变化敏感,是一类理想的环境监测指示生物(王北苏,2010;陆夏铭和杨青,2021)。
湖泊是陆地表层水体的重要组成部分,在社会经济发展和生物多样性维持等方面起着至关重要的作用(张奇等,2020)。青海湖是中国最大的内陆咸水湖,位于青藏高原东北边缘,处于黄土高原、西北干旱区和青藏高寒区的过渡地带,是维系青藏高原东北部生态安全的重要屏障(张明,2016;张明和曹学章,2017)。在经济社会发展特别是旅游业发展及全球气候变化的大背景下,青海湖流域的水生态健康受到国内外学者的普遍关注。连喜红等(2019)探讨人类活动影响下的青海湖生态系统服务空间格局,结果表明氮、磷负荷随人类活动的增强呈现递增趋势。孟星亮等(2014)对青海湖流域大型底栖动物的群落结构进行了调查,共注释到底栖动物28个分类单元(Operational Taxonomic Units, OTUs),隶属于3门5纲15科。罗颖等(2020)根据2014年夏季青海湖水生生物调查,研究水体浮游动物的群落结构特征,共鉴定出浮游动物19种,结果表明2014年夏季青海湖浮游动物群落结构简单但处于较为稳定的状态。Ren等(2017)对青海湖及其入湖河流微生物群落的分类和功能进行研究,结果表明河流与湖泊之间的微生物群落在分类和功能上存在显著差异。
目前,青海湖流域原生动物研究主要为基于形态学方法的生物多样性调查。1961-1962年第一次开展青海湖原生动物调查,发现原生动物6属(中国科学院兰州地质研究所等,1979);1964年9月-1965年8月的调查发现原生动物1属1种(青海省生物研究所,1975);2006-2007年,共发现原生动物2属2种(杨建新等,2008);2006-2010年夏季,共发现原生动物3属3种(姚维志,2011)。已有的研究中,青海湖流域原生动物物种记录较少,一方面与高原湖泊的特殊生境有关,另一方面与原生动物个体微小、生命周期短、受环境影响大、保存和鉴定困难等因素有关(沈韫芬,1999)。
高通量测序技术日渐成熟,具有数据量大、准确度高,对物种识别灵敏等特点,因此被广泛应用于原生动物物种组成、群落时空分布等相关研究(黄平平,2017;安瑞志,2021;葛畅,2021)。此外,高通量测序技术的研究周期远小于传统形态分类学研究,一定程度上提高了研究效率。
本研究利用高通量测序方法,对青海湖流域入湖河流、湖滨带、子湖、主湖区的原生动物物种多样性、群落结构及其与环境因子的关系进行研究,旨在深入了解青藏高原地区咸水湖泊的原生动物群落特征,为青海湖流域水环境生物监测提供基础数据,为将来青海湖流域水生态环境健康评估提供参考依据。
1 材料与方法
1.1 研究区域概况及采样点设置
1.1.1 研究区域概况 青海湖地处青藏高原东北部,周长约360 km,东西长约104 km,南北宽约62 km,湖泊面积为4 625.6 km2,湖区气候属高原高寒半干旱气候,年均气温1.2℃,年均降水量336 mm(孟星亮等,2014)。青海湖水补给来源是河水,其次是湖底的泉水和降雨(杨建新等,2008),入湖河流包括布哈河、菜挤河、黑马河、泉吉河、沙柳河等。其中,布哈河和沙柳河是最大的2条入湖河流,流域面积分别为14 337 km2和1 442 km2,多年平均径流量为7.8 ×108 m3和3.1×108 m3,占青海湖入湖径流量的48.7%和15.3%(孙永亮等,2008)。青海湖的3个子湖中,金沙湾部分与主体湖区季节性连通,尕海与主体湖完全隔离且无明显河流补给,耳海与主体湖完全隔离且有倒淌河补给(孟星亮等,2014)。
1.1.2 采样点设置 青海湖流域入湖河流、湖滨带、主湖区及子湖4类水体共设置32个采样点(S1~S32),其中入湖河流(RHHL)设置样点5个,分别为布哈河(S1)、菜挤河(S2)、黑马河(S3)、泉吉河(S4)和沙柳河(S5);子湖(ZH)设置样点3个,分别为耳海(S6)、尕海(S7)和金沙湾(S8);湖滨带(HBD)设置样点8个,编号为S9~S16;主湖区(ZHH)设置样点16个,编号为S17~S32(图1)。本研究于2020年8月对青海湖流域的32个样点进行水环境样品的采集,每个样点取3个平行样,共获得水体样品95份(其中入湖河流沙柳河的1份样品测序失败)。
1.2 样品采集与处理
采集表层水(约50 cm水深),用300 [μ]m的尼龙滤网过滤去除大的杂质和大型水生生物(组织)后置于采水袋中。然后取1 L水样抽滤至0.22 [μ]m PC膜(Millipore,USA)上,放置于无菌离心管中,保存于-80℃低温冰箱,用于后续DNA提取(Wang et al,2019),同时采集1 L水样低温避光保存,用于水环境指标测定。
水体酸碱度(pH)、水温(T)、溶解性总固体(TDS)、盐度(SAL)及溶解氧(DO)用美国哈希HQ40D便携式多参数水质分析仪现场测定;浊度(TUR)用美国哈希2100Q便携式浊度仪现场测定;总氮(TN)、总磷(TP)测定参照《水和废水监测分析方法》(国家环境保护总局编委会, 2002)于实验室内完成。
1.3 数据处理与分析
1.3.1 DNA的提取与宏基因组测序 样本的DNA提取采用CTAB方法,每100 mg样品添加500 [μ]L CTAB缓冲液,混合并彻底涡旋,置于60°C水浴孵育30 min后,离心5 min,加入5 ?L RNase A溶液,37°C孵育20 min。然后加入等体积的苯酚-氯仿-异戊醇抽提除去蛋白质、多糖等杂质,将样品离心1 min并重复此步骤提取,直到上层澄清。最后加入乙醇沉淀分离出总DNA(王先锋等, 2017)。DNA纯度和浓度利用2%的琼脂糖凝胶检测。使用M220聚焦超声仪(Covaris Inc., Woburn, MA, USA)将质量合格的DNA破碎成大约300 bp的片段,把已纯化的DNA片段加入到末端补齐体系中,然后加入3末端“A”缓冲反应体系,连接测序接头,利用T4 DNA连接酶将Illumina测序接头连接至文库DNA两端,应用Agencourt SPRIselect核酸片段筛选试剂盒以纯化文库,同时进行片段大小筛选,PCR扩增完成DNA文库的构建。文库质量检测合格后,利用Illumina Hiseq 4 000对样品进行测序。
1.3.2 数据处理 对采集得到的95份样品进行测序,共获得数据量1.5 Tb。然后用fastQC(v0.11.9)对测序所得的原始序列进行质量评估,对于低质量碱基使用Fastx trimmer(v0.0.14)移除,通过BLASTN(BLAST Version 2.10.1+,http://blast.ncbi.nlm.nih.gov/Blast.cgi) 将经过质控的序列比对至SILVA数据库,设置e值阈值为1e-5,将符合要求的rDNA序列筛选出来,然后使用MEGAHIT(v1.1.3)组装得到全部样本的rDNA contigs。使用nhmmer判定组装得到的 rDNA contigs,筛选出属于16S和18S rDNA的序列使用脚本进行截取,经97%相似度聚类后,最终得到的rDNA contigs同时与Nucleotide Sequence Database(NT, https://www.ncbi.nlm.nih.gov/)、Protist Ribosomal Reference database(PR2, https://figshare.com/articles/PR2_rRNA_gene_database/3803709)、SILVA NR99(https://www.arb-silva.de/)3个数据库进行比对,选取最优注释结果,用于物种鉴定。使用Bwa(0.7.17-r1188)将每个样品的rDNA序列分别比对至rDNA contigs,每个样本的比对结果使用feature Counts(v1.6.0)进行比对,然后进行统计,并用RPKM(Reads Per Kilobase per Million mapped reads)的方式进行标准化得到OTU(Operational Taxonomic Units)丰度表。
1.3.3 统计分析 利用R4.0.3软件(R Core, 2020)Vegan包计算均匀度指数(Pielou)、香农指数(Shannon)、丰富度指数(Richness)、辛普森指数(Simpson)等多样性指数并进行非度量多维尺度分析(NMDS)。利用OTU丰度表计算优势OTUs。利用R软件的vegan、psych、 pheatmap和indicspecies等软件包进行冗余分析、相关性分析和指示种类分析。使用R和Gephi软件进行共现网络分析。
2 结果与分析
本研究对青海湖流域32个样点的水环境样品进行了宏基因组测序,组装后共提取到4 181条 rDNA contigs,经过97%相似性聚类后,共获得336个真核生物的OTUs,其中原生动物有176个OTUs。
2.1 青海湖流域原生动物多样性
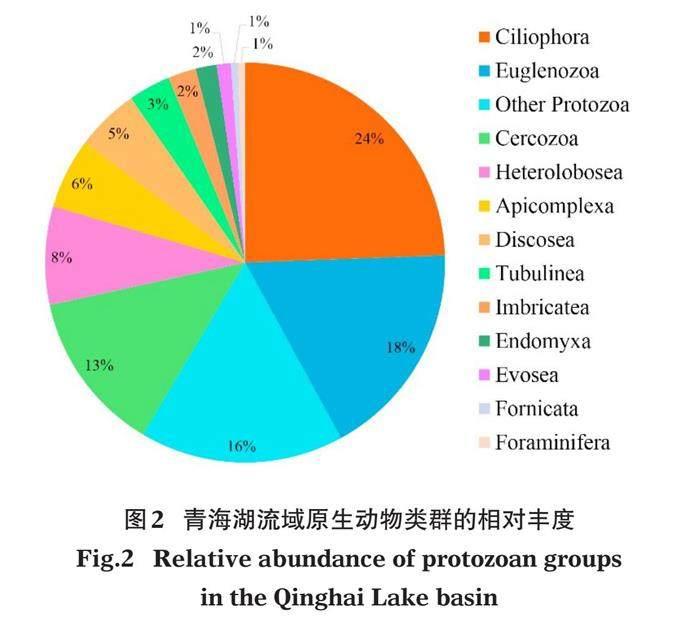
本研究所鉴定到的176个原生动物OTUs隶属12门19纲43目61科72属,纤毛门(Ciliophora, 24%)占比最高,其次为眼虫门(Euglenozoa, 18%)和丝足虫门(Cercozoa, 13%),占比较低为透色门(Heterolobosea, 8%)、顶复门(Apicomplexa, 6%)、Discosea(5%)、管涌足虫门(Tubulinea, 3%)、Imbricatea(2%)、Endomyxa(2%)、Evosea(1%)、多鞭毛虫门(Fornicata, 1%)和有孔虫门(Foraminifera, 1%)(图2)。
青海湖流域原生动物多样性指数如表1,均匀度指数为0.54~0.89,香农指数为2.52~4.45,丰富度指数为88.00~157.00,辛普森指数为0.72~0.98。各指数均为入湖河流>湖滨带>子湖>主湖区,表明青海湖流域原生动物多样性为入湖河流高于湖滨带、子湖和主湖区。
2.2 青海湖流域不同水体原生动物的群落组成
青海湖流域入湖河流、湖滨带、主湖区和子湖原生动物物种组成相似,仅3个子湖无有孔虫门(Foraminifera)分布。但是,原生动物非度量多维尺度(NMDS)分析(图3A)显示,4类水体之间的原生动物群落结构存在显著差异(P<0.05)。4种水体环境的原生动物OTUs组成均为纤毛门和丝足虫门最多,但比例不同,入湖河流、湖滨带、主湖区和子湖的2个类群占比分别为48%和14%、30%和28%、38%和36%、29%和28%。高丰度类群在不同水体的分布呈现差异,纤毛门和眼虫门在入湖河流占比最高,眼虫门在主湖区占比最低。丝足虫门在主湖区占比最高,在入湖河流占比最低。纤毛门、丝足虫门、眼虫门在湖滨带和子湖的相对丰度无显著差异,在入湖河流和主湖区的丰度差异显著(图3B)。
2.3 青海湖流域原生动物优势种类和指示种类
青海湖各个水体环境原生动物优势种(相对丰度>0.02)如表2,共鉴定25个优势OTUs,其中入湖河流12个,湖滨带12个,主湖区10个,子湖11个。入湖河流、湖滨带、主湖区和子湖共有优势种为Mataza hastifera;湖滨带、主湖区和子湖共有优势种为Pseudodifflugia sp.、Protaspa longipes;入湖河流和湖滨带共有优势种为Vorticella sp.、Korotnevella stella、Sessilida sp.、Peritrichia sp.;湖滨带和子湖共有优势种为Metanophrys sp.、Paraphelidium sp.;主湖区和子湖共有优势种为Lagenoeca sp.、Cercozoa sp.otu95、Mesodinium sp.、Cercozoa sp.otu102。结果表明Mataza hastifera、Pseudodifflugia sp.、Protaspa longipes、Vorticella sp.、Korotnevella stella、Sessilida sp.、Peritrichia sp.、Metanophrys sp.、Paraphelidium sp.等在青海湖流域原生动物群落中占有重要地位。
利用R软件indicspecies包计算各类水体环境原生动物指示种类(图4),以P≤0.01定为指示种类,共16个指示OTUs。其中入湖河流12个,湖滨带指示种7个,主湖区指示种3个,子湖指示种7个。相对丰度较高的指示种为Mesodinium sp.,是子湖和主湖区的共有指示种。
2.4 青海湖流域原生动物群落与环境因子的关系
青海湖流域不同水体环境因子测定值见表3所示。对青海湖流域原生动物群落与环境因子的关系进行冗余(RDA)分析(图5A)。结果显示,青海湖流域不同水体环境原生动物群落结构的影响因素不同。入湖河流原生动物群落与溶解性总固体、总氮有较强的正相关,与盐度和pH有较强的负相关;湖滨带原生动物群落与溶解氧、温度、浊度、总磷有较强的正相关;主湖区原生动物群落与pH和盐度有较强的正相关,与溶解氧、温度、浊度、总磷有较强的负相关;子湖原生动物群落与湖滨带原生动物群落类似,与溶解氧、温度、浊度、总磷有较强的正相关。
原生动物主要门类与环境因子的相关性(Spearman)分析(图5B)显示,原生动物主要门类被划分为2个类群。类群Ⅰ包括眼虫门、多鞭毛虫门和顶复门等,这些类群与溶解性总固体、总氮、温度、总磷、浊度呈正相关,与pH、盐度呈负相关。类群Ⅱ包括纤毛门、管涌足虫门、丝足虫门等,与总氮、温度、总磷、浊度呈负相关,与盐度、pH呈正相关。
2.5 原生动物与其他浮游生物群落共现网络分析
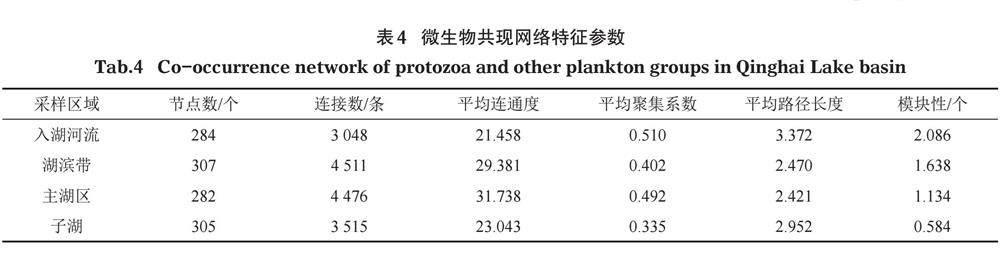
为探究青海湖流域原生动物与其他浮游生物类群(藻类、桡足类、轮虫、枝角类)的互作关系,分别对青海湖各个水体环境的原生动物及其他浮游生物群落进行共现网络分析(图6)。结果显示,4类水体环境共现网络节点间的连接均以正相关为主,在网络中正相关占多数表明群落的物种间更多的是互利关系。对比不同水体环境共现网络属性(表4),入湖河流共现网络由284个节点和3 048条边组成,湖滨带共现网络由307个节点和4 511条边组成,子湖共现网络由282个节点和4 476条边组成,主湖区共现网络由305个节点和3 515条边组成。4类水体环境模块性均大于0.4,表明为模块化结构。当把4类水体环境网络中的所有节点模块化时,入湖河流所有节点分为5个模块,主要表现为原生动物与藻类,原生动物与藻类、枝角类、轮虫,原生动物与藻类、枝角类、轮虫、桡足类间的相互作用;湖滨带所有节点分为4个模块,主要表现为原生动物与藻类、桡足类,原生动物与藻类、桡足类、轮虫,原生动物与藻类、桡足类、枝角类、轮虫间的相互作用;子湖所有节点分为4个模块,主要表现为原生动物与藻类、枝角类,原生动物与藻类、桡足类、轮虫,原生动物与藻类、桡足类、枝角类、轮虫间的相互作用;主湖区所有节点分为2个模块,主要表现为原生动物与藻类、桡足类、枝角类、轮虫间的相互作用。模块性为入湖河流>湖滨带>子湖>主湖区,即从入湖河流、湖滨带、子湖到主湖区,共发生网络的模块性逐渐变低,生物群落逐渐碎片化。
3 讨论
3.1 青海湖流域原生动物多样性和群落结构
本研究通过宏基因组测序,共鉴定青海湖流域176个原生动物OTUs,隶属于12门19纲43目61科72属,其中占比最高的类群为纤毛门。原生动物多样性存在区域差异,入湖河流>湖滨带>子湖>主湖区,这可能与水环境营养水平有关,入湖河流总氮含量最高,主湖区总磷含量最低。同时这也符合高原水生态系统的特性,普遍在营养水平较高的生境生物多样性相对较高(王芸,2017;支珞昀,2020)。入湖河流中黑马河采样点位于草场附近,其氮磷可能来源于地表径流输送或其它天然源;布哈河和沙柳河采样点位于城镇周围城镇草场下游,氮磷可能来源于城镇人为排入和草地系统的淋溶。湖滨带是人类活动最多的区域,人类放牧、农耕及旅游等活动带来的各种人为干扰,可能是导致湖滨带总磷浓度较高的原因。子湖是相对比较封闭的环境,总磷较高可能与物质长时间累积有关。主湖区相对其他区域,人为活动较少,因此减少了外源营养物质的输入,从而导致其营养物质较为缺乏,因而使得主湖区原生动物多样性较低(杨建新等,2008)。
Mataza hastifera、Pseudodifflugia sp.、Protaspa longipes、Vorticella sp.、Korotnevella stella等是青海湖流域水生态系统的优势类群,隶属于纤毛门、丝足虫门和Discosea。同时,Mesodinium sp.、Agolohymena aspidocauda、Euglena agilis、Naegleria fultoni等是青海湖流域水生态系统的指示种类,隶属于纤毛门、眼虫门、透色门和Imbricatea。这些优势和指示生物种类可以作为4类水体环境变化的生物指标,将来用于监测青海湖流域不同水体环境的水质变化情况。
3.2 青海湖流域原生动物群落的影响因素
原生动物在水体环境中营浮游生活,其种类组成、丰度以及优势种等群落结构与水体环境因子密切相关。已有研究表明,温度、盐度、pH、营养水平等多种因素会对原生动物群落结构产生影响(王鑫,2014;杨渐,2015;郭飞飞等,2016)。本研究中青海湖流域的原生动物群落受pH、温度、盐度、总磷、总氮多种环境因子的影响。
4类水体原生动物群落结构的环境因素存在差异,入湖河流原生动物群落受盐度、pH、溶解性总固体、总氮含量影响较大,与前人对高原河流原生动物的研究结果一致(杨欣兰等,2019;安瑞志,2021)。湖滨带、子湖原生动物群落受溶解氧、温度、浊度、总磷含量影响较大,主湖区原生动物群落受pH、盐度、溶解氧、温度、浊度、总磷含量影响较大,与前人对高原湖泊原生动物研究的结论一致(董云仙和王忠泽,2013;冯钟等,2018;支珞昀,2020;杨鸿雁等,2020;胡文渊,2021)。
3.3 青海湖流域原生动物与其他浮游生物群落共现网络的影响因素
微生物群落的复杂性及相互作用在维持生态系统结构和功能的稳定方面起着关键作用(Chaffron et al,2010)。群落中的各种生物之间存在着共生、合作、竞争、掠夺等互作关系,这些互作关系也决定了生物群落共存的模式(Liu et al,2019)。微生物共现网络模型可用于揭示微生物之间潜在的相互作用(Morris et al,2019),并被广泛用于研究自然环境中微生物之间的共存关系(Proulx et al,2005)。本研究中,青海湖流域4类水体环境原生动物与其他浮游生物的正相关关系占主要部分,它们之间可能存在互惠互利的关系或者生态位的重叠(Hou et al,2019;石晴等,2019;张海涵等,2021)。4类水体环境网络节点数差异不大,但是入湖河流网络连接数和平均连通度最低,表明与湖滨带、子湖和主湖区相比,入湖河流浮游生物间的相互作用更复杂。入湖河流和湖滨带受到草地淋溶、地表径流以及人类互动等因素的影响,营养水平相对较高,生物多样性相对较高,生物互作网络也相对复杂。主湖区与其他3类水体相比温度较低、营养水平较低,生物多样性也较低,导致生物之间的网络结构相对简单和碎片化。因此,温度和营养水平是影响青海湖流域浮游生物互作网络的重要因素。
参考文献
安瑞志,2021. 麦地卡湿地国家级自然保护区原生动物群落生态学研究[D]. 拉萨:西藏大学.
董云仙,王忠泽,2013. 程海浮游动物种群特征与数量的周年变化[J]. 水生态学杂志,34(3):17-24.
冯钟,赵帅营,陈丽,等,2018. 抚仙湖浮游动物群落分布特征及其影响因子分析[J].云南师范大学学报(自然科学版),38(5):56-65.
葛畅,2021. 两种作物根围土壤微生物组扩增子测序分析[D]. 哈尔滨:哈尔滨师范大学.
郭飞飞,张云,赵广,等,2016. 金沙河水库浮游动物群落结构及其与环境因子的关系[J]. 生态学杂志,35(8):2208-2216.
国家环境保护总局编委会,2002. 水和废水监测分析方法[M].4版. 北京:中国环境科学出版社.
胡文渊,2021. 云南典型砷污染湖泊: 阳宗海浮游动物群落特征研究[D]. 昆明:云南师范大学.
黄平平,2017. 基于高通量测序和形态学的黄渤海沉积物中纤毛虫生物多样性及分布特征研究[D]. 青岛:中国科学院大学(中国科学院海洋研究所).
连喜红,祁元,王宏伟,等,2019. 人类活动影响下的青海湖流域生态系统服务空间格局[J]. 冰川冻土,41(5):1254-1263.
陆夏铭,杨青,2021. 原生动物在环境监测与城镇污水处理中的应用[J]. 广西城镇建设,(7):36-38.
罗颖,祁洪芳,闫丽婷,等,2020. 夏季青海湖浮游动物群落结构特征[J]. 海洋湖沼通报,(2):137-143.
孟星亮,何玉邦,宋卓彦,等,2014. 青海湖区大型底栖动物群落结构与空间分布格局[J]. 水生生物学报,38(5):819-827.
青海省生物研究所,1975. 青海湖地区的鱼类区系和青海湖裸鲤的生物学[M]. 北京:科学出版社:37-45.
沈韫芬,顾曼如,龚循矩,等,1994. 微型生物监测新技术[J]. 北京:中国建筑工业出版社.
沈韫芬,1999. 原生动物学[M]. 北京:科学出版社.
石晴,韩睿,邢江娃,等,2019. 青海湖微生物群落的共生模式[J]. 中国高原医学与生物学杂志,40(2):85-93,117.
宋微波,胡晓钟,魏军,1997. 海洋赤潮纤毛虫: 中缢虫(Mesodinium sp.)的形态学及种间比较[J]. 应用与环境生物学报,(2):163-167.
孙永亮,李小雁,汤佳,等, 2008. 青海湖流域气候变化及其水文效应[J]. 资源科学,(3):354-362.
王北苏,2010. 原生动物在环境监测与污水处理中的应用[J]. 甘肃科技,26(8):42- 43.
王先锋,林承刚,许强,等,2017. 利用18S rDNA分子方法分析浒苔绿潮过境期间长牡蛎摄食情况的变化[J]. 海洋与湖沼,48(6):1362-1370.
王鑫,2014. 青藏高原不同海拔咸水湖微生物多样性及适应性特征[D]. 兰州:兰州交通大学.
王芸,2017. 拉萨河中上游原生动物群落结构特征及其与水环境之间的关系[D].拉萨:西藏大学.
许木启, Kasprzar P, 2001. 德国柏林市Stechlin湖原生动物群落多样性特征的初步研究[J]. 湖泊科学,13(4):322-330.
杨鸿雁,杨劭,刘毅,等,2020. 云贵高原富营养化湖泊杞麓湖浮游生物群落的季节性演替及其驱动因子分析[J]. 环境科学研究,33(4):876-884.
杨建新,祁洪芳,史建全,等,2008. 青海湖夏季水生生物调查[J]. 青海科技,15(6):19-25.
杨渐,2015. 青藏高原湖泊微生物群落演替及其环境指示意义[D]. 武汉:中国地质大学.
杨欣兰,巴桑,黄香,2019. 拉萨河中上游夏秋季纤毛虫群落时空变动及其与环境的关系[J]. 生态学报,39(9):3121-3132.
姚维志,2011. 青海湖夏季饵料生物资源研究[D]. 重庆:西南大学.
张海涵,黄鑫,黄廷林,等,2021. 水源水库真核微生物种群结构季相演替特征[J]. 环境科学,42(12):5804-5713.
张明,2016. 青海湖流域主要生态环境问题成因与发展对策研究[J]. 青海环境, 26(3):135-138.
张明,曹学章,2017. 青海湖流域水资源变化特征研究[J]. 中国水土保持,(6):51-53.
张奇,刘元波,姚静,等,2020. 我国湖泊水文学研究进展与展望[J]. 湖泊科学,32(5):1360-1379.
支珞昀,2020. 高原湖泊浮游动物群落空间分布驱动力解析[D]. 北京:中国地质大学.
中国科学院兰州地质研究所,中国科学院水生生物研究所,中国科学院微生物研究所,等,1979. 青海湖综合考察报告[M]. 北京:科学出版社.
Chaffron S, Rehrauer H, Pernthaler J, et al, 2010. A global network of coexisting microbes from environmental and whole-genome sequence data[J]. Genome Research, 20(7):947-959.
Hou F, Zhang H, Xie W, et al, 2019. Co-occurrence patterns and assembly processes of microeukaryotic communities in an early-spring diatom bloom[J]. Science of the Total Environment, 711:134624.
Liu L, Chen H, Liu M, et al, 2019. Response of the eukaryotic plankton community to the cyanobacterial biomass cycle over 6 years in two subtropical reservoirs[J]. The ISME Journal,13:2196-2208.
Morris L A, Voolstra C R, Quigley K M, et al, 2019. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses[J]. Trends in Microbiology,27(8):678-689.
Pawlowski J, 2014. Protist evolution and phylogeny[M]. New Jersey: John Wiley&Sons, Ltd.
Proulx S R, Promislow D, Phillips P C, 2005. Network thinking in ecology and evolution[J]. Trends in Ecology & Evolution, 20(6):345-353.
Ren Z, Fang W, Qu X, et al, 2017. Taxonomic and functional differences between microbial communities in Qinghai Lake and its input streams[J]. Frontiers in Microbiology, 8:2319.
Wang J W, Liu Q X, Zhao X F, et al, 2019. Molecular biogeography of planktonic and benthic diatoms in the Yangtze River. Microbiome, 7(1):1-15.
(责任编辑 张俊友 熊美华)
Protozoan Community Structure and Influencing Factors in the Qinghai Lake Basin
LIU Yu1, LUO Shuai2,3,ZHANG Peng4, WANG Xue‐yan2, XIONG Jie2, XIONG Xiong2,
WU Chen‐xi2, JIANG Chuan‐qi2, MIAO Wei2
(1. Key Laboratory of Biodiversity of Aquatic Organisms, Heilongjiang Province, Harbin Normal University,
Harbin 150025, P. R. China;
2. Key Laboratory of Aquatic Biodiversity and Conservation, Institute of Hydrobiology,
Chinese Academy of Sciences, Wuhan 430072, P. R. China;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, P. R. China;
4. Laboratory of Wetland and Catchments Ecology in Tibetan Plateau, Faculty of Natural Sciences,
Tibet University, Lhasa 850000, P. R. China)
Abstract: Protozoa are a group of single-celled eukaryotes with a wide variety of species, broad distribution, short life cycle and a keen response to environmental changes. They are an important structural and functional component of the microbial food web, and the material circulation and energy flow in aquatic ecosystems. As the largest inland saltwater lake in China, Qinghai Lake is a representative of plateau inland lakes and an important water body that is crucial for maintaining the ecological stability of the Qinghai-Tibet Plateau. In this study, we explored the community structure, species diversity and the factors influencing protozoa in four waters of the Qinghai Lake basin (inflow river, near shore, open water and sub-lake) using metagenomic sequencing and bioinformatics. In August 2020, water samples were collected at 32 sampling sites in the four waters for the determination of water environmental parameters and for metagenomic sequencing. Results are as follows: (1) A total of 176 protozoan operational taxonomic units (OTUs) were identified, belonging to 72 genera, 61 families, 43 orders, 19 classes and 12 phyla. (2) Protozoan diversity in the Qinghai Lake basin presented significant spatial differences, and the diversity of the four waters was in the order of inflow river>near shore>sub-lake>open water. (3) The protozoan community was affected by pH, salinity, water temperature, total dissolved solids, turbidity, total nitrogen, and total phosphorus. (4) The co-occurring protozoan networks and other plankton in the inflow river, near shore, sub-lake and open waters gradually became less modular, and the interaction networks among taxonomic groups gradually became fragmented. In summary, high-throughput sequencing was used to conduct a comprehensive investigation of the protozoa in the Qinghai Lake basin, and the results provide a basis for assessing and monitoring the aquatic ecosystems of Qinghai Lake basin.
Key words: protozoan; metagenomic; diversity; community structure; Qinghai Lake basin
