莲花洲港航道工程的生态修复效果初步研究
叶丽娟 王珂 刘绍平 段辛斌 于琪 贾春艳 陈大庆 郑永华

摘要:为了解莲花洲港生态涵养区的修复效果,2021年1月、4月、10月在武汉至安庆段的东流水道莲花洲港设置21个采样点,对底栖动物群落和鱼类分布状况进行调查,分析工程区不同区域及非工程区底栖动物和鱼类群落结构差异。结果显示,不同区域底栖动物的种类数不同,透水框架区获取底栖动物6种,鱼巢排区17种,工程其他区域25种,非工程区8种。单因素方差分析表明,不同区域的底栖动物密度差异显著(P<0.05),透水框架区最高,为191.1个/m2,其次为鱼巢排区60.44个/m2,其他工程区44.44个/m2,非工程区较少,仅28.39个/m2。各区域Pielou 均匀度指数(J)差异性不显著(P>0.05),Margalef丰富度指数(D)和Shannon-Wiener 多样性指数(H′)差异性显著(P<0.05)。CCA分析表明,影响底栖动物的环境因子为流速、水深、温度、溶解氧、硝态氮、氨氮。水声学调查显示,鱼类密度以透水框架区最高,为25 581.21尾/hm2,鱼巢排区次之,为3 239.00尾/hm2,工程其他区域为808.73尾/hm2,非工程区最低,仅6.82尾/hm2。研究表明,透水框架和鱼巢排营造了适宜底栖动物和鱼类栖息的水流条件,有利于底栖动物生存和鱼类聚集,且透水框架的生态涵养效果优于鱼巢排。
关键词:航道工程;生态修复;底栖动物;透水框架;人工鱼巢;莲花洲港
中图分类号:X171.4 文献标志码:A 文章编号:1674-3075(2023)05-0025-08
长江干线武汉至安庆段6 m水深航道整治工程的实施,充分发挥了长江黄金水道的功能,提高了长江航运整体通过能力,但不可避免地对附近河道水生生境造成了一定影响。杨雪(2016)研究表明,航道工程的实施造成了底栖动物和浮游生物的下降。为了平衡开发与保护的关系,武汉至安庆段航道整治工程围绕生态优先的原则,以生境修复和生态涵养为目的,设计实施了一系列生态建设工程;其中,在东流水道莲花洲港建设了生态涵养区,铺设透水框架和人工鱼巢,以营造水生生物庇护场所,改善其栖息环境。
涵养工程的实施,促进了底沙沉积(潘美元等,2018a;2018b)和有机质富集(郭杰等,2020)。由于食物链效应的影响,进而促进了水生植物、底栖动物等的恢复。各类底栖动物对环境条件的适应性以及对污染程度的耐受力和敏感程度不同,底栖动物的种群结构、优势种类、数量等参数可反映水环境质量状况(潘保柱等,2011);另一方面,鱼类处于河流生态系统食物链的顶端,是水生生物中较敏感的生物,在生态环境改变的情况下,鱼类的种类、数量和分布容易发生改变,能较好地反映河流综合生态状况(王兆印等,2007)。
目前,对于航道整治中有关生态工程的研究大多集中于水力学特性等方面(李洪,2003;夏炜,2019;刘建华等,2020)和结构(黄云龙,2021;耿海彬等,2021;杨燕华等,2021);对于透水框架、人工鱼巢等生态友好型结构的生态效应验证却很少。有鉴于此,本文以底栖动物和鱼类为研究对象,选择莲花洲港生态涵养区及其上下游水域,对比分析涵养区与非工程区底栖动物群落结构以及鱼类分布状况的差异,探究涵养水域的生态修复效果,以期为生态友好航道建设及优化提供科技支撑。
1 材料与方法
1.1 研究区域
莲花洲港生态涵养区位于武汉至安庆段的东流水道,下距安庆市41 km,是武汉至安庆段6 m水深整治工程重点区域之一;该区域整体禁航,并设置了2处生境改良区(图1)。其中,第一处生境改良区为人工鱼巢区(简称改良区S1),放置长×宽×厚=2 m×2 m×0.5 m的田字形钢混透空格栅,横向放置80件,纵向放置25件,各构件相互间隔1 m,形成阵列;第二处生境改良区为透水框架区(简称改良区S2),该区域放置与水流方向成30°夹角的“W型”的透水框架带,长×宽=240 m×10 m,每1 m2放置3层6架。
1.2 采样位点布设
1.2.1 底栖动物采集 在生态涵养区和上下游水域(非涵养区)共布设7个采样断面,采集底栖动物样品。其中,为了揭示不同生态结构涵养效果差异,在生态涵养区设置5个断面,分别位于洲头、洲中、洲尾、透水框架区和鱼巢排区,在涵养区上游和下游即非工程区各设置1个监测断面。每个断面设左、中、右3个采样点,共21个采样点(表1、图1)。调查时间为2021年1月、4月和10月。
1.2.2 水声学监测 2021年10月在莲花洲港生态涵养区及上下游各10 km范围进行水声学监测,范围覆盖生态涵养区和生态涵养区上、游水域。
1.3 调查方法
1.3.1 环境因子测定 水温(WT)、溶解氧(DO)、pH采用YSI水质分析仪(YSI Pro 2000,美国)测定,流速(FV)、透明度(SD)、水深(WD)分别使用旋杯式流速仪、萨氏盘、水声学仪器测定(李剑辉和金福一,2010)。总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3-N)和化学需氧量(CODCr)等环境因子现场采集水样后带回实验室,通过Hach DR1900 可见分光光度计进行测定。
1.3.2 底栖动物采集 使用1/16 m2的彼德生采集器进行底栖动物采集,每个样点采2~3次。采集的底泥用40目铜筛进行筛洗,将底泥与底栖动物混合物装入标记后的样品瓶,带回实验室分拣,底栖动物用75%的酒精固定。使用OLYMPUS SZ61解剖镜和OLYPUS BX51 显微镜进行底栖动物鉴定,参考文献将底栖动物鉴定至尽可能低的分类单元(刘月英等,1979;王俊才和王新华,2011),最后计数、称重。计数时,若样本损坏,只需记录头部;称量湿重时,先用滤纸吸干样本表面水分。
1.3.3 鱼类数据获取 使用鱼探仪(Simard EY60)和GPS(Garmin60 CSx)“之”字型进行鱼类调查。数据监测时,船只航速保持在6~10 km/h,同时采用GPS进行导航并同步存贮导航信息和调查航线。
1.4 数据处理与分析
1.4.1 底栖动物 底栖动物群落特征采用Shannon-Wiener多样性指数(H')、Margalef丰富度指数(D)、Pielou均匀度指数(J)和优势度(Y)评价,计算公式如下:
式中:S为物种数目,N为总个数;Pi=ni/N,Pi为第i种的个数百分比,ni为第i种的个体数;fi为第i种在采样点的出现频率;若Y≥0.02,表明该底栖动物为优势种(Lampitt et al,1993)。
利用Excel进行数据整理,筛选符合计算标准的底栖动物种类,按物种在样点的出现频度不小于12.5%,且至少在1个样点的相对密度不小于1%进行筛选(Lopes et al,2005);之后对筛选后的底栖动物密度和环境参数(除pH外)进行lg(x+1)转换;最后对处理后的数据进行499次蒙特卡罗置换检验(Monte Carlo Test,P<0.05) ,以判定显著影响底栖摄食功能群的环境因子。单因素方差分析和双因素方差分析在SPSS中进行,检验不同区域环境参数以及生物各指标之间的差异性,显著性水平设置为0.05。
1.4.2 水声学数据 采用回声计数方法进行鱼类密度估算,计算方法如下:
式中:V为每个声纳脉冲(ping)探测的水体体积,θ和σ分别为换能器横向和纵向方向的有效检测角度,R2为探测水深,R1为换能器1 m以下的水深,ρ为单位水体的鱼类数量即鱼类体积密度,N为探测到的鱼类总数量,P为分析数据的ping数量。
采用Foote(1987)提出的公式进行目标强度和体长转换:
TS = 20lgL-71.9 ⑦
式中:TS为目标强度(dB),L为标准体长(cm)。
使用Sonar X对数据进行处理和转换,表层线设置为探头下0.8 m,消除0.75 m的探测盲区。参数设置包括前景滤波器(1,3)、背景滤波器(55,1)、目标平滑滤波(1,3)、信号长度(3,50),最大增益补偿6 dB,最小目标强度2 pings,最大脉冲缺失2 pings,门闸过滤范围0.3 m。
2 结果与分析
2.1 环境因子
对不同时期(表2)和不同区域环境参数(表3)进行单因素方差分析。结果显示,不同时间温度、透明度、水深、氨氮、总磷、硝酸盐、化学需氧量差异性显著(P<0.05),流速、总氮差异性不显著(P>0.05)。不同区域之间溶解氧差异性显著(P<0.05),其他环境因子差异不显著(P>0.05)。
2.2 底栖动物
2.2.1 种类组成 本次调查共采集到底栖动物31种,隶属于3门(环节动物门、节肢动物门、软体动物门)6纲(昆虫纲、甲壳纲、双壳纲、腹足纲、寡毛纲、多毛纲)。其中,改良区S1、S2甲壳纲占比最多,分别为79.03%、55.17%;其他工程区昆虫纲(28.92%)、甲壳纲(27.84%)、寡毛纲(35.95%)占比相近;非工程区寡毛纲占比最多,为79.21%。不同区域底栖动物种类分布情况见表4。底栖动物密度、生物量均选取3种优势类群列举,并以密度或生物量高低排列。
2.2.2 优势种 本次调查共发现优势种类5种(表5),包括马速达多足摇蚊(Polypedilum masudai)、日本大螯蜚(Grandidierella japonica)、围沙蚕(Perinereis sp.)、霍甫水丝蚓(Limnodrilus hoffmeisteri)、颤蚓属一种(Tubifex sp.);其中,日本大螯蜚在整个调查期间占有绝对优势,并在改良区S2优势度值达到最大,为0.460。
2.2.3 密度和生物量 监测区域底栖动物密度为0.00~800.00 个/m2,平均密度为65.28 个/m2;生物量为0.00~42.18 g/m2,平均生物量为1.11 g/m2。
不同区域底栖动物密度及生物量见图2。改良区S2密度明显大于其他区域,总体表现为改良区S2(191.11 个/m2)>改良区S1(60.44 个/m2)>其他工程区(44.44 个/m2)>非工程区(28.39 个/m2);生物量总体表现为其他区域(1.96 g/m2)>改良区S2(0.39 g/m2)=非工程区(0.39 g/m2)>改良区S1(0.09 g/m2)。
2.2.4 生物多样性指数 对改良区S1、改良区S2、其他工程区、非工程区的单因素方差分析(图3)表明,4个区域的丰富度(D)和多样性指数(H′)呈显著差异(P<0.05),均匀度(J)差异性不显著(P>0.05)。
Margalef丰富度指数(D)为0~1.86,整个调查区域均值为0.66,最高值出现在(4月)站点6,总体表现为改良区S2>其他工程区>改良区S1>非工程区;Shannon-Wiener多样性指数(H′)为0~1.88,整个调查区域均值为0.52,最大值出现在(1月)站点6,总体表现为改良区S2>其他工程区>非工程区>改良区S1;Pielou 均匀度指数(J)为0~1.50,整个调查区域均值为0.47,最高值出现在(1月)站点3,总体表现为非工程区>改良区S2>其他工程区>改良区S1。
2.3 水声学调查
2.3.1 鱼类密度 Simard EY60不同区域监测结果见图4。不同断面鱼类密度为0.66~30 897.00 尾/hm2,最小值出现在非工程区(涵养区上游)的B断面,最大值出现在S2断面。改良区S1鱼类密度为2 386.00~4 538.00 尾/hm2 ,均值为3 239.00尾/hm2,改良区S2密度为19 886.00~30 897.00 尾/hm2,均值为25 581.21 尾/hm2,其他工程区鱼类密度为317.16~1 416.70 尾/hm2,均值为808.73 尾/hm2,非工程区鱼类密度为0.66~12.98 尾/hm2,均值为6.82尾/hm2。
鱼类密度总体表现为改良区S2(25 581.21 尾/hm2)>改良区S1(3 239.00 尾/hm2)>其他工程区(808.73 尾/hm2)>非工程区(6.82 尾/hm2),各区域之间鱼类密度均有显著性差异 (P<0.05)。
2.3.2 鱼类目标强度分布 调查水域鱼类目标强度在-62.18~-45.21 dB,均值为-53.89 dB(表6)。其中,改良区S1目标强度为-60.51~-46.27 dB,均值为-56.57 dB,改良区S2目标强度为-61.78~-52.12 dB,均值为-58.33 dB,其他工程区目标强度为-62.18~-45.21 dB,均值为-54.29 dB,非工程区目标强度为-54.23~-45.23 dB,均值为-49.73 dB。目标强度分布在-60~-55 dB最多,达到93.21%,其次为-65~-60 dB、-50~-45 dB,占总调查量的百分比分别为4.53%、2.21%;目标强度-45~-40 dB无分布。
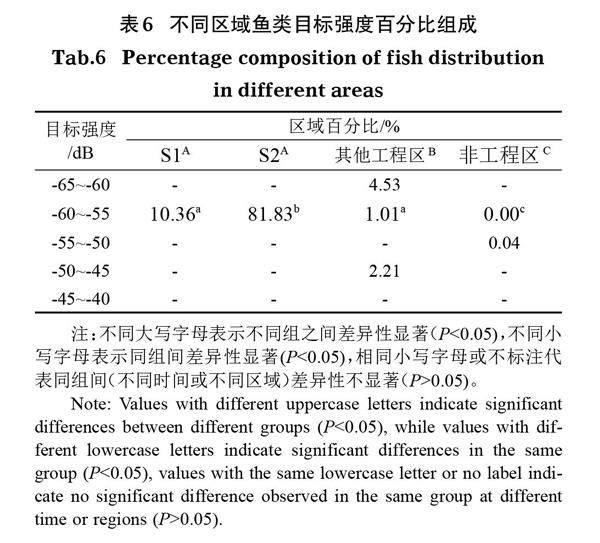
2.3.3 鱼类体长分布 调查结果显示,莲花洲港鱼类体长分布为9.46~52.24 cm,均值为26.30 cm(图5)。不同区域间鱼类体长分布均表现为显著性差异(P<0.05),改良区S1、改良区S2鱼类体长在10~20 cm,非工程区在50~60 cm,其他工程区在0~10 cm、10~20 cm、50~60 cm。其中,鱼类体长分布在10~20 cm的最多,占总调查量的93.21%;其次为0~10 cm,占4.53%;体长20~50 cm的分布最少,仅占约0.01%。
2.4 生物类群与环境因子的关系
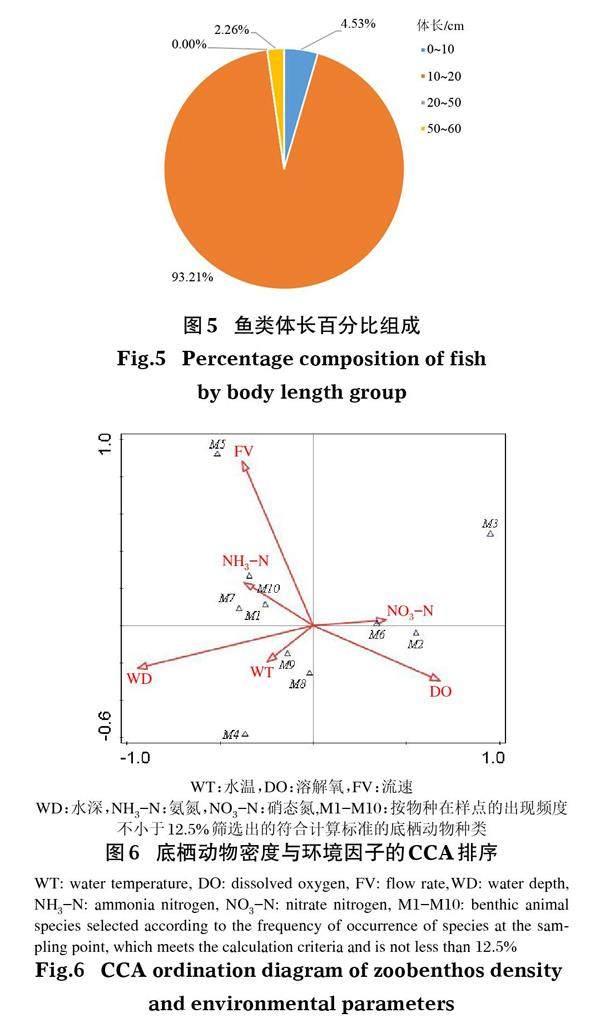
CCA分析结果表明,底栖动物密度与环境因子表现出较强的相关性(图6)。其中,流速、水深、温度、溶解氧、硝态氮、氨氮对底栖动物的影响较大,且不同环境因子与不同物种的相关性有较大差异。
3 讨论
3.1 不同区域的水生生物分布差异
改良区S1、S2甲壳纲底栖动物密度较高,章飞军(2007)也认为底栖动物在群落恢复开始阶段,甲壳类丰度增加较多。莲花洲港航道整治工程于2019年6月完工,底栖动物群落还处于恢复阶段。甲壳纲等生长较快的机会种,其丰富度能够为更高营养级物种的出现提供充足的食物来源,从而进一步促进群落恢复。调查结果显示,其他工程区的生物量最高,与Odum (1969)的假设相反,这是由于生物量的增长主要受初级生产增长的影响,在群落恢复初期,底栖动物生物量恢复的速度低于底栖动物密度。
改良区S1和S2鱼类体长多分布在10~20 cm和50~60 cm;而体长较大的鱼类多分布于其他工程区以及非工程区,这可是因为其具有较强的选择适合流速区域的能力(杜浩等,2010;郭杰,2016;王珂等,2017)。体长较小的鱼类只能被动适应环境,而体长较大的鱼可以自主选择生境较好的索饵区域。刘明典等(2017)研究表明,安庆段鱼类以鲇 、鲫和贝氏? 为优势种。鲇、鲫均为底栖鱼类,由于食物链关系,改良区鱼类密度较高可能与所处区域底栖动物密度较高有关。
3.2 水生生物分布与环境因子的关系
环境因子能够解释大部分底栖动物群落结构的空间分异状况(陈小华等,2013;卓异,2014;李艳利等,2015;Norris & Hawkins,2000)。单因素方差(流速)分析显示,其他工程区>非工程区>改良区S1>改良区S2,且改良区S2流速明显低于其他区域,说明透水框架、鱼巢排等生态友好型结构具有降低流速的作用,与Gunaydma & Kabdas(2003)的研究结果一致。改良区流速变缓,底质粒径变小,更利于寡毛类、腹足纲和摇蚊幼虫等种类的生存(汪兴中,2009;王强,2011)。
鱼类主要受水温(龙华,2005)、光照(白艳勤等,2013)、人类活动(Urban et al,2006)等因素影响。本次研究显示,非工程区水深高于其他区域,与Kendall & Haedrich(2006)的研究结果一致;随水深增加,初级生产力降低,鱼类物种将减少。Maes等(2007)认为,鱼类倾向于溶解氧含量高的水域,非工程区溶解氧低于生态涵养区,水较深、溶氧较低可能是非工程区鱼类密度低于涵养区的原因之一。
3.3 不同区域的生态效果差异
生态涵养区底栖动物密度、Margalef丰富度指数、鱼类密度均大于非涵养区,说明生态涵养区有利于某些底栖动物、鱼类生存及资源恢复。
不同区域底栖动物密度对比结果显示,改良区S2、S1明显大于其他工程区,这与长江中游透水框架护岸工程对底栖动物群落结构的影响(李莎,2015)和长江下游莲花洲港大型底栖动物摄食功能群时空分布及其影响因子(于琪等,2021)的研究结果吻合。改良区S2底栖动物密度、Margalef丰富度指数、Shannon-Wiener 多样性指数均大于改良区S1及其他区域,改良区S2底栖动物群落结构较复杂,说明透水框架、鱼巢排等生态构筑物在一定程度上有利于某些底栖动物生存和资源恢复,且透水框架的生态效应优于鱼巢排区。
不同区域鱼类密度对比结果显示,改良区S1、S2鱼类密度远高于其他工程区,这与郭杰(2016)对航道整治建筑物透水框架生态效应初步研究结果吻合;说明透水框架、鱼巢排生境改良结构对鱼类具有诱集作用。S2的鱼类密度大于S1,说明透水框架营造的水体环境相对于鱼巢排更有益于某些鱼类的生存。
参考文献
白艳勤,陈求稳,许勇,等,2013. 光驱诱技术在鱼类保护中的应用[J]. 水生态学杂志, 34(4):85-88.
陈小华,康丽娟,孙从军,等,2013. 典型平原河网地区底栖动物生物指数筛选及评价基准研究[J]. 水生生物学报, 37(2):191-198.
杜浩,班璇,张辉,等,2010. 天然河道中鱼类对水深、流速选择特性的初步观测——以长江江口至涴市段为例[J]. 长江科学院院报, 27(10):70-74.
耿海彬,廖一鸣,冯蒙,等,2021. 透水框架自密实钢纤维混凝土制备试验研究[J]. 人民长江, 52(9):198-202.
郭杰,2016. 航道整治建筑物透水框架生态效应初步研究[D]. 南京:南京农业大学.
郭杰,王珂,段辛斌,等,2020. 长江中游航道整治工程区沉积物及有机质变化[J]. 水生态学杂志, 41(1):53-59.
黄云龙,2021. 航道整治工程顺水沉排施工问题探讨[J]. 珠江水运, (17):73-74.
李洪,2003. 丁坝水力学特性研究[D]. 成都:四川大学.
李剑辉,金福一,2010. 旋杯式低流速仪应用与维护保养[J]. 水利水文自动化, (1):63-64.
李莎,2015. 长江中游透水框架护岸工程对底栖动物群落结构的影响[J]. 水生态学杂志, 36(6):72-79.
李艳利,李艳粉,徐宗学,2015. 影响浑太河流域大型底栖动物群落结构的环境因子分析[J]. 环境科学, 36(1):94-106.
刘建华,杨中华,李达,等,2020. 考虑底部过流的透水框架群阻力系数研究[J]. 水利水运工程学报, (2):73-78.
刘明典,李鹏飞,黄翠,等,2017. 长江安庆段春季鱼类群落结构特征及多样性研究[J]. 水生态学杂志, 38(6):64-71.
刘月英,张文珍,王耀先,1979. 中国经济动物志:淡水软体动物[M]. 北京:科学出版社.
龙华,2005. 温度对鱼类生存的影响[J]. 中山大学学报(自然科学版), (S1):254-257.
潘保柱,王兆印,何雪宝,2011. 西江大型底栖动物群落特征研究[J]. 水生生物学报, 35(5):851-856.
潘美元,王晓燕,王欣霖,2018a. 透水框架群促淤护滩效果Ⅰ:平面布置形式[J]. 水运工程, (11):5-10,24.
潘美元,王晓燕,王欣霖,2018b. 透水框架群促淤护滩效果研究Ⅱ:分层分时施工[J]. 水运工程, (12):12-15.
汪兴中,蔡庆华,李凤清,等,2009. 南水北调中线水源区溪流大型底栖动物群落结构的时空动态[J]. 应用与环境生物学报, 15(6):803-807.
王俊才,王新华,2011. 中国北方摇蚊幼虫[M]. 北京:中国言实出版社.
王珂,郭杰,段辛斌,等,2017. 荆江航道整治工程中透水框架集鱼效果初步评估[J]. 淡水渔业, 47(4):97-104.
王强,2011. 山地河流生境对河流生物多样性的影响研究[D]. 重庆:重庆大学.
王兆印,程东升,段学花,等,2007.东江河流生态评价及其修复方略[J]. 水利学报, 38(10):1228-1235.
夏炜,2019. 航道整治工程软体排压载体的水力特性[J]. 水运工程, (10):98-105.
杨雪,2016. 长江中段荆江航道整治工程对浮游生物和底栖动物群落的影响研究[D]. 武汉:华中师范大学.
杨燕华,王鑫,许海勇,等,2021. 长江中游航道整治建筑物类型选取方法研究[J]. 应用基础与工程科学学报, 29(6):1347-1358.
于琪,王珂,郭杰,等,2021. 长江下游莲花洲港大型底栖动物摄食功能群时空分布及其影响因子[J]. 淡水渔业, 51(2):47-54.
章飞军,童春富,谢志发,等,2007. 长江口潮间带大型底栖动物群落演替[J]. 生态学报, (12):4944-4952.
卓异,2014. 泉州湾潮间带不同生境小型底栖动物群落的多样性研究[D]. 厦门:厦门大学.
Foote K G, 1987. Fish target t stre engths for use in echo integrator surveys[J]. The Journal of the Acousstical Society of America, 82(3):981-987.
Gunaydma K, Kabdas M S, 2003. Static stability of submerged partial revetment structures under regular and irregular waves[J]. Ocean Engineering, 30:761-777.
Kendall V J, Haedrich R L, 2006. Species richness in Atlantic deep-sea fishes assessed in terms of the mid-domain effect and Rapoport's rule[J]. Deep Sea Research Part I: Oceanographic Research Papers, 53:506-515.
Lampitt R S, Wishner K F,Turley C M, et al, 1993. Marine snow studies in the Northeast Atlantic Ocean: Distribution, composition and marine food sources of plankton[J]. MarBiol, 116(4):689-702.
Lopes M R M, Bicudo CEd M, Ferragut M C, 2005. Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, southeast brazil[J]. Hydrobiologia, 542:235-247.
Maes J, Stevens M, Breine J, 2007. Modelling the migration opportunities of diadromous fish species along a gradient of dissolved oxygen concentration in a European tidal watershed[J]. Estuarine Coastal and Shelf Science, 75:151-162.
Norris R H, Hawkins C P, 2000. Monitoring river heaith[J]. Hydrobiologia, 435:5-17.
Odum E P, 1969. The strategy of ecosystem development[J]. Science, 164:267-270.
Urban M C, Skelly D K, Burchsted D, et al, 2006. Stream communities across a rural-urban landscape gradient[J]. Diversityand Distributions, 12:337-350.
(责任编辑 万月华)
Effect of Ecological Restoration on the Lianhuazhou Port Channel
YE Li‐juan1,2, WANG Ke2, LIU Shao‐ping2, DUAN Xin‐bin2, YU Qi2,
JIA Chun‐yan2,3, CHEN Da‐qing2, ZHENG Yong‐hua1
(1. College of Fisheries, Southwest University, Chongqing 400715, P.R. China;
2. The Yangtze River Fisheries Research Institute of the Chinese Academy of Fishery Sciences,
the Experimental Station for Fishery Resources and Environmental Science Observation
in the Middle and Upper Reaches of the Yangtze River of the Ministry
of Agriculture and Rural Affairs, Wuhan 430223, P.R. China;
3. Shanghai Ocean University Aquatic Science National Experimental Teaching
Demonstration Center, Shanghai 201306, P.R. China)
Abstract:To understand the effect of ecological restoration Lianhuazhou Port, we analyzed and compared zoobenthos community structure and fish distribution in the ecological conservation area, including upstream and downstream from the area. In January, April, and October of 2021, zoobenthos surveys and acoustic monitoring of the fish community were carried out at 21 representative sites of the engineered and nonengineered areas. A total of 31 zoobenthos species from 6 classes and 3 phyla were identified during the investigation. Zoobenthos diversity varied spatially, with 6 species observed in the permeable framework area, 17 species in the fish nest area, 25 species in the remaining engineered area and 8 species in the nonengineered area. The density and biomass of zoobenthos was in the range of 0.00-800.00 organisms/m2 and 0.00-42.18 g/m2, with average values of 65.28 organisms/m2 and 1.11 g/m2. Single factor analysis of variance showed significant differences in zoobenthos density among regions (P<0.05), with the highest density (191.1 organisms/m2) in the permeable framework area, followed by the fish nest area (60.44 organisms/m2), the remaining engineered area (44.44 organisms/m2), and the nonengineered area (28.39 organisms/m2). There were no significant differences in the Pielou evenness index (J) among areas (P>0.05), but the Margalef richness index (D) and Shannon Wiener diversity index (H') did differ significantly (P<0.05) among areas. CCA analysis showed that flow velocity, water depth, temperature, dissolved oxygen, nitrate nitrogen, and ammonia nitrogen were the environmental factors most affecting the zoobenthos. Underwater acoustic surveys of fish community showed that fish density in the permeable frame area was the highest (25 581.21 fish/hm2), followed by the fish nest area (3 239.00 fish/hm2), the remaining engineered area (808.73 fish/hm2), and the nonengineered area (6.82 fish/hm2). In conclusion, the permeable frame and fish nest both created water flow conditions conducive to zoobenthos survival and fish aggregation, but the effect of permeable frames was better than that of fish nests.
Key words:waterway engineering; ecological restoration; zoobenthos; permeable frame; artificial fish nests; Lianhuazhou Port
收稿日期:2022-01-11 修回日期:2023-04-19
基金项目:国家重点研发计划-2018YFD0900901;长江干线武汉至安庆段6 m水深航道整治工程 探索生态涵养试验区建设理念及设计方法研究;中国水产科学研究院创新团队项目( 2020TD09);中国长江三峡集团有限公司项目“长江水生生物完整性评价指标体系研究”(202003229)。
作者简介:叶丽娟,1997年生,女,硕士研究生,研究方向为渔业发展。E-mail:1926383320@qq.com
通信作者:郑永华,1963年生,男,副教授,主要从事水产养殖、渔业资源环境与生态方面的教研工作。E-mail:zhyh3000@163.com

