杜仲种子内生微生物群落组成及生态功能分析
张青青 董醇波 邵秋雨 陆莹霞 董旋 梁宗琦 韩燕峰

关键词:高通量测序;可培养法;多样性;生态功能
植物内生菌(Endophytes)是指某一阶段或所有阶段生活在健康植物的组织或器官中,与植物建立特殊的相互关系,并不会对宿主引起明显病害的一类微生物。据报道,植物内生菌作为一种新兴微生物资源,对植物的生长和健康至关重要,且在医学、农业、工业等领域具有潜在的应用前景。
种子是植物的重要繁殖器官,是遗传信息的保存和传递者,其内携带丰富多样的微生物。种子内生菌主要包括多种真菌和细菌,能从不同环境(如空气、水、昆虫)通过水平传播获得,同时也能从母株通过垂直传播获得,并代代相传。种子中常见真菌属有链格孢属(Alternaria)、枝孢霉属、青霉属等,常见细菌属有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、泛菌属(Pantoea)等;而种子内生菌的群落组成和多样性常受多种生物与非生物因素的影响,如植物品种、基因型、种子成熟过程、地理位置及病原体入侵等。研究表明,种子作为微生物的载体会因自身及特殊的生存环境在内部形成独特的微生物群落,这些特殊类群可为宿主植物提供保护功能。当种子内生菌作为益生微生物资源,能通过直接(如固氮、溶磷和产生植物激素)或间接作用(对抗植物病害、提高植物抗逆性和生物与非生物的耐受性)促进种子的萌发和幼苗的建立
除此之外,种子相关内生菌可以产生与宿主次级代谢成分相同或者相似的化合物,它们能调控宿主植物的次级代谢,促进有效成分的合成与积累。陈海敏等发现,种子中的草茎点霉(Phoma herbarum)D603可以有效促进丹参根部丹参酮类成分,尤其是丹参酮IIA的合成与积累。然而,并非所有的微生物都是有益的,种子携带的一些病原菌会降低种子活力、抑制种子萌发和引起植物病害,进而对粮食作物和林木安全生产造成威胁。因此,了解种子相关的微生物群落组成和功能可以帮助我们了解种子健康,防止有害微生物的影响,并充分利用与种子相关的有益微生物。
杜仲(Eucommia ulmoides Oliver)是我国特有的药用和经济树种,作为药材,具有降压、增强免疫力、降血糖等药理作用;杜仲果、叶、皮中均含有丰富的杜仲橡胶,且杜仲果实富含油脂,是开发保健品、功能食品、高档食用油的优质原料。前期研究发现,杜仲的不同组织中都伴有丰富的内生微生物,并且这些微生物与宿主健康、生产力和药用成分的合成和积累有关。杨娟等研究表明,杜仲树皮中的某些真菌类群与树皮的药理活性成分成正相关。Dong等通过探究杜仲树皮中细菌群落组成和核心微生物群的功能,发现细菌菌群中的大部分核心菌群与树皮的药理活性成分相关。然而,迄今为止,大多数相关研究通常集中在根际、茎、叶,对于杜仲种子相关微生物的组成结构以及生态功能的了解仍然知之甚少。因此,本研究结合分离培养法和高通量测序技术对杜仲种子内生真菌和细菌群落组成结构和多样性进行探究。同时,利用FUNGuild和FAPROTAX平台进行功能注释。高通量测序技术能更加全面的揭示杜仲种子内生菌群落组成和多样性,可培养法可以分离获得实体菌株,这2种方法的结合能全面认识杜仲种子微生物,丰富杜仲相关微生物资源,并为今后杜仲种子内生菌的功能研究以及杜仲的高效栽培提供参考依据。
1材料与方法
1.1种子处理
杜仲果实采自陕西省汉中市宁强县大安镇。样品编号后封存在自封袋中,放人4℃冰箱保存备用。将杜仲果实剥去果皮,称取5g种子置于烧杯中,依次用无菌蒸馏水对杜仲种子进行冲洗,75%的酒精消毒30s,5%的次氯酸钠进行消毒3~5min,75%酒精消毒30s,最后使用无菌蒸馏水冲洗5~6遍,在无菌条件下晾干,以备用。将最后一次冲洗种子的无菌水涂布到PDA培养基和LB培养基上作为对照实验,以保证表面灭菌彻底。
1.2分离培养
1.2.1内生真菌的分离纯化真菌的分离培养基分别使用PDA培养基、MS培养基。分离方法采用(1)组织块分离法:将一部分表面灭菌好的种子放人研钵中碾碎,直接放在PDA培养基和MS培养基中;另一部分使用无菌刀划开几个小口,将其接种到PDA培养基、MS培养基,并保证切口直接接触培养基,各设置3个重复;(2)稀释涂布平板法:取表面灭菌后的种子样品5g,放在加有5mL的无菌蒸馏水的无菌研钵中充分研磨,装入离心管中充分摇匀,并稀释成10-1、10-2、10-3悬液,分别吸取100、200、300UL稀释液涂布于PDA培养基中,每个处理3个重复,置于25~28℃下培养5~7d。待菌丝长出,用接菌针从边缘挑取菌丝移至PDA平板,采用菌丝顶端纯化法对分离出的菌种逐步进行纯化。
1.2.2内生细菌的分离纯化细菌的分离培养基使用LB、NA、牛肉膏蛋白胨培养基。分离方法采用稀释涂布平板法:取表面灭菌后的样品5g,放在加有5mL的无菌蒸馏水的无菌研钵中充分研磨,装入离心管中充分摇匀,将其稀释成10-1、10-2、10-3悬液,并分别吸取100、200、300μL稀释液涂布于LB、NA、牛肉膏蛋白胨培养基中,各设置3个重复,置于25~28℃下培养4~5d。根据菌落形态(大小、形状、颜色、表面光泽度、边缘整齐度、透明度等),随机挑取具有差异的代表性菌株进行平板划线法逐步纯化。
1.3分子鉴定
1.3.1DNA的提取、PCR扩增反应参考真菌基因组DNA提取试剂盒(北京白泰克生物技术有限公司)和细菌基因组DNA提取試剂盒(北京百泰克生物技术有限公司)进行真菌和细菌的DNA提取。细菌16SrDNA引物:27F(5-AGAGTTTGATGCTGGCTGAG-3)和1 492R(5-GGTTACCTTGTTACGACTT-3),真菌ITS引物:ITS1(5-TCCGTAGGTGAACCTGCGG-3 7)和ITS4(5-TCCTCCGCTTATTGATATGC-3).PCR反应体系( 25 pL):引物ITS1和ITS4均为1 UL,2×Taq PCR Master-mix为12.5UL, ddH20 8.5pL,细菌/真菌DNA 2 pL。细菌PCR反应条件:95℃预变性5min,92℃变性30s,50℃退火30s,68℃延伸2min,共35个循环,78℃延伸8min。真菌PCR反应条件:94℃预变陛5min,1个循环,94℃变性1min,50℃退火1min,72℃延伸1min,共35个循环,72℃延伸10min。分别取扩增后的PCR产物进行琼脂糖凝胶电泳检测合格后,送至昆明硕擎生物科技有限公司进行测序。
1.3.2序列数据分析将获得的待鉴定的ITS和16SrDNA扩增序列,经手工校对后登陆NCBI(http://blast.ncbi.nlm.nih.gov)进行blast比对,得到相似度最高的序列,进行种属鉴定。
1.4高通量测序
1.4.1总DNA提取、PGR扩增及llluminaMiSeq测序选取颗粒大小一致的饱满种子,经表面灭菌后(同上1.1),分别用液氮进行充分研磨,并装入无菌离心管中,样本共设置3个重复。处理后的所有样本均置于-80℃冰箱保存,用于总DNA提取和高通量测序。总DNA的提取按总DNA提取试剂盒(FastDNA⑩SPIN Kit for Soil)的说明书操作程序进行。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。PCR扩增分别选用ITS1区真菌引物(ITSIF,5-CTTGGTCATTTAGAGGAAGTAA-3和ITS2R,5-GCTGCGTTCTTCATCGATGC-3)和细菌引物(799F,5-AACMGGATTAGATACCCKG-3和1193R, 5'-ACGTCATCCCCACCTTCC-3)。采用20mL的PCR反应体系:5×Buffer4UL,2.5mmoI.L-1 dNTPs 2UL,每个正向和反向引物(5mol-1)0.8UL,rTaq多聚酶0.4pL,BSA 0.2UL,模板DNA10ng,而后补ddH20至20UL。真菌PCR扩增反应参数:95℃3min;95℃30s,退火温度55℃30s,72℃45s,35个循环;72℃10min,10℃直至用户停止。细菌PCR扩增反应条仵:95℃3min;95℃15s,退火温度55℃30s,72℃45s,13个循环;72℃10min,4℃保存。PCR仪:ABI GeneAmp9700型。得到的PCR产物经上海美吉生物医药科技有限公司(www.majorbio.com)lllumina Miseq平台进行高通量测序。
1.4.2原始数据处理使用Qiime2软件中的DADA2插件对所有样品的全部原始序列进行质控、去噪、拼接及去嵌合体处理,形成OTU(operational taxonomic unit)。选取OTU的代表性序列于Unite(Release7.0,http://unite.ut.ee/index.php)数据库进行比对,获得每个OTU的物种注释信息。基于物种注释信息,去除注释为叶绿体、线粒体和不能注释到界(kingdom)水平的OTU及其包含的序列,最终形成数据均一化的OTU及其他分类水平物种丰度谱。
1.5多样性分析
使用Qiime2和Excel软件计算各样本Alpha多样性指数,包括香农.维纳指数(Shannondiversity index)、辛普森指数(Simpson diversityindex).chaol指数、ACE指数等。
1.6生态功能注释
真菌功能类群分析:采用FUNGuild(http://fungu.ld.org)数据库对真菌群落进行功能注释,置信度选择可能(probable)和很可能(highlyprobable)。
细菌功能类群分析:采用FAPROTAX数据库(http://www.ehbio.com/lmageGP/index.php/Ho-me/lndex/FAPROTAX.html)对细菌群落进行功台旨注释。
2结果与分析
2.1杜仲种子微生物群落组成
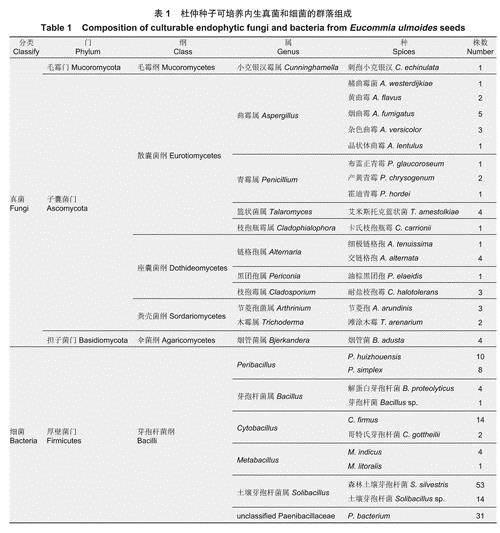
传统培养法获得的杜仲种子微生物群落组成(表1)表明:采用分离培养法共获得真菌40株,初步鉴定为3门、5纲、8目、10科、11属、18种。在门水平,杜仲种子中可培养真菌归为3个门:子囊菌门(Ascomycota)(87.50%)、担子菌门(10%)、毛霉门(Mucoromycota)(2.50%),其中,子囊菌门(Ascomycota)为主要优势菌门,其次为担子菌门。在纲水平,散囊菌纲(Eurotiomycetes)为主要优势菌纲,占比52.50%;其决为座囊菌纲(Dothideomycetes)(22.50%)、粪壳菌纲(Sordariomycetes)(12.50%)、伞菌纲(Agaricomycetes)(10%)以及占比为2.50%的毛霉纲(Mucoromycetes)。在属水平,以曲霉属(Aspergillus)(30%)、链格孢属(Alternaria)(12.50%)为主要优势属,随后是占比均为10%的青霉属(Penicillium)、篮状菌属(Talaromyces)、烟管菌属(Bjerkandera),枝孢霉属(Cladosporium)(7.50%)和节菱孢菌属
(Arthrinium)(7.50%)较为常见。在种水平上,烟曲霉(Aspergillus fumigatus)(12.50%)、交链格孢(Alternaria alternata)(10%)、艾米斯托克蓝状菌(Talaromyces amestolkiae)(10%)占据一定优势。
杜仲种子中分离到内生细菌共142株,隶属于1门(厚壁菌门(Firmicutes))1纲(芽孢杆菌纲(Bacilli))1目(芽孢杆菌目(Bacillales))5科6属(含1个未定属)11种(含2个未定种)。6个属中,土壤芽孢杆菌属(Solibacillus)以47.18%的相对多度占据优势地位,其次为类芽孢杆菌科( Paenibacillaceae)中一未定属
(21.83%)、Peribacillus(12.67%)和Cytobacillus(11.27%)。在种水平,森林土壤芽孢杆菌(Solibacillus silvestris)(37.32%)在整个细菌菌群中占有绝对优势,类芽孢杆菌科(Paenibacillaceae)中一未定属(21.83%)、坚强芽孢杆菌(Cytobacillus firmus)(9.86%)和一种土壤芽孢杆菌(Solibacillus sp.)(9.86%)
次之。此外,Peribacillushuizhouensis(7.04%)和Peribacillussimplex(5.63%)也占据较高比例。
高通量测序获得的杜仲种子微生物群落组成:对杜仲种子内生真菌和细菌测序获得平均有效序列分别为64 368条、40121条,平均长度为234、376bp。杜仲种子内生真菌归为141个OTUs,包括6门、15纲、38目、76科、101属。在门水平,内生真菌肃属于子囊菌门( Ascomycota)、担子菌门、鞭毛菌门(Mortierellomycota) 、罗兹菌门(Rozellomycota)、球囊菌门(Glomeromycota)和未分类真菌6大类,其中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)为主要优势门,分别占比47.56%和46.91%;在属水平,主要包括Apiotrichum、德巴利氏酵母属15个优势属,其中Apiotrichum(31.28%)和德巴利氏酵母属(Debaryomyces)(26.07%)占有绝对优势,为主要优势属(图1a)。其余优势属如Leucosporidium、Kernia、青霉属(Penicillium)等总占比为30.04%。常见属如链格孢属(Alternaria)(0.87%)也占据较高比例。
杜仲种子内生细菌归为442个OTUs,包括24门、46纲、117目、193科、313属。在门水平,内生细菌隶属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota).放线菌门(Actinobacteriota)和蓝细菌(Cyanobacteria)等24大类,其中,优势门主要为变形菌门( Proteobacteria)和厚壁菌门(Firmicutes),分别占比52.49%和17.22%;随后为拟杆菌门(Bacteroidota)(10.72%)、放线菌门(Actinobacteriota)(10.55%);在纲水平,以Y-变形菌纲(Gammaproteobacteria)(33.68%),(18.81%)为优势纲;在属水平,所有类群主要归为假单胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)、鞘氨醇单胞菌属(Sphingomonas)、固氮弧菌属(Azoarcus)等13个优势属,主要优势类群为假单胞菌属(Pseudomonas)(16.66%),其次为乳杆菌属(Lactobacillus)(9.68%)、鞘氨醇单胞菌属(Sphingomonas)(8.22%)(图1b)。
综上表明,与传统培养法相比,高通量测序技术能获得更多种类和数量的杜仲种子内生真菌和细菌。
从门水平上分析,2种方法获得的优势真菌都主要集中在子囊菌门(Ascomycota)、担子菌门(Basidiomycota),但其占比不同;高通量测序获得的优势细菌主要集中在变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),而可培养法主要分离到厚壁菌门(Firmicutes)的细菌。而从属水平上分析发现,高通量获得的菌株,如优势真菌青霉属(Penicillium)、曲霉属(Aspergillus)、枝孢霉属(Cladosporium)可通过可培养法获得,并同样占据优势地位(表1和图1)。另外,以上结果还可看出,高通量测序法获得的大部分菌株都属于未被培养的菌株。因此,2种方法的结合能更加全面的揭示杜仲相关内生菌的组成和结构。
2.2杜仲种子微生物多样性
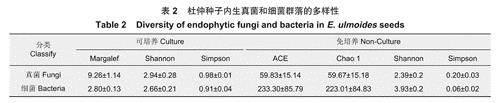
在a多样性指数中,Margalef指数、Chao1和ACE指数表示微生物群落的丰富度,值越大,丰富度越高。Shannon和Simpson指数表示微生物群落的多样性程度,Shannon指数值越大,多样性越高,而Simpson指数值越小,多样性越大。在97%相似性下,分析杜仲种子内生真菌和内生细菌的多样性指数(表2)。a多样性指数分析结果表明,与传统培养法相比,高通量测序技术得到的多样性指数Shannon、高通量测序技术能更完整的展现出杜仲种子中微生物群落的丰富度和多样性。
2.3杜仲种子微生物群功能分析
使用FUNGuilds平台对杜仲种子内真菌类群的营养型和生态功能类群进行分析,其中,110个OTUs被成功注释,营养型包括腐生型(Saprotroph)(950TUs,82.97%)、致病-腐生-共生型(Pathotroph-Saprotroph-Symbiotroph)(18 0TUs,6.10%)、致病型(Pathotroph)(12 0TUs,2.41%)、致病.腐生型(Pathotroph-Saprotroph)(7 0TUs,6.60%)、腐生-共生型(Saprotroph-Symbiotroph)(6 0TUs,0.63%)、共生型(Symbiotroph)(4 0TUs,0.34%)、致病-共生型(Pathotroph-Symbiotroph)(3 0TUs,0.83%)、致病-腐生-共生型(Pathogen-Saprotroph-Symbiotroph)(1 0TU,0.11%)8大类。除未定类群(unknow),所有真菌类群主要涉及到未定义腐生茵(Undefined Saprotroph)(48 0TUs,33.83%)、植物病原菌(PlantPathogen)(5 0TUs,0.49%)、动物病原菌(Animal Pathogen)(5 0TUs,1.28%)、木质腐生菌(Wood Saprotroph)(4 0TUs,
0.45%)、真菌寄生菌(Fungal Parasite)(20TUs,0.27%)、粪生真菌(Dung Saprotroph) (2 0TUs,0.21%)、丛枝菌根(Arbuscular Mycorrhizal fungi)(2OTUs,0.06%)、土壤腐生菌(Soil Saprotroph)(1 0TU,31.28%)、地衣(Lichenized fungi)(1 0TU,0.16%)、外生菌根(Ectomycorrhizalfungi)(1 0TU,0.07%)10类生态功能类群。此外,还包括多种混合功能类群如真菌寄生.未定义腐生菌(Fungal Parasite-UndefinedSaprotroph)(4 0TUs,1.51%)、内生菌-地衣腐生菌-土壤腐生菌-未定义腐生菌( Endophyte-Litter Saprotroph-Soil Saprotroph-UndefinedSaprotroph)(4 0TUs.0.48%)、内生菌-植物病原菌(Endophyte-Plant Pathogen)(2 0TUs,0.21%)等21类。31个OTUs在FUNGuilds数据库中未能注释到对应功能。整体来看,在OTU水平上杜仲种子内的真菌功能群主要集中于未定义腐生菌(48 0TUs)、植物病原菌(5 0TUs)、动物病原菌(5 0TUs)(图2a)。在属水平,物种丰度占比最高的Apiotrichum(31.28%)、德巴利氏酵母属(Debaryomyces)(26.07%)分别属于腐生型中的土壤腐生菌和未定义腐生菌。此外,一些常见属在生态系统中扮演多重角色,如枝孢霉属(Cladosporium)、链格孢属(Alternaria),既属于动物病原菌,又属于内生菌、植物病原菌、腐生菌。
使用FAPROTAX平台对细菌功能分类注释(图2b),选取总丰度前50的功能,结果发现,杜仲种子中的细菌群落生态功能归为化能异氧(chemoheterotrophy)、有氧化能异养(aerobicchemoheterotrophy)、
发酵(fermentation)、硝酸还原(nitrate reduction)、亚硝酸呼吸(nitrate respiration)、尿素分解(ureolysis)、动物寄生生物或共生体(animal parasites orsymbionts)、芳香族化合物降解(aromaticcompound degradation)、固氮作用(nitrogenfixation)、人类病原菌(human pathogens)、植物病原菌(plant pathogen)等44个功能类群,其中,细菌功能主要集中于化能异氧(31.96%)、有氧化能异养(23%)、发酵(8.79%)。部分集中于硝酸还原(4.50%)、亚硝酸呼吸(3.06%)、氮呼吸(3.06%)、尿素分解(2.63%)、动物寄生生物或共生体(2.51%)、芳香族化合物降解(1.88%)、固氮作用(1.61%)、人类病原菌(1.38%)、植物病原菌(1.03%)9类。少部分属于暗氢氧化(dark hydrogen oxidation)(0.95%)、亚硝酸盐氨化(0.92%)等32个功能类群,总占比为14.60%。
3讨论
种子微生物是定殖于种子和幼苗的第一个微生物群,这类微生物的组成和垂直传播对种子质量、植物生长及次生代谢产物的合成至关重要。本研究通过对杜仲种子内生真菌和细菌进行分离培养,最终获得真菌共40株,鉴定为3门11属,主要优势属为曲霉属(30%)、链格孢属(12.50%);内生细菌共142株,鉴定为1门6属,以土壤芽孢杆菌属(47.18%)为主要优势属。该结果与早前研究报道有相似之处,如链格孢属被证实是植物种子中最常见的真菌属。其次,与本课题组前期在杜仲树皮中分离到的内生菌相比,种子中的内生菌种类和数量明显降低,说明内生菌在同种植物不同器官中的分布存在差异。这可能是由于种子是受植物高度保护的封闭性器官,导致其内生菌的种类和数量比其他器官要少。由于自然环境中绝大多数微生物是不能被传统培养方法所培养,常规分离培养方法和较单一培养基分离到的微生物并不能完整地反映杜仲种子中微生物的群落结构,而高通量测序结果分析能更全面的展现杜仲种子中微生物群落结构和多样性。因此,本文以高通量测序结果对杜仲种子内生微生物多样性和功能进行补充分析。
功能预测注释到多种有益功能菌群。目前,报道指出,植物种子的内生细菌主要集中在变形菌门、厚壁菌门和放线菌门;而本研究也发现,变形菌门和厚壁菌门为杜仲种子中细菌的主要优势门。在属水平,细菌主要包括假单胞菌属、乳杆菌属、鞘氨醇单胞菌属、固氮弧菌属等13个优势属,其中,假单胞菌属(16.66%),乳杆菌属(9.68%)和鞘氨醇单胞菌属(8.22%)在整个细菌群落中占有绝对优势。相关研究表明,假单胞菌和鞘氨醇单胞菌作为有益内生菌广泛存在水稻、烟草、丹参等植物种子中,它们可以通过提高植物的固氮能力或启动植物免疫系统、分泌抗生素以及抑制病原菌(与病原体竞争资源)来改善植物生产力和健康。如Pham等发现,固氮菌(Pseudomonasstutzeri)A15在温室条件下能显著促进水稻幼苗的生长,且该菌株的固氮效果优于普通化学氮肥。绿蚜假单胞菌(Pseudomonas chlororaphis)和Pseudomonas aurantiaca可以通过产生次级代谢产物促进植物生长。沈兴亮等证实,Pseudomonasfluorescens能显著提高茶树的生长生理水平。Sphingomonas sp. cra20也被证明在干旱胁迫下能促进拟南芥根系的发育,并改变根际微生物群落结构。同时,Matsumoto等研究发现,Sphingomonasmelonis能在抗病水稻种子中积累、代代相传,并通过产生邻氨基苯甲酸(anthran.lic acid)使高感病品种产生抗病性。李晓君等报道,来自丹参根中的Pseudomonas sp.具有抗氧化和抗菌活性的作用。此外,生态功能注释结果也显示杜仲种子中的细菌功能大多集于潜在化能异氧、有氧化能异养、硝酸还原、氮呼吸、固氮作用。总之,杜仲种子中存在的多种潜在有益细菌在调节氮循环和对抗病原体中可能发挥一定的重要性作用。
在真菌中子囊菌门和担子菌门为主要优势门,其中,Apiotrichum(31.28%)和德巴利氏酵母属(26.07%)为主要优势属。近期研究发现,Apiotrichum中的某些物种被认为能产生油脂类的次级代谢物,这可能与杜仲种子中富含大量的油脂类物质相关。如Apiotrichum porosum DSM27194被证实不仅能同化乙酸、丙酸、丁酸及其不同混合物以积累微生物油脂,还具有将木质纤维素水解产物中的多种碳源转化为微生物油脂的能力。而德巴利氏酵母属对灰霉病、炭疽病具有明显的抑制作用。此外,生态功能注释结果表明,在杜仲种子中多数真菌都属于腐生型真菌(95 0TUs,82.97%),这些真菌被认为具有降解木质素、纤维素的能力,其可能参与凋落物的分解,帮助宿主吸收有机物和矿物质元素。凋落物的分解是森林生态系统化学循环的主要环节之一,对群落组成及分布具有重要作用。另外,部分真菌还被注释为内生真菌、外生菌根真菌和丛枝菌根真菌,这些类群有较强的适应能力,可促进宿主植物生长、土壤养分吸收与利用、改善土壤环境微生物群落结构。如球囊菌门作为一类的重要的真菌门类,其成员包括一些分布广泛、具有重要生态意义的真菌群一丛枝菌根真菌(AMF)。该类真菌不仅能改善磷营养、促进非生物和生物胁迫的耐受性,还能通过菌丝网络和产生如球囊霉素等土壤颗粒结合物质并维持土壤的物理性质,在土壤聚集中发挥重要作用。因此,该类微生物可为种子在自然环境中的萌发提供各种有利条件。然而,除了注释到的大量有益功能菌群,还有相当部分OTU被检测为植物病原菌。如链格孢属是多种植物病原菌,相关文献报道称这类真菌是引起小麦黑斑病、刺梨叶斑病的重要致病菌。因此,揭示种子相关微生物组成和功能是了解种子健康以及后续人为调整微生物菌群增强植物健康、提高作物产量和质量的先决条件。
4结论
本研究结果证实了杜仲种子中存在多种内生细菌和真菌,且功能注释表明杜仲种子中携带多种有益功能菌和潜在致病菌。本研究不仅分离到节菱孢菌属(引起大麦立枯病)、链格孢属和黑团孢属(引起刺梨叶斑病)等多种已被报道的植物病原菌,同时还获得多株可能对植物生长及生防具有潜在作用的内生菌(如青霉属、曲霉属、枝孢霉属和芽孢杆菌属)。但这类微生物是否对杜仲植物生长及药理活性成分的合成产生积极影响,还有待进一步研究。此外,高通量测序数据还可以帮助我们通过确定优势目标菌株,然后针对目标菌株的特性选择更为合适的培养基,从而最大限度地获取更多的内生菌。因此,本研究结果将为今后杜仲种子内生菌的功能研究、杜仲的高效栽培以及生物防治提供参考信息。

