线粒体动力学在糖尿病心肌病中的研究进展
王一硕 罗皓文 王晨旭 孙路轩 阿如汗 张茵 常盼
[基金项目:陕西省科技厅项目(2021JQ-787);陕西省卫健委项目(2021E023);2022年省级大学生创新创业训练计划项目(S202211840036)
通信作者:常盼,E-mail:herepanpan@163.com]
【摘要】糖尿病心肌病是糖尿病患者死亡的主要原因之一,其發病机制尚未完全阐明。线粒体作为细胞能量工厂,与糖尿病心肌病的发病及进展密切相关。既往研究已经发现,线粒体能量代谢紊乱、氧化应激增强、钙稳态失调和线粒体自噬等因素与糖尿病心肌病密切相关。近年来,线粒体动力学作为上述损伤机制的上游事件得到广泛关注。现将重点阐述线粒体动力学在糖尿病心肌病的发病机制及演进过程中的研究进展。
【关键词】糖尿病心肌病;线粒体动力学;融合;分裂;平衡
【DOI】10.16806/j.cnki.issn.1004-3934.2023.12.000
Mitochondrial Dynamics in Diabetic Cardiomyopathy
WANG Yishuo1,LUO Haowen1,WANG Chenxu1,SUN Luxuan1,Aruhan1,ZHANG Yin1,CHANG Pan2
(1. Department of Anesthesia,the Second Clinical Medical College,Xian Medical College,Xian 710038,Shaanxi,China;2. Department of Cardiology,the Second Affiliated Hospital of Xian Medical College,Xian 710038,Shaanxi,China)
【Abstract】Diabetic cardiomyopathy is one of the main causes of death in diabetic patients,and its pathogenesis has not been fully elucidated. Mitochondria,as the cell's energy factories,are closely related to the occurrence and progression of diabetic cardiomyopathy. Previous studies have found that mitochondrial energy metabolism disorders,oxidative stress,calcium homeostasis imbalance,and mitochondrial autophagy are closely related to diabetic cardiomyopathy. In recent years,mitochondrial dynamics as an upstream event of these pathological mechanisms have attracted widespread attention. This article reviews the role of mitochondrial dynamics in the pathogenesis and progression of diabetic cardiomyopathy.
【Key words】Diabetic cardiomyopathy;Mitochondrial dynamics;Fusion;Fission;Balance
糖尿病(diabetes mellitus,DM)是全球患病率最高的慢性病之一。国际糖尿病联盟最新版世界糖尿病报告指出,1980—2022年糖尿病患者人数从1.08亿增加到5.37亿。其中,中国糖尿病患者人数为1.41亿,占全球报告患者总人数的26.3%。据报道[1],糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病最主要的并发症之一,其以心肌细胞肥大、心肌间质纤维化和冠状动脉微小血管病变为主要病理特征,并排除高血压心脏病、冠心病、风心病等其他心脏疾病的干扰[2]。DCM在DM患者中的发病率为16.9%,致死率和致残率分别约为18%和22%。DCM早期不易被检出,病变极易进展到终末期的心力衰竭[3],最终可导致75%以上的DM患者死于心力衰竭[4]。因此,探究DCM的发病机制并进行早期干预,对DCM的预防与治疗具有重要的意义。
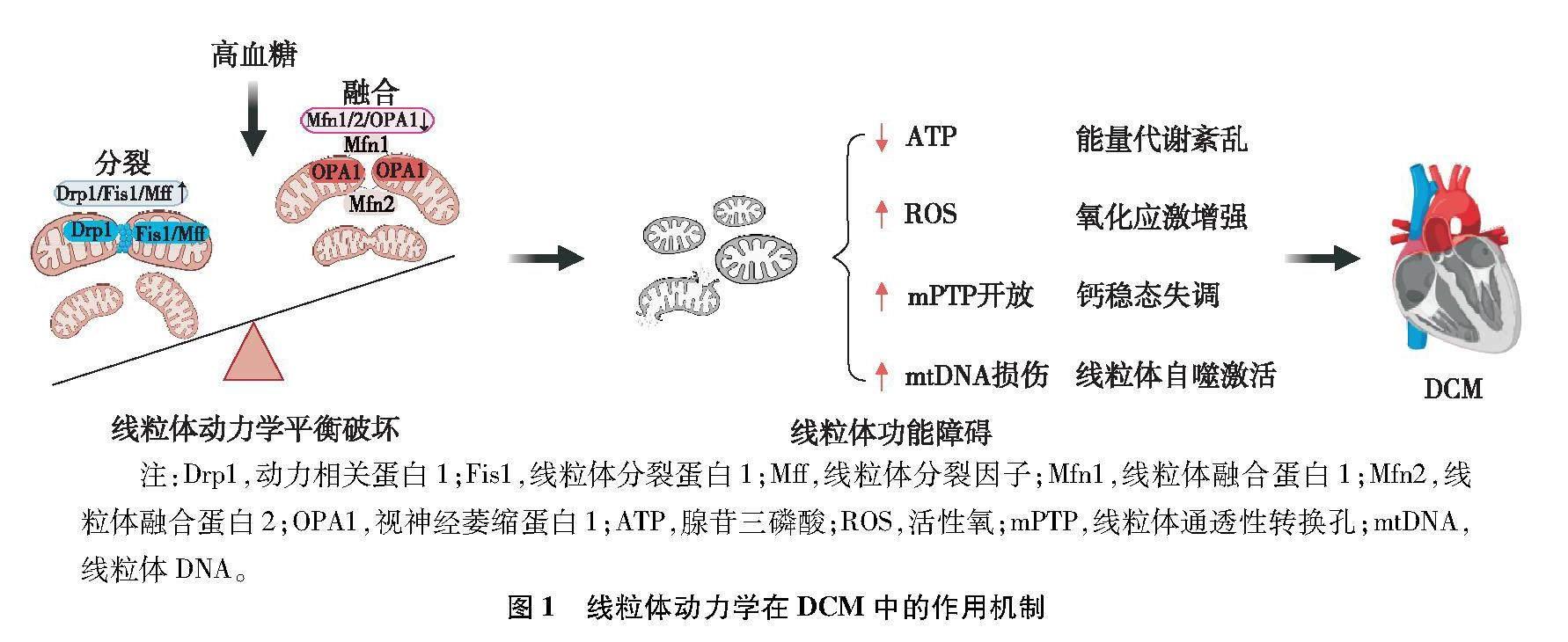
线粒体是一种高度动态的细胞器,可进行连续循环的融合与分裂以改变线粒体形态、大小及位置,该生理过程被称为线粒体动力学。研究[5]发现,线粒体可通过融合、分裂及自噬以补充和修复线粒体DNA及相关蛋白,给细胞提供能量,满足机体能量需求。线粒体的氧化呼吸链是心肌细胞最主要的能量来源,因此线粒体的正常形态和功能对维持心肌细胞功能和结构稳态至关重要。在心肌细胞中,持续高血糖可通过抑制线粒体融合和促进线粒体分裂,破坏线粒体动力学稳态,进而引起线粒体能量代谢紊乱、氧化应激增强、钙稳态失调和线粒体自噬激活等,导致线粒体功能障碍,继而引起心肌细胞肥大、心肌间质纤维化和冠状动脉微小血管病变[6]等,促使DCM的发生与发展(图1)[7]。
由于线粒体动力学平衡紊乱是DCM的主要促发因素,因此,维持线粒体动力学稳态、促使线粒体发挥正常的功能可能是治疗DCM的重要靶点。现主要讨论线粒体动力学在DCM发病及进展过程中的作用机制,以期为DCM的有效防治提供新思路和新靶点。
1线粒体融合与DCM
1.1线粒体融合蛋白
线粒体融合是线粒体形态改变的一种方式,其可导致线粒体结构延长,腺苷三磷酸(adenosine triphosphate,ATP)含量增加,以及各种线粒体活性物质被转移至新融合的线粒体中。在哺乳动物细胞中,线粒体融合蛋白1/2(mitofusin1/2,Mfn1/2)和视神经萎缩蛋白1(optic atrophy l,OPA1)通过调节相邻两个线粒体的外膜、内膜和基质融合等功能,使线粒体DNA、蛋白质和代谢产物得以共享,修复受损的线粒体,从而维持线粒体遗传物质的稳定性[8]。Mfn1和Mfn2定位于线粒体外膜,在缺乏Mfnl或Mfn2时,线粒体融合受抑制;当Mfn1和Mfn2同时缺乏时,线粒体融合完全消失[9]。以上提示Mfnl及Mfn2在线粒体融合中发挥不可或缺的作用。OPA1作为线粒体动力学相关的蛋白质合成GTP酶,在介导线粒体内膜融合过程中发挥重要作用。其经历不同位点的剪切后可形成长型OPA1(long-OPA1,L-OPA1)和短型OPA1(short-OPA1,S-OPA1)。L-OPA1锚定在线粒体内膜上,它与Mfnl和Mfn2共同作用,介导线粒体内膜融合[10]。然而,线粒体产能不足或功能障碍时会导致金属蛋白酶升高,进一步降解L-OPA1,从而打破其与内膜的锚定,抑制线粒体融合。S-OPA1局限于线粒体膜间腔,主要参与线粒体氧化磷酸化以及线粒体嵴形态的重构。最近有研究发现,S-OPA1与内质网和线粒体接触点的线粒体外膜分裂组件[线粒体蛋白动力相关蛋白1(dynamin-like protein 1,Drp1)和线粒体动力学蛋白49 kDa(mitochondrial dynamics proteins of 49 kDa,MiD49)]有共同定位,能够促进线粒体分裂,但其作用机制尚不清楚。
1.2Mfn1/2与DCM
Mfn1和Mfn2是线粒体融合的关键蛋白。Mfn1通过调控线粒体嵴形态的重构,减少活性氧(reactive oxygen species,ROS)蓄积和细胞色素C的释放,从而缓解心肌细胞的氧化应激,抑制心肌细胞凋亡[11]。Mfn2可通过调节自噬体的成熟以及提高自噬活性介导心肌细胞线粒体自噬的发生。然而,Mfn2的缺失可能加剧内质网应激,导致心肌细胞能量供应不足,最终破坏心肌细胞线粒体的稳态[12]。有实验[13]表明,高糖处理原代培养的新生大鼠心肌细胞后,Mfn1/2泛素化现象明显增加,并伴有线粒体膜电位降低和线粒体通透性转换孔开放增加,进而导致心肌细胞的线粒体结构异常和功能障碍。Mfn1/2同时敲除后,小鼠心肌细胞的线粒体氧化呼吸链耗氧量升高、能量产生减少,这可能与Mfn1/2缺乏导致呼吸链复合物Ⅳ的活性及其亚基的稳定性降低有关。有研究[14]显示,在db/db小鼠心肌组织中,线粒体Mfn2表达减少,可能与过氧化物酶体增殖物激活受体α的表达减少和过氧化物酶体增殖物激活受体α与Mfn2启动子的结合减少有关。以上提示Mfn1和Mfn2两种蛋白的协同作用对于心肌细胞线粒体的融合至关重要。
1.3OPA1与DCM
Morio等[15]的研究发现,在DM早期,高血糖和胰岛素信号的缺陷导致线粒体融合蛋白的表达减少,尤其是OPA1的表达明显受损,进而抑制线粒体融合。还有研究[16]显示,OPA1敲除后通过破坏小鼠的葡萄糖稳态,导致胰岛素抵抗和肥胖的发生。DM患者通过胰岛素治疗可以提高心肌细胞中OPA1的表达并促进线粒体融合,进而增强线粒体氧化磷酸化的能力,而在OPA1和Mfn2低表达的细胞中,胰岛素治疗对线粒体代谢的影响减弱[17]。以上研究提示,DCM中OPA1异常表达是影响心肌细胞线粒体融合并加重线粒体功能障碍的关键因素。
2线粒体分裂与DCM
2.1线粒体分裂蛋白
线粒体分裂是指线粒体分裂成多个较小线粒体,同时清除功能失调线粒体的过程,其发生受线粒体分裂相关蛋白的调节,主要有线粒体Drp1、线粒体分裂蛋白1(mitochondrial fission 1 protein,Fis1)、线粒体分裂因子(mitochondrial fission factor,Mff)、线粒体动力学蛋白49kDa和51kDa(mitochondrial dynamics proteins of 49 kDa and 51 kDa,MiD49/51)[18]。Drp1是调控线粒体分裂的关键蛋白,它绝大多数以二聚体或多聚体的形式分布于细胞质,在受到分裂信号刺激时,Fis1等受体蛋白独立或协同作用形成分裂位点,同时募集Drp1围绕线粒体外膜聚集,进而水解GTP,在特定的分裂点收缩内膜并使线粒体发生断裂,完成分裂过程。进一步的研究[19]发现,不同修饰方式可影响Drp1的功能,其中以磷酸化修饰为主,如Drp1在Ser616和Ser585位点的磷酸化可促进线粒体分裂,而在Ser637位点的磷酸化可促使Drp1失活,抑制线粒体分裂。Fis1是线粒体外膜上的小分子锚定蛋白,它通过竞争性结合MiD51提高Drp1的活性并招募其到线粒体外膜聚集,促进分裂过程。Mff与Fis1相似,也锚定于线粒体外膜,过表达Mff可诱导线粒体分裂,而单独过表达MiD49或MiD51可延长线粒体[17]。然而,在不表达Mff或MiD49/51的细胞系中,线粒体分裂部分被抑制,在Mff和MiD49/51均不表达的细胞系中,线粒体分裂完全被抑制[20],以上表明Mff、MiD49/51协同作用参与线粒体分裂,但具体机制尚不明确。
2.2Drp1与DCM
H9C2大鼠心肌细胞经高糖处理后,Drp1表达上调,导致线粒体分裂的发生,同时诱发ROS蓄积[21]。而使用Drp1抑制剂Mdivi-1可促进心肌细胞线粒体的融合,并延迟线粒体通透性转换孔开放和减少ROS的生成,从而减轻线粒体功能障碍[22]。这表明高糖中线粒体过度分裂可能与Drp1表达升高和ROS介导的氧化应激有关。研究[23]显示,Mdivi-1下调Drp1表达的同时,还可以降低Drp1在Ser616位点的磷酸化水平并增加其在Ser637位点的磷酸化,从而避免高糖刺激下心肌细胞异常肥大的情况。然而,高糖导致线粒体过度分裂,也可能通过细胞内钙瞬变和细胞外调节蛋白激酶的激活,促进Drp1的Ser616位点磷酸化[24]。此外,敲低Drp1表达可缓解心肌细胞线粒体的功能障碍[25]。以上表明,Drp1是调节DCM损伤的重要分子之一。
2.3Fis1、Mff、MiD49/51与DCM
在血管功能减退的DM患者内皮细胞中,Fis1表达增加并伴有线粒体碎片化明显,这一现象可以通过抑制Drp1表达而使其发生逆转[26],说明Drp1的低表达可影响Fis1的表达,进而促进线粒体分裂的发生。Yang等[27]实验发现,MiD51和Mff表达减弱后,线粒体融合增强、分裂被抑制。而MiD51有较强的Drp1招募能力,可能是Drp1的一种分子支架[28]。宋元秀等[29]实验研究也显示MiD51可介导细胞缺氧/复氧后Drp1的转位和活化。以上提示,MiD51可能是抑制线粒体分裂和减轻心肌细胞损伤的新靶点。Liu等[30]发现,Mff基因缺陷小鼠的心肌组织中线粒体密度下降、呼吸链功能不足,出现明显的扩张型心肌病的表现。以上表明,Fis1、Mff及MiD49/51在募集Drp1和调控线粒体分裂中发挥着重要作用。还有学者[31]认为MiD51、Mff和Drp1之間有密切的关联,但Fis1与Drp1的关联较小。然而,关于线粒体分裂蛋白在DCM中的作用机制仍存在争议,需要进一步深入研究。
3线粒体动力学异常与DCM
线粒体的融合和分裂由多种线粒体动力学相关蛋白介导,这两个过程虽然独立进行但高度协调。有研究[32]显示,抑制Drp1的表达不仅引起Mfn1/2表达的降低,还可使L-OPA1水解形成S-OPA1,这表明细胞中调控线粒体分裂和融合的相关蛋白可能存在平衡机制。有相关研究[14]比较T2D患者和健康受试者,发现T2D患者细胞中Mfn1、Mfn2和OPA1蛋白的表达降低。类似的,在肥胖大鼠中也发现骨骼肌细胞中Mfn2的信使RNA和蛋白质水平均降低,而Fis1的表达显著上调[33]。以上表明,在多数DM患者的心肌中都出现线粒体动力学失衡的现象。
高糖誘导3周后,线粒体形态未发生明显变化,诱导5周后,线粒体形态开始扭曲、体积缩小,基质呈空泡状、电子密度降低,并伴随着OPA1水解增加。这些结果表明,DCM中线粒体动力学的渐进性破坏可能是由于损伤因素长期作用打破融合和分裂的动态平衡[34]。郑宏庭等[35]实验显示,DM小鼠冠状动脉内皮细胞中OPA1表达降低并伴有Drp1表达明显升高,提示DCM心肌细胞中存在明显的线粒体动力学异常,且分裂增强、融合受阻。针对DM患者皮肤创缘的研究发现,Mfn2表达降低,Fis1表达上调。表明DM患者创口愈合受阻也与线粒体动力学失衡密切相关[36]。以上表明,维持心肌细胞线粒体动力学平衡可能是防治代谢相关心血管疾病有效的策略。
4其他线粒体相关机制与DCM
DM小鼠的研究[37]表明,超氧阴离子清除剂可以逆转线粒体碎片化并减少OPA1的表达,这显示ROS是损害线粒体融合的因素之一。ROS可以激活金属蛋白酶,使L-OPA1被剪切为S-OPA1,抑制融合过程并引发线粒体嵴形态的重构,导致心肌细胞的凋亡[38]。随着血糖水平的升高,DM患者心肌细胞对脂肪酸的利用率呈明显上升趋势,这导致毒性脂肪酸中间产物(如神经酰胺、二酰基甘油等)积聚,增加蛋白激酶A锚定蛋白12的泛素化,进而调节Drp1的磷酸化,增强线粒体分裂[39]。线粒体作为细胞内主要的钙调节场所,能够调控钙离子的摄取与释放,维持细胞的钙稳态。然而有实验[40]发现,链脲佐菌素诱导的DM小鼠心肌细胞线粒体通透性过度增加,导致钙离子不断释放至细胞基质,加剧细胞内钙超载。同时,基因敲除Mfn2可扰乱内质网和线粒体的连接,使其膜间距增宽,导致钙信号的运输障碍和线粒体呼吸功能减弱,影响心肌细胞的电生理活动。
5结语
线粒体是心肌细胞中制造能量的主要细胞器,是细胞代谢的中心,且在心脏含量中最高。在生理状态下,线粒体通过调节融合和分裂的平衡,维持心肌细胞线粒体的稳态。然而,在DCM发病早期,高血糖及胰岛素信号通路障碍导致线粒体氧化呼吸链的能量生成减少,进而通过下调融合蛋白的表达和增加分裂蛋白来代偿细胞的“能量缺口”。越来越多的证据[41]表明,DCM发病的核心是线粒体功能障碍,线粒体动力学是维持线粒体功能的基础,而线粒体分裂和融合是维持线粒体动力学稳态的重要保障。因此,通过干预异常的线粒体融合和分裂,以维持线粒体动力学稳态,可能是防治DCM的新靶点。然而,如何将调控线粒体动力学的基础研究成果转化为临床实践,仍需要进一步探索。
参 考 文 献
[1]Fernandes CJ,Steigner ML,Piazza G,et al. Collaborative cardiology and pulmonary management of pulmonary hypertension[J]. Chest,2019,156(2):200-202.
[2]中国医师协会中西医结合医师分会内分泌与代谢病学专业委员会.糖尿病心肌病病证结合诊疗指南(2021-12-31)[J]. 世界中医药,2022,17(12):1641-1653.
[3]张倩,卫晓红,陈洁,等.慢性心力衰竭常用动物模型的研究进展及其在中医药研究中的应用[J].中国中药杂志,2023,48(3):614-624.
[4]Ritchie RH,Abel ED. Basic mechanisms of diabetic heart disease[J]. Circ Res,2020,126(11):1501-1525.
[5]Audzeyenka I,Rachubik P,Typiak M,et al. Hyperglycemia alters mitochondrial respiration efficiency and mitophagy in human podocytes[J]. Exp Cell Res,2021,407(1):112758.
[6]Zhao X,Liu S,Wang X,et al. Diabetic cardiomyopathy:clinical phenotype and practice[J]. Front Endocrinol,2022,13:1032268.
[7]Yu R,Liu T,Jin SB,et al. MIEF1/2 orchestrate mitochondrial dynamics through direct engagement with both the fission and fusion machineries[J]. BMC Biol,2021,19(1):229-230.
[8]Huang S,Li Z,Wu Z,et al. DDAH2 suppresses RLR-MAVS-mediated innate antiviral immunity by stimulating nitric oxide-activated,Drp1-induced mitochondrial fission[J]. Sci Signal,2021,14(678):eabc7931.
[9]Fajardo G,Coronado M,Matthews M,et al. Mitochondrial quality control in the heart:the balance between physiological and pathological stress[J]. Biomedicines,2022,10(6):1375.
[10]Noone J,OGorman DJ,Kenny HC. OPA1 regulation of mitochondrial dynamics in skeletal and cardiac muscle[J]. Trends Endocrinol Metab,2022,33(10):710-721.
[11]Bian W,Chen W,Nguyen T,et al. miR-199a overexpression enhances the potency of human induced-pluripotent stem-cell-derived cardiomyocytes for myocardial repair[J]. Front Pharmacol,2021,12:673621.
[12]Han S,Zhao F,Hsia J,et al. The role of Mfn2 in the structure and function of endoplasmic reticulum-mitochondrial tethering in vivo[J]. J Cell Sci,2021,134(13):jcs253443.
[13]Inagaki S,Suzuki Y,Kawasaki K,et al. Mitofusin 1 and 2 differentially regulate mitochondrial function underlying Ca2+ signaling and proliferation in rat aortic smooth muscle cells[J]. Biochem Biophys Res Commun,2023,645:137-146.
[14]胡朗. Mfn2介導的线粒体动力学障碍在糖尿病心肌病中的作用及分子机制[D].空军军医大学,2019.
[15]Morio A,Tsutsumi R,Kondo T,et al. Leucine induces cardioprotection in vitro by promoting mitochondrial function via mTOR and Opa-1 signaling[J]. Nutr Metab Cardiovasc Dis,2021,31(10):2979-2986.
[16]徐佳. 黄连素通过调控SIRT1/Opa1通路改善肝胰岛素抵抗的作用及机制研究[D].吉林:吉林大学,2020.
[17]Xu J,Zhang Y,Yu Z,et al. Berberine mitigates hepatic insulin resistance by enhancing mitochondrial architecture via the SIRT1/Opa1 signalling pathway[J]. Acta Biochim Biophys Sin,2022,54(10):1464-1475.
[18]Chehaitly A,Guihot AL,Proux C,et al. Altered mitochondrial Opa1-related fusion in mouse promotes endothelial cell dysfunction and atherosclerosis[J]. Antioxidants,2022,11(6):1078.
[19]Yu R,Jin SB,Ankarcrona M,et al. The molecular assembly state of Drp1 controls its association with the mitochondrial recruitment receptors Mff and MIEF1/2[J]. Front Cell Dev Biol,2021,9:706687.
[20]刘振华,刘银姬,牛津,等.U50,488H抑制心肌细胞缺氧/复氧诱导Drp1线粒体转位的作用及机制[J].心脏杂志,2020,32(6):565-571.
[21]Ostaszewska-Bugajska M,Podgórska A,Szal B. Markers for mitochondrial ROS status[J]. Methods Mol Biol,2022,2363:199-213.
[22]Bland AR,Payne FM,Ashton JC,et al. The cardioprotective actions of statins in targeting mitochondrial dysfunction associated with myocardial ischaemia-reperfusion injury[J]. Pharmacol Res,2022,175:105986.
[23]Wu QR,Zheng DL,Liu PM,et al. High glucose induces Drp1-mediated mitochondrial fission via the Orai1 calcium channel to participate in diabetic cardiomyocyte hypertrophy[J]. Cell Death Dis,2021,12(2):216.
[24]Alcántar-Fernández J,González-Maciel A,Reynoso-Robles R,et al. High-glucose diets induce mitochondrial dysfunction in Caenorhabditis elegans[J]. PloS One,2019,14(12):e0226652.
[25]Robson A. A novel cardioprotective function for DRP1 inhibition[J]. Nat Rev Cardiol,2021,18(5):306-307.
[26]Kim D,Sankaramoorthy A,Roy S. Downregulation of Drp1 and Fis1 inhibits mitochondrial fission and prevents high glucose-induced apoptosis in retinal endothelial cells[J]. Cells,2020,9(7):1662.
[27]Yang J,Chen P,Cao Y,et al. Chemical inhibition of mitochondrial fission via targeting the DRP1-receptor interaction[J]. Cell Chem Biol,2023,30(3):278-294.e11.
[28]劉小丽,廖达文,王星琛,等.BLOC-3介导Rab32线粒体定位改变对肝癌细胞生长的作用研究[J].中国癌症防治杂志,2023,15(2):129-137.
[29]宋元秀,崔鸣.线粒体动力学异常与相关心血管疾病[J].心血管病学进展,2021,42(2):162-166.
[30]Liu A,Kage F,Higgs HN. Mff oligomerization is required for Drp1 activation and synergy with actin filaments during mitochondrial division[J]. Mol Biol Cell,2021,32(20):ar5.
[31]Jin JY,Wei XX,Zhi XL,et al. Drp1-dependent mitochondrial fission in cardiovascular disease[J]. Acta Pharmacol Sin,2021,42(5):655-664.
[32]Sultan A,Jacobson M,Adeghate E,et al. Effects of obesity and diabesity on heart rhythm in the Zucker rat[J]. Clin Exp Pharmacol Physiol,2021,48(5):735-747.
[33]Gilkerson R,De La Torre P,St Vallier S. Mitochondrial OMA1 and OPA1 as gatekeepers of organellar structure/function and cellular stress response[J]. Front Cell Dev Biol,2021,9:626117.
[34]Fealy CE,Mulya A,Lai N,et al. Exercise training decreases activation of the mitochondrial fission protein dynamin-related protein-1 in insulin-resistant human skeletal muscle[J]. J appl physiol,2014,117(3):239-245.
[35]郑宏庭,瞿华. 线粒体动力学与糖尿病并发症发病机制[J]. 第三军医大学学报,2022,44(1):64-68.
[36]Lorenzo-Almorós A,Cepeda-Rodrigo JM,Lorenzo ?. Diabetic cardiomyopathy[J]. Rev Clin Esp,2022,222(2):100-111.
[37]Méndez-López I,Sancho-Bielsa FJ,Engel T,et al. Progressive mitochondrial SOD1G93A accumulation causes severe structural,metabolic and functional aberrations through OPA1 down-regulation in a mouse model of amyotrophic lateral sclerosis[J]. Int J Mol Sci,2021,22(15):8194.
[38]Ramzan R,Dolga AM,Michels S,et al. Cytochrome c oxidase inhibition by ATP decreases mitochondrial ROS production[J]. Cells,2022,11(6):992.
[39]Li H. Physiologic and pathophysiologic roles of AKAP12[J]. Sci Prog,2022,105(3):368504221109212.
[40]Yuan M,Gong M,Zhang Z,et al. Hyperglycemia induces endoplasmic reticulum stress in atrial cardiomyocytes,and mitofusin-2 downregulation prevents mitochondrial dysfunction and subsequent cell death[J]. Oxid Med Cell Longev,2020,2020:6569728.
[41]Zhi F,Zhang Q,Liu L,et al. Novel insights into the role of mitochondria in diabetic cardiomyopathy: molecular mechanisms and potential treatments[J].Cell Stress Chaperones,2023.DOI: 10.1007/s12192-023-01361-w.
收稿日期:2023-04-11