利伐沙班治疗肝硬化门静脉血栓的研究进展
刘双 赵东强
摘要:
门静脉血栓(PVT)是肝硬化常见并发症之一,與肝病的不良预后有关。新型直接口服抗凝药物利伐沙班通过直接作用于Ⅹa因子的活性中心,抑制凝血酶的生成从而发挥抗栓作用,具有直接口服、无需监测国际标准化比值等优势,是肝硬化PVT长期抗凝治疗的新选择。近年来,越来越多的临床研究表明利伐沙班治疗肝硬化PVT相对安全、有效,但在目前的临床实践中利伐沙班治疗肝硬化PVT的应用经验仍很少,个体化用药方案尚未明确。本文综述了利伐沙班治疗肝硬化PVT的研究进展,以期为肝硬化PVT的临床治疗提供新思路。
关键词:
肝硬化; 利伐沙班; 静脉血栓栓塞; 治疗学
Research advances in rivaroxaban in the treatment of portal vein thrombosis in liver cirrhosis
LIU Shuang1,2, ZHAO Dongqiang2. (1. Graduate School of Hebei Medical University, Shijiazhuang 050000, China; 2. Department of Gastroenterology, The Second Hospital of Hebei Medical University, Hebei Key Laboratory of Gastroenterology, Hebei Institute of Gastroenterology, Hebei Clinical Research Center for Digestive Diseases, Shijiazhuang 050000, China)
Corresponding author:
ZHAO Dongqiang, hbzdq1998@163.com (ORCID:0000-0003-3470-448X)
Abstract:
Portal vein thrombosis (PVT) is one of the common complications of liver cirrhosis and is associated with the poor prognosis of liver disease. Rivaroxaban, a novel direct oral anticoagulant, exerts an antithrombotic effect by directly acting on the active center of factor Xa to inhibit the generation of thrombin, and it is a new choice for long-term anticoagulant treatment of PVT in liver cirrhosis with the advantages of direct oral administration and no need for international normalized ratio (INR) monitoring. In recent years, more and more clinical studies have shown that rivaroxaban is relatively safe and effective in the treatment of PVT in liver cirrhosis; however, there is still little experience in the application of rivaroxaban in the treatment of PVT in liver cirrhosis in the current clinical practice, and individualized medication regimen remains to be clarified. This article reviews the research advances in rivaroxaban in the treatment of PVT in liver cirrhosis, in order to provide new ideas for the clinical treatment of PVT in liver cirrhosis.
Key words: Liver Cirrhosis; Rivaroxaban; Venous Thromboembolism; Therapeutics
门静脉血栓(portal vein thrombosis, PVT)是指门静脉主干和/或门静脉左、右分支发生血栓,伴或不伴肠系膜静脉和脾静脉血栓形成[1]。与非肝硬化患者相比,肝硬化患者更易发生PVT[2],其患病率在1%~25%,且患病率的高低与肝硬化的严重程度呈正相关[3]。肝硬化患者发生PVT可能会导致门静脉压力升高和入肝血流减少,从而增加胃肠道出血、肝功能受损和顽固性腹水等不良事件发生的风险。已有研究显示PVT与急性静脉曲张出血、再出血的较高风险相关[4],与肝移植后的早期(90 d)病死率升高和移植失败有关[5-6]。利伐沙班作为新型直接口服抗凝药物(direct oral anticoagulant, DOAC)之一,具有口服简便、无需监测国际标准化比值(INR)等优势,弥补了传统抗凝药物的不足,是肝硬化PVT长期抗凝治疗的新选择。由于肝硬化患者常存在肝储备功能受损和凝血功能障碍,且目前缺乏有效的实验室检测指标来全面反映体内的止血状态,因此利伐沙班在肝硬化PVT患者中的应用受到限制,使用经验相对缺乏。现对利伐沙班治疗肝硬化PVT的研究进展作一综述,以期提高临床医师的认识,推动相关研究的发展。
1 肝硬化PVT的发病机制与临床表现
肝硬化PVT的形成机制复杂,目前尚不完全清楚。有研究[7]显示,肝硬化患者肝脏实质结构扭曲导致的肝内血管阻力增加和门静脉血流速度降低是肝硬化PVT的重要危险因素,门静脉侧支循环形成和内脏血管代偿性扩张,进一步减少了门静脉主干的血流。已有研究[8]认为门静脉中位血流速度<15 cm/s是PVT形成的独立危险因素。非选择性β受体阻滞剂在肝硬化中诱发PVT可能也是因为降低了门静脉的压力,减少了门静脉的血流,从而加剧了肝脏循环中的血液瘀滞。有研究[7]显示,在肝脏合成功能受损时,除Ⅷ因子外所有促凝蛋白与抗凝蛋白同时减少,相比之下,Ⅷ因子水平增加,蛋白S、蛋白C水平降低,降低了血栓形成的阈值。此外,门静脉压力增高可能损伤血管内皮功能,多种炎症细胞因子可能促进大尺寸血小板的活化[9]。患者也可能存在其他系统性或局部血栓形成原因,如骨髓增生性疾病、腹部手术等。临床上患者往往不除外多种致病因素同时存在的情况。
肝硬化PVT的临床表现与血栓形成的急缓、部位和程度有关。多数肝硬化PVT无任何临床症状,仅在检查中被偶然发现,发病时间难以界定[1]。未被早期发现的肝硬化PVT可以导致肠系膜缺血、门静脉高压症和门静脉海绵样变等。还有一部分肝硬化PVT患者仅出现腹胀、食欲不振、恶心、呕吐等非特异性的上消化道症状以及发热等,易被忽视。另外,血栓快速蔓延至肠系膜静脉者,因肠壁淤血肿胀,患者表现为腹痛、腹胀、发热等症状,当淤血不能解除,坏死累及肌层及神经时,可引起麻痹性肠梗阻,甚至肠坏死、肠穿孔等,严重者危及生命。因此,对肝硬化PVT及时诊断和分期并考虑抗凝治疗至关重要。
2 肝硬化PVT的治疗现状
目前肝硬化PVT是否进行抗凝治疗存在较大争议。一项队列研究[10]观察到部分性PVT在超过一半的肝硬化患者中保持稳定/改善,在大约1/4的患者中加重且与肝硬化失代偿率增加有关。Qi等[11]对肝硬化PVT自发再通的比例进行荟萃分析显示,一过性PVT(<3个月的随访时间里PVT自发再通)的发生率为39.8%(95%CI: 35.4%~44.4%),但其纳入的研究之间存在显著的异质性,尚不明确自发再通的预测因素,该研究表明如果临床情况允许观察,且近期PVT没有临床进展的肝硬化患者可以不进行抗凝治疗,每3个月监测血栓的动态变化。因为肝硬化患者常常出现血小板减少、凝血酶原时间延长、部分活化凝血活酶时间延长,所以在过去长时间里,肝硬化患者被认为有出血趋势[12]。在肝硬化PVT是否进行抗凝治疗的困境中,相当一部分临床医师选择在没有任何干预措施的情况下更多地关注肝硬化患者PVT的自然病史,很少使用抗栓药物[13],并且忽略了对肝硬化PVT并发症的观察与总结。有研究显示,若患者发生急性肠系膜静脉血栓应充分抗凝防止肠梗死的发生[14],移植前进行抗凝治疗可使手术更易进行,术后发病率及病死率也相应减低[15]。已有研究[4,16]显示早期抗凝治疗可提高门静脉再通率,降低曲张静脉的压力和失代偿发生的风险。近年来,人们开始关注肝硬化PVT的并发症,意识到抗栓治疗的必要性。
国内指南[1]提出抗凝治疗是肝硬化PVT最重要的治疗手段之一。抗凝治疗的适应证为急性症状性PVT、等待肝移植及合并肠系膜静脉血栓的肝硬化PVT,疗程通常为6个月以上。PVT阻塞程度<50%且血栓尚未累及肠系膜静脉的患者可随访观察。抗凝药物包括维生素K拮抗剂、肝素类和新型直接口服抗凝药物。直接口服抗凝药物对代偿期肝硬化伴PVT患者相对安全、有效,对Child-Pugh C级肝硬化患者的安全性和疗效需进一步评估。欧洲肝病学会临床实践指南[17]指出DOAC在Child-Pugh A级肝硬化患者中的安全性没有太大的担忧;由于存在蓄积的可能,在Child-Pugh B级患者以及肌酐清除率<30 mL/min的患者中应谨慎使用DOAC;在Child-Pugh C级患者中不推荐使用DOAC。目前尚無指南提出全面且明确的肝硬化PVT患者应用DOAC的治疗方案,临床医师在实践过程中尚不明确肝硬化PVT是否需要治疗、启动治疗的时机、所选DOAC的种类及剂量、治疗时间、监测方法及随访时间等。
3 利伐沙班的药物特点与作用机制
目前临床常用的传统抗凝药物包括华法林、低分子肝素等,其临床应用久远,抗栓效果明确,但存在各自的不足。华法林起效慢、失效慢,与多种食物药物存在相互作用,口服期间需频繁监测INR来调整药物剂量。由于肝硬化患者INR基线水平升高,目前尚不清楚肝硬化PVT抗凝治疗的目标INR。低分子肝素作用方式依赖抗凝血酶Ⅲ,具有一定免疫原性,需警惕肝素诱导的血小板减少症,临床应用受肾损伤限制,需皮下注射且有皮肤反应。上述药物的长期使用在一定程度上影响了患者的治疗依从性。人体内凝血过程是一个典型的瀑布式级联酶促反应。基于目前临床精准化和个体化的治疗发展趋势,直接作用于某一凝血因子的药物更加直接有效、安全方便。近些年,新型直接口服抗凝药物因弥补传统抗凝药物的缺陷而问世。目前国内批准上市的新型口服抗凝药有直接凝血酶抑制剂达比加群酯和直接Ⅹa因子抑制剂利伐沙班、阿哌沙班。基于目前肝硬化PVT应用利伐沙班抗凝治疗的研究相对较多,本文作以相关总结。
利伐沙班为小分子化合物,无需辅助因子直接作用于Ⅹa因子的活性中心,抑制凝血酶的生成,具有直接口服、起效快、半衰期短、剂量固定、轻度肝肾功能不全时无需调整用量、无需监测INR、与食物药物相互作用少的优点[18-19]。利伐沙班以活性形式在消化道中被迅速吸收,在门静脉可达到较高的血浆浓度。自2016年美国胸科医师学会发布的第10版静脉血栓栓塞抗栓治疗指南首次将DOAC作为静脉血栓栓塞长期抗凝治疗的首选用药后[20],DOAC应用于深静脉血栓、肺栓塞、非瓣膜性房颤、髋关节或膝关节置换手术相关的血栓治疗与预防的临床研究蓬勃发展,而其中合并肝硬化Child-Pugh A/B级甚至Child-Pugh C级的患者使用利伐沙班的疗效与安全性也得到研究者的关注。
4 利伐沙班治疗肝硬化PVT的疗效与安全性
多个临床实践指南推荐DOAC用于肝硬化患者深静脉血栓的预防与治疗,但缺乏相关的临床数据[1,17]。目前尚不清楚门静脉血流速度降低和肝损伤对门静脉部位血药浓度的影响。让人担忧的是,有研究显示常规凝血功能监测并不能反映肝硬化的出血风险。有研究[21]认为血栓弹力图优于常规凝血功能指标,可及时反映肝硬化患者的低凝状态,但血栓弹力图尚未被广泛应用,其临床应用价值仍需进一步研究。一项肝硬化和/或内脏静脉血栓形成患者接受DOAC治疗的安全性报告为随机临床试验提供了基础[22]。
Hanafy等[23]在利伐沙班与华法林治疗代偿期肝硬化急性PVT的随机对照试验中,发现利伐沙班组的再通率和短期生存率均较华法林组有所提高,部分PVT在治疗(6.7±1.2)个月后才发生再通。一项前瞻性观察研究[24]显示,使用依诺肝素或利伐沙班而不是华法林的长期抗凝治疗与减少血栓形成和改善生存率相关,且未增加患者出血的风险。国内多项小型临床研究[21,25-26]均表明利伐沙班治疗肝硬化PVT安全、有效,利伐沙班抗凝治疗还可以改善患者的肝功能,血栓形成时间、抗凝开始的时间可作为门静脉再通的预测因素,动态监测D-二聚体对PVT的诊断和治疗结果有预测价值。Xu等[27]报道了1例急性闭塞性门静脉-肠系膜静脉血栓形成的肝硬化患者,通过及时抗凝治疗(应用低分子量肝素后改用利伐沙班 10 mg/d)在住院期间实现了门静脉血栓完全再通和肠系膜上静脉血栓部分再通,出院后继续口服利伐沙班,患者无不适主诉且抗凝治疗期间没有发生出血事件。由此可见,急性症状性肝硬化PVT患者可先应用低分子肝素实现血栓的快速再通,避免手术风险,后改为口服利伐沙班在离院期间也能安全方便的接受抗凝治疗。
研究[28]报道了1例Child-Pugh A级肝硬化复发性急性PVT患者在利伐沙班治疗6个月后实现了PVT完全再通,且未发生任何不良事件,该病例表明利伐沙班对肝硬化复发性PVT亦有疗效,但是否维持抗凝以防止再次血栓形成目前尚无共识。关于预防PVT的发生,Ponziani等[29]观察到1例每天接受20 mg利伐沙班治疗慢性房颤的Child-Pugh B级肝硬化患者仍发生了PVT,在该病例中利伐沙班并没有预防PVT的形成。一项随机对照试验[30]表明,预防性使用利伐沙班比低分子肝素加华法林能更好地降低肝硬化患者脾切除术和贲门周围血管断流术后PVT的发生率,并与改善肝功能和凝血功能相关。目前利伐沙班是否可以预防肝硬化PVT的发生尚无定论。
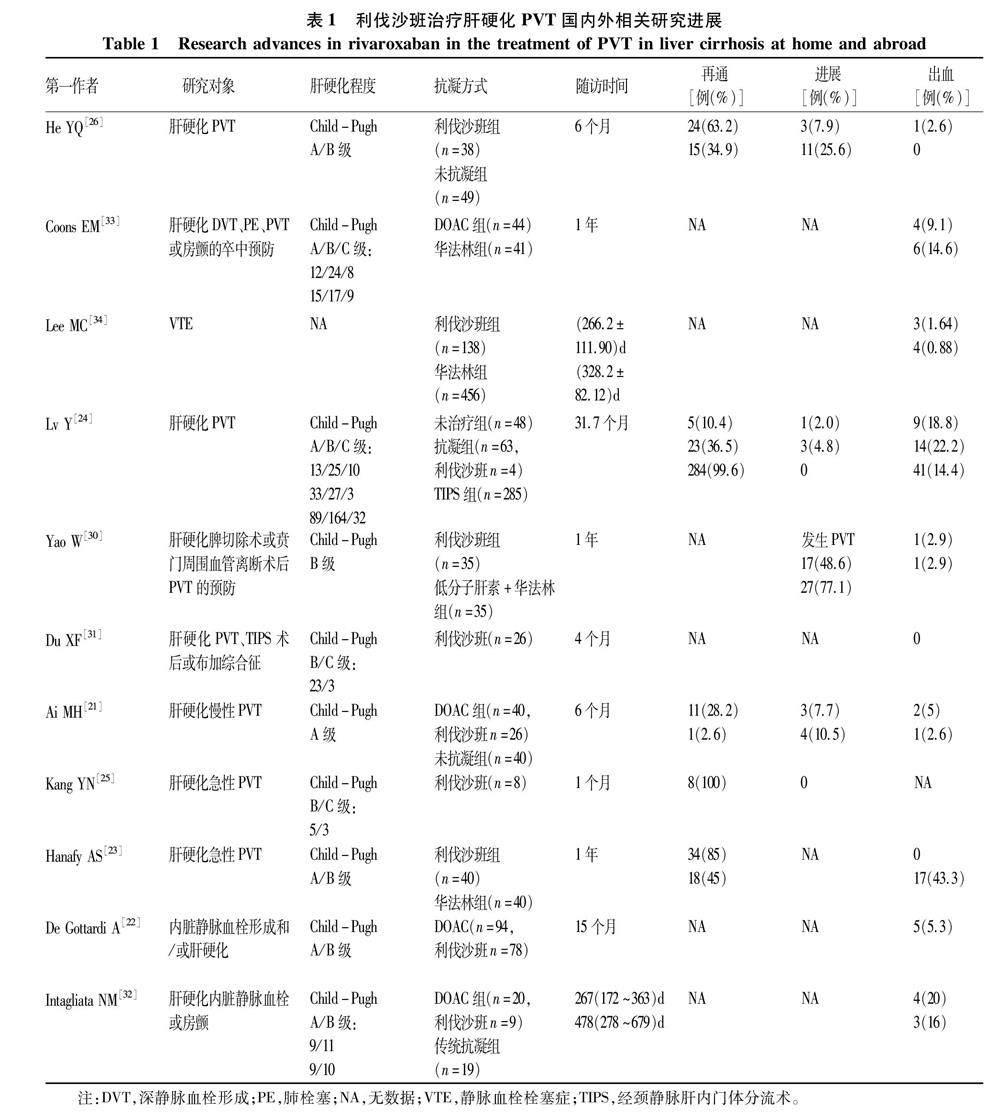
由于肝硬化患者存在凝血功能障碍和门静脉高压相关出血风险,安全问题是临床医师使用利伐沙班时关注的焦点。一项小型观察性研究[31]表明,小剂量利伐沙班(10 mg/d)用于失代偿期肝硬化患者安全性良好,无显著出血及肝损伤,其中Child-Pugh C级患者有3例。有研究[21]显示利伐沙班或达比加群酯不增加肝硬化患者的出血风险。一项回顾性对照研究[32]显示肝硬化患者应用DOAC和传统抗凝剂的出血风险相似。Coons等[33]的研究表明肝硬化患者使用DOAC与华法林的大出血发生率相似,并提出可在未来研究中进一步纳入Child-Pugh C级患者。一项亚洲患者使用利伐沙班与肝素或低分子肝素加华法林治疗静脉血栓栓塞的研究[34]表明,应用不同抗凝剂患者的复发性血栓栓塞、出血和病死率无明显差异。目前研究显示利伐沙班治疗肝硬化PVT相对安全,但临床医师仍需警惕个别出血事件。de Gott ardi等[35]报告了1例肝硬化PVT患者使用利伐沙班治疗7个月后虽然肠系膜静脉完全再通但发生了再次静脉曲张出血。另1例因呕血在当地医院接受药物和内镜静脉曲张结扎术治疗后的肝硬化患者应用利伐沙班(前4周15 mg,后7周10 mg)期间出现反复胃肠道出血[36]。上述病例报道表明,使用利伐沙班治疗肝硬化患者的出血风险也可能增加,应根据每位患者的风险状况尤其是内镜下静脉曲张情况仔细评估是否选用利伐沙班进行抗凝治疗。以下对利伐沙班治疗肝硬化PVT的国内外相关研究进展做总结(表1)。
Russmann等[37]报告了14例与利伐沙班相关的肝损伤病例,包括2例肝活檢,提示利伐沙班治疗患者出现肝病的症状和体征应视为潜在的药物不良反应。2例在利伐沙班治疗期间以肝细胞受损为主的肝损伤患者,迅速停止利伐沙班治疗后得到了临床恢复[38]。几项小型回顾性研究均未观察到利伐沙班的肝毒性[26,31],这可能与DOAC诱导的肝损伤事件发生率低于1%有关[22]。一项DOAC导致药物性肝损伤风险的荟萃分析[39]纳入了29项随机临床对照试验152 116例患者(平均随访16个月),结果表明DOAC与药物性肝损伤风险增加无关。目前临床数据显示利伐沙班致肝硬化PVT患者肝损伤的风险极低,未来仍需大型临床试验进一步证实。
目前肝硬化PVT应用利伐沙班治疗的相关研究多为小型回顾性研究,临床研究数据仍较少,研究设计存在很大差异,部分患者因病情变化而更改了抗凝方案,且不同研究之间存在诸多混杂因素,如:门静脉严重程度、凝血功能障碍程度、肝功能受损程度、既往病史等的不同。未来需要相应的出血风险评分表来指导利伐沙班的治疗剂量与疗程;需要更多高质量的研究探索利伐沙班预防肝硬化PVT的应用方案;需要更长期的随访来探索复发的危险因素及远期预后。
5 小结与展望
与非肝硬化患者相比,肝硬化患者的凝血系统发生了重大变化,更易出现血栓栓塞性及出血性疾病。在目前尚无准确的肝硬化PVT风险预测模型的情况下,定期监测肝硬化患者的影像学动态变化,以期及早识别出肝硬化PVT人群。
监测困难将难以获得最佳的抗凝治疗强度,这将增加血栓形成、复发性血栓形成或出血的风险。与常规凝血功能监测指标相比,血栓弹力图或许能更好地反映肝硬化患者的凝血功能异常,其在预测肝硬化PVT形成风险及PVT抗凝治疗相关出血风险的价值值得进一步研究。目前尚无法预测个体肝硬化PVT能否自发再通,且目前研究显示利伐沙班治疗肝硬化PVT相对安全、有效,因此若条件允许如在控制了静脉曲张出血风险的情况下,建议临床医师及早使用利伐沙班治疗Child-Pugh A级肝硬化患者的PVT,抗凝时间至少6个月,以获得更高的再通率及改善肝病预后。对于Child-Pugh B/C级肝硬化患者,仍需进一步研究证实利伐沙班的安全性。
利伐沙班治療肝硬化PVT的有效性及安全性仍需要更多高质量多中心研究进一步探索,并与其他DOAC进行比较。利伐沙班为肝硬化PVT患者的长期抗凝治疗带来了新希望,未来亦有可能成为临床一线用药,因此,如何合理规范的使用利伐沙班,优化患者的受益/风险比,实现个体化用药值得进一步思考与探索。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘双参与选题,负责收集资料,分析资料,撰写文章;赵东强负责选题,拟定写作思路,指导撰写文章并最终定稿。
参考文献:
[1]Hepatobiliary Disease Study Group, Chinese Society of Gastroenterology, Chinese Medical Association. Consensus for management of portal vein thrombosis in liver cirrhosis(2020,Shanghai)[J]. J Clin Hepatol, 2020, 36(12): 2667-2674. DOI: 10.3969/j.issn.1001-5256.2020.12.007.
中华医学会消化病学分会肝胆疾病学组. 肝硬化门静脉血栓管理专家共识(2020年, 上海)[J]. 临床肝胆病杂志, 2020, 36(12): 2667-2674. DOI: 10.3969/j.issn.1001-5256.2020.12.007.
[2]HUANG X, ABOUGERGI MS, SUN C, et al. Incidence and outcomes of thromboembolic and bleeding events in patients with liver cirrhosis in the USA[J]. Liver Int, 2023, 43(2): 434-441. DOI: 10.1111/liv.15325.
[3]NORONHA FERREIRA C, MARINHO RT, CORTEZ-PINTO H, et al. Incidence, predictive factors and clinical significance of development of portal vein thrombosis in cirrhosis: A prospective study[J]. Liver Int, 2019, 39(8): 1459-1467. DOI: 10.1111/liv.14121.
[4]SENZOLO M, GARCIA-TSAO G, GARCA-PAGN JC. Current knowledge and management of portal vein thrombosis in cirrhosis[J]. J Hepatol, 2021, 75(2): 442-453. DOI: 10.1016/j.jhep.2021.04.029.
[5]GHABRIL M, AGARWAL S, LACERDA M, et al. Portal vein thrombosis is a risk factor for poor early outcomes after liver transplantation: analysis of risk factors and outcomes for portal vein thrombosis in waitlisted patients[J]. Transplantation, 2016, 100(1): 126-133. DOI: 10.1097/TP.0000000000000785.
[6]YERDEL MA, GUNSON B, MIRZA D, et al. Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome[J]. Transplantation, 2000, 69(9): 1873-1881. DOI: 10.1097/00007890-200005150-00023.
[7]MANTAKA A, AUGOUSTAKI A, KOUROUMALIS EA, et al. Portal vein thrombosis in cirrhosis: diagnosis, natural history, and therapeutic challenges[J]. Ann Gastroenterol, 2018, 31(3): 315-329. DOI: 10.20524/aog.2018.0245.
[8]STINE JG, WANG J, SHAH PM, et al. Decreased portal vein velocity is predictive of the development of portal vein thrombosis: A matched case-control study[J]. Liver Int, 2018, 38(1): 94-101. DOI: 10.1111/liv.13500.
[9]ABDEL-RAZIK A, MOUSA N, ELHELALY R, et al. De-novo portal vein thrombosis in liver cirrhosis: risk factors and correlation with the Model for End-stage Liver Disease scoring system[J]. Eur J Gastroenterol Hepatol, 2015, 27(5): 585-592. DOI: 10.1097/MEG.0000000000000325.
[10]GIRLEANU I, STANCIU C, COJOCARIU C, et al. Natural course of nonmalignant partial portal vein thrombosis in cirrhotic patients[J]. Saudi J Gastroenterol, 2014, 20(5): 288-292. DOI: 10.4103/1319-3767.141687.
[11]QI X, GUO X, YOSHIDA EM, et al. Transient portal vein thrombosis in liver cirrhosis[J]. BMC Med, 2018, 16(1): 83. DOI: 10.1186/s12916-018-1069-8.
[12]LISMAN T, KAMPHUISEN PW, NORTHUP PG, et al. Established and new-generation antithrombotic drugs in patients with cirrhosis - possibilities and caveats[J]. J Hepatol, 2013, 59(2): 358-366. DOI: 10.1016/j.jhep.2013.03.027.
[13]QI X, YANG Z, FAN D. Spontaneous resolution of portal vein thrombosis in cirrhosis: where do we stand, and where will we go?[J]. Saudi J Gastroenterol, 2014, 20(5): 265-266. DOI: 10.4103/1319-3767.141680.
[14]European Association for the Study of the Liver. EASL clinical practice guidelines: vascular diseases of the liver[J]. J Hepatol, 2016, 64(1): 179-202. DOI: 10.1016/j.jhep.2015.07.040.
[15]FRANCOZ C, BELGHITI J, VILGRAIN V, et al. Splanchnic vein thrombosis in candidates for liver transplantation: usefulness of screening and anticoagulation[J]. Gut, 2005, 54(5): 691-697. DOI: 10.1136/gut.2004.042796.
[16]INTAGLIATA NM, CALDWELL SH, TRIPODI A. Diagnosis, development, and treatment of portal vein thrombosis in patients with and without cirrhosis[J]. Gastroenterology, 2019, 156(6): 1582-1599.e1. DOI: 10.1053/j.gastro.2019.01.265.
[17]European Association for the Study of the Liver. EASL clinical practice guidelines on prevention and management of bleeding and thrombosis in patients with cirrhosis[J]. J Hepatol, 2022, 76(5): 1151-1184. DOI: 10.1016/j.jhep.2021.09.003.
[18]SAMAMA MM. The mechanism of action of rivaroxaban—an oral, direct Factor Xa inhibitor—compared with other anticoagulants[J]. Thromb Res, 2011, 127(6): 497-504. DOI: 10.1016/j.thromres.2010.09.008.
[19]TURPIE AG, KREUTZ R, LLAU J, et al. Management consensus guidance for the use of rivaroxaban—an oral, direct factor Xa inhibitor[J]. Thromb Haemost, 2012, 108(5): 876-886. DOI: 10.1160/TH12-03-0209.
[20]KEARON C, AKL EA, ORNELAS J, et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report[J]. Chest, 2016, 149(2): 315-352. DOI: 10.1016/j.chest.2015.11.026.
[21]AI MH, DONG WG, TAN XP, et al. Efficacy and safety study of direct-acting oral anticoagulants for the treatment of chronic portal vein thrombosis in patients with liver cirrhosis[J]. Eur J Gastroenterol Hepatol, 2020, 32(10): 1395-1400. DOI: 10.1097/MEG.0000000000001846.
[22]de GOTTARDI A, TREBICKA J, KLINGER C, et al. Antithrombotic treatment with direct-acting oral anticoagulants in patients with splanchnic vein thrombosis and cirrhosis[J]. Liver Int, 2017, 37(5): 694-699. DOI: 10.1111/liv.13285.
[23]HANAFY AS, ABD-ELSALAM S, DAWOUD MM. Randomized controlled trial of rivaroxaban versus warfarin in the management of acute non-neoplastic portal vein thrombosis[J]. Vascul Pharmacol, 2019, 113: 86-91. DOI: 10.1016/j.vph.2018.05.002.
[24]LV Y, BAI W, LI K, et al. Anticoagulation and transjugular intrahepatic portosystemic shunt for the management of portal vein thrombosis in cirrhosis: a prospective observational study[J]. Am J Gastroenterol, 2021, 116(7): 1447-1464. DOI: 10.14309/ajg.0000000000001194.
[25]KANG YN, SUN CY, ZHANG ZH, et al. Effect of rivaroxaban on acute portal vein thrombosis in patients with decompensated cirrhosis[J]. Henan Med Res, 2019, 28(4): 593-596. DOI: 10.3969/j.issn.1004-437X.2019.04.006.
康艷楠, 孙长宇, 张致淏, 等.利伐沙班对肝硬化失代偿期患者急性门静脉血栓的效果[J]. 河南医学研究, 2019, 28(4): 593-596. DOI: 10.3969/j.issn.1004-437X.2019.04.006.
[26]HE YQ, JIANG WW, LIU YP. Efficacy analysis of rivaroxaban anticoagulant in the treatment of cirrhotic portal vein thrombosis and predictors of portal vein thrombosis recanalization[J]. J Binzhou Med Univ, 2022, 45(3): 171-176. DOI: 10.19739/j.cnki.issn1001-9510.2022.03.003.
贺业群, 姜伟炜, 刘一品. 利伐沙班抗凝治疗肝硬化门静脉血栓的疗效分析以及门静脉血栓再通的预测因素[J]. 滨州医学院学报, 2022, 45(3): 171-176. DOI: 10.19739/j.cnki.issn1001-9510.2022.03.003.
[27]XU X, GUO X, WANG R, et al. Low-molecular-weight heparin followed by rivaroxaban for acute occlusive portomesenteric vein thrombosis in a cirrhotic patient treated with multiple endoscopic variceal procedures[J]. Ann Hepatol, 2020, 19(5): 573-577. DOI: 10.1016/j.aohep.2019.08.002.
[28]YANG H, KIM SR, SONG MJ. Recurrent acute portal vein thrombosis in liver cirrhosis treated by rivaroxaban[J]. Clin Mol Hepatol, 2016, 22(4): 499-502. DOI: 10.3350/cmh.2016.0016.
[29]PONZIANI FR, DE CANDIA E, DE CRISTOFARO R, et al. Portal vein thrombosis occurrence in a cirrhotic patient during treatment with rivaroxaban[J]. Liver Int, 2017, 37(8): 1251. DOI: 10.1111/liv.13406.
[30]YAO W, FENG Y, LIU T, et al. Rivaroxaban versus low-molecular weight heparin plus warfarin prevents portal vein system thrombosis after splenectomy and pericardial devascularization: A randomized clinical trial[J]. EXCLI J, 2021, 20: 537-549. DOI: 10.17179/excli2020-3120.
[31]DU XF, WEI XH, QIU LX, et al. Safety of rivaroxaban in patients with decompensated cirrhosis[J]. Beijing Med. J, 2021, 43(7): 593-596. DOI: 10.15932/j.0253-9713.2021.07.001.
杜晓菲, 韦新焕, 仇丽霞, 等. 失代偿期肝硬化患者应用利伐沙班的安全性研究[J]. 北京医学, 2021, 43(7): 593-596. DOI: 10.15932/j.0253-9713.2021.07.001.
[32]INTAGLIATA NM, HENRY ZH, MAITLAND H, et al. Direct oral anticoagulants in cirrhosis patients pose similar risks of bleeding when compared to traditional anticoagulation[J]. Dig Dis Sci, 2016, 61(6): 1721-1727. DOI: 10.1007/s10620-015-4012-2.
[33]COONS EM, STAUBES BA, CASEY AL, et al. Direct oral anticoagulants versus warfarin for treatment of thrombosis or atrial fibrillation in patients with cirrhosis: a retrospective cohort study[J]. Ann Pharmacother, 2022, 56(5): 533-540. DOI: 10.1177/10600280211025050.
[34]LEE MC, LIAO CT, FENG IJ, et al. Recurrent thromboembolism, bleeding, and mortality in Asian patients with venous thromboembolism receiving different oral anticoagulants: A nationwide analysis[J]. Medicine (Baltimore), 2022, 101(37): e30412. DOI: 10.1097/MD.0000000000030551.
[35]de GOTTARDI A, GARCIA-PAGAN JC, VALDIG Investigators. Risk of bleeding in cirrhotic patients treated with rivaroxaban[J]. Liver Int, 2017, 37(10): 1575-1576. DOI: 10.1111/liv.13543.
[36]QI X, YOSHIDA EM, MENDEZ-SANCHEZ N, et al. Rivaroxaban recanalized occlusive superior mesenteric vein thrombosis, but increased the risk of bleeding in a cirrhotic patient[J]. Liver Int, 2017, 37(10): 1574-1575. DOI: 10.1111/liv.13511.
[37]RUSSMANN S, NIEDRIG DF, BUDMIGER M, et al. Rivaroxaban postmarketing risk of liver injury[J]. J Hepatol, 2014, 61(2): 293-300. DOI: 10.1016/j.jhep.2014.03.026.
[38]LIAKONI E, RTZ BRAVO AE, TERRACCIANO L, et al. Symptomatic hepatocellular liver injury with hyperbilirubinemia in two patients treated with rivaroxaban[J]. JAMA Intern Med, 2014, 174(10): 1683-1686. DOI: 10.1001/jamainternmed.2014.3912.
[39]CALDEIRA D, BARRA M, SANTOS AT, et al. Risk of drug-induced liver injury with the new oral anticoagulants: systematic review and meta-analysis[J]. Heart, 2014, 100(7): 550-556. DOI: 10.1136/heartjnl-2013-305288.
收稿日期:
2022-10-12;錄用日期:2022-12-05
本文编辑:朱晶
引证本文:
LIU S, ZHAO DQ. Research advances in rivaroxaban in the treatment of portal vein thrombosis in liver cirrhosis[J]. J Clin Hepatol, 2023, 39(7): 1721-1727.
刘双, 赵东强.
利伐沙班治疗肝硬化门静脉血栓的研究进展
[J]. 临床肝胆病杂志, 2023, 39(7): 1721-1727.

