铁死亡在非酒精性脂肪性肝病发病和治疗中的作用
吴龙云 鲁晓岚

摘要:
铁死亡是以铁依赖和脂质过氧化为特征的非凋亡性细胞死亡方式。非酒精性脂肪性肝病(NAFLD)是以脂肪浸润为主要病理特征,与胰岛素抵抗和遗传易感性密切相关的一类代谢性疾病。肝脏单纯脂肪变性向脂肪性肝炎转变的机制仍不清楚,有研究发现肝细胞性铁死亡可能是脂肪性肝炎炎症启动的触发因素。本综述重点关注铁代谢异常和脂质过氧化在促进NAFLD发生及发展中的作用,并归纳总结一些铁死亡相关抑制剂在NAFLD治疗中的应用前景。
关键词:
铁死亡; 铁代谢障碍; 非酒精性脂肪性肝病; 脂质过氧化作用; 药物疗法
基金项目:
国家自然科学基金(82070587)
Research advances in ferroptosis in the pathogenesis and treatment of nonalcoholic fatty liver disease
WU Longyun, LU Xiaolan. (Department of Gastroenterology, Shanghai Pudong Hospital, Fudan University Pudong Medical Center, Shanghai 201399, China)
Corresponding author:LU Xiaolan xiaolan_lu@163.com (ORCID:0000-0001-5745-6373)
Abstract:
Ferroptosis is a pattern of non-apoptotic cell death characterized by iron dependence and lipid peroxidation. Nonalcoholic fatty liver disease (NAFLD) is a metabolic disease with fat infiltration as its main pathological feature, and it is closely associated with insulin resistance and genetic susceptibility. The mechanism of transition from hepatic steatosis alone to steatohepatitis remains unclear, and studies have shown that ferroptosis in hepatocytes may be the trigger for the inflammatory initiation of steatohepatitis. This article reviews the role of abnormal iron metabolism and lipid peroxidation in promoting the development and progression of NAFLD and summarizes the application prospect of ferroptosis-related inhibitors in the treatment of NAFLD.
Key words:
Ferroptosis; Iron Metabolism Disorders; Non-alcoholic Fatty Liver Disease; Lipid Peroxidation; Drug Therapy
Research funding:
National Natural Science Foundation of China (82070587)
細胞死亡是细胞活动中一种必不可少、受到精细调控的过程,常见的方式包括细胞凋亡、自噬、坏死性凋亡、细胞焦亡,以及一种新型的铁依赖性非凋亡性细胞方式——铁死亡[1]。铁死亡在多种疾病(如肿瘤发生、缺血-再灌注损伤、肾衰竭、消化系统疾病、神经系统疾病和血液学疾病)的发生、发展中起着至关重要的调节作用[1]。
非酒精性脂肪性肝病(NAFLD)是以脂肪浸润为主要病理特征,与胰岛素抵抗和遗传易感性密切相关的一类代谢性疾病的统称;随着疾病的进展,非酒精性脂肪肝(NAFL)可发展成为非酒精性脂肪性肝炎(NASH)、肝纤维化、肝硬化及肝恶性肿瘤。由于NAFLD常常合并其他代谢综合征(如血糖异常),2020年有专家提出将NAFLD 更名为“代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)”[2]。本综述为方便检索、分析及阐述文献,此次暂沿用“非酒精性脂肪性肝病”。
肝脏由脂肪变向脂肪性肝炎转变的机制仍不清楚。有研究[3]发现抑制铁死亡而不是凋亡可减少肝细胞坏死以及免疫细胞浸润和炎症反应;由此提示,肝细胞性铁死亡可能作为脂肪性肝炎炎症启动的触发因素,是治疗NAFLD的另一个治疗靶点。本综述重点关注铁死亡在NAFLD发病中的机制,并探讨铁死亡能否成为NAFLD治疗的新靶点。
1 NAFLD中肝细胞死亡方式
NAFL患者肝细胞可出现脂滴沉积,随着疾病进展,肝细胞呈气球样变、肝小叶内可见炎细胞浸润,进一步发展可出现肝细胞死亡、结缔组织增生、纤维隔形成,破坏正常肝小叶,形成假小叶,更有甚者可致肝细胞异型增生,甚至癌变。NASH病理过程中的肝细胞死亡复杂多样,可能涉及的细胞程序性死亡方式,包括细胞凋亡、坏死性凋亡、自噬、细胞焦亡和铁死亡等[1,4-5](表1)。
受体相互作用蛋白激酶3 (receptor interacting protein kinase 3, RIPK3)在坏死性凋亡过程中起关键作用,临床研究[6]发现,NASH患者中RIPK3高表达,并与肝脏炎症和纤维化相关。细胞焦亡是一种依赖于炎性小体(如NLRP3)的细胞死亡方式,Gasdermin D被激活的caspase-1切割后,插入细胞膜形成质膜孔,导致渗透压改变和细胞肿胀直至细胞膜破裂,被释放的细胞内容物可诱发炎症反应。一项研究[5]发现,NASH 患者的肝脏和血清中可检测到活化形式caspase-1,并与疾病严重程度呈正相关;体外实验发现,通过阻断caspase-1和Gasdermin D活化可抑制肝細胞焦亡;肝星状细胞吞噬细胞外NLRP3炎症小体,导致IL-1β分泌和α-SMA表达增加;由此提示,肝细胞焦亡和炎症小体成分的释放是促进肝损伤和肝纤维化发展的一种新机制。自噬通过去除错误折叠的蛋白质、受损的细胞器和脂滴,在能量平衡和细胞质质量控制中发挥作用。自噬功能受损会导致脂质代谢功能障碍,有研究[7]发现NASH患者中存在自噬失调,Sequestosome-1(一种选择性自噬接头蛋白)将Unc-51样自噬激活激酶1磷酸化,诱导自噬,从而抑制饱和脂肪酸介导的肝细胞死亡,由此提示自噬也许能抑制NASH的进一步进展。
传统观点认为,NAFL受到其他刺激(如氧化应激等)后,进一步进展为NASH,这就是经典的“二次打击”学说。许多分子机制(如自噬的失调、肝细胞焦亡)有助于NASH的发展,但NASH的触发机制尚不清楚。一项来自Tsurusaki等[3]的研究发现,在胆碱缺乏、添加乙硫氨酸饮食的NASH模型中,肝细胞坏死发生在细胞凋亡之前,且铁死亡抑制剂而非坏死性凋亡抑制剂能保护肝细胞,提示铁死亡可能在触发脂肪性肝炎的炎症方面起着重要作用。铁死亡是一种铁依赖性程序性死亡方式,细胞内铁过载和脂质过氧化是最主要的生化特征[1]。下面将结合NAFLD的体内外实验综合阐述铁代谢异常和脂质过氧化在NAFLD中的作用机制。
2 铁代谢异常在NAFLD中的作用
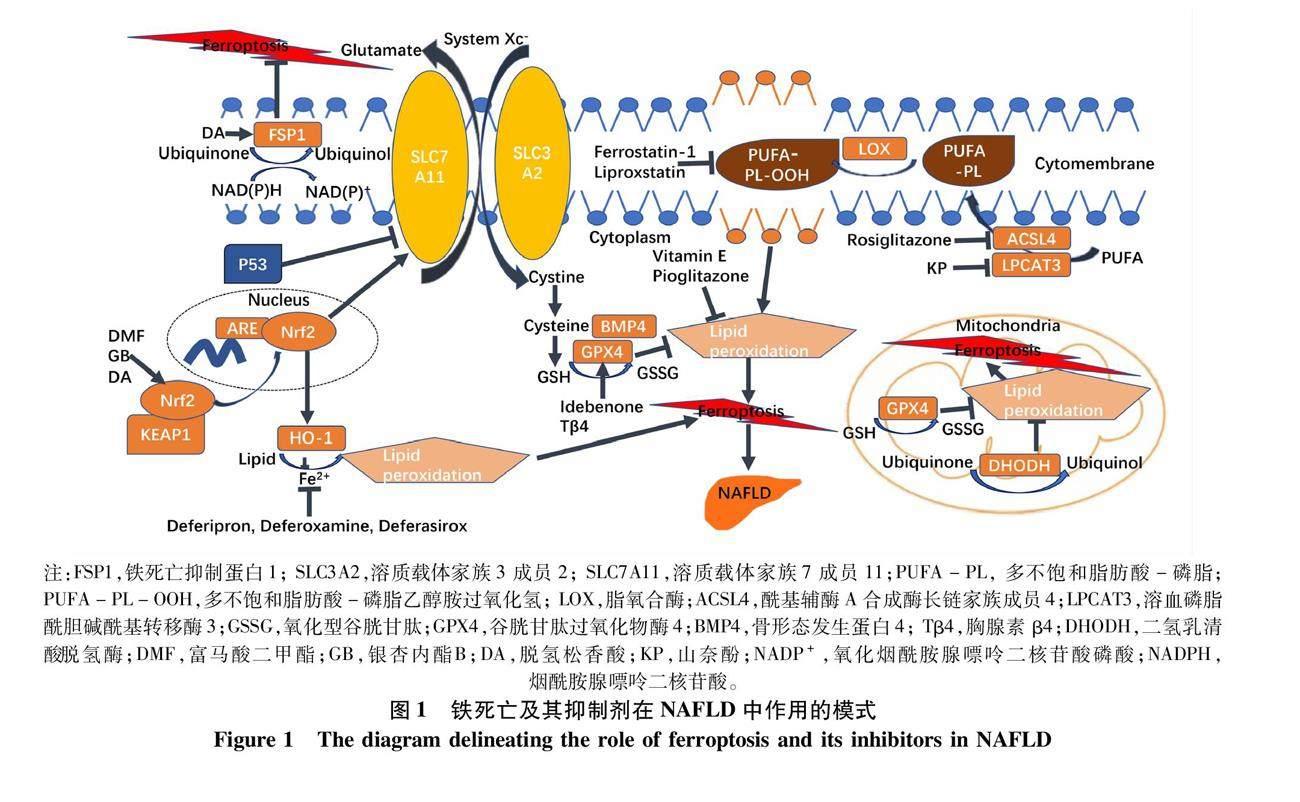
过量的铁通过Fenton反应可产生过量的ROS,而铁螯合剂可有效地抑制铁过载所致的细胞死亡;当缺乏铁离子时,erastin(一种铁死亡诱导剂)无法诱导铁死亡,因而铁离子被认为是铁死亡发生的重要驱动因子[8]。细胞内铁主要来自于血红素的分解,Kwon等[9]发现血红素加氧酶-1(heme oxygenase-1, HO-1)是细胞发生铁死亡时铁依赖性脂质过氧化的必要酶。核因子红细胞2相关因子2(nuclear factor erythroid-2 related factor 2, Nrf2)是一种抗氧化应激的调节因子,在受到刺激后(如氧化应激时)与Kelch 样环氧氯丙烷相关蛋白 1(Kelch-like ECH-associated protein 1, KEAP1)解离,并由细胞质转位至细胞核中,与抗氧化反应元件(antioxidant response element, ARE)的启动子结合,促进HO-1的转录和翻译,从而抑制铁死亡的发生[10-11](图1)。
既往[12]研究发现,NASH患者的肝脏中存在铁富集,代谢功能障碍(如肝铁质沉积症和遗传性血色素沉着症)所致铁过载也可加重NASH患者的肝损伤;而在NAFLD患者中,静脉放血降低血清铁后亦能改善肝损伤。铁稳态在维持细胞和组织生物功能上具有重要意义,降低铁离子浓度的药物(如铁螯合剂)在治疗NAFLD中也许能有一席之地。
脂质过氧化是铁死亡的另一个重要特征,由于多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)存在易被氧化的双烯丙基质子,所以PUFA对氧化损伤非常敏感[13]。目前尚不清楚脂质过氧化过程中的具体作用机制,下面将重点讨论PUFA、system Xc-、GPX4、FSP1、DHODH和Enoyl辅酶A水合酶1 (enoyl coenzyme A hydratase 1, ECH1)在脂质过氧化中的作用。
3.1 PUFA的作用 ACSL4优先将AA酰化,随后LPCAT3催化酰化的AA插入膜磷脂(特别是磷脂酰乙醇胺)中,在促进铁死亡中发挥了关键作用[14]。Xiang等[15]发现抑制肝X受体α/溶血磷脂酰胆碱酰基转移酶3 (LXRα/LPCAT3)信号通路可减轻NASH小鼠的肝脏脂肪变性及炎症。
脂质过氧化可由LOX调控,LOX催化PUFA生成脂质过氧化物如丙二醛(malondialdehyde,MDA)和4-羟基壬醛,促进铁死亡的发生[13]。Yang等[13]发现细胞还原型GSH水平正常时,LOX介导的PUFA氧化作用微乎其微,而GSH耗尽时,LOX介导的PUFA氧化可具有致死作用,提示LOX在驱动铁死亡时对环境(主要是GSH)有依赖作用。
3.2 system Xc-的作用 System Xc-是细胞膜上逆向转运胱氨酸/谷氨酸的异源二聚体,由SLC3A2和SLC7A11组成,可实现胱氨酸/谷氨酸细胞内外转运[10]。细胞内的胱氨酸被还原为半胱氨酸,后者成为GSH合成的前体。Nrf2可通过与ARE结合激活SLC7A11[10];Jiang等[16]发现,P53通过抑制SLC7A11的表达,进而使system Xc-失活、抑制胱氨酸的摄取,降低GSH水平,促进细胞铁死亡的发生。
3.3 GPX4的作用 GPX4是一种能清除脂质过氧化物的酶,主要在细胞质及线粒体中发挥作用。GPX4将细胞毒性脂质过氧化物还原为无毒脂质醇,同时将GSH氧化为GSSG;而GSSG则被谷胱甘肽还原酶还原成GSH[17]。血清BMP4水平在肥胖和代谢综合征患者中显著升高,但在减重后降低;有研究[18]发现,免疫沉淀实验表明BMP4和GPX4在HepG2和LO2细胞中存在物理相互作用,共聚焦成像证实BMP4和细胞质GPX4共定位;在HepG2和LO2细胞中上调BMP4,可降低ROS和MDA,上调GPX4的mRNA和蛋白水平,抑制铁死亡。
3.4 FSP1的作用 FSP1本质是一种不依赖GSH的氧化还原酶,辅酶Q10的还原形式——泛醇捕获能介导脂质过氧化的自由基,而FSP1则通过NADP将泛醇再生。FSP1主要在细胞膜而非线粒体中发挥作用,还能与GPX4协同作抑制脂质过氧化和铁死亡[19-20]。
3.5 DHODH的作用 DHODH是一种黄素依赖性线粒体酶,最初用于治疗类风湿性关节炎和多发性硬化等非肿瘤性疾病,近年来正成为肿瘤(如非小细胞肺癌)治疗的潜在靶点[21-22]。一项使用全球代谢组学分析和代谢示踪剂的研究[22]显示,二氢乳清酸(DHODH的底物)或乳清酸(DHODH的产物)可分别减弱或增强由 GPX4 抑制剂诱导的肿瘤细胞铁死亡,进一步發现DHODH可能与线粒体 GPX4(但独立于细胞质 GPX4 或 FSP1)具有类似作用,可通过将泛醌还原为泛醇来抑制线粒体内膜铁死亡的发生。
3.6 ECH1 ECH1最初被认为是线粒体脂肪酸β-氧化的关键成分,能调节脂肪褐变、参与脂质代谢,在人NASH活检标本和蛋氨酸和胆碱缺乏造模小鼠中,ECH1的表达显著升高[23-24]。过表达ECH1显著减轻小鼠肝脏脂肪变性、炎症、纤维化、细胞凋亡和氧化应激;此外,过表达ECH1还可降低血清丙氨酸转氨酶、促炎细胞因子和甘油三酯水平。ECH1基因敲除后小鼠肝脏炎症、纤维化程度加重,且GPX4表达下降,GSH水平降低,MDA水平升高,但在联合铁死亡抑制剂(Ferrostatin-1)组可减轻肝脏炎症[24]。研究发现,ECH1可能通过抑制铁死亡改善NASH;通过药物或遗传性激活ECH1在未来可能成为NASH的一种治疗方法。
4 铁死亡的抑制剂在NAFLD中的应用
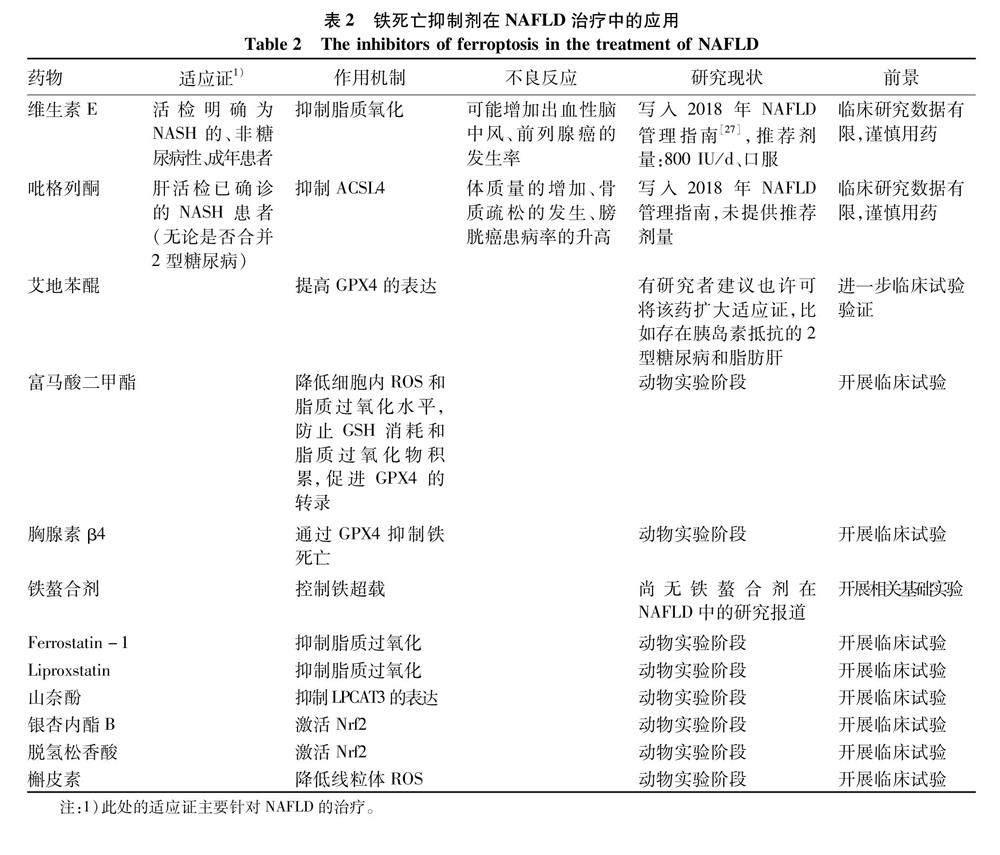
NAFLD患者生活干预效果因人而异、减重手术存在创伤及术后并发症且必须把握严格手术指征(亚太人群BMI>27.5 kg/m2的2型糖尿病患者可考虑减重手术[25]);因而药物治疗在NAFLD的治疗中有着重要地位。尽管一项Ⅲ期临床试验的中期结果提示,25 mg奥贝胆酸可显著改善NASH患者纤维化及疾病活动[26];但总体来说,NASH新药研发遭遇瓶颈;2020年因Elafibranor(一种过氧化物酶体增殖物激活受体α和δ的双重激动剂)120 mg/d、治疗72周后NASH患者的组织学改善不明显,不得不终止临床试验(RESOLVE-IT)。2018年美国肝病学会(AASLD)在NAFLD管理指南[27]中指出目前用于NAFLD治疗的药物仍然有限。前文发现,铁死亡可能是脂肪性肝炎炎症启动的触发因素,铁死亡的抑制剂可通过抑制铁死亡从而减轻NAFLD患者的肝损伤。在此总结了目前抑制铁死亡的药物及其在肝脏相关疾病中的应用,并分析这些药物在NAFLD中应用现状及前景(表2)[15,27-50]。
4.1 维生素E 维生素E是一种脂溶性抗氧化剂,可以降低PUFA氧化水平,抑制细胞性铁死亡的发生[28]。一项临床研究[29](PIVENS)纳入247例、非糖尿病NASH患者,随机分组后分别接受维生素E(800 IU/d)、吡格列酮(30 mg/d)或安慰剂治疗96周,结果发现,维生素E可显著缓解非糖尿病NASH患者的脂肪变性和炎症。但另一项临床研究[30](TONIC)发现,与安慰剂对比,维生素E并未改善儿童NAFLD患者肝脏的组织学结构,亦不能显著改善肝功能。长时间、大剂量服用维生素E的安全性尚不清楚;有研究[31]发现与安慰剂相比,服用维生素E(400 IU/d、超过7年)的每1 000人年患前列腺癌的风险绝对增加为1.6;有荟萃分析[32]发现维生素E致出血性脑卒中的风险增加了22%。2018年NAFLD管理指南指出可考虑将维生素E(800 IU/d)用于治疗病理明确诊断NASH、非糖尿病性、成年患者,并且需要权衡利弊后谨慎使用[27]。
4.2 吡格列酮 胰岛素增敏剂也是目前国内外指南中比较关注的、一大类用于治疗NAFLD的药物,二甲双胍已被排除用于NASH的治疗[27],噻唑烷二酮类因其可影响糖、脂肪代谢而成为关注点。吡格列酮是一种胰岛素增敏剂,亦可通过抑制ACSL4抑制铁死亡[33]。Bell等[29]在PIVENS临床研究中发现,口服吡格列酮(30 mg/d)后可改善脂肪组织胰岛素抵抗,从而在不同程度上改善了非糖尿病、成年NASH患者肝组织病理学表现。Cusi等[34]进一步评估了吡格列酮在合并糖尿病前期或2型糖尿病的NASH患者中的疗效,一项临床研究(NCT00994682)纳入101例病理确诊NASH、合并糖尿病前期或2型糖尿病的患者,随机进入吡格列酮组(45 mg/d)或安慰剂组,治疗18个月,结果发现与安慰剂组相比,吡格列酮组NASH患者肝组织学评分明显改善,并增加了胰岛素敏感性(P<0.001)。体质量的增加[34]、骨质疏松的发生[35]、膀胱癌患病率的升高[36]是吡格列酮需要警惕的不良反应;2018年NAFLD管理指南指出,吡格列酮可用于治疗肝活检已确诊的NASH患者(无论是否合并2型糖尿病);鉴于目前研究数据有限,2018年NAFLD管理指南未提供推荐剂量,并指出吡格列酮需权衡利弊后合理用药[27]。
4.3 艾地苯醌 艾地苯醌是辅酶Q10的类似物,属于抗氧化剂,最初被用来治疗痴呆症,现也被认为是一类新型胰岛素增敏剂。艾地苯醌可能通过增加GPX4的表达,从而降低脂质过氧化产物的水平[37];还可改善蛋氨酸和胆碱缺乏饮食所致小鼠NASH中肝脏的炎症和纤维化[38]。艾地苯醌安全性佳,有研究者[39]认为也许可以将该药扩大适应证,比如存在胰岛素抵抗的2型糖尿病和脂肪肝患者。
4.4 DMF DMF主要用于治疗多发性硬化,这是一种FDA批准的Nrf2激活剂。DMF能够显著上调Nrf2蛋白水平,并促进Nrf2在肝细胞中的核定位,发挥抗炎、抗氧化作用[40]。Vanani等[41]发现DMF通过调节转录因子Nrf2和NF-κB,降低高脂饮食所致小鼠NAFLD的发生率。此外,DMF还能降低细胞内ROS和脂质过氧化水平,防止GSH消耗和脂质过氧化物积累,增加FTH1和GPX4 mRNA表达,维持线粒体膜电位,从而抑制铁死亡[42]。上述研究结果提示DMF存在治疗NAFLD的潜能,但目前有关DMF的研究还局限于动物实验阶段,未来还需要更多的临床试验加以佐证。
4.5 Tβ4 Tβ4可提高抗氧化水平,抑制細胞内ROS的异常积累,改善高脂饮食诱导的NAFLD大鼠炎症、生化和脂质代谢指标;通过体内和体外实验发现,Tβ4能调节与铁死亡相关基因(如Gpx4、Slc7a11和Nrf2等)的表达,且抑制Gpx4的表达后可同时减弱Tβ4对大鼠肝脏和LO2细胞的保护作用[43]。由此提示,Tβ4可能通过GPX4途径抑制铁死亡、保护肝细胞,这为NAFLD的治疗提供了新的策略和靶点。
4.6 铁螯合剂 铁富集也是铁死亡的重要环节之一,铁螯合剂可以与游离铁离子有效结合,降低体内铁含量,目前主要用于地中海贫血的治疗,常用的铁螯合剂有去铁胺、去铁酮、地拉罗司等[44]。肝脏缺血再灌注损伤中亦存在铁超载,Wu等[45]发现予去铁胺抑制铁死亡可减轻小鼠缺血后肝损伤。但目前尚无铁螯合剂在NAFLD治疗中的研究报道。
4.7 铁死亡抑制剂 Ferrostatin-1被认为是第一种铁死亡抑制剂,也是一种脂溶性自由基捕获抗氧化剂。Luo等[46]发现Ferrostatin-1预处理后可预防肥胖所致GPX4下降,可以减轻高脂饮食对小鼠肝组织的病理和功能损害、纤维化、炎症细胞浸润和炎症细胞因子表达。Liproxstatin是另一种铁死亡抑制剂,可以抑制NASH小鼠肝脏脂质过氧化及细胞死亡,减轻NASH的严重程度[47]。但目前关于上述铁死亡抑制剂的研究止步于动物实验,尚未进入临床研究阶段。
4.8 一些中成药 KP广泛存在于各种植物中,具有抗炎、抗氧化、抗衰老和心血管保护的作用。有研究[15]发现,在脂肪细胞分化过程中,KP可能通过抑制LPCAT3的表达,从而减轻高脂饮食NASH小鼠的肝脏炎症。GB是银杏叶提取物中的主要成分,Yang等[48]发现GB 通过激活Nrf2信号通路,提高GPX4和HO-1水平、抑制铁死亡,可降低高脂饮食诱导的NAFLD小鼠肝脏中脂质积累。DA是一种树脂酸,分离自针叶植物,DA不仅可增加FSP1的表达,还可通过激活Keap1/Nrf2-ARE信号通路,促进下游HO-1、GSH、GPX4的表达,降低脂质过氧化物MDA,抑制铁死亡,从而改善高脂饮食诱导NAFLD小鼠的肝脏炎症[49]。槲皮素是一种在蔬菜、瓜果及中药中广泛存在的类黄酮,越来越多的体外和体内实验室证据表明,槲皮素通过抗炎、改善脂质代谢,促进肝脏极低密度脂蛋白的合成、降低脂肪水平,从而改善高脂饮食诱导的NAFLD。有研究[50]发现,槲皮素通过降低线粒体ROS介导的脂滴沉积和脂质过氧化,抑制铁死亡,减轻肝脂肪变性。
5 总结
铁死亡目前已被证实参与包括NAFLD在内的多种疾病的发生及发展,铁代谢异常和脂质过氧化是其最主要的生化特征。铁过载成为驱动铁死亡发生的重要因子;当体内氧化还原系统失衡(如谷胱甘肽耗竭)时,脂氧合酶介导PUFA发生过氧化,促进铁死亡的发生。胰岛素抵抗和遗传易感性与NAFLD发生、发展密切相关,而基于饮食和运动管理的生活方式干预的治疗效果在不同个体中差异较大。肝细胞性铁死亡可促进NAFLD的进展,意味着铁死亡也许能成为NAFLD的治疗新靶点。维生素E和吡格列酮不仅可抑制铁死亡,二者还是2018年AASLD提出的可用于NASH患者、但需严格把握适应证的药物,文中其他一些抑制铁死亡发生药物(如艾地苯醌、银杏内酯B)目前还处于动物实验阶段,但将来通过大量临床试验也许能看到它们在NAFLD治疗中的潜能。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:吴龙云负责论文构思,文献检索及分析,表格制作,论文撰写;鲁晓岚负责论文构思,文章润色及修订。
参考文献:
[1]LI J, CAO F, YIN HL, et al. Ferroptosis: past, present and future[J]. Cell Death Dis, 2020, 11(2): 88. DOI: 10.1038/s41419-020-2298-2.
[2]ESLAM M, SANYAL AJ, GEORGE J, et al. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease[J]. Gastroenterology, 2020, 158(7): 1999-2014.e1. DOI: 10.1053/j.gastro.2019.11.312.
[3]TSURUSAKI S, TSUCHIYA Y, KOUMURA T, et al. Hepatic ferroptosis plays an important role as the trigger for initiating inflammation in nonalcoholic steatohepatitis[J]. Cell Death Dis, 2019, 10(6): 449. DOI: 10.1038/s41419-019-1678-y.
[4]EZQUERRO S, MOCHA F, FRHBECK G, et al. Ghrelin reduces TNF-α-induced human hepatocyte apoptosis, autophagy, and pyroptosis: role in obesity-associated NAFLD[J]. J Clin Endocrinol Metab, 2019, 104(1): 21-37. DOI: 10.1210/jc.2018-01171.
[5]GAUL S, LESZCZYNSKA A, ALEGRE F, et al. Hepatocyte pyroptosis and release of inflammasome particles induce stellate cell activation and liver fibrosis[J]. J Hepatol, 2021, 74(1): 156-167. DOI: 10.1016/j.jhep.2020.07.041.
[6]AFONSO MB, RODRIGUES PM, MATEUS-PINHEIRO M, et al. RIPK3 acts as a lipid metabolism regulator contributing to inflammation and carcinogenesis in non-alcoholic fatty liver disease[J]. Gut, 2021, 70(12): 2359-2372. DOI: 10.1136/gutjnl-2020-321767.
[7]LEE DH, PARK JS, LEE YS, et al. SQSTM1/p62 activates NFE2L2/NRF2 via ULK1-mediated autophagic KEAP1 degradation and protects mouse liver from lipotoxicity[J]. Autophagy, 2020, 16(11): 1949-1973. DOI: 10.1080/15548627.2020.1712108.
[8]LI Y, ZENG X, LU D, et al. Erastin induces ferroptosis via ferroportin-mediated iron accumulation in endometriosis[J]. Hum Reprod, 2021, 36(4): 951-964. DOI: 10.1093/humrep/deaa363.
[9]KWON MY, PARK E, LEE SJ, et al. Heme oxygenase-1 accelerates erastin-induced ferroptotic cell death[J]. Oncotarget, 2015, 6(27): 24393-24403. DOI: 10.18632/oncotarget.5162.
[10]DONG H, QIANG Z, CHAI D, et al. Nrf2 inhibits ferroptosis and protects against acute lung injury due to intestinal ischemia reperfusion via regulating SLC7A11 and HO-1[J]. Aging (Albany NY), 2020, 12(13): 12943-12959. DOI: 10.18632/aging.103378.
[11]GHANIM BY, QINNA NA. Nrf2/ARE axis signalling in hepatocyte cellular death[J]. Mol Biol Rep, 2022, 49(5): 4039-4053. DOI: 10.1007/s11033-022-07125-6.
[12]VALENTI L, MOSCATIELLO S, VANNI E, et al. Venesection for non-alcoholic fatty liver disease unresponsive to lifestyle counselling-a propensity score-adjusted observational study[J]. QJM, 2011, 104(2): 141-149. DOI: 10.1093/qjmed/hcq170.
[13]YANG WS, KIM KJ, GASCHLER MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. Proc Natl Acad Sci U S A, 2016, 113(34): E4966- E4975. DOI: 10.1073/pnas.1603244113.
[14]DOLL S, PRONETH B, TYURINA YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1): 91-98. DOI: 10.1038/nchembio.2239.
[15]XIANG H, SHAO M, LU Y, et al. Kaempferol alleviates steatosis and inflammation during early non-alcoholic steatohepatitis associated with liver X receptor α-lysophosphatidylcholine acyltransferase 3 signaling pathway[J]. Front Pharmacol, 2021, 12: 690736. DOI: 10.3389/fphar.2021.690736.
[16]JIANG L, KON N, LI T, et al. Ferroptosis as a p53-mediated activity during tumour suppression[J]. Nature, 2015, 520(7545): 57-62. DOI: 10.1038/nature14344.
[17]CARLSON BA, TOBE R, YEFREMOVA E, et al. Glutathione peroxidase 4 and vitamin E cooperatively prevent hepatocellular degeneration[J]. Redox Biol, 2016, 9: 22-31. DOI: 10.1016/j.redox.2016.05.003.
[18]WANG X, MA B, WEN X, et al. Bone morphogenetic protein 4 alleviates nonalcoholic steatohepatitis by inhibiting hepatic ferroptosis[J]. Cell Death Discov, 2022, 8(1): 234. DOI: 10.1038/s41420-022-01011-7.
[19]DOLL S, FREITAS FP, SHAH R, et al. FSP1 is a glutathione-independent ferroptosis suppressor[J]. Nature, 2019, 575(7784): 693-698. DOI: 10.1038/s41586-019-1707-0.
[20]BERSUKER K, HENDRICKS JM, LI Z, et al. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis[J]. Nature, 2019, 575(7784): 688-692. DOI: 10.1038/s41586-019-1705-2.
[21]LI L, NG SR, COLN CI, et al. Identification of DHODH as a therapeutic target in small cell lung cancer[J]. Sci Transl Med, 2019, 11(517): eaaw7852. DOI: 10.1126/scitranslmed.aaw7852.
[22]MAO C, LIU X, ZHANG Y, et al. DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer[J]. Nature, 2021, 593(7860): 586-590. DOI: 10.1038/s41586-021-03539-7.
[23]MAO X, HUANG D, RAO C, et al. Enoyl coenzyme A hydratase 1 combats obesity and related metabolic disorders by promoting adipose tissue browning[J]. Am J Physiol Endocrinol Metab, 2020, 318(3): E318-E329. DOI: 10.1152/ajpendo.00424.2019.
[24]LIU B, YI W, MAO X, et al. Enoyl coenzyme A hydratase 1 alleviates nonalcoholic steatohepatitis in mice by suppressing hepatic ferroptosis[J]. Am J Physiol Endocrinol Metab, 2021, 320(5): E925-E937. DOI: 10.1152/ajpendo.00614.2020.
[25]SCHAUER PR, NOR HANIPAH Z, RUBINO F. Metabolic surgery for treating type 2 diabetes mellitus: Now supported by the world's leading diabetes organizations[J]. Cleve Clin J Med, 2017, 84(7 Suppl 1): S47-S56. DOI: 10.3949/ccjm.84.s1.06.
[26]YOUNOSSI ZM, RATZIU V, LOOMBA R, et al. Obeticholic acid for the treatment of non-alcoholic steatohepatitis: interim analysis from a multicentre, randomised, placebo-controlled phase 3 trial[J]. Lancet, 2019, 394(10215): 2184-2196. DOI: 10.1016/S0140-6736(19)33041-7.
[27]CHALASANI N, YOUNOSSI Z, LAVINE JE, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases[J]. Hepatology, 2018, 67(1): 328-357. DOI: 10.1002/hep.29367.
[28]IMAI H, MATSUOKA M, KUMAGAI T, et al. Lipid peroxidation-dependent cell death regulated by GPx4 and ferroptosis[J]. Curr Top Microbiol Immunol, 2017, 403: 143-170. DOI: 10.1007/82_2016_508.
[29]BELL LN, WANG J, MURALIDHARAN S, et al. Relationship between adipose tissue insulin resistance and liver histology in nonalcoholic steatohepatitis: a pioglitazone versus vitamin E versus placebo for the treatment of nondiabetic patients with nonalcoholic steatohepatitis trial follow-up study[J]. Hepatology, 2012, 56(4): 1311-1318. DOI: 10.1002/hep.25805.
[30]LAVINE JE, SCHWIMMER JB, van NATTA ML, et al. Effect of vitamin E or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: the TONIC randomized controlled trial[J]. JAMA, 2011, 305(16): 1659-1668. DOI: 10.1001/jama.2011.520.
[31]KLEIN EA, THOMPSON IM Jr, TANGEN CM, et al. Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT)[J]. JAMA, 2011, 306(14): 1549-1556. DOI: 10.1001/jama.2011.1437.
[32]SCHRKS M, GLYNN RJ, RIST PM, et al. Effects of vitamin E on stroke subtypes: meta-analysis of randomised controlled trials[J]. BMJ, 2010, 341: c5702. DOI: 10.1136/bmj.c5702.
[33]KUNG YA, CHIANG HJ, LI ML, et al. Acyl-coenzyme a synthetase long-chain family member 4 is involved in viral replication organelle formation and facilitates virus replication via ferroptosis[J]. mBio, 2022, 13(1): e0271721. DOI: 10.1128/mbio.02717-21.
[34]CUSI K, ORSAK B, BRIL F, et al. Long-term pioglitazone treatment for patients with nonalcoholic steatohepatitis and prediabetes or type 2 diabetes mellitus: a randomized trial[J]. Ann Intern Med, 2016, 165(5): 305-315. DOI: 10.7326/M15-1774.
[35]AUBERT RE, HERRERA V, CHEN W, et al. Rosiglitazone and pioglitazone increase fracture risk in women and men with type 2 diabetes[J]. Diabetes Obes Metab, 2010, 12(8): 716-721. DOI: 10.1111/j.1463-1326.2010.01225.x.
[36]TANG H, SHI W, FU S, et al. Pioglitazone and bladder cancer risk: a systematic review and meta-analysis[J]. Cancer Med, 2018, 7(4): 1070-1080. DOI: 10.1002/cam4.1354.
[37]AVCI B, GNAYDIN C, GVEN T, et al. Idebenone ameliorates rotenone-induced parkinson's disease in rats through decreasing lipid peroxidation[J]. Neurochem Res, 2021, 46(3): 513-522. DOI: 10.1007/s11064-020-03186-w.
[38]JIANG JX, TOMILOV A, MONTGOMERY C, et al. Shc inhibitor idebenone ameliorates liver injury and fibrosis in dietary NASH in mice[J]. J Biochem Mol Toxicol, 2021, 35(10): e22876. DOI: 10.1002/jbt.22876.
[39]TOMILOV A, ALLEN S, HUI CK, et al. Idebenone is a cytoprotective insulin sensitizer whose mechanism is Shc inhibition[J]. Pharmacol Res, 2018, 137: 89-103. DOI: 10.1016/j.phrs.2018.09.024.
[40]YAN N, XU Z, QU C, et al. Dimethyl fumarate improves cognitive deficits in chronic cerebral hypoperfusion rats by alleviating inflammation, oxidative stress, and ferroptosis via NRF2/ARE/NF-κB signal pathway[J]. Int Immunopharmacol, 2021, 98: 107844. DOI: 10.1016/j.intimp.2021.107844.
[41]VANANI AR, KALANTARI H, MAHDAVINIA M, et al. Dimethyl fumarate reduces oxidative stress, inflammation and fat deposition by modulation of Nrf2, SREBP-1c and NF-κB signaling in HFD fed mice[J]. Life Sci, 2021, 283: 119852. DOI: 10.1016/j.lfs.2021.119852.
[42]QIU YB, WAN BB, LIU G, et al. Nrf2 protects against seawater drowning-induced acute lung injury via inhibiting ferroptosis[J]. Respir Res, 2020, 21(1): 232. DOI: 10.1186/s12931-020-01500-2.
[43]ZHU Z, ZHANG Y, HUANG X, et al. Thymosin beta 4 alleviates non-alcoholic fatty liver by inhibiting ferroptosis via up-regulation of GPX4[J]. Eur J Pharmacol, 2021, 908: 174351. DOI: 10.1016/j.ejphar.2021.174351.
[44]KONTOGHIORGHE CN, KONTOGHIORGHES GJ. Efficacy and safety of iron-chelation therapy with deferoxamine, deferiprone, and deferasirox for the treatment of iron-loaded patients with non-transfusion-dependent thalassemia syndromes[J]. Drug Des Devel Ther, 2016, 10: 465-481. DOI: 10.2147/DDDT.S79458.
[45]WU S, YANG J, SUN G, et al. Macrophage extracellular traps aggravate iron overload-related liver ischaemia/reperfusion injury[J]. Br J Pharmacol, 2021, 178(18): 3783-3796. DOI: 10.1111/bph.15518.
[46]LUO Y, CHEN H, LIU H, et al. Protective effects of ferroptosis inhibition on high fat diet-induced liver and renal injury in mice[J]. Int J Clin Exp Pathol, 2020, 13(8): 2041-2049.
[47]QI J, KIM JW, ZHOU Z, et al. Ferroptosis affects the progression of nonalcoholic steatohepatitis via the modulation of lipid peroxidation-mediated cell death in mice[J]. Am J Pathol, 2020, 190(1): 68-81. DOI: 10.1016/j.ajpath.2019.09.011.
[48]YANG Y, CHEN J, GAO Q, et al. Study on the attenuated effect of Ginkgolide B on ferroptosis in high fat diet induced nonalcoholic fatty liver disease[J]. Toxicology, 2020, 445: 152599. DOI: 10.1016/j.tox.2020.152599.
[49]GAO G, XIE Z, LI EW, et al. Dehydroabietic acid improves nonalcoholic fatty liver disease through activating the Keap1/Nrf2-ARE signaling pathway to reduce ferroptosis[J]. J Nat Med, 2021, 75(3): 540-552. DOI: 10.1007/s11418-021-01491-4.
[50]JIANG JJ, ZHANG GF, ZHENG JY, et al. Targeting mitochondrial ROS-mediated ferroptosis by quercetin alleviates high-fat diet-induced hepatic lipotoxicity[J]. Front Pharmacol, 2022, 13: 876550. DOI: 10.3389/fphar.2022.876550.
收稿日期:
2022-10-14;錄用日期:2022-12-12
本文编辑:王莹
引证本文:
WU LY, LU XL. Research advances in ferroptosis in the pathogenesis and treatment of nonalcoholic fatty liver disease
[J]. J Clin Hepatol, 2023, 39(7): 1687-1695.
吴龙云, 鲁晓岚.
铁死亡在非酒精性脂肪性肝病发病和治疗中的作用
[J]. 临床肝胆病杂志, 2023, 39(7): 1687-1695.

