高流量搭桥手术在头颈复杂病变中的应用及疗效观察
袁国艳 杨光华 吴平安 张作洪 张振宇 何伟成 任铭新

【摘要】 目的 探讨高流量搭桥手术在头颈复杂病变中的应用及疗效观察。方法 回顾性分析2016年3月—2021年2月香港大学深圳医院收治的10例颅底复杂病变患者的临床资料,术中应用高流量颅内外搭桥进行血管重建,对患者的术前评估、诊疗经过及术后随访情况进行分析。结果 10例患者均成功实施颅内外高流量搭桥手术,术中吲哚菁绿荧光造影显示搭桥血管通畅。术后并發症颅内出血2例,颅内感染2例,脑积水2例,脑卒中1例,术后3个月改良Rankin量表评分0~3分9例,4分1例。结论 头颈部复杂病变累及颈内动脉的情况下,应用高流量颅内外血管搭桥手术是一种有效的治疗方法。术前评估脑组织供血状态、选用合适的搭桥血管和吻合方式是治疗方案的关键。
【关键词】 颅内外血管搭桥术;高流量;头颈部复杂病变
【中图分类号】 R651.1+1 【文献标志码】 B 【文章编号】 1672-7770(2023)01-0084-05
Abstract: Objective To investigate the application and therapeutic observation of high flow bypass surgery in complex head and neck lesions. Methods The clinical data of 10 patients with complex head and neck lesions admitted to the University of Hong Kong-Shenzhen Hospital from March 2016 to February 2021 were analyzed retrospectively. During the operation, high flow extracranial bypass was used for vascular reconstruction, and the preoperative evaluation, diagnosis and treatment process and postoperative follow-up were analyzed. Results Intracranial and extracranial high flow bypass surgery was successfully performed in all 10 patients. Indocyanine green fluorescence angiography showed patency of bypass vessels during operation. Postoperative complications included intracranial hemorrhage in 2 cases, intracranial infection in 2, hydrocephalus in 2 and infarction in 1. After 3 months of operation, the modified Rankin scale scored 0-3 points in 9 and 4 points in 1. Conclusions High flow intracranial to extracranial bypass surgery is a safe and effective method for complex head and neck lesions. Preoperative evaluation of brain blood supply, selection of appropriate bypass vessels and anastomosis are the key to treatment.
Key words: extracranial to intracranial revascularization; high flow bypass; complex head and neck lesions
基金项目:香港大学深圳医院科研培育计划青年项目(HKUSZH201901041)
作者单位:518000 深圳,香港大学深圳医院神经外科(袁国艳,杨光华,张作洪, 张振宇,何伟成),头颈外科(吴平安);南方科技大学医学院(任铭新)
通信作者:任铭新
对于头颈部复杂病变侵及颈内动脉(internal carotid artery,ICA)的手术治疗,因缺乏大样本的临床研究结论及规范治疗的指南,手术难度及风险远高于普通颅内病变的手术,使得该类疾病的并发症发生率较高,治愈率低,术后病死率、致残率也较高[1-3]。随着显微血管吻合手术技术和对颅内血管疾病的认识不断进步,1982年Sundt首次采用高流量颅外-颅内(extracranial-intracranial,EC-IC)血管搭桥技术治疗难治性动脉瘤开始,颅内外血管重建手术为复杂颅底病变提供了一个有效的治疗方法[4]。本研究回顾性分析了2016年3月—2021年2月香港大学深圳医院收治的10例实施高流量搭桥手术患者的临床资料,初步探讨颅内外血管搭桥手术的适应证,术前评估,并发症和治疗效果。
1 资料与方法
1.1 一般资料 10例患者中,男6例,女4例;年龄8~64岁,平均49.5岁;其中6例为病变侵及ICA(急性假性动脉瘤破裂出血4例,未破裂2例),4例为病变包绕ICA(1例为肿瘤侵及颅底伴脑脊液鼻漏,1例为海绵窦巨大海绵状血管瘤,1例为颈部非横纹肌肉瘤,1例为甲状腺乳头状癌术后复发)。临床主要表现为ICA假性动脉瘤6例,复视伴视力下降1例,脑脊液漏1例,颈部肿瘤性溃疡2例,吞咽障碍1例。术前通过MRI、CT、CTA、DSA、BOT实验以及CTP评估涉及肿瘤的部位、性质、大小与ICA的关系、双侧脑组织灌注等情况。10例患者均行术前头颈部CT增强及颈部MRI增强检查,影像学诊断明确;6例曾行术前DSA检查,3例术前行球囊闭塞实验,两例结果为阳性,1例为阴性,1例曾因颈动脉假性动脉瘤破裂出血急诊行颈动脉覆膜支架置入术;6例患者行CTA检查,术前评估颅内及颈部血管情况;1例因脑脊液鼻漏,颅内大量积气行脑脊液造影检查;1例颅底巨大病变,术后病理提示为海绵窦海绵状血管瘤,大小约70 mm×48 mm×71 mm。10例患者具体情况见表1。所有患者或家属均签署知情同意书。
1.2 治疗方法
1.2.1 围手术期评价与监测 术前应用CTA、MRA、DSA、CTP、B超及Allen实验评估移植血管、吻合血管、颅内侧支循环及脑组织灌注情况,有3例患者术前行球囊闭塞实验,两例为阳性,1例为阴性。术中应用吲哚菁绿荧光显影术中评估搭桥血管、受血的血管通畅情况及吻合口是否有狭窄,部分患者术中应用神经电生理监护,应用SEP及MEP检测脑组织缺氧情况。
1.2.2 手术方法 10例患者中因ICA假性动脉瘤破裂出血急诊手术4例,1例因术中损伤ICA大出血急诊行搭桥手术,5例为择期手术。手术方式分为同侧颈部动脉与MCA搭桥(7例)及“Bonnet”技术跨侧行颅内外高流量血管搭桥(3例)。移植血管有桡动脉(5例)和大隐静脉(5例)。手术经过:(1)在病变侧常规扩大翼点开颅,分离侧裂血管,选取MCA的M2合适分支,颈部仔细解剖CCA、ECA和ICA;(2)桡动脉通常作为首选移植血管,可提供15~20 cm的长度,如果需要较长的移植血管(>20 cm)的时候,或者双手的Allen试验均失败,则可以使用大隐静脉;(3)随后在颅脑切口和颈部切口之间的耳前区域形成皮下隧道,避免损伤面部神经,使用胸导管作为引导,将移植血管通过皮下隧道,以确保移植血管不变形扭转;(4)在手术显微镜下进行移植血管与MCA的M2段和CCA/ECA之间端侧吻合,术中应用神经电生理检测脑组织是否有缺氧变化,应用吲哚菁绿荧光显影技术评估搭桥血管、受血血管的通畅情况及吻合口是否有狭窄;(5)头颈部肿瘤组患者,确认搭桥血管通畅后,夹闭同侧ICA床突段,颈部结扎ICA頸段,随后经由头颈外科医生行二期(搭桥手术后2~4周)肿瘤切除手术。
1.2.3 预后评估 术后3个月按照改良Rankin量表(modified Rankin scale,mRS),参照患者复诊记录或电话随访评价患者神经功能改善程度,其中0~3分为神经功能正常或轻度残疾,生活能够自理;4~5分为重度残疾,生活完全不能自理。
2 结 果
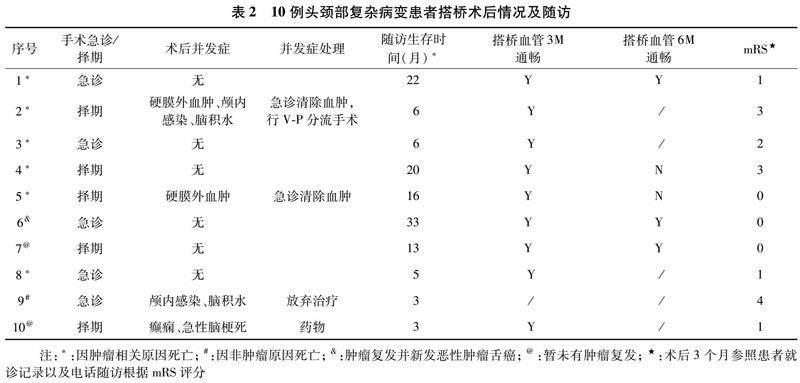
2.1 临床随访 本组患者10例,头颈部恶性肿瘤9例,颅底病变1例,均成功实施高流量搭桥手术,一期切除病变1例,二期切除病变4例,共随访3~28个月,平均11.6个月;术后急性颅内出血2例(2/10),均行急诊手术清除,其中1例患者出现对侧肢体偏瘫,经过3个月康复锻炼,肌力恢复2~3级;另一例患者术后未有神经功能缺失。2例(2/10)术后出现颅内感染,行抗感染治疗后,感染症状控制;脑积水2例,1例行脑室腹腔分流手术,另一例,家属放弃治疗,自动出院。1例(1/10)患者术后第10天因窒息后出现急性脑梗死及癫痫发作,经积极抢救治疗后,右手精细运动稍差,生活能自理;术后3个月采用mRS评分评价临床预后,0~2分7例,3分2例,4分1例。随访期间恶性肿瘤9例患者因肿瘤相关疾病死亡6例,非手术相关并发症死亡1例,生存时间3~22个月,中位生存时间11.14个月,肿瘤原位复发1例,并新发恶性肿瘤(舌癌),暂未复发2例,移植血管通畅率3个月(9/10),6个月为(3/10)(见表2)
本组患者中3例应用“Bonnet Bypass”的方法,也就是跨侧行颅内外高流量血管搭桥,在同侧高流量搭桥步骤基础上,在颅骨外板磨出一个骨槽,容纳移植血管,使得移植的血管可以连接对侧颈动脉与同侧颅内MCA。因需要较长距离的移植血管,故本组3例患者中选用大隐静脉为移植血管的两例,搭桥术两周后,二期行颈部病变切除术,围手术期未出现脑卒中症状。但两例患者(序号4和5)分别在术后6个月和5个月时发现搭桥血管闭塞,两例患者均未出现明显的脑梗死症状,第3个患者(10号)采用双侧桡动脉为移植血管,术前评估时行BOT实验,结果为阴性,搭桥术后第10天因突发窒息引起低血压低血氧情况,进而出现症状性癫痫以及急性脑梗死症状,给予积极抢救治疗,右侧肢体肌力1~2级,复查颅脑MRI及MRA检查示,左侧额叶小片状梗死,搭桥血管通畅,经康复锻炼后,右侧肢体肌力恢复,但右手精细运动稍差,生活自理;目前术后3个月搭桥血管波动良好,搭桥术后6周行颈部肿瘤二期肿瘤切除,围手术期未出现脑梗死症状。
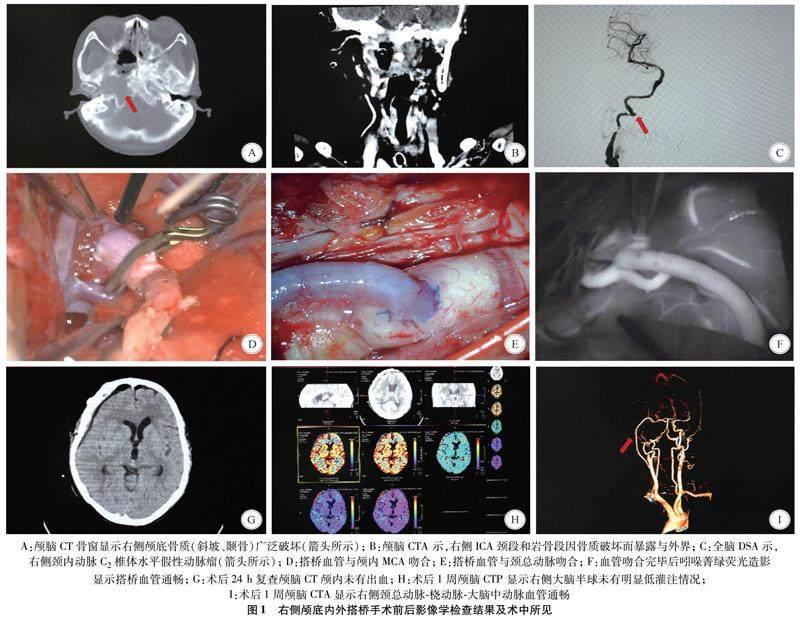
2.2 典型病例 患者女,63岁,以“鼻咽癌术后14 d,呕血半天”为主诉入院,既往鼻咽癌综合治疗后18年。14 d前因鼻咽部肿瘤复发在外院行鼻内镜下鼻咽部复发恶性肿瘤切除+右侧海绵窦、斜坡颅底肿瘤切除+颅底重建,术后恢复顺利。入院前5 h突然出现口腔出血并有血凝块,出血量约100 mL,急诊入香港大学深圳医院。抢救期间反复多次出血,血红蛋白最低达52 g/L,给予输血、补液;经鼻放置尿管水囊压迫止血,因张口困难,急诊行气管切开术,保护气道;行全脑血管造影示,右侧ICA颅外段C2椎体水平假性动脉瘤破裂出血。急诊行“右侧颈内动脉-桡动脉-大脑中动脉搭桥术+颈部淋巴结清扫”,手术时间8 h 29 min,手术顺利,术后24 h复查颅脑CT,颅内未有术后出血情况,1周复查CTA+CTP检查示,右侧搭桥血管通畅,右侧半球未有明显低灌注区。术后21 d出院,出院时神志清楚,四肢活动正常。见图1。
3 讨 论
高流量搭桥以大管径血管为桥血管(一般取大隐静脉或桡动脉),提供可靠的血流替代,移植血管内血流速度可超过50 mL/min(70~140 mL/min)对于头颈部复杂肿瘤的患者, 为了提高肿瘤的全切率,降低术中损伤重要血管的风险,行血管重建手术是可行的手术方案。切除侵犯颈部大血管的巨大肿瘤,术中ICA破裂出血的风险高达18%[5],对于ICA球囊闭塞阳性的患者,手术分期先行血管重建再行肿瘤切除,并没有增加术中及术后死亡率,是可行的手术方案,并且使肿瘤全切率有了明显的提高。对于球囊闭塞实验阴性的患者,在ICA切除后,发生渐进性、短暂性脑缺血发作或脑梗死的风险从2%到22%不等,甚至存在5%的死亡率[6-8]。故Lawton等[9]认为所有需要阻断颅内主要供血动脉的患者,均宜先行血管重建。Kalani等[10]成功实施颅内外血管重建和颈动脉切除治疗18例晚期头颈部恶性肿瘤患者,排除手术相关死亡,平均生存时间和中位生存时间为13.2和8.3个月(1.5~48个月),最终所有的患者均死于肿瘤相关疾病。所以本研究不主张对于晚期恶性肿瘤患者使用该术式,对于低级别恶性肿瘤可以考虑使用该治疗方案。Mourad等[11]报告51例确定需要切除颈部动脉和重建颅内外血管的晚期头颈癌(IVB期)患者,术后发生急性脑血管意外2例(3.9%),其余49例(96%)无神经后遗症。围手术期死亡1例,肿瘤相关死亡5例,两年总生存率为82%,总结认为在无远处转移性疾病的情况下,切除颈动脉和自体血管重建是一种可行的治疗方案。Yang等[4]总结了搭桥手术的四种适应证情况:(1)对于包裹大动脉的良性肿瘤,在受累动脉上切除肿瘤的过程中损伤血管的风险很高,进行搭桥手术以降低血管损伤引起恶性大出血;(2)对于恶性肿瘤,搭桥手术可以避免损伤受累血管的潜在风险,有机会全切肿瘤;(3)对于已经因肿瘤侵袭重要颈部血管,术前已经有短暂性脑缺血发作或脑卒中事件发生的患者;(4)对于术中发生血管损伤而不能直接缝合修复的患者,搭桥手术是必需的。
本组10例肿瘤患者也是因为上述四种原因,实施高流量搭桥手术,其中9例患者是因为颈部大血管受侵犯,符合第二种情况,另一例患者肿瘤切除过程中出现ICA破裂出血,修补未能成功,一期行颅内外搭桥手术,控制动脉出血。手术时间达13 h,对神经外科医生的团队合作、多科室之间协助、手术医生的应变能力及体力都是较大的挑战。术后8例恶性肿瘤患者因肿瘤进展而导致死亡,使得远期观察搭桥血管的通畅率有所下降,综合考虑术后并发症、生存时间、肿瘤复发时间、术后脑卒中的发生率、mRS评分,颅内外搭桥手术是一种安全可行的治疗方案,可以提高恶性肿瘤的全切程度,降低术中大出血的风险,延长患者生存时间。对于颅底复杂病变包裹大血管的良性肿瘤,分期行搭桥手术和肿瘤切除手术,可以降低术中损伤大血管而导致的不可控大出血,减低术后神经功能损害的发生率,是一种可行的手术治疗方案。
本组有7例为鼻咽癌晚期患者,鼻咽癌是华南和东南亚地区最常见的头颈部恶性肿瘤,发病率为15/10万~50/10万,以放疗为主的综合治疗是目前治疗鼻咽癌最有效的方法[12-13]。同时放疗也会造成诸多并发症,包括耳毒性、张口受限、颞叶坏死、颅底放射性骨坏死及颈动脉爆裂综合征(carotid blowout syndrome,CBS)[14-15]。CBS是颈动脉及其分支破裂后引起患者呼吸、循环及神经系统急性功能障礙的一系列病理表现,是一种罕见且极具致命性的鼻咽癌放疗并发症。晚期头颈肿瘤患者中,CBS的患病率为3.9%,死亡率很高,通常超过50%,CBS包括3种不同的临床亚型[16]:(1)Ⅰ型(威胁型)指血管暴露于外部环境中,没有出血迹象,如果不采取措施,出血将不可避免;(2)Ⅱ型(濒临型)指间歇性颈动脉出血,可以自发停止或通过填塞压迫止血;(3)Ⅲ型(急性出血型)是指颈动脉大出血,通常不能通过压迫来止血。目前的治疗方法包括颈动脉结扎、血管内介入治疗以及EC-IC血管搭桥术[17]。本组7例患者Ⅰ型 1例,Ⅱ型 3例,Ⅲ型2例,经过多科室参与评估与治疗,及时手术干预并控制大出血,挽救患者的生命,提高患者的生存时间。
本组患者中,第4、5例患者在术后随访期间发现,搭桥血管分别在6个月和5个月时闭塞,这两例患者是采取Bonnet的方法,即跨侧行颅内外高流量血管搭桥。因为病变侧的颈动脉不能作为供血血管,故选用对侧颈部血管作为供血血管,选用大隐静脉为移植血管,与病变侧的MCA相连接,术中结扎病变侧的ICA,选用大隐静脉的原因首先是考虑其管径较粗,可以提供的血流速度较高(70~140 mL/min),其次是可以满足跨侧移植血管需要较长皮下通道的要求,可选用长度达60 cm,相较选用多根动脉血管连接一起为移植血管可以减少血管吻合接头,缩短手术时间,减少创伤以及出血量。术后短时间内搭桥血管闭塞考虑可能是因为通道周围软组织张力引起静脉受压导致血栓形成而闭塞搭桥血管,或是因为静脉瓣的解剖结构,导致血流动力学改变,形成血管内血栓进而导致移植血管闭塞。动脉的血管壁比静脉更有弹性,对抗通道内软组织引起的压力,更为有利。由于缺乏瓣膜可能会降低移植物血栓形成的可能性,所以动脉移植血管的通畅率也更高。根据心血管文献的报道,桡动脉5年后通畅率可达91.9%[18]。但是桡动脉可选用的长度在20~40 cm,对于需要跨侧搭桥的血管吻合手术,需选用两根桡动脉连接才能达到移植血管所需的长度,所以病例10患者采用双侧桡动脉连接后作为移植血管,两个桡动脉之间采用端端吻合,增加了一个吻合接口,因随访时间尚短,仍需较多的病例和较长的随访时间来观察移植血管的通畅情况,评估影响移植血管通畅的因素。
搭桥方式的选择以及移植血管的选择都是术前评估的重点。术前常用的评估方法有CTA、DSA、CTP、PWI、PET/CT、BOT实验、Allen实验等,近年来有学者[19-20]提出,采用搭桥前后大脑动脉血管内压力与临时夹闭ICA后MCA的血管内压力的值,同时考虑搭桥血管的直径、ICA直径与MCA直径的因素,根据哈根-泊肃叶定律(Hagen-Poiseuille law)计算,评估移植血管是否能提供足够和适量的血流,从而为降低围手术期的脑卒中及高灌注综合征的发生,提供更为有利的依据。本组病例仅纳入10例搭桥术患者的治疗经过及预后,经验尚浅,尚存在许多需深入探讨的技术难点。
[参 考 文 献]
[1]Powers WJ,Clarke WR,Grubb RL,Jr,et al.Extracranial-intracranial bypass surgery for stroke prevention in hemodynamic cerebral ischemia:the carotid occlusion surgery study randomized trial[J].JAMA,2011,306(18):1983-1992.
[2]Zhu MH,Zheng HL,Chen SC,et al.Surgical management and reconstruction of petrous internal carotid artery involved in malignant tumors of lateral skull base[J].Chin J Otorhinolaryngol Head Neck Surg,2012,47(12):1008-1012.
[3]Yu GN,Zhu MH,Zheng HL,et al.Analysis of the effect of one-stage revascularization with internal carotid artery resection on cervical metastatic carcinoma in advanced head and neck carcinomas[J].J Clin Otorhinolaryngol Head Neck Surg,2020,34(10):901-905.
[4]Yang T,Tariq F,Chabot J,et al.Cerebral revascularization for difficult skull base tumors:a contemporary series of 18 patients[J].World Neurosurg,2014,82(5):660-671.
[5]Li YH,Wang JS,Yao C,et al.Risk factors of rupture of internal carotid artery during surgical resection of carotid body tumor[J].Natl Med J China,2017,97(22):1724-1728.
[6]Guinto G,Guinto Y.Reconstruction techniques in skull base surgery[J].World Neurosurg,2015,83(1):17-18.
[7]Horowitz PM,DiNapoli V,Su SY,et al.Complication avoidance in endoscopic skull base surgery[J].Otolaryngol Clin North Am,2016,49(1):227-235.
[8]Sivakumaran R,Mohamed AZ,Akhunbay-Fudge CY,et al.Internal carotid artery test balloon occlusion using single photon emission computed tomography scan in the management of complex cerebral aneurysms and skull base tumors:a 20-year review[J].World Neurosurg,2020,139(3):e32-e37.
[9]Lawton MT,Hamilton MG,Morcos JJ,et al.Revascularization and aneurysm surgery:current techniques,indications,and outcome[J].Neurosurgery,1996,38(1):83-94.
[10]Kalani MYS,Kalb S,Martirosyan NL,et al.Cerebral revascularization and carotid artery resection at the skull base for treatment of advanced head and neck malignancies[J].J Neurosurg,2013,118(3):637-642.
[11]Mourad M,Saman M,Stroman D,et al.Carotid artery sacrifice and reconstruction in the setting of advanced head and neck cancer[J].Otolaryngol Head Neck Surg,2015,153(2):225-230.
[12]Pastor M,Lopez Pousa A,Del Barco E,et al.SEOM clinical guideline in nasopharynx cancer(2017)[J].Clin Transl Oncol,2018,20(1):84-88.
[13]Wang FZ,Chuner J,Lei W,et al.Optimal induction chemotherapeutic regimen followed by concurrent chemotherapy plus intensity-modulated radiotherapy as first-line therapy for locoregionally advanced nasopharyngeal carcinoma[J].Medicine(Baltimore),2020,99(39):e22283.
[14]Lam JWK,Chan JYW,Lui WM,et al.Management of pseudoaneurysms of the internal carotid artery in postirradiated nasopharyngeal carcinoma patients[J].Laryngoscope,2014,124(10):2292-2296.
[15]Suárez C,Fernández-Alvarez V,Hamoir M,et al.Carotid blowout syndrome:modern trends in management[J].Cancer Manag Res,2018,10(11):5617-5628.
[16]Manzoor NF,Rezaee RP,Ray A,et al.Contemporary management of carotid blowout syndrome utilizing endovascular techniques[J].Laryngoscope,2017,127(2):383-390.
[17]Liang NL,Guedes BD,Duvvuri U,et al.Outcomes of interventions for carotid blowout syndrome in patients with head and neck cancer[J].J Vasc Surg,2016,63(6):1525-1530.
[18]Yaargil MG.A legacy of microneurosurgery:memoirs,lessons,and axioms[J].Neurosurgery,1999,45(5):1025-1092.
[19]Matsukawa H,Miyata S,Tsuboi T,et al.Rationale for graft selection in patients with complex internal carotid artery aneurysms treated with extracranial to intracranial high-flow bypass and therapeutic internal carotid artery occlusion[J].J Neurosurg,2018,128(6):1753-1761.
[20]Matsukawa H,Tanikawa R,Kamiyama H,et al.Graft occlusion and graft size changes in complex internal carotid artery aneurysm treated by extracranial to intracranial bypass using high-flow grafts with therapeutic internal carotid artery occlusion[J].Neurosurgery,2017,81(4):672-679.
(收稿2021-12-31 修回2022-03-28)