基于罗丹明B的荧光探针“关-开”法测定硫普罗宁的含量
孙双姣 何芳 邓子璇


摘 要:目的 建立一种基于碘-罗丹明B(rhodamine B,RhB)体系的“关-开”荧光探针的新方法测定药物中硫普罗宁(tiopronin,TPN)含量。方法 RhB水溶液具有荧光性质,以365 nm为激发波长时,RhB在582 nm处有最大荧光强度。加入碘后,荧光强度减弱甚至消失,发生荧光猝灭。TPN含有巯基官能团而具有较强的还原性,能将I3还原为I-,I-不与RhB作用,将TPN加入到上述体系中,体系的荧光信号得以恢复。根据荧光强度的增强值(△F365/582)与TPN的浓度呈现较好的线性关系实现对TPN浓度的测定。结果 TPN浓度在1.00-20.00 μmol/L范围内与荧光强度(△F365/582)有较好的线性关系,回归方程为△F365/582=84.783+9.6962C(r=0.999 3),检出限为0.33 μmol/L。结论 该法测定药品中TPN含量,操作简便可行。
关键词:罗丹明B;碘;硫普罗宁;荧光法;含量测定
中图分类号:O657.3
文献标志码:A
Determination of tiopronin content based on“off-on”rhodamine Bas fluorescent probe
SUN Shuangjiao HE Fang DENG Zixuan
(1. School of Pharmacy, Shaoyang University, Shaoyang 422000, China;
2. Hunan Engineering Research Center of Development and Utilization of Traditional Chinese Medicine in Southwest Hunan, Shaoyang 422000, China)
Abstract: Objective To establish a new fluorescence spectroscopic method for the determination of tiopronin (TPN) in medicine by the fluorescence switch based on iodine-rhodamine B. Method Rhodamine B aqueous solution exhibits fluorescence properties. When 365 nm used is the excitation wavelength, Rhodamine B has the maximum fluorescence intensity at 582 nm. After adding iodine to the solution of rhodamine B, the fluorescence intensity weaken or even disappears and undergoes fluorescence quenching. TPN containsed a sulfhydryl functional group and has strong reducibility, which can reduce I-3 to I-. Because I- does not interact with rhodamine B, the fluorescence signal of the system is reproduced when adding TPN to the above system. According to the good linear relationship between the enhanced value of fluorescence intensity (△F365/582) and the concentration of TPN, the inverse fluorescence determination of the concentration of TPN was achieved. Results When the concentration of TPN was 1.00~20.00 μmol/L, it had a good linear relationship with the fluorescence intensity (△F365/582). The regression equation was △F365/582=84.783+9.696 2 C(r=0.999 3) with a detection limit of 0.33 μmol/L. Conclusion The method is simple and feasible to determine the content of TPN in drugs.
Key words: rhodamine B; iodine; tiopronin; fluorescence method; content determination
硫普罗宁(tiopronin,TPN)又称作为凯西莱,分子结构如图1所示,在侧链中含有巯基(-SH),该巯基具有活性可以保护肝脏,在体内具有多种药理效应,在临床上主要用于治疗有机磷中毒[1]、药物性肝损伤[2]、早期肝硬化、慢性肝炎[3]、脂肪肝[4]等各种疾病。
已报道的测定TPN的仪器分析方法主要有RP-HPLC[5]、超高效液相色谱-串联质谱法[6]、柱前衍生-高效液相色谱荧光法[7]、LC-ESI-MS-MS[8]、褪色光度法[9]、UV-Vis[10]、 HPLC[11]、浮选法[12]、金纳米荧光法[13]等,但这些方法有的检测灵敏度較低,分离效果较差,有的仪器设备较为复杂或昂贵,分析的成本较高,有的需要具备特殊的检测器,在实际操作过程中存在一定的限制。
罗丹明B(rhodamine B,RhB)属于三苯甲烷类染料,具有荧光特性,常作为分析试剂用于荧光分析。现有文献报道的氧化性物质的测定分析中已有使用过RhB荧光猝灭法,如测定I-[14]、铁(Ⅲ)[15]、亚氯酸根[16]等,对于分析还原性药物的研究鲜见报道。本研究发现,在弱酸反应环境下,I-3-RhB缔合物使得体系荧光消失,在实验体系中加入TPN,TPN分子中的官能团巯基将I-3还原成I-,溶液荧光再现,荧光强度的增加值与TPN的浓度存在较好的线性关系,本研究据此建立了RhB荧光“关-开”法测定TPN含量的光谱分析新方法,该法用于肠溶片中TPN含量的分析,具有试剂易得,选择性较好,简化便捷,分析成本较低、灵敏度较高的特点。
1 材料与方法
1.1 仪器及试剂
FA2004电子分析天平(购自上海舜宇恒平科學仪器有限公司)、F97pro荧光分光光度计(购自上海棱光技术有限公司)。
RhB(天津市科密欧化学试剂有限公司)、TPN标准品(美仑生物科技有限公司)、TPN肠溶片(上海凯宝新谊(新乡)药业有限公司;江苏亚邦爱普森药业有限公司;远大医药(中国)有限公司)、0.20 mol/L HAc-NaAc缓冲溶液(广检(广州)检测科技有限公司)、碘单质(天津市永大化学试剂有限公司)、碘化钾(国药集团)。所有试剂均为分析纯。所用的化学品均未经进一步纯化。实验用水均为去离子水。
1.2 实验方法
1.2.1 样液的制备
TPN标准品贮备液:分析天平准确称取0.163 3 g标准品,将其加水溶解后定容至10.00 mL,制成0.10 mol/L TPN标准品贮备液,实验时溶液稀释1 000倍。RhB贮备液[17]:分析天平称量RhB 0.119 8 g,加水溶解后定容至250.00 mL,配制浓度为1.00 mmol/L的RhB贮备液。碘标准溶液[18]:分析天平准确称量碘单质12.650 0 g(分析纯)置1.0 L容量瓶中,然后加入1.00 mol/L的氢氧化钠150.00 mL,随后震荡半分钟,密封静置至碘完全溶解,溶液无色说明反应完全,加碘化钾固体36.000 0 g,1.00 mol/L HCl 150.00 mL,蒸馏水定容至1.0 L,制成浓度为0.05 mol/L碘标准溶液。随后将溶液转移至棕色细口瓶内,静置36 h待用,使用时稀释50倍。
1.2.2 测定方法
取HAc-NaAc缓冲溶液1.00 mL,TPN标准溶液适量于10.00 mL容量瓶中,然后加碘液0.40 mL,反应6 min后再依次加入RhB 1.00 mL,加蒸馏水定容,摇匀静置9 min。当以365 nm作为激发波长时,体系的荧光强度最强[17]。本研究的激发波长选择365 nm。于荧光分光光度计500~700 nm范围扫描体系的荧光强度,得到体系的荧光光谱,测定不同TPN浓度在582 nm处的荧光强度F365/582,并记录实验数据。
2 结果与讨论
2.1 荧光光谱与波长的选择
图2为激发波长365 nm 时反应体系的荧光光谱图,其中,曲线a为RhB的荧光发光曲线,结果表明RhB有较强的荧光强度,且荧光发射峰位于582 nm处;曲线b为碘液加入后的发光曲线,与曲线a相比,曲线b的荧光强度发生了猝灭,这说明碘和RhB之间发生了缔合,生成了I-3-RhB缔合物而导致罗丹明的荧光强度明显减弱;曲线c至曲线f为加入不同浓度TPN后碘液与RhB体系的荧光发射曲线,由图2可知,随着TPN的加入,体系的荧光再一次增强,且TPN加入的量越大,荧光增强幅度越大,这是因为TPN含有巯基官能团而具有较强的还原性,能将I3还原为I-,I-不与RhB作用,体系的荧光信号得以恢复。
2.2 条件的优化
2.2.1 酸度与缓冲溶液用量的选择
取0.10 mmol/L TPN标准液1.00 mL,通过加入不同体积的0.20 mol/L的盐酸和氢氧化钠溶液,调节其pH,探究不同酸度对体系的影响[14]。结果表明,当pH不断增强时,荧光强度增加,这是由于RhB分子结构中的羧基随着OH-浓度不断增加而导致电离程度不断增大,吸电子能力减弱,从而荧光强度增大[19];当pH在4.0至8.0时处于一个比较稳定的状态;pH开始大于9.0时,碘开始发生歧化[20],F365/582二次增大,说明pH在4.0~8.0时比较适合罗丹明和碘的缔合,也有利于TPN的氧化。因此本试验选择的反应介质为pH为4.6的醋酸-醋酸钠缓冲溶液。
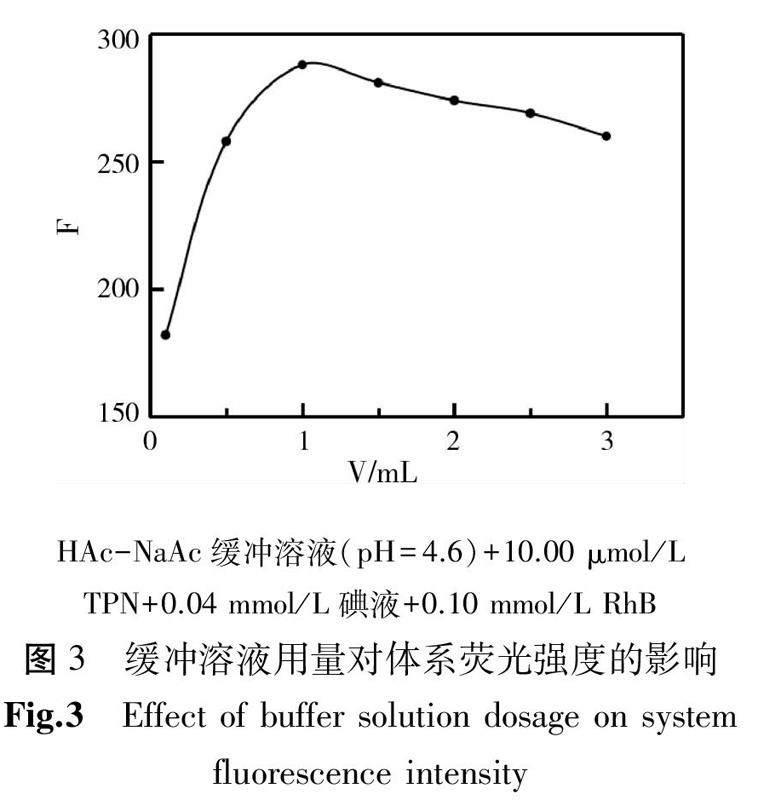
考察缓冲溶液用量对体系荧光强度的影响。结果如图3所示,随着体积的增大,体系的荧光强度先增后降,当缓冲溶液用量为1.00 mL时体系的荧光强度最大,故实验选择1.00 mL为醋酸-醋酸钠缓冲溶液的用量。
2.2.2 RhB最佳浓度的选择
RhB的荧光强度与自身浓度有着非常密切的关系。在10.00 mL容量瓶中加入HAc-NaAc缓冲液(pH=4.6)1.00 mL,RhB 0~1.80 mL,加水定容测定其荧光强度。实验结果如图4所示,RhB水溶液的体积在0~1.00 mL范围内时,其荧光强度与体积存在线性关系,当RhB浓度大于0.10 mmol/L,即RhB体积大于1.00 mL,荧光强度趋于稳定,可知RhB的水溶液超过一定浓度则会形成二聚体甚至多聚体,自熄灭增强,线性关系会消失[19]。为了实验的线性范围足够大且具有较低的检测限,实验确定RhB的浓度为0.10 mmol/L,即加入1.00 mL的RhB溶液。
2.2.3 碘液最佳浓度的选择
考察I-3-RhB体系在不含有TPN的情况下,改变碘液用量的情况下对RhB的荧光猝灭的影响。在10.00 mL容量瓶内分别加入HAc-NaAc 1.00 mL,不同体积的碘液0~2.00 mL,RhB溶液1.00 mL,定容至10.00 mL,测定其荧光强度。图5分析结果表明,当加入的碘液在0~0.40 mL时猝灭的线性度较好,当浓度大于0.50 mL时体系的荧光强度开始呈现较为平缓的趋势,当加至1.20 mL时体系荧光强度不再发生明显变化。为了实验具有良好的线性,故碘液用量为0.40 mL,此时体系内碘液的浓度为0.04 mmol/L。
2.2.4 最佳反应温度与时间的选择
取0.10 mmol/L TPN标准溶液1.00 mL、其他条件不变。通过考察在20~50 ℃的温度下体系的荧光强度,可知体系的荧光强度在反应温度为20~35 ℃为最大且变化较小。因此,选择室温25 ℃为TPN氧化以及RhB荧光猝灭反应的最佳温度。
探究TPN与碘的氧化以及碘与RhB缔合2个反应时间对荧光强度的影响。实验结果见图6,曲线a为HAc-NaAc 1.00 mL,0.10 mmol/L TPN标准溶液1.00 mL,碘液0.40 mL,分别反应2~10 min(间隔为2 min一组)后加入1.00 mLRhB溶液于10.00 mL容量瓶定容,静置10 min后。在不同氧化时间点分别测定的体系荧光强度;曲线b为取HAc-NaAc1.00 mL,0.10 mmol/L TPN标准溶液1.00 mL,碘液0.40 mL,反应8 min后加入1.00 mLRhB溶液定容至10.00 mL,分别摇匀静置2~10 min(间隔为2 min一组)后测定不同静置时间下体系的荧光强度。结果表明,TPN与I-3反应较快,加入瞬间黄色有变化,6 min时反应完全,荧光强度达到最大;RhB与碘缔合在8 min时反应完全,10 min时荧光强度基本保持不变,因此,RhB加入后的静置时间为9 min。
2.2.5 试剂加入最佳顺序的选择
取1.00 mL 0.10 mmol/L的TPN标准溶液,重点考察了“氧化后缔合”以及“缔合后氧化”两种顺序对荧光强度(F365/582)的影响。结果表明顺序为:TPN+碘液+RhB,即先氧化后缔合时体系荧光强度最为稳定,并且此时体系的荧光强度最高。所以实验选择TPN+I-3+RhB的加入顺序为最佳。
2.2.6 共存物质的影响
针对药物中常见的赋形剂和添加剂,实验考察了葡萄糖、淀粉、硬脂酸镁、糊精、蔗糖、乳糖、甘油以及Ca2+、Fe3+、Mg2+、Al3+等阳离子在优化条件下对测定的干扰。干扰实验表明,当相对误差小于或等于±5%时,150倍的淀粉、葡萄糖、糊精、硬脂酸镁、蔗糖、乳糖以及100倍的金属离子Mg2+、Al3+、Ca2+对测定结果均无干扰,TPN和I-皆可被Fe3+氧化,Fe3+存在一定的干扰。由于药品中附加成分和辅料很少加Fe3+,因此,不在此讨论其干扰情况。
2.3 标准曲线的绘制
分别取一系列浓度的TPN标准溶液于10.00 mL容量瓶中按照前面的实验方法测其荧光强度。实验表明,TPN浓度在1.00~20.00 μmol/L时与荧光强度有较好线性,线性方程为△F365/582=84.783+9.696 2C(μmol/L),相关系数为0.999 3,通过10次空白溶液的测定,用3σ/k求得检测限DL为0.33 μmol/L。
2.4 样品分析
分别取来自3个不同厂家的TPN肠溶片10片于分析天平中准确称重,除去包衣后在研钵中粉碎混匀,精密称取一定量的TPN粉末,大约相当于TPN 0.33 mg。加水溶解,于100.00 mL容量瓶中定容,经滤纸过滤,取滤液10.00 mL定容至100.00 mL,作为待测液使用。按照2.2的实验方法取待测液1.00 mL进行含量的测定,并进行标准品加入回收实验,所得回收率结果见表1。
3 结论
本实验基于RhB的荧光“关-开”建立了测定TPN含量的荧光光谱分析新方法,TPN在1.00-20.00 μmol/L浓度范围内的TPN与荧光强度有较好的线性,线性回归方程为△F365/582=84.783+9.696 2C(μmol/L),相关系数r=0.999 3,DL为0.33 μmol/L。利用该方法测定TPN肠溶片中TPN的含量,操作简便可行。
参考文献:
[1]王剑桥. 硫普罗宁联合杂合式血液净化治疗急性有机磷中毒的临床疗效[J]. 内蒙古医学杂志, 2022, 54(1): 43-44, 47.
[2]梁建英, 杜元平, 张昌艳, 等. 硫普罗宁联合恩替卡韦治疗慢性乙型肝炎的临床研究[J]. 现代药物与临床, 2018, 33(7): 1711-1714.
[3]代景丽. 硫普罗宁的临床应用及药理作用探讨[J]. 数理医药学杂志, 2019, 32(6): 890-891.
[4]范文俊, 吴霞. 阿托伐他汀联合硫普罗宁治疗非酒精性脂肪性肝病患者疗效研究[J]. 临床合理用藥杂志, 2021, 14(36): 97-99.
[5]安冏, 李堪, 许晓明, 等. RP-HPLC测定注射用硫普罗宁的有关物质[J]. 中国药科大学学报, 2019, 50(3): 317-324.
[6]刘素琴. 基于荧光共振能量转移和超高效液相色谱-串联质谱在硫普罗宁和雌激素分析检测中的应用研究[D]. 上海: 上海交通大学, 2018.
[7]刘飞宇, 陈晓辉, 毕开顺. 柱前衍生-高效液相色谱荧光法测定硫普罗宁片含量[J]. 药物分析杂志, 2008, 28(8): 1336-1338.
[8]MATSUURA K, MURAI K, FUKANO Y, et al. Simultaneous determination of tiopronin and its metabolites in rat blood by LC-ESI-MS-MS using methyl acrylate for stabilization of thiol group[J]. Journal of Pharmaceutical and Biomedical Analysis, 2000, 22(1): 101-109.
[9]何优选, 张鹏, 梁奇峰. 铁(Ⅲ)-硫氰酸钾体系褪色光度法测定硫普罗宁含量[J]. 化工技术与开发, 2018, 47(6): 52-54, 61.
[10]林瑜, 李见能, 韦小玲, 等. 紫外-可见分光光度法间接测定硫普罗宁的含量[J]. 理化检验-化学分册, 2022, 58(10): 1194-1198.
[11]BELTZ J, PFAFF A, ERCAL N. Simultaneous determination of tiopronin and its primary metabolite in plasma and ocular tissues by HPLC[J]. Biomedical Chromatography, 2019, 33(2): e4375.
[12]李全民, 赵伟, 刘国光. 异丙醇-硫酸铵-水体系浮选硫氰酸亚铜法间接测定硫普罗宁[J]. 分析化学, 2008, 36(3): 377-380.
[13]YANG X P, YANG J, ZHANG M X, et al. Tiopronin protected gold-silver bimetallic nanoclusters for sequential detection of Fe3+ and ascorbic acid in serum[J]. Microchemical Journal, 2022, 174, 107048.
[14]乔玉春, 龙大成, 孙宗招, 等. 罗丹明B荧光猝灭法测定水中碘[J]. 化学传感器, 2018, 38(1): 39-43.
[15]CEN R, LIU M, LU J H, et al. Synthesis and characterization of a sensitive and selective Fe3+ fluorescent sensor based on novel sulfonated calix[4]arene-based host-guest complex[J]. Chinese Chemical Letters, 2022, 33(5): 2469-2472.
[16]康彩艳, 蒋治良, 奚旦立. 罗丹明B荧光猝灭法测定水中痕量亚氯酸根[J]. 光谱学与光谱分析, 2007, 27(2): 339-341.
[17]薛林科, 張小林. 碘-罗丹明B反荧光猝灭法测定药物中的乙酰半胱氨酸[J]. 华西药学杂志, 2020, 35(3): 291-294.
[18]白莹, 张小林. 碘标准溶液配制方法改进[J]. 化学教育(中英文), 2018(4): 29-30.
[19]黄保军, 李建军, 屈凌波. 罗丹明B荧光光谱机理的研究[J]. 天津师范大学学报(自然科学版), 2005, 25(3): 8-10.
[20]梁笑语. 碘与淀粉显色影响因素的实验探究[J]. 当代化工研究, 2017(9): 106-107.

