裸燕麦硬度相关基因 AnVin-2的等位变异与表达分析
张文静,王 轲,2,安江红,2,秦海英,刘慧艳,2,杨 燕,2,韩 冰,2
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018; 2.麦类种质创新利用自治区高等学校重点实验室,内蒙古呼和浩特 010018)
燕麦是禾本科(Gramineae)燕麦属(AvenaL.)一年生草本植物[1-2],可分为带稃型的皮燕麦和不带稃型的裸燕麦两种类型,其栽培种是世界性粮饲兼用作物[3-4]。在国外,主要栽培种为普通栽培燕麦(AvenasativaL.);在国内,主要栽培种为大粒裸燕麦(AvenanudaL.),主要分布在我国华北、西北及西南地区[5-6]。燕麦中富含多种氨基酸和膳食纤维,其中β-葡聚糖作为膳食纤维的一种,具有良好的降血脂效应[7],可降低多种潜在疾病发生的风险[8]。
籽粒硬度是指破坏籽粒所需力的大小,反映籽粒的质地,是麦类作物重要的品质性状之一[9]。籽粒硬度值与胚乳中淀粉和蛋白质之间的相互作用有关,软质麦胚乳淀粉粒间较分散,基质蛋白质与其呈分离的状态;而硬质麦胚乳蛋白质基质与淀粉粒之间结合较为紧密,淀粉粒被蛋白质紧紧包裹[10]。燕麦籽粒硬度对于籽粒加工有很大影响,直接决定磨粉出粉率、燕麦片爽滑度、燕麦米弹性,因此了解燕麦的籽粒硬度,有利于燕麦的开发利用。
2015年,Gazza等[11]发现了影响燕麦籽粒硬度的Vromindoline(Vin)蛋白家族,该家族包含Vin-1、Vin-2和Vin-3三个成员,分别由Vin-1、Vin-2和Vin-3基因编码;向不含籽粒硬度同源基因的硬粒小麦Svevo转化中Vin-D2a和Vin-A3a基因后,籽粒硬度降低50%。这说明Vin蛋白是一种燕麦属特异的淀粉结合蛋白,具有脂质结合特性,可通过影响淀粉颗粒表面和周围基质蛋白质之间的粘附作用,影响燕麦籽粒的硬度[12-13]。
本研究选用裸燕麦核心种质材料街棚莜麦对燕麦Vin-2(AnVin-2)基因进行克隆和基因标记开发,根据前期试验测定的裸燕麦籽粒硬度值(未发表),选取10个不同籽粒硬度的裸燕麦材料(5 份软质,5 份硬质)验证分子标记,并进行Vin-2基因的等位变异及表达模式分析,以期为阐明Vin-2基因在裸燕麦籽粒硬度中的作用奠定基础。
1 材料与方法
1.1 供试材料
试验材料共11份(表1),由国家种质资源库提供。种植于内蒙古乌兰察布市燕麦分子育种基地(113°087 ′E,41°12 ′N),每行种植1.5 m,行距40 cm,田间管理按照大田标准进行。成熟籽粒收获后晾干,保持籽粒水份一致,储存于仓库。其中,街棚莜麦用于开发燕麦AnVin-2基因A、C 和 D 染色体组的标记以及AnVin-2C1和AnVin-2C4基因的标记;同时,街棚莜麦用于分析AnVin-2基因在籽粒不同发育时期的表达丰度,73014-336、8399/3/4、冀麦二号和7929/1/6用于分析AnVin-2基因在不同硬度品种成熟籽粒中的表达丰度。燕麦、73014-336、小莜麦、同系四五六号、8399/3/4、蒙燕7805、蒙燕8202、冀杂二号、7929/1/6和晋8713-1这10个品种用于分析AnVin-2C1和AnVin-2C4基因的等位变异。
1.2 样品采集
以街棚莜麦为材料,根据单个小花开花日期以及籽粒发育形态确定开花授粉时间,采集授粉后1、7、14、21、28、35 d和成熟期干籽粒,用灭菌镊子随机摘取籽粒,立即放入液氮中,随后放入-80 ℃超低温冰箱中保存。每样品每次取10~20粒种子,用于 RNA 的提取。
1.3 引物设计及筛选
从NCBI中分别获取普通栽培燕麦AnVin-2.1、AnVin-2.2和AnVin-2.3(基因ID分别为JQ518369.1、JQ518370.1和JQ518371.1)基因的DNA序列,设计通用引物 AnVin-2-F/R(表2),通过PCR扩增得到目的片段。根据该扩增片段的测序结果,使用ARMS-PCR方法[12-13],利用Primer 5.0设计特异性引物,即在3′端引物错配碱基以增加引物的特异性。分别设计AnVin-2的A、C、D染色体组标记引物(AnVin-2A-F/R、AnVin-2C-F/R和 AnVin-2D-F/R)以及AnVin-2C1和AnVin-2C4基因的分子标记特异性引物(AnVin-2C1-F/R和AnVin-2C4-F/R)(表2)。试验所用引物均由北京六合华大有限公司合成。
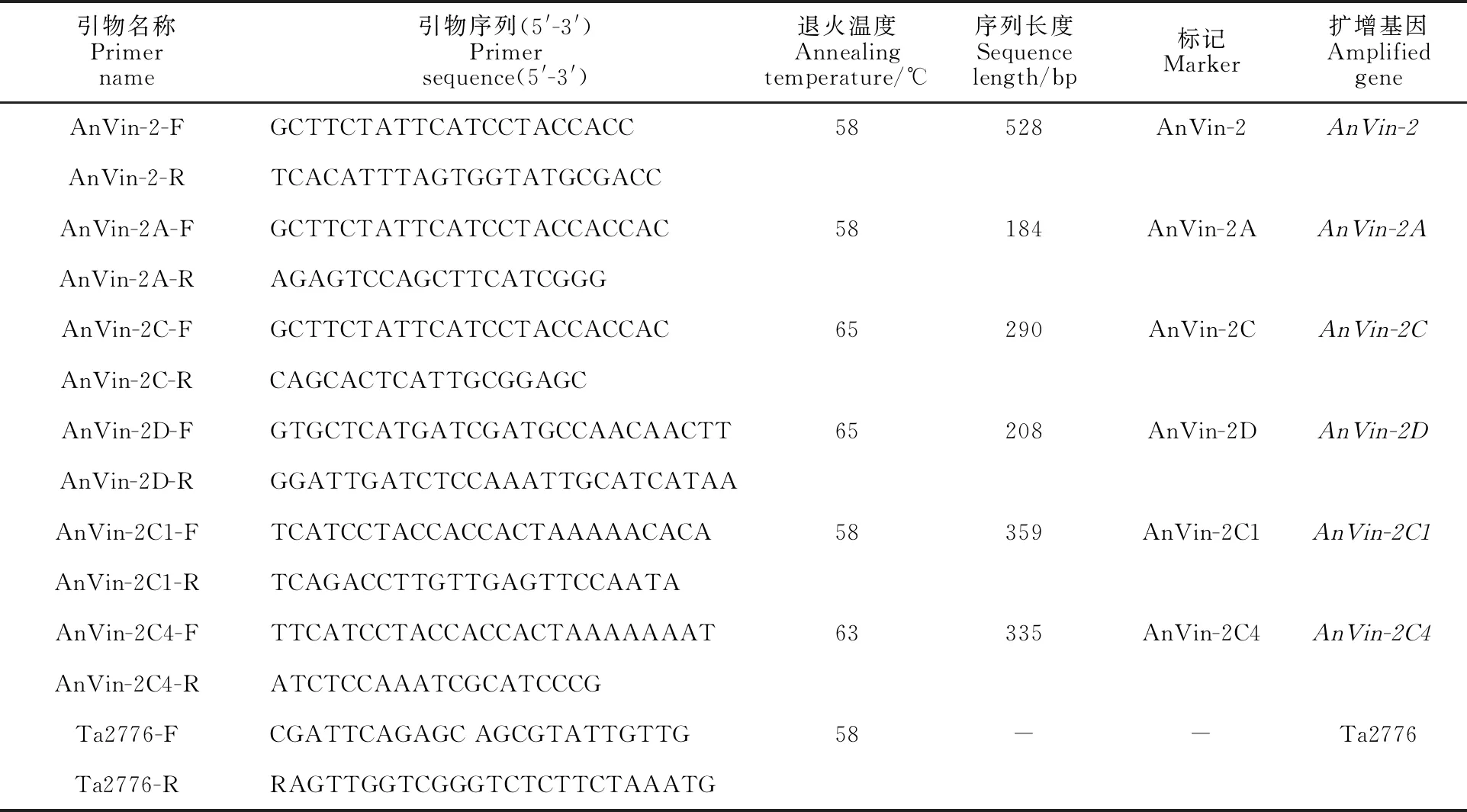
表2 本研究所用的引物信息
1.4 DNA和总RNA的提取以及cDNA的合成
用DNAsecure Plant Kit试剂盒(天根,北京)提取基因组DNA,用Transzol Up Plus试剂盒(全式金,北京)提取总RNA,用Thermo NanoDropTMOne/OneC超微量紫外分光光度计测定RNA的浓度,用1%的琼脂糖凝胶电泳检测RNA的完整性,用EasyScript One-Step gDNA Removal and cDNA Synthesis Super Mix(全式金,北京)将RNA进一步反转录合成为cDNA。
1.5 AnVin-2基因的克隆
用AnVin-2-F/R引物在Biometra PCR仪上进行PCR扩增,PCR扩增体系为20 μL,包括基因组DNA 1 μL,上、下游引物各0.3 μL,LA Taq(TaKaRa,大连) 0.5 μL,dNTP 1.5 μL,5×Buffer 4 μL,ddH2O 12.4 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸20 s,35个循环;72 ℃延伸7 min。用Easy Pure Quick Gel Extraction Kit说明书(全式金,北京)对DNA片段回收纯化后,连接至PMD-19T载体,并转化至DH5α大肠杆菌感受态细胞中,筛选阳性克隆并测序。
1.6 AnVin-2基因序列比对及系统发育分析
将测序得到的AnVin-2基因序列通过Primer 5.0推导获得氨基酸序列。从NCBI下载普通栽培燕麦(Avenasativa)、小麦(Triticumaestivum)、山羊草(Aegilopstauschii)、黑麦(Hordeumvulgare)和玉米(Zeamays)5个物种的Vin-2蛋白氨基酸序列,用Blastp进行同源性比较,用MEGA 6.0软件进行系统进化树的构建,bootstrap设置为1 000。
1.7 不同硬度裸燕麦品种 AnVin-2C4基因不同等位变异的鉴定
以10份不同籽粒硬度裸燕麦品种的基因组DNA为模板,用AnVin-2C1-F/R和 AnVin-2C4-F/R引物在Biometra PCR仪上进行PCR扩增,将扩增产物送北京六合华大有限公司进行测序,PCR反应体系及反应程序同1.5。由于在燕麦品种73014-336、8399/3/4、冀杂二号和7929/1/6中未能克隆到AnVin-2C1基因,只有AnVin-2C4基因在10份材料中均扩增得到目的片段,因此用DNAMAN软件仅分析AnVin-2C4基因的等位变异。
1.8 AnVin-2基因的表达模式分析
利用半定量反转录-聚合酶链式反应(Semi-quantitative reverse transcription-polymerase chain reaction,SqRT-PCR),以Ta2776为内参基因[18],PCR反应体系及反应程序同1.5。检测AnVin-2A、AnVin-2C和AnVin-2D基因在街棚莜麦籽粒中不同发育时期(开花后1、7、14、21、28、35 d和成熟期)的表达丰度,以及AnVin-2基因在73014-336、8399-3-4、冀杂二号和7929-1-6四份裸燕麦品种成熟籽粒中的表达丰度。用Quantity one图像分析软件分析各基因对应电泳条带的灰度值,计算AnVin-2基因与内参基因Ta2776之间的比值,为AnVin-2基因的相对表达量。采用Excel和SPSS 25.0对数据进行整理和方差分析。
2 结果与分析
2.1 AnVin-2基因的克隆与序列分析结果
以街棚莜麦的基因组DNA为模板,利用通用引物AnVin-2-F/R进行PCR扩增,获得大小约为500 bp的条带(图1)。对100个阳性克隆测序的结果进行整理,共获得14个AnVin-2基因(图2)。将这14个AnVin-2基因序列在普通栽培燕麦基因组数据库(https://wheat.pw.usda.gov/jb/?data=/ggds/oat-ot3098-pepsico)中进行比对定位,将其分别定位到4A、7C和4D染色体上。结合定位结果将这些基因分别命名为AnVin-2A、AnVin-2C1、AnVin-2C2、AnVin-2C3、AnVin-2C4、AnVin-2C5、AnVin-2C6、AnVin-2C7、AnVin-2C8、AnVin-2D1、AnVin-2D2、AnVin-2D3、AnVin-2D4和AnVin-2D5。进一步分析发现,这14个基因的序列长度为523~526 bp,序列同源性为 98.06%,均包含完整的开放阅读框(444 bp),无内含子,可编码147个氨基酸。以上结果表明,AnVin-2作为多拷贝基因存在于裸燕麦中。氨基酸序列分析表明,这14个AnVin-2基因编码的蛋白氨基酸序列均存在10个保守的C骨架和4个色氨酸残基构成的TRD结构域。应用NCBI Conserved Domain Search对蛋白结构域分析显示,AnVin-2蛋白属于AAI_LTSS家族SS亚家族。
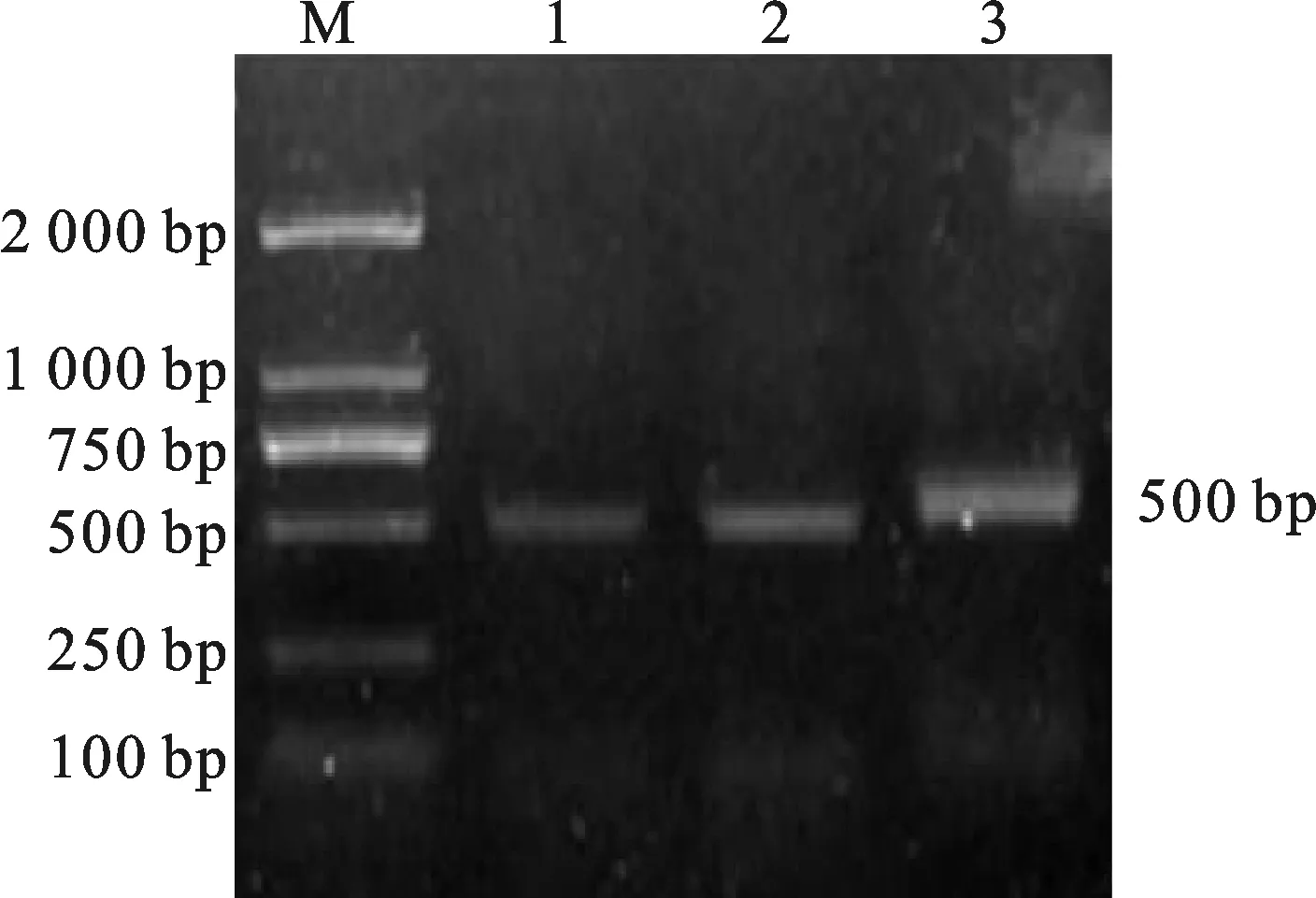
M:DL2000; 1~3: AnVin-2.
2.2 AnVin-2基因的同源分析
为了探索裸燕麦AnVin-2基因家族的进化关系,对其编码的蛋白及其他5个物种的同源蛋白进行进化分析。结果(图3)显示,这些蛋白聚类于三个不同的分支。其中,14个AnVin-2蛋白与小麦、山羊草和黑麦的SS蛋白亚家族聚类于一个分支;小麦、山羊草、黑麦和燕麦的AAI蛋白亚家族聚类于第二分支;小麦、山羊草、黑麦和玉米的LTP蛋白聚类于第三分支。

As:燕麦;Hv:黑麦;Ae:山羊草;Ta:小麦;Zm:玉米。
2.3 AnVin-2基因的A、C、D染色体组标记开发
经AnVin-2基因序列比对分析发现,AnVin-2A与AnVin-2D基因的序列高度相似,相似性高达98.04%,基因序列间均为单碱基的差异,不存在大片段的插入与缺失。从40对基因标记引物中筛选出带型质量高、扩增结果稳定的引物,最终筛选出3对引物( AnVin-2A-F/R、AnVin-2C-F/R和AnVin-2D-F/R),分别用于特异性扩增AnVin-2A、AnVin-2C和AnVin-2D。其中,AnVin-2A与AnVin-2C、AnVin-2D在165 bp处存在特异性位点C,据此开发出可以特异区分AnVin-2A基因的标记AnVin-2A;AnVin-2C与AnVin-2A、AnVin-2D在274和279 bp两处存在特异性位点C,据此开发出可以特异区分AnVin-2C基因的标记AnVin-2C;AnVin-2D与AnVin-2A在165 bp处存在特异性位点T,AnVin-2D与AnVin-2C在324和333 bp处分别存在特异性位点C和G,根据以上三个特异性位点开发出可以特异区分AnVin-2D基因的标记 AnVin-2D(表2和图2)。经过PCR笔测序验证,发现AnVin-2A、 AnVin-2C和AnVin-2D这3个标记可分别特异识别AnVin-2A、AnVin-2C和AnVin-2D基因(图4)。

M:DL2000; 1: AnVin-2A; 2: AnVin-2C; 3: AnVin-2D.
2.4 AnVin-2C1和 AnVin-2C4基因的分子标记开发
由于在街棚莜麦中扩增得到的14个AnVin-2基因中,只有AnVin-2A、AnVin-2C1、AnVin-2C4和AnVin-2C5存在特异性位点(图2);又由于AnVin-2A和AnVin-2C5在裸燕麦各个生育时期并未扩增到,因此仅开发AnVin-2C1和AnVin-2C4基因的分子标记。
其中,AnVin-2C1与其他13个基因在367 bp处存在特异性位点T,据此开发出AnVin-2C1标记;AnVin-2C4与其他13个基因在274 bp处存在特异性位点C,据此开发出AnVin-2C4标记(表2和图2)。经过PCR和测序验证,发现AnVin-2C1和AnVin-2C4标记可分别特异识别AnVin-2C1和AnVin-2C4基因。
2.5 不同硬度裸燕麦 AnVin-2C4不同等位变异的鉴定
以AnVin-2C1-F/R和AnVin-2C4-F/R为引物,以10份不同籽粒硬度裸燕麦品种(燕麦、73014-336、小莜麦、同系四五六号、8399/3/4、蒙燕7805、蒙燕8202、冀杂二号、7929/1/6和晋8713-1)基因组DNA为模板,克隆AnVin-2C1和AnVin-2C4基因。由于在燕麦品种73014-336、8399-3-4、冀杂二号和7929-1-6中未能克隆到AnVin-2C1基因,只有AnVin-2C4基因在10份材料中均扩增得到目的片段,因此后续仅分析AnVin-2C4基因。
测序结果显示,AnVin-2C4基因在10份材料中存在5种等位变异,分别命名为AnVin-2C4-1、AnVin-2C4-2、AnVin-2C4-3、AnVin-2C4-4和AnVin-2C4-5(图5)。与AnVin-2C4-1等位基因相比,AnVin-2C4-2在74 bp处发生C-A的无义突变;AnVin-2C4-3在179 bp和215 bp处分别发生T-C和G-A的无义突变,AnVin-2C4-5在266 bp和271 bp处分别发生C-G和C-G的有义突变,导致78位亮氨酸突变为缬氨酸;AnVin-2C4-4在100、119、135、149 和215 bp处分别发生T -C、C-T、G-T、T-C、G-A的突变,导致22位缬氨酸突变为丙氨酸以及34位丙氨酸突变为丝氨酸。

图5 AnVin-2C4的5种等位变异序列比较
2.6 AnVin-2基因的表达模式分析
以街棚莜麦为材料,以Ta2776基因为内参,利用SqRT-PCR检测AnVin-2A、AnVin-2C和AnVin-2D基因在燕麦籽粒不同发育时期(开花后1、7、14、21、28、35 d和成熟期)的表达丰度(图6),利用Quantity one图像分析软件分析各基因对应电泳谱带的灰度值,计算Vin-2基因的相对表达量(图7)。结果显示,AnVin-2C和AnVin-2D基因的表达量在7个发育时期的变化趋势基本一致,均在开花后21 d表达量达到峰值,在开花后1、7、35 d和成熟期表达量较低。AnVin-2A基因在裸燕麦籽粒各个发育阶段均没有检测到。
以4种不同籽粒硬度的裸燕麦品种(73014-336、8399/3/4、冀杂二号和7929/1/6)为材料,利用标记引物AnVin-2A-F/R、 AnVin-2C-F/R和AnVin-2D-F/R(SqRT-PCR法)检测AnVin-2基因在成熟籽粒中的表达丰度(SqRT-PCR法),结果(图6和图7)显示,AnVin-2C基因在在冀杂二号成熟籽粒中的表达量显著低于在73014-336、8399/3/4和7929/1/6成熟籽粒中的表达量,而AnVin-2D基因在4种不同籽粒硬度裸燕麦品种中的表达量无明显差异。AnVin-2A在成熟籽粒中未能扩增到。
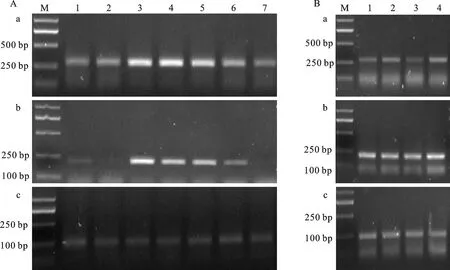
A图中a、b和c分别表示 AnVin-2C、 AnVin-2D和内参基因Ta2776在燕麦籽粒7个发育时期的表达丰度,M:DL2000;1:开花后1 d;2:开花后7 d;3:开花后14 d;4:开花后21 d;5:开花后28 d;6:开花后35 d;7:成熟期。B图中a、b和c分别表示 AnVin-2C、 AnVin-2D和内参基因Ta2776在4个不同裸燕麦品种成熟籽粒的表达丰度,M:DL2000;1:73014-336;2:8399/3/4;3:冀杂二号;4:7929/1/6。
3 讨 论
研究表明,小麦的籽粒硬度是由Ha位点的主效基因Gsp-1、Pina和Pinb控制[14],大麦是由Hordoindoline(HIN)基因控制[15],普通栽培燕麦是由Vin基因控制[11]。Bhave等[16]和Kumar等[14]已经证明了Pin突变类型与小麦籽粒硬度具有相关性,Pina和Pinb基因单独或同时突变会导致小麦籽粒硬度发生改变,常见的Pin突变类型是编码序列中的点突变,导致单个氨基酸或者无义等位基因的替换。而大麦HIN基因的等位变异间均具有保守的10个半胱氨酸骨架及TRD区域,且等位变异HINa和HINb-1之间的表达也没有差异,因而推测HINa和HINb-1等位变异引起的氨基酸差异并不影响籽粒硬度[17]。关于普通栽培燕麦Vin基因突变类型对裸燕麦籽粒硬度的影响还不明确。
基因家族的起源和分化是生物进化领域的重要研究内容,基因家族成员源于同一个祖先基因,因此在结构和功能上具有很多相似性,可编码功能相似的蛋白产物。基因复制为新基因的产生提供了可能。生物在进化中相对保守,直系同源基因间的功能区别不大,而旁系同源基因间的功能比较容易发生改变[18-19]。普通栽培燕麦AnVin-2的同源基因还有AnVin-1和AnVin-3[15],本课题组在裸燕麦中也克隆得到了AnVin-1和AnVin-3基因(未发表)。AnVin基因对籽粒硬度的影响以及是否存在累加或功能冗余效应,还有待进一步探究。
本研究发现,AnVin-2C4基因在10份不同籽粒硬度裸燕麦品种中存在5种等位变异,其中AnVin-2C4-5编码的第78位氨基酸由亮氨酸突变为缬氨酸,缬氨酸和亮氨酸均为脂肪族、非极性、中性氨基酸,推测不会改变蛋白质的功能;AnVin-2C4-4编码的第22位氨基酸由缬氨酸突变为丙氨酸,缬氨酸和丙氨酸也均为脂肪族、非极性、中性氨基酸,推测也不会改变蛋白质的功能,第34位氨基酸由非极性的丙氨酸突变为极性的丝氨酸,可能会导致蛋白质的结构、亲疏水性发生变化,进而影响蛋白质的功能。等位基因AnVin-2C4-1、AnVin-2C4-2和AnVin-2C4-3编码的氨基酸均为无义突变,但是否改变蛋白质的功能还有待进一步研究。
对裸燕麦籽粒中AnVin-2基因的表达模式分析发现,AnVin-2C和AnVin-2D基因的表达量随着籽粒的发育而发生变化,均在开花后21 d表达量达到峰值,之后逐渐下降,在成熟期趋于稳定;但对不同硬度裸燕麦的成熟籽粒中表达量分析发现,AnVin-2C基因在在冀杂二号成熟籽粒中的表达量显著低于在73014-336、8399/3/4和7929/1/6成熟籽粒中的表达量,而AnVin-2D基因在4种不同籽粒硬度裸燕麦品种中的表达量无显著差异,原因可能是AnVin-2C的遗传背景不一致,在各品种间具有表达差异。AnVin-2A基因在裸燕麦籽粒各个发育阶段均未检测到。另外,籽粒硬度除了受遗传因素的影响以外,还与淀粉、脂质和蛋白的结合程度有关[9, 20],但仍需进一步研究。

