拉萨长期不同施肥青稞田土壤固氮菌分离鉴定
马瑞萍,戴相林,刘国一,谢永春,普布贵吉,张国新
(1.西藏自治区农牧科学院农业资源与环境研究所,西藏拉萨 850000;2.河北省农林科学院滨海农业研究所,河北唐山 063299)
青稞(HordeumvulgareL.)是西藏主要的粮食作物,其播种面积占西藏粮食作物总播种面积的75.3%,产量占西藏粮食作物总产量的 76.3%,维持青稞高产、稳产是实现西藏粮食安全的重要保障[1]。拉萨地处青藏高原中部,具有海拔高、紫外线强和低温干旱的气候特点[1],土壤氮素含量低,pH偏碱性,故不利于铵态氮肥的施用[2]。同时,作为典型的生态脆弱区和气候变化敏感区[3-4],化肥的过量施用会导致青藏高原环境污染问题。因此,如何在生态环境友好的前提下保障青藏高原青稞产量稳定是当前农业生产的首要任务。
氮素是植物生长发育所需的大量营养元素之一,也是农作物生产中最常见的养分限制因子[5]。生物固氮是陆地生态系统中氮的重要来源,为大气氮的利用提供了可能[6]。自Berthelot发现微生物能够固氮以来,人们对生物固氮的研究已经超过了130年[7]。生物固氮分共生固氮和自生固氮,相对于共生固氮,自生固氮虽然速率低,但时空分布广泛,可为土壤-植物系统提供每年约0~60 kg·hm-2的氮素输入量[1,6,8-10]。因此,自生固氮作为一种环境友好型和可持续性的供氮方式,可部分替代无机氮肥以减轻由于农业生产中过量施氮导致的环境污染。生物固氮主要靠固氮微生物实现,不同作物类型、土壤理化性质、时空分布和气候因子对固氮微生物的丰度、多样性、活性和群落组成影响不同。
施肥是农业生产中最重要的农艺措施之一, 施肥通过改变土壤理化性质而影响固氮菌的生存环境,进而影响固氮菌多样性和群落组成及其固氮酶活性[11]。有研究表明,固氮微生物组成对不同施肥模式的响应不同[12-19]。目前,针对不同植物内生固氮菌[20]和不同气候、土壤、植被环境下非共生固氮菌多样性、群落结构及不同作物种类非共生固氮菌固氮量研究较多[20-24],而针对长期不同施肥条件下高原地区农田土壤固氮菌筛选、鉴定的研究少见报道。本研究拟寻找西藏高原青稞田长期不同施肥模式下土壤中可培养固氮微生物,明确其固氮能力,为利用当地固氮菌资源研制更加安全环保的生物肥料提供理论依据。
1 材料与方法
1.1 材 料
土壤样品:供试土壤采集于西藏自治区农牧科学院四号试验地长期定位试验土壤,试验地位于西藏自治区拉萨市(29°38′N,91°02′E),海拔 3 662 m,属高原温带半干旱季风气候区。试验开始于2018年,种植模式为青稞-青稞-青稞-油菜轮作,6种施肥模式见表1,小区面积20 m2,设置重复4次,小区间浇筑1 m深水泥板防止耕层土壤水肥侧向运移。于2021年4月,根据S型多点混合法采集各小区耕层(0~20 cm)土壤样品6份,置于4 ℃保温箱中迅速带回实验室进行后续分析。
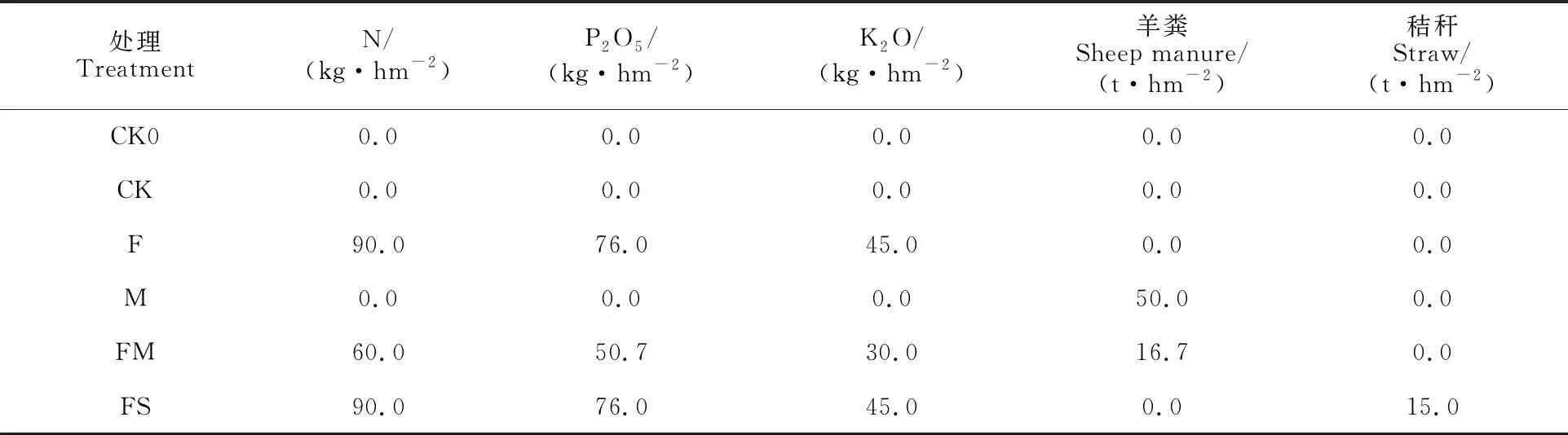
表1 土壤长期定位试验各处理施肥情况
固氮菌富集培养液:蔗糖10 g,氯化钠0.2 g,碳酸钙1 g,七水合硫酸镁0.2 g,磷酸二氢钾0.5 g,蒸馏水1 000 mL,pH值7.0~7.2。
固氮菌分离培养基:固氮菌富集培养基加 1.5%~2.0%琼脂。
固氮菌纯化和保存培养基:蔗糖10 g,氯化钠0.2 g,碳酸钙1 g,七水合硫酸镁0.2 g,磷酸二氢钾0.5 g,酵母膏0.5 g,蒸馏水1 000 mL,pH值 7.0~7.2,固体加1.5%~2.0%琼脂。
1.2 方法
1.2.1 固氮菌的分离
取10 g新鲜土样放入盛有100 mL固氮菌富集培养液的250 mL三角瓶中,100 r·min-1、28 ℃富集培养72 h,取0.1 mL悬浮液转入有100 mL固氮菌富集培养液的250 mL三角瓶中,100 r·min-1、28 ℃富集培养72 h;重复3次。取富集培养后的悬液1 mL,依次稀释至10-2、10-3、10-4、10-5、10-6、10-7浓度梯度;分别吸取不同浓度菌悬液0.1 mL在分离培养基上均匀涂布,重复3次;涂布好的平板于28 ℃静置培养3~5 d,挑取单菌落用平板划线法进行菌种纯化。将纯化后的单菌落涂布于纯化保存斜面上,编号,4 ℃保存。
1.2.2 固氮菌的鉴定
形态学鉴定:将1.2.1中纯化得到的单菌落进行同样条件平板划线培养,观察菌落颜色、大小、形状、边缘、干湿、表面光滑程度等。
16s rDNA序列分析鉴定:提取分离得到的每个单菌落的DNA作为模板,采用16s rDNA通用引物进行PCR,目标片段1 500 bp。引物由上海生物工程有限公司合成,正向引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492r:5′-TACGGTTACCTTGTTACGACTT-3′。PCR反应体系:2×Master(上海生物) 25 μL,引物(20 μM)1 μL,模板2 μL,用ddH2O补足50 μL。PCR反应程序:95 ℃预变性5 min; 95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸2 min,共30个循环; 72 ℃延伸10 min,4 ℃保存。测序由上海生物工程有限公司完成,在NCBI(https://www.ncbi.nlm.nih.gov/)blast进行序列比对,确定它们的属水平分类学地位。
1.2.3 固氮酶活性测定
采用乙炔还原法:将待测菌株接种于含10 mL纯化保存培养基的25 mL小瓶中,30 ℃培养2 d;将棉塞换成胶塞密封,抽出10 %气体后加入1.5 mL C2H2,分别培养2、4、6和8 d;从瓶中抽取混合气体0.2 mL注入气相色谱仪中,测定C2H2、C2H4的产生情况。色谱参数:不锈钢层析柱2 mm×1 000 mm,柱温150 ℃,氢离子火焰检测器温度20 ℃,载气为氮气,气体流量30 mL·min-1。用下列公式计算固氮酶活性(nmol·h-1·mL-1):
固氮酶活性=(58.0×Se×T×Pe)/(Sb×Te×P×t×V)
式中,Se为乙烯峰面积;T为开氏绝对温度(T=273.13K);Pe为试验条件下的大气压强(Pa);Sb为乙炔峰面积;Te为试验条件下的温度(K);P为绝对大气压强(P=101 324.72 Pa);t为培养时间;V为气体体积。
2 结果与分析
2.1 菌株分离状况分析
由表2 可见,从CK0、CK、F、M、FM和FS 6种不同施肥模式的土壤样品中分别分离得到形态不同的菌株6株、10株、6株、9株、10株和9株,即CK和FM处理土壤中各分离出固氮菌10株;M和FS处理各分离出9株;单施化肥(F)和撂荒(CK0)处理土壤中可培养固氮菌种类最少,各分离出6株,共50株菌。观察各菌株形态特征,发现不同施肥处理土壤中分离出来的菌株有部分形态特征较相似,疑似同种菌株,部分菌株只分离自某一特定施肥处理土壤。图1为部分菌株在平板上生长情况。

表2 不同施肥模式土壤中固氮菌形态
2.2 固氮菌属水平分类学地位
由表3可以看出,分离自6个不同施肥处理土壤的50个菌株分别属于14个属。CK0处理中分离出的6株菌分别属于伯克霍尔德氏菌属、类芽孢杆菌属、叶杆菌属、链霉菌属、鞘胺醇单胞菌属、芽孢杆菌属。CK处理中分离出的10株菌属于伯克霍尔德氏菌属、叶杆菌属、链霉菌属、假食酸菌属、芽单胞菌属、甲基细菌属、链霉菌属、芽孢杆菌属、红球菌属、农杆菌属。F处理中分离出的6株菌属于伯克霍尔德氏菌属、类芽孢杆菌属、叶杆菌属、链霉菌属、假食酸菌属、鞘胺醇单胞菌属。M处理中分离出的9株属于伯克霍尔德氏菌属、类芽孢杆菌属、叶杆菌属、链霉菌属、假食酸菌属、链霉菌属、芽孢杆菌属 、红球菌属、农杆菌属。FM处理中分离出的10株菌属于伯克霍尔德氏菌属、叶杆菌属、链霉菌属、假食酸菌属、鞘胺醇单胞菌属、芽单胞菌属、甲基细菌属、链霉菌属、土地杆菌属、芽孢杆菌属、类诺卡氏属。FS处理中分离出的9株菌属于伯克霍尔德氏菌属、叶杆菌属、链霉菌属、假食酸菌属、鞘胺醇单胞菌属、芽单胞菌属、链霉菌属、土地杆菌属、类诺卡氏属。说明分离自不同土壤的部分菌株系同属。

表3 固氮菌属水平分类学地位
2.3 固氮菌固氮酶活性分析
由表4 可见,分离得到的50株固氮菌中,固氮酶活性范围在0.11~1.31 nmol·h-1·mL-1之间,其中固氮酶活性最高的菌株为CK4、F5、M5、FM4和FS4,均属于假食酸菌属,分别分离自CK、F、M、FM、FS处理,酶活性均接近1.31 nmol·h-1·mL-1;
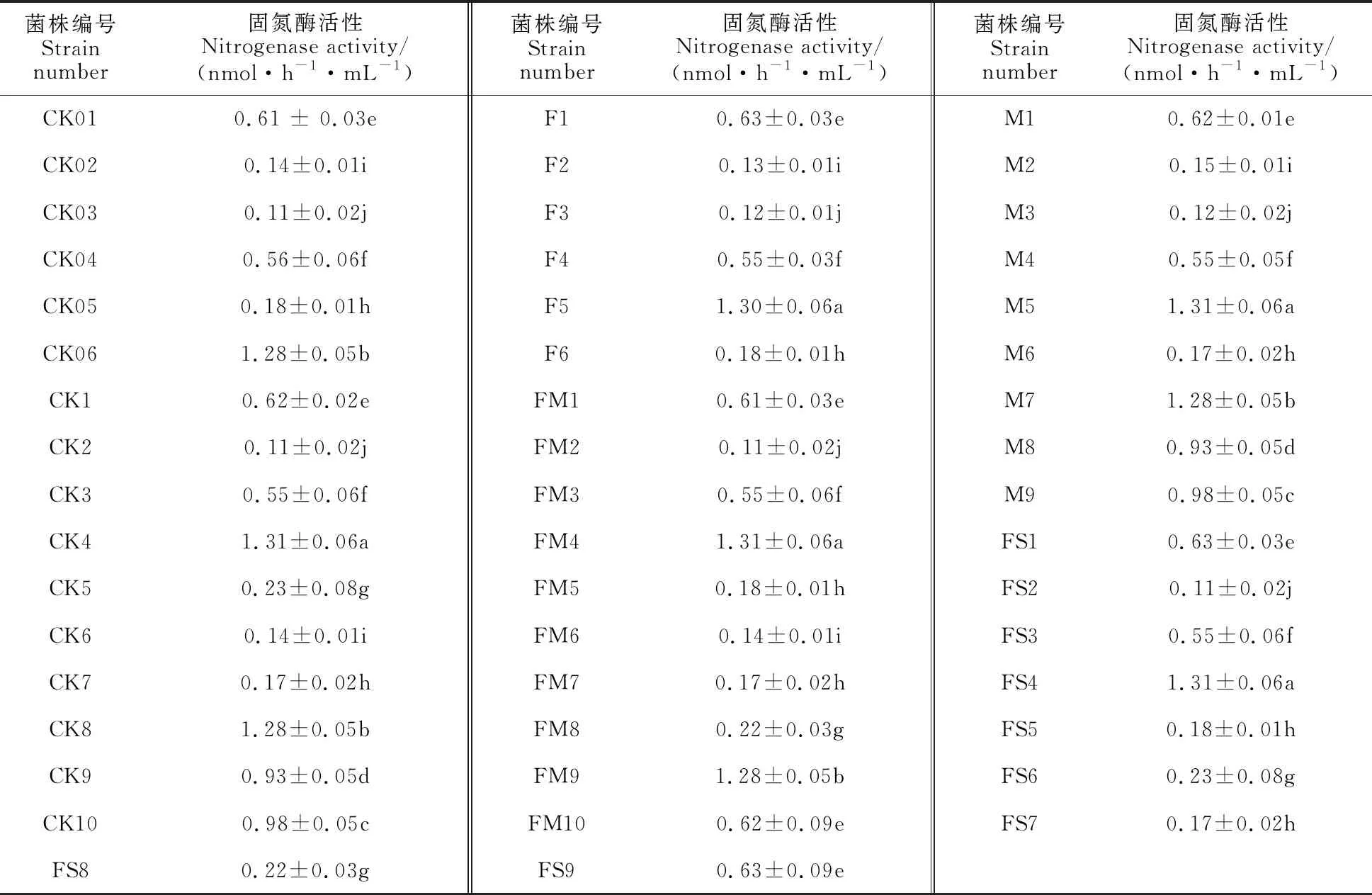
表4 固氮菌固氮酶活性
叶杆菌属各菌株固氮酶活性最低,为0.11 nmol·h-1·mL-1;伯克霍尔德氏菌属、叶杆菌属、链霉菌属固氮酶活性较低,但分布较为广泛,存在于所有处理土壤中,说明其对土壤环境适应能力较强。对于分别属于假食酸菌属、芽孢杆菌属、红球菌属和农杆菌属的13个菌株CK4、F5、M5、FM4、FS4、CK06、CK8、M7、FM9、CK9、M8、CK10、M9,其固氮酶活性均高于0.8 nmol·h-1·mL-1,具有高效固氮能力。CK和M处理土壤中分离到高效固氮能力菌株最多,均有4株;FM处理土壤中分离出高效固氮能力菌株2株;CK0、F、FS处理各分离出1株。由此可见,施用化肥使土壤中可分离固氮菌种类减少,说明固氮菌对土壤微环境较敏感。
3 讨 论
本研究显示,从不同施肥处理土壤中筛选的分别属于假食酸菌属、芽孢杆菌属、红球菌属和农杆菌属的13个菌株CK4、F5、M5、FM4、FS4、CK06、CK8、M7、FM9、CK9、M8、CK10、M9,具有高效固氮能力。这与前人研究一致,如Fu等[25]发现,假食酸菌属是活跃的固氮微生物类群,在土壤、植物和水环境中广泛存在;刘振东等[5]对不同产区青稞根部可培养内生固氮菌的多样性研究,发现11株高固氮酶活性的菌中,有5株菌属于芽孢杆菌属;王惟帅等[26]对马铃薯根际固氮解磷微生物进行分离与鉴定,发现归属于红球菌属的N34菌株活性最高。
有研究表明,不同施肥模式对土壤固氮微生物多样性、群落组成和活性影响不同;施用化肥会降低土壤固氮微生物多样性和活性[14,27],施用有机肥则反之[13]。本研究中,单施化肥处理土壤可培养固氮菌种类较CK处理减少,且属于芽孢杆菌属、红球菌属和农杆菌属的高效固氮菌在F处理中均未培养出,而单施有机肥处理土壤则培养出了假食酸菌属、芽孢杆菌属、红球菌属和农杆菌属的全部高效固氮菌株。这可能是由于有机肥的施用为固氮微生物提供了充足的碳源,从而促进其生长[17]。本研究还显示,化肥配施秸秆处理下,虽然可培养的固氮微生物种类较CK处理变化不大,但高效固氮菌种类却显著减少。这与前人研究结果相类似,即长期施用化肥或化肥加秸秆还田会抑制土壤固氮微生物活性,降低其丰度[28-29],可能是由于秸秆还田后前期秸秆腐解和微生物争氮所致。另外, CK处理可培养固氮菌和高效固氮菌种类较CK0处理均显著增加,可能是撂荒的自然状态下,拉萨4月份长期无降水,因水分缺乏,土壤微生物活动受限导致其固氮微生物种类减少。
本项目组前期研究结果[1]表明,假食酸菌属是青稞田土壤中固氮菌的优势菌属,且在土壤、植物和水环境中广泛存在[26,30]。本研究中,CK、F、M、FM、FS处理中均培养出了假食酸菌属菌株,而CK0中未分离出,说明假食酸菌对施肥模式具有较强的适应性,而对于是否耕种青稞较敏感,可能在西藏较为特殊的气候环境条件下,假食酸菌属固氮菌与青稞根系存在某种共生互利关系,具体有待进一步探索。
本研究还发现,不同施肥模式土壤可培养高效固氮菌相似性呈3类,CK与M有4株、FM有2株、CK0、F与FS均只培养出1株。羊粪腐解速率高于秸秆[31],能更快速地提供易分解有机碳作为固氮微生物生长的碳源,而秸秆含有较多纤维二糖及纤维素,施入土壤后分解速度慢,使固氮微生物自身生长受限;化肥的施用则增加了土壤铵态氮含量,抑制了固氮酶活性[32],因此F与FS处理较CK和M处理高效固氮菌种显著 减少。
4 结 论
本研究从6个长期不同施肥模式下的土壤中,共分离得到50株形态不同的固氮菌,并从其中筛选出了13种高效固氮菌株,分别是CK4、F5、M5、FM4、FS4、CK06、CK8、M7、FM9、CK9、M8、CK10、M9,对应的属水平分类学地位分别是假食酸菌属、芽孢杆菌属、红球菌属和农杆菌属。
施用化肥会减少土壤中高效固氮菌种类,不施化肥或施用有机肥能丰富土壤中高效固氮菌 种类。
——固氮微生物

