宫颈环形电切术联合抗HPV蛋白敷料治疗宫颈癌前病变Ⅱ级的临床效果
李世大 陈秀英 张士表

[关键词]宫颈环形电切术;抗HPV蛋白敷料;CINⅡ;HPV感染
宫颈癌是最为常见的妇科恶性肿瘤,居女性恶性肿瘤的第二位,起源于子宫颈上皮内病变,发病与高危型人乳头瘤病毒(humanpapillomavirus,HPV)持续感染密切相关[1]。宫颈癌前病变是宫颈癌发生前出现的病变,属于高级别宫颈上皮内病变,具有癌变的潜能,其具有一定的可逆性,有些可随着疾病的发展而消失,部分进一步浸润导致病情恶化[2]。因此早期诊断、早期治疗,才能有效清除病灶,降低宫颈癌的发生率,目前宫颈环形电切术是治疗高级别病变的主要手段,但术后容易出现感染、出血等并发症,同时存在病灶切除不彻底的问题,增加了复发率,基于此本研究对宫颈环形电切术患者术后联合抗HPV蛋白敷料治疗取得了满意的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年4月至2021年9月河北省沧州中西医结合医院妇科门诊及住院治疗的宫颈癌前病变患者126例,所有患者组织病理学分级均为CINⅡ级(宫颈癌前病变Ⅱ级)。随机分为手术治疗组(A组)、药物治疗组(B组)和联合治疗组(C组),每组各42例。A组年龄28~56岁,平均(41.21±3.10)岁;HPV感染时间0.3~3.1年,平均(1.53±0.42)年;产次1~3次,平均(2.10±0.43)次;HPV分型:16型18例,18型15例,其他型9例。B组年龄26~58岁,平均(42.38±3.12)岁;HPV感染时间0.4~3.5年,平均(1.55±0.44)年;产次1~4次,平均(2.13±0.41)次;HPV分型:16型20例,18型12例,其他型10例。C组年龄28~55年,平均(42.41±3.14)岁;HPV感染时间0.3~4.0年,平均(1.52±0.40)年;产次1~3次,平均(2.05±0.34)次;HPV分型:16型18例,18型14例,其他型10例。本研究符合《赫尔辛基宣言》中伦理要求并经我院医学伦理委员会备案[3]。
1.2 纳入与排除标准
1.2.1 纳入标准[4] ①所有患者均为已婚女性,且已生育,近期无生育要求;②均经阴道镜及组织病理学确诊符合CINⅡ及合并HPV高危型感染;③有规律的性生活;④治疗前3个月未使用过抗病毒药物、免疫抑制剂,且未接种HPV疫苗者;⑤无其他基础疾病者;⑥无药物过敏史;⑦患者及家属知情同意并签署知情同意书。
1.2.2 排除标准[5] ①已婚女性,近期有生育要求者;②不符合组织病理学诊断者;③近期使用过抗病毒药物及免疫抑制剂者;④既往接种过HPV疫苗者;⑤有内科疾病及肝、肾功能异常者,不能耐受手术者;⑥合并有重度阴道炎者;⑦妊娠期和哺乳期患者;⑧存在精神类疾病者;⑨治疗期间不能严格避孕者;⑩依从性差者。
1.3 方法
A组患者于月经干净2~8d行宫颈环形电切术,患者取膀胱截石位,行蛛网膜下腔阻滞麻醉,碘伏棉球进行阴道、宫颈消毒,宫颈涂卢格氏碘溶液确定病变的范围,于碘不着色区外0.5cm用高频电波刀切入并旋转360°,切除病变及转化区域组织,术后组织病理切缘均阴性为止,并填塞明胶海绵予以止血,术后常规应用抗生素预防感染。B组患者给予抗HPV生物蛋白敷料治疗(山西锦波生物医药股份有限公司,晋械注准20152640040,规格:3g/支):于睡前将外阴清洗干净,将抗HPV生物蛋白敷料铝箔打开后,应用一次性推注器将敷料推送至阴道内宫颈部位,每隔1天用药1次,20d为1个疗程,连续应用2个疗程,经期停药。C组患者在A组患者基础上,术后1周后给予抗HPV生物蛋白敷料治疗,用药方法及疗程同B组。三组患者均术后及用药结束后3个月后复查。
1.4 观察指标及评价标准
比较三组的临床疗效,疗效判定标准[6],治愈:术后复查宫颈光滑,HPV阴性,TCT正常,未发现CIN病变,临床症状消失;有效:术后复查宫颈尚光滑,HPV部分转阴或出现其他高危阳性,TCT基本恢复,组织病理学病变级别降低,临床症状改善明显;无效:未达到上述标准,甚至病变加重。总有效率=(治愈+有效)例数/总例数×100%。比较三组治疗后3个月复查HPV转阴率、自我症状(阴道出血量、阴道出血时间、阴道排液时间及创面愈合时间)、并发症(创面感染、宫颈外口粘连、宫颈创面息肉、下腹部坠痛)发生情况。
1.5 统计学方法
采用SPSS22.0统计学软件进行数据处理,计量资料用均数±标准差(x±s)表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组临床疗效比较
A组总有效率為71.43%,B组总有效率为69.05%,C组总有效率为95.24%;A组总有效率与B组比较,差异无统计学意义(P>0.05),C组总有效率明显优于A组和B组,差异有统计学意义(P<0.05)。见表1。
2.2 三组治疗后HPV转阴率比较
A组HPV转阴率为64.29%(27/42),B组HPV转阴率为61.90%(26/42);C组HPV转阴率为83.33%(35/42);A组与B组比较,差异无统计学意义(χ2=0.051,P=0.996),C组HPV转阴率明显优于A组和B组,差异有统计学意义(与A组比较,χ2=3.941,P=0.047;与B组比较,χ2=4.849,P=0.027)。
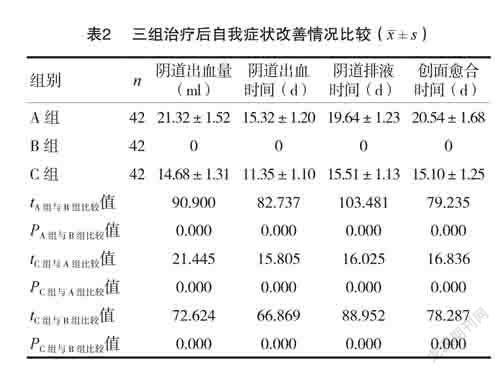
2.3 三组治疗后自我症状改善情况比较
B组术后阴道出血量少于A组和C组,出血时间、阴道排液时间及创面愈合时间均短于A组、C组,差异有统计学意义(P<0.05),C组自我症状改善情况均优于A组,差异有统计学意义(P<0.05)。见表2。
2.4 三组治疗后并发症发生率比较
C组并发症总发生率低于A组,差异有统计学意义(P<0.05),与B组比较差异无统计学意义(P>0.05),见表3。
3 讨论
近年来,随着宫颈癌防治的大力宣传,诊断技术的不断提高,人们的生活水平的提高及保健意识的增强,宫颈病变可以早期通过宫颈防癌筛查HPV、TCT被早期发现及诊断[7]。宫颈癌前病变与宫颈癌密切相关,好发于育龄期妇女,该病变可自然消退,但也容易发展成浸润癌。多项研究表明[8],高危型HPV感染是形成宫颈癌前病变的主要原因,虽然宫颈癌前病变进展成宫颈癌需要很长一段时间,但早期筛查、早期诊断、早期治疗及随诊尤为重要。
CINⅠ级60%左右会自行消除,进展为CINⅡ级的概率不足9%,可以观察随访或使用抗HPV病毒药物治疗。而CINⅡ级20%会发展为宫颈癌前病变Ⅲ级,发展成宫颈癌的概率为5%,因此CINⅡ级以上均需要进行特殊的治疗[9]。宫颈环形电切术是治疗高级别病变的主要手段,宫颈环形电切术具有操作简单、手术时间短、费用低且安全可靠,能有效地将病变组织有效切除,降低了宫颈癌的发生率,其有效率可达80%左右[10]。
宫颈环形电切术后引起复发的主要原因为HPV感染[11],临床研究表明[12],宫颈术后仍有部分患者存在HPV的持续感染,主要原因在于宫颈病变浸润较深,造成病毒残留,引起复发;也可能是因为各种原因引起术后再次感染HPV病毒。因此术后对HPV病毒进行监测并采取相应的治疗措施,可以更好地促进病毒转阴,是预防术后复发的关键所在。而抗HPV生物蛋白敷料其有效成分为酸肝化牛β-乳球蛋白、卡波姆、甘油,其中酸肝化牛β-乳球蛋白是食用牛奶蛋白提取出来的,经过高新生物科技修饰后得到的酸肝化牛β-乳球蛋白表面带有更多的负电荷,该负电荷与HPV衣壳蛋白的L1区的C端的正电荷区域相结合以及L2区的N端的正电荷区域相结合,从而阻断HPV病毒侵入宿主细胞内,进而阻断HPV感染[13];而卡波姆成分是醫用高分子材料,具有性质稳定、无刺激、无致敏性特点,用药后卡波姆可以将宫颈受损的组织所覆盖,感染的宫颈创面被隔离,同时也能阻止创面再次损伤,起到修复损伤黏膜的作用,使损伤的创面愈合,达到治疗疾病的目的[14]。
本研究结果显示,宫颈环形电切术联合抗HPV蛋白敷料治疗CINⅡ临床总有效率为95.24%,HPV转阴率83.33%,术后阴道出血量、出血时间、阴道排液时间及创面愈合时间均低于其他组,且并发症总发生率仅为16.67%。王巧娥等[15]研究发现,对宫颈冷刀锥切术后仍存在HPV感染的子宫上皮内瘤变患者给予抗HPV生物蛋白敷料治疗,治疗3个月后总有效率为78.95%,治疗6个月后总有效率为84.21%,治疗12个月后总有效率为84.21%,与本研究结果基本一致。在未来的研究中,需进行多中心、大样本的临床研究,为临床工作中提供更有利的理论研究,进一步指导临床。
综上所述,宫颈环形电切术联合抗HPV蛋白敷料治疗CINⅡ临床疗效满意,值得临床借鉴。

