不同饲喂条件下蜂王浆品质及抗氧化能力评价
乔栋 ,黎洪霞,刘肇龙,宋梅,庞杰,陈兰珍
1. 福建农林大学食品科学学院(福州 350002);2. 中国农业科学院蜜蜂研究所(北京 100093)
蜂王浆是年轻工蜂出生后第5天至第14天之间由咽下腺和下颌腺分泌的黄白色酸性物质,用于喂养工蜂前三天的幼虫和蜂后的一生[1]。蜂王浆富含多种营养物质[2],大量相关研究表明蜂王浆具有抗氧化活性[3]、胰岛素样作用、改善糖尿病、降血脂及免疫调节等功能特性。蜂王浆的内在组分决定了生物活性功能[4],但是蜂王浆的生产质量受到多方面的影响,如蜂群群势、足够的食物供应(包括蜂蜜和花粉)、适宜的温度(20~30 ℃),以及良好的自然环境(无农药或微量农药)等。已有研究表明,蜜粉源的差异会影响蜂王浆质量[5-6]。在外界蜜粉源缺乏时,为保证蜂王浆的持续性产出,蜂农会进行人工饲喂来补充蜂群生产必需的蛋白质和糖分,但是在生产中添加人工饲料是一个有争议的话题[7]。已有研究表明工蜂在不同采食下会影响蜂王浆产量,部分糖分发生变化,其次人工饲料可能会刺激下咽腺发育[8-10]。
对于饲喂产生的蜂王浆质量仍没有明确定论。此次研究通过比较工蜂采食天然蜜粉源、饲喂糖水和饲喂代花粉三种不同饲喂条件下蜂王浆的品质差异,并通过体外抗氧化测定方法研究了不同蜂王浆的体外抗氧化活性差异,对不同饲喂条件下蜂王浆的质量变化差异提供数据支撑,为生产优质蜂王浆提供理论指导。
1 材料与方法
蜂王浆样品均采集于湖北省钟祥市,根据蜂群不同采食情况对所产蜂王浆进行分类,即天然组和饲喂组,天然组指蜂王浆在生产过程中蜂群食物完全来自天然蜂蜜和蜂花粉,饲喂组指蜂王浆在生产过程中人为添加白糖水和代花粉饲喂蜂群。试验样品有采食天然花粉和花蜜生产的蜂王浆(TRWJ)、采食天然花粉并人工饲喂白糖水生产的蜂王浆(WTWJ)和采食天然蜂蜜并人工饲喂代花粉生产的蜂王浆(WFWJ),三种类别蜂王浆共计76个样品。样品信息见表1,样品采集完成后立即保存在-18 ℃冰箱中备用直到检测。

表1 蜂王浆样品采集信息
Biofuge离心机(美国Thermo Scientific公司);KQ218超声波清洗器(昆山市超声仪器有限公司);Vortex Mixer QL-866涡旋混合器(其林贝尔仪器制造有限公司);PX124ZH电子天平[奥豪斯仪器(常州)有限公司];Synergyneo2 Alpha酶标仪(美国伯腾仪器有限公司);752紫外可见分光光度计(上海菁华科技有限公司)。
牛血清白蛋白Ⅴ(北京索莱宝科技有限公司);考马斯亮蓝G250、维生素C、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐、靛蓝胭脂红、乙酸钠(上海源叶生物科技有限公司);磷酸、苯酚(上海吉至生化科技有限公司);浓硫酸(国药集团化学试剂有限公司);葡萄糖(上海阿拉丁生化科技股份有限公司);没食子酸、水杨酸(河北百灵威超精细材料有限公司);硫酸亚铁(西陇科学股份有限公司);30%过氧化氢、过硫酸钾(福晨化学试剂有限公司)。
1.1 试验方法
1.1.1 水溶性蛋白含量测定
参考文献[11-12]方法,并略作修改。称取0.1 g牛血清白蛋白溶解于纯水定容至100 mL,梯度为0,40,80,120,160,180和200 μg/mL,各取0.2 mL不同质量浓度稀释液于1.5 mL试管中,加入1 mL考马斯亮蓝反应液,立即涡旋15 s,混匀后静置5 min,在波长595 nm处测定吸光度,以牛血清蛋白系列浓度为横坐标、吸光度为纵坐标绘制的标准曲线方程:y=3.449x+0.661,相关系数R2=0.999。
称取0.5 g蜂王浆定容10 mL纯水中,涡旋2 min,4 ℃下超声10 min,12 000 r/min下离心20 min,取上清液并将上清液进行稀释,取50 μL加入950 μL纯水涡旋混匀待测。按照制作标准曲线的操作方法对样品测定水溶性蛋白含量,将测定的吸光度代入标准曲线方程,计算其含量。
1.1.2 总糖含量测定
参考方法[13-14]进行改进。称取50 mg葡萄糖溶于纯水并定容至50 mL,配制梯度浓度为0,80,160,240,320和400 μg/mL葡萄糖标准溶液,配制80%苯酚作为储备液,使用前稀释成5%苯酚工作液,在具塞试管中依次加入0.2 mL不同浓度的葡萄糖标准溶液和0.2 mL 5%苯酚,再迅速加入1 mL浓硫酸,涡旋使其充分混匀,静置10 min,在波长490 nm处测定吸光度,以葡萄糖标准品浓度为横坐标,吸光度为纵坐标绘制标准曲线方程:y=0.006x+0.063 6,相关系数R2= 0.999。
称取0.5 g蜂王浆定容于10 mL去离子水,涡旋混匀后超声10 min,12 000 r/min下离心20 min,取上清液稀释20倍,按照标准曲线操作方法对样品进行测定,将吸光度带入标准曲线方程计算含量。
1.1.3 葡萄糖氧化酶测定
参考权淑静等[15],采用褪色光度法,并略作改动。准确吸取0,0.2,0.4,0.6,0.8,1.0和1.2 mL过氧化氢工作液于具塞比色管,依次加入0.3 mL乙酸-乙酸钠缓冲溶液和0.26 mL靛蓝胭脂红溶液,补水至总体系为5 mL,混匀后置于100 ℃沸水中加热13 min,取出后用冰水冷却3~5 min,终止反应,在波长612 nm处用蒸馏水做参比,测定其吸光度。以过氧化氢溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线方程:y=-0.360 4x+0.847,相关系数R2=0.990。将蜂王浆样品上清液稀释为25 mg/mL,取0.4 mL于具塞试管中,在37 ℃恒温培养箱中加热孵育30 min,取出后按照上述操作过程,依次加入工作液,计算产生过氧化氢的含量,计算葡萄糖氧化酶的活性。酶活力单位规定为:37 ℃条件下,1 min内催化葡萄糖反应产生1 μg过氧化氢所需的酶量为1 U。
1.1.4 总酚酸测定
参考Balkanska等[16]方法。称取50 mg没食子酸溶于乙醇中定容于50 mL容量瓶,配成1 000 μg/mL没食子酸标准品储备液,将储备液用纯水稀释成0,10,20,40,60,80和100 μg/mL质量浓度梯度,取0.2 mL不同质量浓度标准品于试管中,依次加入0.2 mL 1 mol/L福林酚显色液和1 mL 1 mol/L碳酸钠溶液,用水补至3 mL,混匀后静置避光反应30 min时,在波长760 nm处测定吸光度,标准曲线方程为y=0.006 8x+0.066 8,相关系数R2=0.998。
配制100 mg/mL蜂王浆溶液样品并稀释成20 mg/mL,按照标准品的反应过程依次添加反应溶剂,反应后上机检测吸光度。
1.1.5 蜂王浆抗氧化活性
1.1.5.1 总抗氧化能力测定
总抗氧化能力测定方法采用ABTS自由基清除率法[17]。配制7 mmol/L的ABTS储备液和2.45 mmol/L的过硫酸钾水溶液,取等体积溶液于黑暗中反应12~16 h,得ABTS反应液(ABTS+·),反应液以1∶45体积比用去离子水稀释至在734 nm下吸光度为0.70±0.02。以维生素C为当量并制作标准曲线,维生素C质量浓度梯度为0,10,20,40,60和80 μg/mL,取10 μL标准品加入200 μL反应液避光反应8 min,在波长734 nm处测定吸光度。配制100 mg/mL样品,按照上述操作方法进行反应,避光反应8 min后测定蜂王浆样品吸光度,抗氧化能力以VC当量表示。
1.1.5.2 羟基自由基·OH清除率
参考汤兴楠等[18]方法配制9.0 mmol/L的硫酸亚铁溶液、9.0 mmol/L水杨酸-乙醇溶液和8.8 mmol/L的过氧化氢储备溶液。操作过程:配制VC标准溶液作为对照,称取1.0 g维生素C定容于50 mL容量瓶,稀释成0.1,0.2,0.4,0.6,0.8和0.9 mg/mL质量浓度梯度,选择10 mL试管依次加入0.5 mL样品或标准品、适量水、0.5 mL的9 mmol/L硫酸亚铁和0.5 mL 9 mmol/L水杨酸-乙醇溶液,加入0.5 mL 8.8 mmol/L过氧化氢溶液,混匀后在37 ℃水浴静置30 min,在波长510 nm处测定反应体系的吸光度,反应重复测定3次。清除率根据式(1)计算,反应溶剂添加剂量如表2所示。
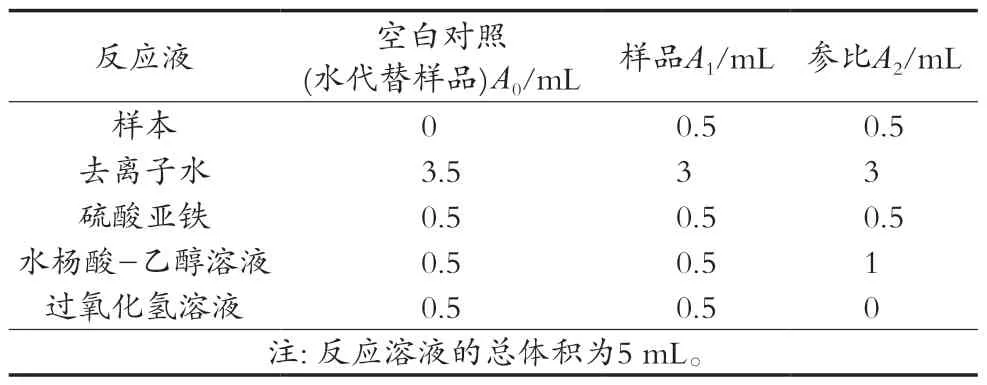
表2 反应溶剂添加剂量
式中:A0为空白对照的吸光度;A1为蜂王浆样品的吸光度;A2为未加反应液的吸光度。
1.2 数据处理
获得数据通过SPSS 24.0软件做单因素方差分析(One-way ANOVA)和相关性分析,P<0.05为显著性差异,P<0.01为极显著性差异,利用Graphpad Prism 8.0软件绘图。
2 结果与分析
2.1 不同饲喂条件对蜂王浆成分影响
蜂王浆中的主蛋白(MRJPS)为水溶性蛋白质,目前已经鉴定出9种不同蛋白质(MRJP1~MRJP9),研究表明蜂王浆水溶性蛋白质具有多种生物活性功能[19]。水溶性蛋白是由工蜂的咽下腺和上颚腺分泌,而蜜蜂发育和分泌蜂王浆所需的蛋白质、能量来源于外界花粉,已有研究表明蜜蜂食用不同蜂花粉会显著影响主蛋白基因表达[20]。试验探究了不同饲喂条件对工蜂分泌蜂王浆水溶性蛋白的影响,结果如表3所示。天然组、饲喂糖水和代花粉三组的水溶性蛋白含量在54.85~59.48 mg/g之间,饲喂代花粉组水溶性蛋白含量最高,为59.48 mg/g,与WTWJ组存在极显著性差异(P< 0.01),表明饲喂代花粉相比饲喂糖水能够显著提高水溶性蛋白含量。TRWJ与WTWJ之间存在极显著差异(P<0.01),说明采食天然花粉花蜜生产蜂王浆水溶性蛋白含量优于饲喂糖水生产的蜂王浆。TRWJ与WFWJ之间不存在显著性差异,与天然蜜粉源相比较饲喂代花粉不会影响水溶性蛋白含量。

表3 不同饲喂条件所产蜂王浆组分含量
工蜂咽下腺是分泌蜂王浆的主要器官之一,有研究表明不同食料会改变工蜂咽下腺的腺泡表面积,对工蜂的生长发育和蜂王浆的生产有一定的影响[21]。蜜蜂营养缺乏会对工蜂下颌腺的合成能力有显著的负面影响[22]。以上结果表明饲喂白糖后对工蜂分泌蛋白产生影响导致含量降低。因为氨基酸是蛋白质基本组成成分,其浓度变化可以反映蜂王浆蛋白质含量变化[23],有研究证实分别喂食工蜂蜂蜜和白糖会导致蜂王浆氨基酸含量存在显著差异且蜂蜜组含量优于白糖组[24],与此次研究结果相似,喂食白糖组蜂王浆水溶性蛋白含量最低,表明饲喂条件不同是导致水溶性蛋白含量差异的重要原因。
糖类占蜂王浆的7.5%~15%,葡萄糖和果糖约占总糖90%,此外还有其他少量的糖,如蔗糖、麦芽糖和海藻糖等[25]。如表3所示,蜂王浆总糖含量在110.50~ 112.69 mg/g之间,TRWJ、WTWJ和WFWJ三组之间不存在显著性差异,而且WTWJ含量略低于TRWJ,表明饲喂糖水不会导致蜂王浆总糖含量升高。研究结果表明不同饲喂条件不会影响蜂王浆总糖的含量。
葡萄糖氧化酶是蜜蜂咽下腺分泌的一种酶,参与D-葡萄糖转化为葡萄糖酸和过氧化氢,在冷冻条件下其活性保持稳定[26]。如表3所示,不同蜂王浆葡萄糖氧化酶活性在1 022.24~1 092.70 U/(g·0.5 h)之间,天然组、喂糖和喂代花粉组内无明显差异,表明不同饲喂条件不会影响葡萄糖氧化酶活性。此外,通过表3数据看出三组蜂王浆的总糖与葡萄糖氧化酶含量无显著性差异,但含量存在相反的趋势。有研究表明葡萄糖氧化酶活性受到底物葡萄糖的影响产生底物抑制[27],并且葡萄糖氧化酶通过化学反应会消耗葡萄糖产生过氧化氢,使蜂王浆中葡萄糖含量下降,说明葡萄糖氧化酶含量可能与蜂王浆中总糖含量存在一定关联性。
如表3所示:不同蜂王浆总酚酸含量差异不明显,平均含量在3.18~3.23 mg/g之间,与Nabas等[28]测定结果相符合,天然组、喂糖和喂代花粉组内无明显差异,说明不同饲喂条件不会显著影响总酚酸的含量。
2.2 不同饲喂条件对蜂王浆体外抗氧化活性影响
如图1所示:蜂王浆总抗氧化能力以VC当量表示,在1.91~2.28 mg/g之间,羟自由基清除率在60.81%~ 62.26%之间,WFWJ的总抗氧化能力最高,VC当量为2.28 mg/g,与TRWJ存在极显著性差异(P<0.01),与WTWJ之间无显著性差异。结果表明人工饲喂代花粉生产的蜂王浆其体外总抗氧化能力均高于喂糖和天然蜜粉源生产的蜂王浆,而喂食糖水与天然蜜粉源生产的蜂王浆相比其体外总抗氧化能力有略微升高,但无显著性差异。不同饲喂条件能够影响蜂王浆体外总抗氧化能力。

图1 不同饲喂蜂王浆体外抗氧化指标
蜂王浆的羟自由基清除率在60.81%~62.26%之间,如图1所示,不同饲喂条件下生产的蜂王浆羟自由基清除率无显著差异,表明不同饲喂条件不会对蜂王浆羟自由基清除能力产生影响。
2.3 相关性分析
为进一步分析不同饲喂蜂王浆成分之间的关系,对蜂王浆测定的各项指标做Pearson相关性分析,如表4所示。葡萄糖氧化酶活性与总糖含量呈极显著负相关,葡萄糖氧化酶和总糖中的葡萄糖发生潜在抑制或降解反应导致存在负相关性,而相关性系数(r= -0.304)较小的原因可能是蜂王浆中其他物质也会影响葡萄糖氧化酶活性。葡萄糖氧化酶与总抗氧化能力(r=0.349)、羟自由基清除率(r=0.625)都存在极显著正相关,主要由于葡萄糖氧化酶分解葡萄糖产生的过氧化氢提高了体外抗氧化能力。总酚与总糖呈极显著负相关(r=-0.396),有研究表明多酚能够与蛋白相互作用抑制酶活性,其次多酚能够产生过氧化氢减缓葡萄糖分解速率[29],这可能是导致总酚和总糖负相关的原因。总酚与蜂王浆水溶性蛋白或游离氨基酸发生共价作用能够提高蛋白的热稳定性[30],使得蜂王浆容易热分解的蛋白质组分能够稳定保存,导致总酚与水溶性蛋白呈极显著正相关。

表4 不同饲喂蜂王浆指标相关性分析
3 结论
研究表明不同饲喂条件会影响蜂王浆水溶性蛋白含量,喂代花粉生产的蜂王浆水溶性蛋白最高,采食天然蜜粉源生产的蜂王浆次之,喂糖生产的蜂王浆水溶性蛋白最低。不同饲喂条件对蜂王浆总糖、总酚、葡萄糖氧化酶活性没有显著影响,说明饲喂条件不是影响其含量的主要因素。蜂王浆的总抗氧化性与饲喂条件有关,喂粉生产的蜂王浆总抗氧化能力最高,其次是喂糖生产的蜂王浆,采食天然蜜粉源生产的蜂王浆总抗氧化能力最低。但是在羟自由基清除能力上不同饲喂蜂王浆之间无显著性差异,后续将通过多种抗氧化方法进一步研究不同饲喂蜂王浆的抗氧化能力。相关性分析表明蜂王浆内在组分之间存在关联,葡萄糖氧化酶与总糖之间存在极显著负相关,与抗氧化能力存在极显著正相关,总酚和总糖存在极显著负相关。蜂群在人工饲喂代花粉和糖水后生产的蜂王浆品质没有下降,在养蜂生产蜂王浆阶段可以考虑人工饲喂。

