鸡细小病毒NS1和VP2蛋白的原核表达及多克隆抗体制备
廖健淇,谢芝勋,张民秀,张艳芳,罗思思,李 孟,谢志勤,谢丽基,邓显文,范 晴,曾婷婷,黄娇玲,王 盛
(1.广西大学动物科学技术学院,南宁 530004;2.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室/农业农村部中国(广西) —东盟跨境动物疫病防控重点实验室,南宁 530001)
【研究意义】自首次在美国发现鸡细小病毒(Chicken parvovirus,ChPV)以来[1],不断有其他地区发现鸡群感染ChPV的案例报道,截至目前,该病已经在美国、波兰、韩国及中国广泛传播[2]。在我国广西地区,ChPV及与其同属的火鸡细小病毒(Turkey parvovirus,ThPV)在大部分商品鸡鸡场中均广泛存在,ChPV在肉鸡中的阳性率达60.18%,在种鸡和蛋鸡中也存在约39.00%的阳性率,ThPV的阳性率高达83.33%,其中在柳州、玉林、北海、南宁和梧州的流行情况较严重,阳性率均在60.00%以上[3]。ChPV/ThPV在健康鸡群中也广泛存在,且存在垂直传播的可能性[4-5],但目前对于该病致病机理及快速诊断方法的研究不够深入。因此,原核表达ChPV的NS1和VP2蛋白,制备其多克隆抗体,对深入探究ChPV的蛋白结构功能及建立其血清学诊断方法有效防控ChPV具有重要意义。【前人研究进展】ChPV是无包膜单链的DNA病毒,其结构为正二十面体对称结构,与ThPV同属细小病毒科细小病毒亚科Aveparvovirus属[6],在抗原上ChPV与ThPV密切相关,二者的NS1蛋白同源性达91.5%~99.6%[7]。Sunil等[8]研究表明,ChPV基因长约5.3 kb,具有3个开放阅读框(ORF),其中,ORF1和ORF3分别编码非结构蛋白NS1和NP1,ORF2编码结构蛋白VP1和VP2;VP1蛋白由675个氨基酸组成,是ChPV的结构蛋白之一,该蛋白可能具有影响病毒侵入和释放的功能。VP1蛋白基因包含VP2蛋白基因完整序列,且共同拥有536个相同的C末端氨基酸。NP1蛋白是ChPV中的最小蛋白,由101个氨基酸组成,目前对该蛋白的研究报道较少,推测该蛋白可能与衣壳蛋白的表达及病毒DNA复制有关[9]。NS1蛋白约由695个氨基酸组成,在细胞核中复制,是病毒DNA复制和包装的必需磷蛋白,具有重叠的N端双链DNA特异性识别位点和链特异性核酸内切酶结构域及复制启动功能[10],NS1蛋白基因在ChPV中具有保守性,常被用作分子诊断的靶点[11]。VP2蛋白约由537个氨基酸组成,是ChPV最重要的结构蛋白和主要衣壳蛋白,在病毒生命周期中具有包装病毒衣壳和DNA复制及对宿主细胞产生细胞毒性等多种功能[12],能刺激机体产生强烈的免疫应答,因此有望用于疫苗制备和血清学诊断,已有学者基于该蛋白构建了重组黑色素疱疹病毒1型(MeHV1)病毒,为抗ChPV疫苗的制备提供了新思路[13]。迄今,国内外针对ChPV的研究少有报道,对该病毒在肠道疾病中的致病机制尚不明确,且该病毒在体外增殖较困难[14],导致对该病的研究进展较缓慢。【本研究切入点】NS1和VP2蛋白基因是ChPV疫苗研制和检测诊断的重要基因,但目前缺少商品化的抗NS1和VP2蛋白抗体及ChPV抗体检测试剂盒,针对ChPV的NS1和VP2蛋白结构和功能研究及ChPV在鸡群中的血清学调查鲜见报道。【拟解决的关键问题】构建ChPV的NS1和VP2蛋白重组表达载体pET-32a-VP2和pET-32a-NS1并进行原核表达,制备NS1和VP2蛋白的多克隆抗体,为后续针对NS1和VP2蛋白的生物学作用研究及建立ChPV血清学检测方法防控ChPV提供参考依据。
1 材料与方法
1.1 试验材料
pET-32a表达载体和ChPV感染性克隆株pBluescript II SK(+)-ChPV质粒由广西兽医生物技术重点实验室保存提供,DL10000 DNA Marker、Sacl和Hind III限制性内切酶和DNA片段纯化试剂盒购自TaKaRa宝生物工程(大连)有限公司;大肠杆菌thanssetta(DE3)感受态细胞和thans 5α感受态细胞购自北京全式金生物技术有限公司;质粒提取试剂盒和胶回收试剂盒购自Omega Bio-Tek公司;AP标记羊抗鼠二抗、His标签抗鼠抗体、HRP标记抗鸡二抗和BCIP/NBT碱性磷酸酯酶显色试剂盒购自碧云天生物技术公司;辣根过氧化物酶DAB显色试剂盒购自上海生工生物工程公司;包涵体蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;PMV-VP2和PMV-NS1为分别含有VP2和NS1蛋白基因序列全长的重组质粒,由深圳华大基因科技有限公司构建。
1.2 试验方法
1.2.1 NS1和VP2蛋白基因序列引物的设计及PCR扩增 根据GenBank上公布的GX-Ch-PV-21毒株基因序列(登录号MG602511),应用Primer Premier 5.0设计NS1和VP2蛋白基因序列的扩增引物,NS1-F:5′-ACGGAGCTCGCATTCCCAACACGC GGTGGGTTTT-3′,NS1-R:5′-CCCAAGCTTTTGAACCAGACAGCACTGTCGACAC-3′,NS1蛋白基因序列大小为2088 bp;VP2-F:5′-ACGGAGCTCGCAGATGAAAATGAACCAACTCAG-3′,VP2-R:5′-CCCAAGCTTATTGGATTTCGGTACCCGACGGGTT-3′,VP2蛋白基因序列大小为1607 bp(下划线部分为酶切位点Sacl和Hind III),引物送至深圳华大基因科技有限公司合成。
以重组质粒PMV-VP2和PMV-NS1为模板,分别进行NS1和VP2蛋白的全长基因序列PCR扩增。PCR反应体系50.0 μL:上、下游引物(10 μmol/L)各2.5 μL,PrimeSTAR GXL Premix(2×) 25.0 μL,DNA模板2.5 μL,ddH2O 17.5 μL;NS1蛋白基因序列的PCR扩增程序:95 ℃预变性3 min;95 ℃ 30 s,65 ℃ 30 s,72 ℃ 2 min,进行35个循环;72 ℃延伸10 min;VP2蛋白基因序列的PCR扩增程序:95 ℃预变性3 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 1.5 min,进行35个循环;72 ℃延伸10 min;PCR扩增产物经1.5%琼脂糖凝胶电泳验证条带正确后,根据胶回收试剂盒操作说明进行回收。
1.2.2 重组克隆载体的构建与鉴定 使用Sacl和Hind III内切酶分别对VP2和NS1蛋白的基因片段和pET-32a表达载体进行双酶切,按照连接酶试剂盒说明将VP2和NS1蛋白的基因片段分别与pET-32a表达载体连接并转化thans 5α感受态细胞,通过PCR及双酶切方法鉴定后,将阳性克隆菌液送至北京六合华大基因科技有限公司进行测序,将测序正确的重组质粒分别命名为pET-32a-VP2和pET-32a-NS1。
将重组质粒pET-32a-VP2和pET-32a-NS1分别转化thansetta(DE3)感受态细胞,构建重组菌pET-32a-VP2/thansetta(DE3)和pET-32a-NS1/thansetta(DE3)。
1.2.3 重组蛋白最佳诱导条件筛选 将1.2.2的重组菌pET-32a-VP2/thansetta(DE3)和pET-32a-NS1/thansetta(DE3)分别接种于含100.0 μg/mL氨苄青霉素的LB培养基中,置于37 ℃摇床培养,当菌液浓度(OD600 nm)约为0.8时,加入终浓度为0、0.1、0.2、0.4、0.6、0.8、1.0、1.2和1.4 mmol/L的IPTG,20 ℃过夜诱导表达,4000 r/min室温离心10 min,弃上清,菌体经放射免疫沉淀法裂解缓冲液(RIPA裂解液)和超声机超声处理后加入蛋白上样缓冲液,沸水水浴10 min使蛋白样品变性,取30.0 μL蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,确定IPTG最佳诱导浓度;在最佳IPTG浓度下,分别于12、16、20、24和37 ℃下过夜诱导,确定诱导表达的最佳温度。
1.2.4 重组蛋白的可溶性分析 根据1.2.3筛选出的最佳诱导条件诱导表达重组菌pET-32a-VP2/thansetta(DE3)和pET-32a-NS1/thansetta(DE3)各400.0 mL,4000 r/min离心10 min,收集菌液沉淀,加入适量无乙二胺四乙酸(EDTA)细胞裂解液及蛋白酶抑制剂,超声破碎细菌后离心,收集上清和沉淀,进行 SDS-PAGE电泳,对重组蛋白进行可溶性分析。
1.2.5 包涵体蛋白的纯化及复性 参考His标签蛋白纯化试剂盒(包涵体蛋白)说明分别对表达的重组NS1和VP2蛋白进行纯化。制备蛋白复性缓冲液[1.0 mmol/L EDTA,50.0 mmol/L Tris-HCl,磷酸盐缓冲液(PBS),pH=8.0],将纯化蛋白放入10 kD孔径的分子透析袋中,依次使用1.0 L含6.0、4.0、2.0和0 mol尿素的蛋白复性缓冲液透析,4 ℃条件下各透析10 h,最后置于1.0 L PBS溶液中4 ℃过夜透析,以紫外可见光分光光度法测定蛋白浓度。
1.2.6 重组VP2蛋白和NS1蛋白多克隆抗体制备 使用纯化的VP2和NS1蛋白对4周龄无特定病原体(SPF)鸡进行免疫,首次免疫将VP2和NS1蛋白稀释至200.0 μg/mL,并分别与等体积完全弗氏佐剂混合乳化后,取1.0 mL通过皮下注射对SPF鸡进行免疫,首次免疫后21和42 d采用VP2和NS1蛋白分别与等体积不完全弗氏佐剂混合乳化后进行加强免疫,第3次免疫后14 d进行翅下静脉采血,采用酶联免疫吸附实验(ELISA)方法测定多克隆抗体效价,第3次免疫后21 d进行第4次免疫,翅下静脉采血后处死SPF鸡,将收集的血液37 ℃水浴1 h后4 ℃过夜,收集的血清置于-40 ℃冰箱冻存。
1.2.7 重组VP2和NS1蛋白及多克隆抗体的免疫印迹(Western-blotting)鉴定 取纯化并复性后的VP2和NS1蛋白,处理后进行SDS-PAGE电泳,将蛋白从变性胶转移至NC膜上,以封闭后加入稀释2000倍的商品化His标签抗体为一抗,以稀释2000倍的AP标记羊抗鼠IgG为二抗,参考BCIP/NBT碱性磷酸酯酶显色试剂盒说明进行显色。以纯化后的VP2 和NS1蛋白为抗原,以VP2和NS1蛋白的鸡多克隆抗体为一抗,HRP标记羊抗鸡IgG为二抗,使用DAB显色试剂盒显色度并拍照保存。
1.2.8 多克隆抗体的间接免疫荧光(IFA)鉴定 在6孔板中培养鸡肝癌细胞(LMH),待细胞长至汇合度约80%后,将由广西兽医生物技术重点实验室制备的ChPV感染性克隆株pBluescript II SK(+)-ChPV质粒转染细胞,5%CO2条件下在37 ℃恒温箱培养3 d;使用细胞固定液(50%甲醇+50%丙酮)将LMH细胞在室温下固定20 min;用5%脱脂奶粉37 ℃封闭后,分别加入NS1和VP2蛋白的多克隆抗体(1∶500稀释),37 ℃孵育1 h;磷酸盐吐温缓冲液(PBST)洗涤3次,加入FITC—山羊抗鸡IgG抗体(1∶500稀释)37 ℃孵育1 h;使用PBST洗净后置于荧光显微镜下观察并拍照。
2 结果与分析
2.1 NS1和VP2 蛋白基因的PCR扩增
使用设计的引物分别对NS1和VP2蛋白基因进行PCR扩增,电泳检测结果显示,NS1蛋白基因片段大小约为2088 bp(图1-A),VP2蛋白基因片段大小约为1607 bp(图1-B),均符合预期结果。
2.2 重组克隆载体的构建与鉴定
对重组质粒pET-32a-NS1和pET-32a-VP2使用Sacl和Hind III内切酶进行双酶切后,均得到符合预期的目的片段条带,重组质粒pET-32a-NS1的Sacl和Hind III内切酶酶切片段大小约为5900和2088 bp(图2-A),重组质粒pET-32a-VP2的Sacl和Hind III内切酶酶切片段大小约为5900和1607 bp(图2-B),表明已成功将目的基因克隆到表达载体pET-32a中。
2.3 重组蛋白最佳诱导条件的筛选及可溶性分析
将VP2和NS1蛋白分别在不同温度和不同IPTG终浓度条件下进行诱导表达,结果显示,VP2蛋白在IPTG 终浓度为0.1~0.4 mmol/L时表达效果不理想,最终确定VP2蛋白在IPTG终浓度为0.8 mmol/L(部分结果见图3-A)、20 ℃下过夜诱导为最佳诱导表达条件(图3-B);NS1蛋白在IPTG终浓度为0.1~0.6 mmol/L时表达效果不理想,最终确定NS1蛋白在IPTG终浓度为1.0 mmol/L(部分结果见图4-A)、16 ℃下过夜诱导为最佳诱导表达条件(图4-B)。可溶性分析结果(图5)表明,VP2和NS1蛋白在最佳诱导条件下主要以包涵体蛋白形式存在,说明在最佳诱导条件下已成功诱导出以包涵体形式存在的VP2和NS1蛋白。
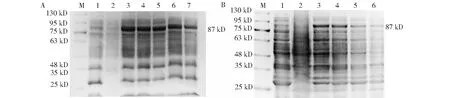
M为130 kD蛋白Marker;1为已诱导pET-32a空载总蛋白;A:2为未诱导的重组菌株,3~7分别为0.6、0.8、1.0、1.2和1.4 mmol/L IPTG 诱导条件下表达的蛋白;B:2~6分别为16、20、24、28和37 ℃诱导条件下表达的蛋白。M was 130 kD protein Marker;1 was pET-32a no-load total protein that has been induced;A:2 was uninduced recombinant strain;3-7 were 0.6,0.8,1.0,1.2 and 1.4 mmol/L IPTG induced protein expression respectively;B:2-6 were proteins expressed at 16,20,24,28 and 37 ℃,respectively.图3 重组蛋白VP2的SDS-PAGE分析Fig.3 SDS-PAGE analysis of VP2 recombinant protein

M为180 kD蛋白Marker;1为已诱导pET-32a空载总蛋白;A:2为未诱导的重组菌株,3~5分别为0.8、1.0和1.2 mmol/L IPTG 诱导条件下表达的蛋白;B:2-5分别为12、16、20和25 ℃诱导条件下表达的蛋白。M was 180 kD protein Marker;1 was pET-32a no-load total protein that has been induced;A:2 was uninduced recombinant strain;3-5 were expressed under the IPTG induction condition of 0.8,1.0 and 1.2 mmol/L,respectively;B:2-5 were the proteins expressed under the induction conditions of 12,16,20 and 25 ℃,respectively.图4 重组蛋白NS1的SDS-PAGE分析Fig.4 SDS-PAGE analysis of NS1 recombinant protein

M为180 kD蛋白Marker;1为诱导后pET-32a空载总蛋白;A:2为NS1蛋白诱导后沉淀,3为NS1蛋白诱导后上清;B:2为VP2蛋白诱导后沉淀,3为VP2蛋白诱导后上清。M was 180 kD protein Marker;1 was pET-32a no-load total protein after induction;A:2 was precipitation after induction of NS1 protein,3 was supernatant after induction of NS1 protein;B:2 was precipitation after induction of VP2 protein,3 was supernatant after induction VP2 protein.图5 重组蛋白的可溶性分析Fig.5 Soluble analysis of recombinant protein
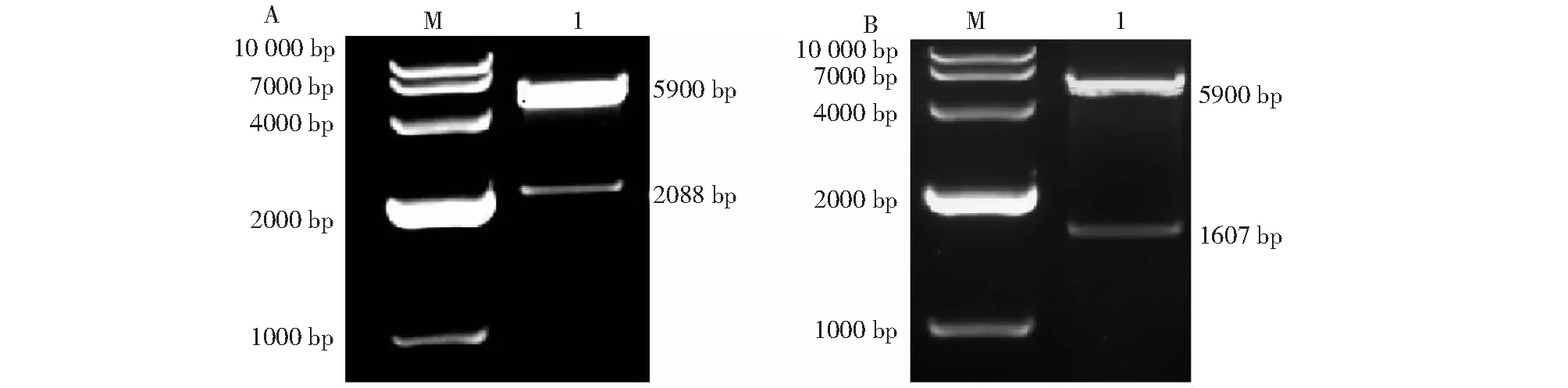
M为DL10000 DNA Marker;A:1为重组质粒pET-32a-NS1双酶切产物;B:1为重组质粒pET-32a-VP2双酶切产物。M was DL10000 DNA Marker;A:1 was recombinant plasmid pET-32a-NS1 double digestion product;B:1 was recombinant plasmid pET-32a-VP2 double digestion product.图2 重组质粒的双酶切鉴定Fig.2 Identification of recombinant plasmids by double digestion

M为DL10000 DNA Marker;A:1为NS1蛋白基因片段的扩增,2为阴性对照;B:1~5为VP2蛋白基因片段的扩增,6为阴性对照。M was DL10000 DNA Marker;A:1 was amplification of NS1 protein gene fragment,2 was negative control;B:1-5 were amplifications of VP2 protein gene fragment,6 was negative control.图1 S1和VP2蛋白基因的PCR扩增Fig.1 PCR amplification of NS1 and VP2 protein genes
2.4 包涵体蛋白的纯化与复性
将重组菌pET-32a-VP2/thansetta(DE3)和pET-32a-NS1/thansetta(DE3)分别在最佳诱导条件下诱导表达,根据蛋白纯化试剂盒说明纯化后,经SDS-PAGE鉴定均得到与预期蛋白大小相符的单一条带(图6),表明蛋白纯化成功,使用透析复性方法逐步降低蛋白复性缓冲液中尿素浓度进行复性,复性后的蛋白在无尿素的PBS缓冲液中未出现沉淀,表明复性效果较好,通过蛋白浓度测定得到VP2和NS1蛋白浓度分别为0.558和0.439 mg/mL。
2.5 多克隆抗体的效价测定
通过间接ELISA方法测定VP2和NS1蛋白的多克隆抗体效价,以包被空载蛋白作为对照组,以P/N≥2.1时的最大稀释度为该2种多克隆抗体的效价。ELISA分析结果(图7)显示,VP2和NS1蛋白的多克隆抗体效价均为1∶10 240 000,说明VP2和NS1蛋白具有良好的免疫原性。

图7 重组蛋白多克隆抗体的效价测定Fig.7 Polyclonal antibody titer determination of recombinant proteins
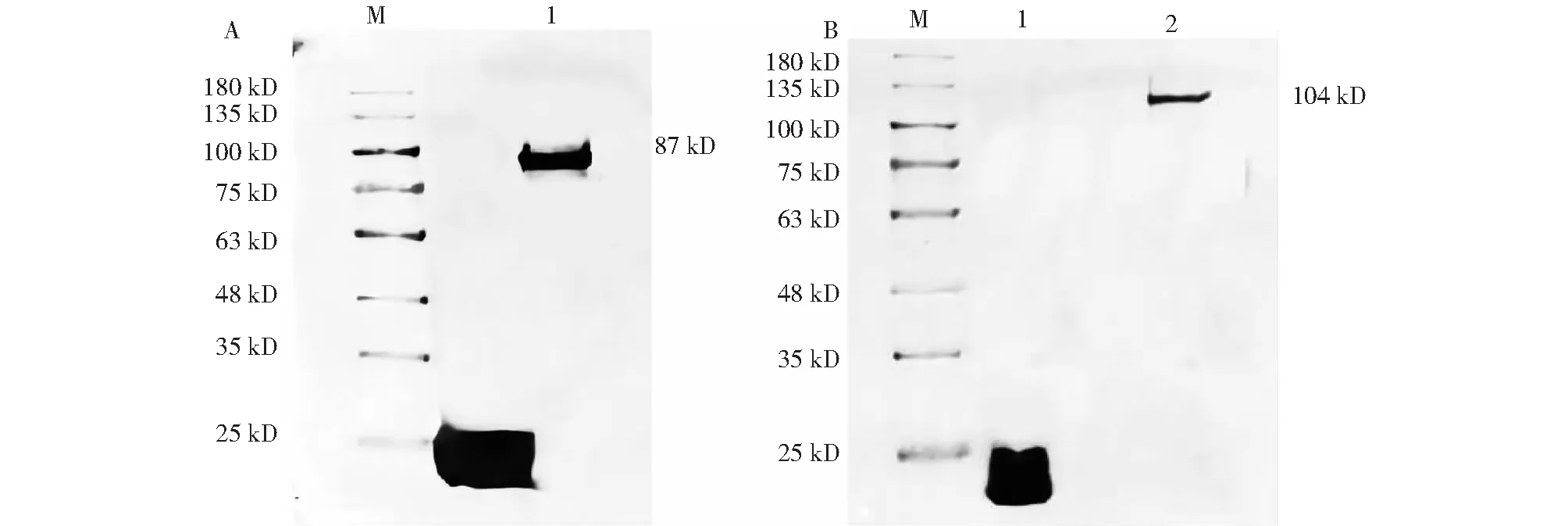
M为180 kD蛋白Marker;1为pET-32a的诱导产物;A:2为重组VP2蛋白的诱导产物;B:2为重组NS1蛋白的诱导产物。M was 180 kD protein Marker;1 was induction product of pET-32a;A:2 was inducible product of recombinant VP2 protein;B:2 was induction product of recombinant NS1 protein.图8 重组蛋白的Western-blotting结果Fig.8 Western-blotting result of recombinant protein
2.6 重组 VP2和NS1蛋白及多克隆抗体的Western-blotting鉴定
将纯化后的VP2和NS1蛋白进行Western-blotting鉴定,以抗His标签抗体为一抗,结果(图8)表明,VP2和NS1蛋白均能与抗His标签抗体特异性结合,说明目的蛋白表达正确。以鸡多克隆抗体为一抗分别进行鉴定,结果(图9)表明,VP2和NS1蛋白均能与多克隆抗体特异性结合。
2.7 多克隆抗体的IFA鉴定
使用制备的VP2和NS1多克隆抗体进行间接免疫荧光检测,结果(图10)表明,在感染ChPV的LMH细胞中均观察到特异的绿色荧光信号,而加入鸡阴性血清的对照中未见荧光信号,说明VP2和NS1多克隆抗体均能与ChPV蛋白特异性结合。
3 讨 论
ChPV是引起鸡肠道疾病的重要病原体之一,临床表现与ThPV相似,在发育迟缓综合征(RSS)中发挥着重要作用[15]。RSS主要发生于1周龄雏鸡,临床表现为羽毛蓬乱、泄殖腔粘连和个体矮小,且表现为腹泻并伴随免疫障碍、发育迟缓和死亡率上升,对养禽业危害严重[8]。已有研究表明,肉鸡感染ChPV后,通过实时荧光定量(qPCR)方法鉴定在其回肠、空肠和十二指肠均存在较高滴度的病毒,显微镜下能观察到十二指肠绒毛变性及肠隐窝肿胀[14]。ChPV由于常与其他肠道病毒共同感染,病理特征不明显,且在健康集群中也能检测到ChPV,导致该病的净化存在困难,因此迫切需要建立实验室检测方法。本研究进行ChPV的NS1和VP2蛋白原核表达,通过制备单克隆抗体和建立ELISA方法,可为ChPV防控提供基于血清学的实验室检测手段。
由于尚未发现合适的细胞系用于增殖培养ChPV,因此对于ChPV生物学特性及致病机制的了解甚少,迄今也未研制出商品化的ChPV/ThPV疫苗,针对商品鸡群中ChPV/ThPV的诊断和防控主要通过PCR检测方法进行,如Carratalà等[16]对NS1和VP1/VP2蛋白基因序列的巢式PCR检测方法和针对VP1/VP2蛋白基因序列建立的定量PCR检测方法进行了优化,Finkler等[17]根据NS1蛋白基因保守序列建立了一种基于SYBR®Green的实时快速qPCR检测ChPV的相对定量方法,广西兽医生物技术重点实验室建立了针对ChPV NS1蛋白基因序列的二温式PCR、半巢式PCR和荧光LAMP快速检测方法[18-20],同时还建立了分别与禽肾炎病毒、新城疫病毒、禽流感病毒和弧长孤病毒的进行多重PCR检测方法[21-24],均可为防控ChPV提供技术支持,但目前基于ChPV血清学诊断方法的研究较少。Strother和Zsak[25]通过杆状病毒表达系统成功表达NS1和VP2蛋白,并建立了间接ELISA方法,Spatz等[13]将VP2蛋白基因序列进行密码子优化后,成功用CEF细胞进行真核表达同样建立了间接ELISA方法,但Spatz等[13]、Strother和Zsak[25]的ELISA方法均未商品化应用。本研究采用原核表达方法成功表达ChPV的VP2和NS1蛋白,原核表达相较于真核表达及杆状病毒表达系统成本更低,表达蛋白所需周期更短,能在短时间内获得大量目的蛋白,且同样可用于血清学检测,可在实际生产中节约大量成本。
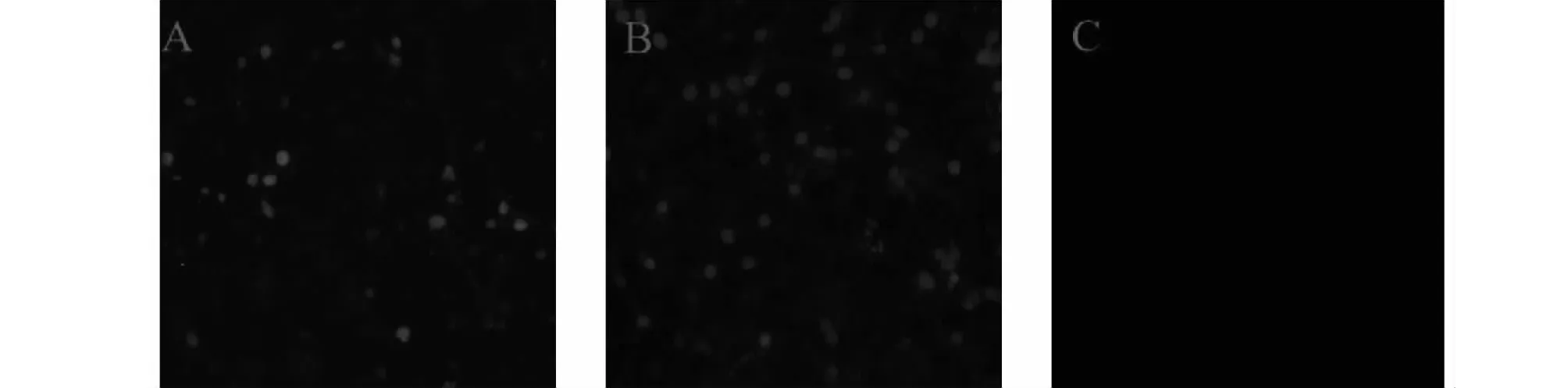
A:为NS1蛋白多克隆抗体;B:为VP2蛋白多克隆抗体;C:为阴性血清。A was polyclonal antibody to NS1 protein;B was polyclonal antibody to VP2 protein;C was negative serum.图10 多克隆抗体的IFA鉴定(10×)Fig.10 IFA identification of polyclonal antibodies(10×)

M为180 kD蛋白Marker;1为pET-32a的诱导产物;A:2为重组VP2蛋白的诱导产物;B:2为重组NS1蛋白的诱导产物。M was 180 kD protein Marker;1 was induction product of pET-32a;A:2 was inducible product of recombinant VP2 protein;B:2 was induction product of recombinant NS1 protein.图9 多克隆抗体的Western-blotting结果Fig.9 Western-blotting results of polyclonal antibodies
本研究成功表达VP2和NS1蛋白,通过以His标签抗体为一抗进行Western-blotting鉴定,结果表明VP2和NS1蛋白的表达和纯化效果较好;通过对SPF鸡免疫成功制备了VP2和NS1蛋白的多克隆抗体,间接ELISA方法测定结果显示其效价较高,Western-blotting鉴定结果显示VP2和NS1蛋白具有较好的免疫原性,IFA鉴定结果显示VP2和NS1蛋白的多克隆抗体均具有良好特异性。因此,成功表达ChPV的NS1和VP2蛋白可作为后续制备单克隆抗体及建立血清学快速诊断方法的基础材料。
4 结 论
成功表达ChPV的NS1和VP2蛋白可作为深入探究ChPV蛋白结构功能的物质基础,为后续单克隆抗体的制备提供基础材料;制备的NS1和VP2蛋白多克隆抗体效价高,有望应用于临床抗原的检测及ELISA方法的建立。

