一品红对重金属锌胁迫的耐受性及其富集能力
磨春丽,谷战英,黄 鹏,高恩婷,曾庆扬
(中南林业科技大学经济林培育与保护教育部重点实验室,长沙 410004)
【研究意义】随着采矿、冶炼、汽车尾气排放、农药化肥滥用等人类活动的增加,出现了一系列重金属污染问题,导致了生态环境恶化、农作物品质受损等,并通过食物链对人们的生命健康造成威胁[1-2]。植物修复因其价格低廉、环境友好、效果好的优势[3],在治理污染土壤方面具有极大的商业价值。一品红(EuphorbiapulcherrimaWilld.)又称“圣诞红”,属大戟科(Euphorbiaceae)大戟属(Euphorbia)灌木,其苞片会转色,是极具观赏价值的盆花植物[4],且生长快,生物量高,可作为植物修复的候选材料。【前人研究进展】锌(Zn)对于生命体具有双重性,它既是植物必需的微量元素,能够促进植物各项重要生命活动所需酶的合成;浓度过高时又是一种潜在的有毒环境污染物,会破坏叶绿体结构、抑制光合作用,从而影响植物的正常生长[5-6]。然而有些植物可以在其地上组织中积累超过10 000 mg/kg(干重)的Zn,且能正常生长,被称为Zn的超富集植物[7]。田间调查表明,野生群体的圆锥南芥(Arabispaniculata)对Zn具有高度耐受性,其地上部分平均可积累20 800 mg/kg(干重)的Zn[8]。遏蓝菜(Thiaspicaerulescens)可以在地上部分超积累高达51 600 mg/kg(干重)的Zn,而且没有表现出毒害或生长减慢的现象[9]。近年来,关于观赏植物应用于植物修复的研究日益增多[10],在废弃污染场地上的应用实例也取得较大成效[11],为重金属污染治理中筛选合适的植物开辟了新思路。【本研究切入点】植物修复的首要条件是筛选出适宜当地并能有效清除污染物的植物,其效率受到生物量和重金属富集含量的综合影响。这些超富集植物大多具有生物量低、生长缓慢的特点,且仅在特定的野外环境下表现出超富集性,限制了其修复效率和适用范围[12-13]。有研究报道称一品红在复合污染下对多种重金属(Zn、Pb、Cu等)具有超量富集的潜力[14]。【拟解决的关键问题】本试验通过设置不同水平锌处理,以不外施锌为对照,进一步探究Zn对一品红生长发育的影响,比较在不同锌浓度梯度下一品红的吸收和转运效率,从而进一步论证其作为植物修复候选对象的可能性。
1 材料与方法
1.1 试验材料
供试基质为泥炭土,pH 4.81,相对含水量27.5%,电导率114.75 μS/cm。供试植物材料为一品红扦插苗,品种为‘Sonora red’。泥炭土和一品红母株均购自长沙市红星花卉市场,供试锌源为硝酸锌[Zn(NO3)2·6H2O]分析纯。
1.2 试验设计
本试验共设置6个处理,每个处理4株,4次重复,采用不完全随机区组排列。根据《农用地土壤污染风险管控标准》(GB 15618—2018)将Zn污染浓度分别设置为200 mg/kg(T1,风险筛选值)、300 mg/kg(T2,筛选值的1.5倍)、500 mg/kg(T3,筛选值的2.5倍)、800 mg/kg(T4,筛选值的4倍)、1000 mg/kg(T5,筛选值的5倍),以不施入Zn的处理组(CK)为对照,均以纯Zn和风干土计。其中CK表示无污染,T1表示轻度污染,T2~T3为中度污染,T4~T5为重度污染。Zn按照各处理设置的浓度,以硝酸锌水溶液的形式于2021年5月15日一次性施入泥炭土中,充分搅拌均匀后装入花盆,避雨静置50 d后再移栽一品红扦插苗。花盆规格为:上口径19.5 cm,下口径15.4 cm,高19.5 cm。试验于2021年7月3日在中南林业科技大学林学院科研基地进行,选取已培养3个月、长势一致的一品红扦插苗移栽至花盆中。待缓苗期过后,根据试验时间测定一品红的生长性状和生理生化指标。
1.3 指标测定
1.3.1 生长指标 试验期间,每隔14 d分别使用卷尺和电子游标卡尺测定一品红的株高、地径。于试验开始的第112天测定叶片数并采集植物样品。依次用清水和超纯水将一品红清洗干净后,分为根、茎、叶3部分,使用电子分析天平(感量为0.1 mg)称量其鲜重,待其他指标测定完毕后放入60 ℃烘箱中烘干至恒重,取出称量其干重。使用爱普生EPSON Expression 11000XL扫描仪扫描一品红根部,使用Winrhizo pro软件分析其根长、总投影面积、根表面积、平均直径、根体积和根尖数等数据。使用Image J 1.52V软件测定叶面积。
1.3.2 生理生化指标 一品红的叶绿素含量采用丙酮-乙醇(1∶1)溶液提取,使用紫外分光光度计(UV-7504c)在665和645 nm波长下进行测定。叶片丙二醛(MDA)含量采用硫代巴比妥酸法[15]进行测定。叶片相对电导率采用浸泡法[16]和电导率仪(雷磁DDS-307A型)进行测定。一品红根、茎、叶各部位的Zn含量采用湿式消解法[17]进行测定,使用微波消解仪(MARS6型)进行消解,同时设置3组空白对照。消解液中Zn浓度使用原子吸收分光光度计(TAS-990型)在213.9 nm波长下测定。以上指标测定每个处理至少3次重复。
1.4 数据处理
本试验数据均在Excel 2016中整理,在SPSS 23软件中进行单因素方差分析,采用Tukey检验方法进行显著性比较(P<0.05)。表格中的数据为平均值±标准误差,使用Origin 2021绘图。耐性系数(TI)和转运系数(TF)的计算公式如下。
TI=M处理组/M对照组
TF=(C茎+C叶)/C根
式中,M处理组、M对照组分别表示处理组、对照组中的植株全株鲜重;C根、C茎和C叶分别表示根、茎、叶中的Zn含量。
2 结果与分析
2.1 Zn对一品红生长性状指标的影响
2.1.1 Zn对一品红株高、地径增量的影响 从图1-a可以看出,一品红的株高增量在重度污染组(800和1000 mg/kg)中,仅在定植后第42天有所上升,随后持续下降;其他处理组在整体上呈双峰曲线,峰值分别出现在定植后第42天和第70天时,此后随着Zn胁迫时长的增加,株高增量快速减小,均在第98天时达到最低点。单因素方差结果显示,各处理的株高增量在定植后第28、70和84天时具有统计学意义,其他时点无显著性差异(P<0.05)。在第28天时,对照组的株高增量最大,为4.38 cm,显著高于T1和T5处理组。
除对照组外,其他处理的地径增长高峰期出现在定植后第98天(图1-b)。地径增量仅在定植后第70天和第84天时具有显著性差异(P<0.05),且对照组的值最高,分别为0.48、0.68 mm;T1处理组(200 mg/kg)的值最低且与对照组具有显著性差异,依次相当于对照组的29.20%、34.93%。第84天时T4处理组(800 mg/kg)的地径增量也显著低于对照组,为对照组的39.64%。
2.1.2 Zn对一品红根部、地上部分干鲜重的影响 由图2可知,一品红的根鲜重仅在T1和T4处理组与对照组具有显著性差异,分别为对照组的48.76%、49.72%。土壤中不同浓度的Zn对一品红根干重不具有显著性差异(P>0.05)。地上部分鲜重随土壤中Zn施入量的增加,呈先上升后下降的趋势,除T3处理组外,其他处理组均显著低于对照组,但组间无显著性差异。Zn对T1处理组一品红的地上部分鲜重抑制作用最强,较对照组降低44.38%。地上部分干重的变化趋势及处理间的显著性差异与其鲜重相同。
2.1.3 Zn对一品红根系形态的影响 由表1 可知,一品红在不同Zn处理下的根系指标的值大多低于对照组,但没有显著性差异(P>0.05),仅根体积显著低于对照组,相当于对照组的36.48%~54.49%。
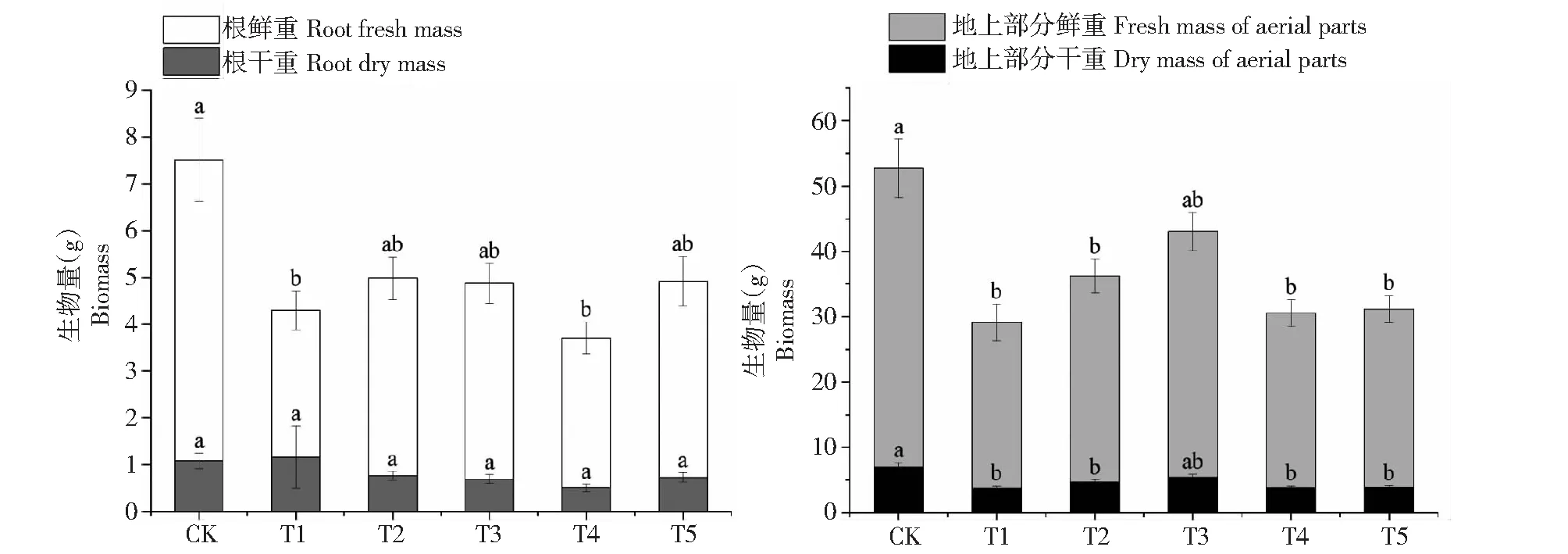
同一个指标中的不同字母表示在P<0.05水平下差异显著,下同。Different letters in the same indicator indicate significant differences at P<0.05 level,the same as below.图2 不同Zn处理下一品红的根部、地上部分干鲜重Fig.2 Fresh and dry mass of poinsettia roots and aerial parts under different zinc treatments
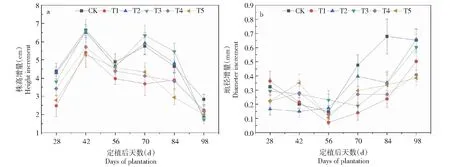
CK、T1~T5分别表示0、200、300、500、800、1000 mg/kg,误差棒为标准误差,下同。CK,T1-T5 represent 0,200,300,500,800 and 1000 mg/kg,respectively,and the error bar is standard error,the same as below.图1 不同Zn处理下一品红株高、地径的增量变化Fig.1 Changes of the increments of poinsettia diameter and height in different zinc treatments
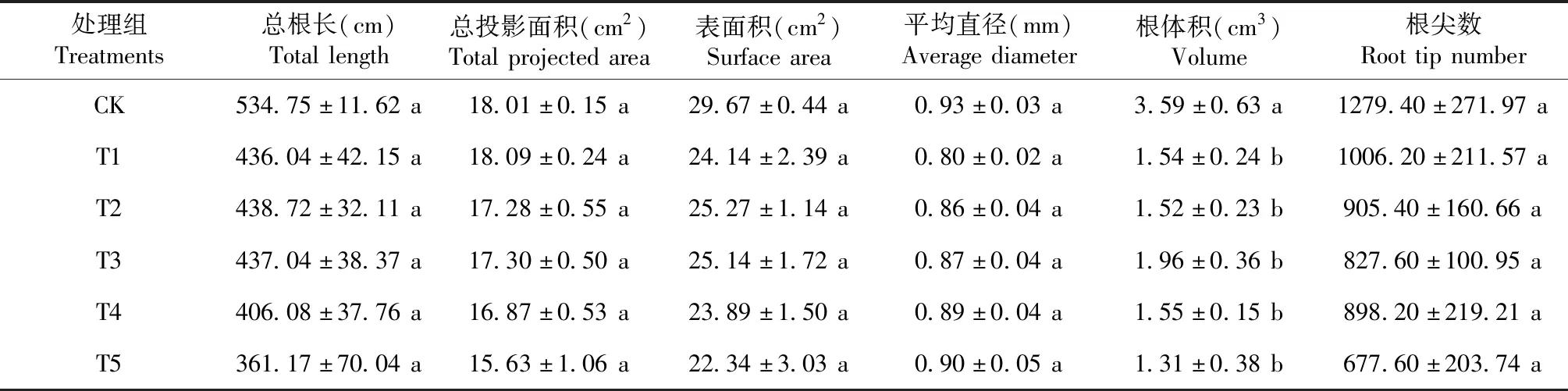
表1 不同Zn处理对一品红根系形态指标的影响Table 1 Effects of different zinc treatments on root-morphology indexes of poinsettia
2.2 Zn对一品红叶片数、叶面积和叶绿素含量的影响
由表2可知,对照组的叶片数最大,T1、T2和T5处理组的叶片数显著低于对照组,仅为对照组的63%~65%。T3和T4处理组的叶片数较高,但与对照组没有显著性差异。叶面积的范围是32.28~51.89 cm2,重度污染组(T4、T5)的叶面积显著低于除T3外的其他处理组(P<0.05),最大、最小值分别出现在对照组和T5处理组中。
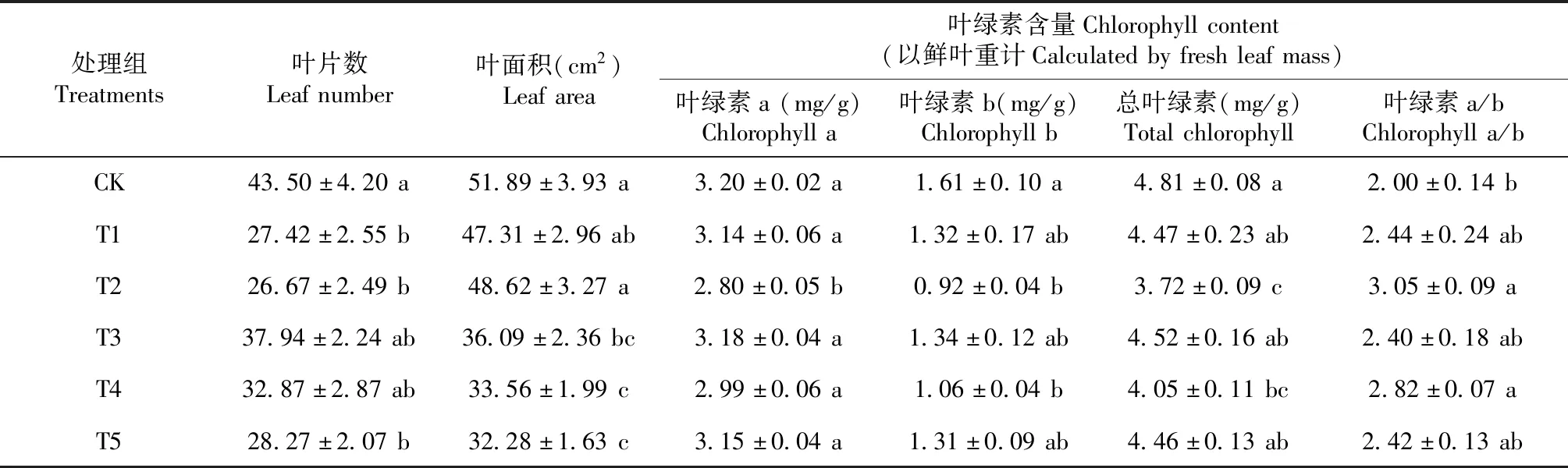
表2 不同Zn处理水平对一品红叶片数、叶面积和叶绿素含量的影响Table 2 Effects of different zinc levels on leaf number,leaf area,and chlorophyll content of poinsettia
一品红叶绿素a、b和总叶绿素含量在各处理间的变化趋势相似,均低于对照组,且方差结果显示具有显著性差异(P<0.05),说明Zn对其产生了抑制作用。其中,Zn对T2处理组的叶绿素含量抑制作用最强,表现为数值最低,较对照组分别显著降低12.52%、42.92%和22.70%。此外,叶绿素b和总叶绿素含量在T4处理组时的值也显著低于对照组,与T2处理组无显著性差异。叶绿素a/b的范围是2.00~3.05,对照组的值最小,T2处理组的值最大。T2和T4处理组的叶绿素a/b与对照组差异显著,但二者之间无显著性差异。
2.3 Zn对一品红耐性系数、MDA含量、相对电导率的影响
由表3可知,所有处理组的耐性系数均大于50%。耐性系数在T3处理组时达到最高,为80.10%,显著高于T1和T4处理组,可见Zn对其有一定的“低促高抑”现象。

表3 不同Zn处理对一品红抗逆性生化指标的影响Table 3 Effects on the stress resistance biochemical indexes of poinsettia under different zinc treatments
除对照组外,一品红MDA含量随土壤中Zn浓度的升高整体呈梯度上升趋势。MDA含量在T4处理组时最大,为90.09 nmol/g。对照组和重度污染组的MDA含量显著高于T1(43.79 nmol/g)和T2(45.81 nmol/g)处理组(P<0.05),说明土壤Zn浓度的增加造成一品红体内MDA的积累。
对照组、T1和T5处理组中的相对电导率较高,而其他处理组的值相差不大。方差分析表明,一品红叶片的相对电导率在各处理组间无显著性差异(P<0.05)。
2.4 一品红植株对Zn的富集和转运特征
随着土壤中Zn元素浓度增加,一品红体内不同部位以及全株的Zn含量也显著增加(P<0.05)。从图3可以看出,不同Zn处理下,一品红体内不同部位中的Zn含量变化不一,但以根部的最高。根部Zn含量占全株的37.66%~51.04%,且与土壤Zn浓度呈线性正相关关系(相关线性方程为:y=104.1x-53.447,R2=0.9803)。叶和茎中的Zn含量占全株比例分别为27.20%~39.38%、17.56%~34.75%。一品红茎对Zn的吸收效果最为明显,表现在较前一处理,茎中Zn含量的增幅保持在44%以上。根、茎、叶中Zn含量在各处理间的最大增幅及其所在处理组分别为192.26%(T1)、124.31%(T3)和88.01%(T1)。
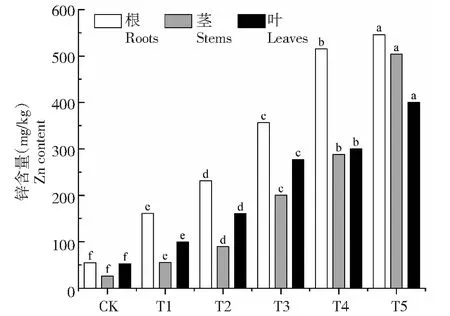
图3 不同Zn处理下一品红根、茎、叶的锌含量Fig.3 Zn content of poinsettia in roots,stems,leaves under different zinc treatments
由图4可知,培养112 d后,T4处理组中一品红全株Zn含量超过1000 mg/kg,最大值出现在T5处理组中,为1450.57 mg/kg。一品红从根部到地上部分的转运系数在各处理间均具有显著性差异(P<0.05)。转运系数随土壤Zn浓度的增加呈现“W”型变化趋势,在T5处理组时达到最大值,为1.66。T1处理组的转运系数最低,为0.96,接近1,除此之外,其他处理组的转运系数均大于1。
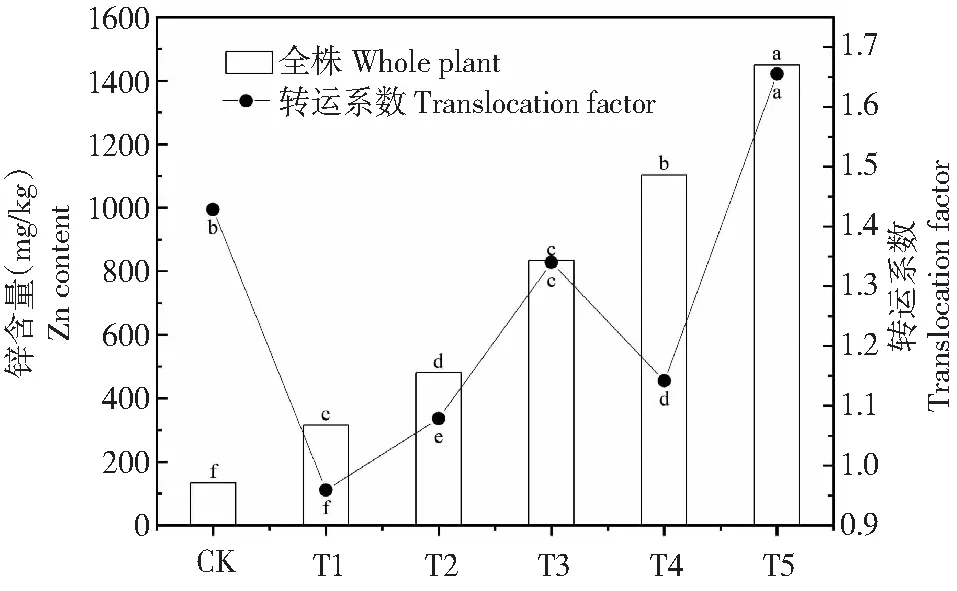
图4 不同Zn处理一品红全株的锌含量和转运系数Fig.4 Zn content in whole plant and the translocation factor (TF) of poinsettia under different zinc treatments
3 讨 论
3.1 Zn对一品红生长发育的影响
本研究中一品红的株高前期生长较快,培养70 d后进入生长缓慢期,在重度锌污染中受到抑制,这与中华金叶榆(Ulmuspumila)和银水牛果(Shepherdiaargentea)[18]的研究结果一致。然而,轻度污染组(T1,200 mg/kg)Zn对一品红株高的抑制作用更为强烈,同样的现象也出现在地径增量的变化中,从而影响生物量。这可能是因为一品红对Zn的需求量大,Zn缺乏同样导致植物生长减缓、产量和酶活性降低[19]。一品红各处理的根体积显著低于对照组,与黄瓜(Cucumussativus)[20]的研究类似,根系生长受到Zn胁迫后,减缓了水分和矿质元素的输送,从而限制地上部的生长。
Zn中毒的症状在叶片上的表现为嫩叶卷曲、成熟叶片坏死、叶片褪绿[21]。不同Zn处理下未观察到一品红叶片明显的毒害现象,但叶面积和叶片数都受到了不同程度的抑制,可能是由于Zn抑制了细胞分裂或伸长[22]。叶绿素参与植物的光合作用,在光能的吸收、传递和转化过程中起着至关重要的作用[23]。土壤Zn浓度为300和800 mg/kg条件下,一品红叶绿素a、b和总叶绿素含量受到抑制,叶绿素a/b的值均显著高于对照组,说明叶绿素b比叶绿素a对Zn胁迫更为敏感,容易受到破坏。叶绿素含量降低的原因可能是有毒浓度的Zn导致叶绿体结构紊乱,表现在叶绿体膜解体、类囊体和叶绿体基粒减少[24],或者通过抑制参与叶绿素生物合成的酶、提高叶绿素降解酶的活性,打破了叶绿素在植株内的平衡[25]。
3.2 Zn对一品红抗逆性的影响
耐性系数反映处理组与对照组之间的差距值,其值超过50%表示植物对该限制因子具有耐受性[26]。本研究中一品红的耐性系数均达到了耐受标准,且Zn对其有一定的“低促高抑”作用,表明土壤中适当的Zn浓度能提高一品红的抗逆性。Goodarzi等[27]对红花(Carthamustinctorius)幼苗的研究发现达到毒性水平的Zn会刺激细胞膜脂质过氧化,并影响膜的完整性和通透性。本试验中,在高Zn浓度下一品红的丙二醛(MDA)含量较高,表明此时细胞膜受损较严重,激发了一品红的保护系统。一品红的相对电导率数值均较低,但在组间的差异不显著(P>0.05),说明土壤Zn浓度对一品红的细胞膜外渗的影响不大。
3.3 一品红对Zn的富集和转运能力
不同污染程度下植物对重金属的积累和转移能力不一定相同,通过评估对比可为其应用于相应污染程度的场地提供指导。早期的研究将地上部分对Zn的积累超过10 000 mg/kg的植物定义为超富集植物[7],一些学者认为该标准值设为3000 mg/kg更合理[28]。本研究中一品红地上部分的Zn含量最多为904.27 mg/kg,未达到超富集植物的标准。然而,通常认为,植物体内的Zn含量超过400 mg/kg(干重)时,将会对植物产生毒性[29]。本研究中土壤Zn浓度为300 mg/kg时,一品红的Zn含量已高于400 mg/kg,且在所有梯度处理中均未观察到明显的毒性症状。因此,可以认为一品红对Zn具有较强的耐受能力,是Zn的富集植物。
Zn通常积累在根中[30],而一旦被输送到地上部分,Zn优先被储存在叶片中,作为酶促因子参与植物的呼吸作用[6]。与其他植物组织相比,一品红的根部Zn含量最高,叶片次之,茎中最少,与Xiao等[14]的研究结果一致,这可能是一品红为维持叶片、茎部较低的Zn浓度而采取的一种耐性机制。然而,一品红的TF>1,对Zn具有较强的转运能力,因此Zn更多地集中在地上部分。植物更有效地将金属从根部转移到地上器官可以减少这些污染物对根系生理和生化造成的破坏性影响[31],同时也是植物提取技术的一个重要因素。此外,不同Zn浓度处理下,一品红地上部分的生物量也远高于根部,用于植物提取效率会很高。
4 结 论
较高浓度的Zn抑制一品红的株高、地径、生物量、根体积、叶片数、叶面积和叶绿素含量,没有出现明显的视觉毒害特征。一品红对Zn的抗逆性较强,耐性系数在组间呈“低促高抑”现象,丙二醛(MDA)含量在高浓度Zn处理下较高,相对电导率的值无显著变化。土壤Zn浓度与一品红不同部位的积累量呈正相关关系,不同处理间的TF大多大于1,具有较强的Zn富集和转运能力。因此,一品红可用于修复Zn污染土壤,尤其在植物提取方面发挥作用。同时,一品红作为观赏植物,还可以在漫长修复过程中美化污染场地的环境,或者做成切花产品进行售卖,提高生态、经济双重效益。

