应用双分子荧光互补技术研究靶标肽与互补肽之间的互作关系
梁洪宇,刘成倩,高 骏,周佳明,司伏生,易建中
(1.上海市农业科学院畜牧兽医研究所,上海 201106;2.上海市金山区动物疫病预防控制中心,上海 201500)
【研究意义】猪流行性腹泻病毒 (PEDV)属于冠状病毒科(Alphacoronavirus),是一种线性无节段、单股正链的RNA病毒,是引起猪流行性腹泻(PED)的主要病原,临床上对养猪生产造成严重威胁。在病毒基因组编码的众多蛋白中S蛋白包含诱导宿主产生中和抗体的主要抗原表位,因此,S蛋白在PED基因工程疫苗的研究中倍受关注[1-3]。研究表明多肽可用于多种病原检测[4],在临床上作为一种诊断方法可以进行病原监测。鉴于S蛋白在PEDV检测和疫苗研发中的重要作用以及多肽在病原监测中的应用,针对S蛋白设计多肽来检测PEDV的流行具有重要理论和现实意义。【前人研究进展】多肽间的相互作用是多肽用于抗原检测的基础。目前有多种方法可研究蛋白质间的相互作用,其中能够用来研究活细胞内蛋白质之间相互作用的方法是Hu等[5-6]在2002年开发的双分子荧光互补(Bimolecular fluorescent complimentary,BiFC)技术。彭也等[7]基于BiFC技术验证IMM-H004对CKLF1/CCR4结合的影响;杨迷等[8]利用BiFC技术对拟南芥的ROP2与GGB蛋白进行了互作分析。BiFC技术也广泛用于研究病毒与宿主之间的相互作用,研究病毒蛋白之间及其与寄主蛋白之间的互作关系,构建互作网络,对于研究病毒蛋白的功能和致病机制等具有非常重要的意义[9]。Hemerka等[10]利用BiFC系统研究了流感病毒聚合酶复合物PA与PB2亚基的互作,并详细分析了PA-PB2二元复合物的亚细胞定位与进核。BiFC技术也已被用于一些与人类病毒相关的研究,如哺乳动物细胞膜中Epstein Barr病毒潜伏膜蛋白1的表征、HIV病毒Vor分子之间的互作[11]等。近年来,多肽技术在疾病的诊断方面取得长足进展。科学家们已经研究出放射性标记的肽作为癌症诊断的有效试剂,Farahani等[12]对放射性肽进行了修饰,提高了用于肿瘤诊断和治疗的多肽的特异性和敏感性。张蕾等[13]研究根据ASFV的p30、p54和p72 3种重要抗原设计3条合成肽,以此为包被抗原建立了 ASFV间接 ELISA 抗体检测方法,并验证其敏感性、特异性、稳定性。宁静等[14]发现RV1737多肽有成为潜伏结核诊断候选抗原潜力。目前,与靶标蛋白相互作用的多肽或蛋白质主要是利用噬菌体展示、酵母双杂交或免疫动物产生特异性抗体等方法来筛选获得,存在筛选周期长、工作量大等缺点,且筛选的是线性结构位点,对天然蛋白质结合力较弱[15-16]。【本研究切入点】PEDV的增殖依赖于其自身基因组编码蛋白的表达,封闭PEDV S蛋白上的受体结合位点,可阻止病毒侵入细胞。设想依据S蛋白受体结合位点肽段的二级及空间结构,创新性地设计与S蛋白受体结合位点相互作用的多肽,再结合当前在活细胞内研究多肽间互作的BiFC技术来探索2个肽段间互作的可能性以及两者结合后形成的复合物在细胞内的定位情况,为进一步利用该肽段进行临床检测奠定前期基础。【拟解决的关键问题】本研究依据S蛋白受体结合位点肽段的特征以及密码子的偏好性首先设计出编码靶标肽(DEFFLIDEDYFD)的氨基酸序列,设计理论上与靶标肽互补且可能与其发生相互作用的互补肽(KKFFLLRKYNWK),通过构建互补肽和靶标肽的BiFC真核表达载体,研究互补肽和靶标肽在活细胞内的相互作用情况以及形成的BiFC复合物在活细胞内的亚细胞定位。因此,明确2个肽段间的互作关系以及两者结合后形成复合物在细胞内的定位是本研究拟解决的2个关键问题。
1 材料与方法
1.1 材料
1.1.1 细胞、培养基及血清 非洲绿猴肾细胞(Vero)由实验室保存;胎牛血清(Fetal bovine serum,FBS),Dulbecco’s Modified Eagle’s medium(DMEM)细胞培养液为美国HyClone公司产品,0.25%胰蛋白酶-EDTA购自Invitrogen公司。
1.1.2 DNA合成、试剂及BiFC系统载体 编码靶标肽及互补肽的引物由上海捷瑞有限公司合成;Venus双分子荧光互补载体载体pBiFC-VC155和pBiFC-VN173以及阳性对照载体pBiFC-bFos-VC155与pBiFC-bJun-VN173购自Addgene公司;质粒抽提试剂盒、DNA片段凝胶回收试剂盒、PCR产物回收试剂盒为Axygen公司产品;NotI、SalI、EcoR I、XhoI等限制性内切酶为NEB公司产品;大肠杆菌感受态细胞DH5α为本实验室制备;Lipofectamine 3000转染试剂和T4 DNA连接酶购自Thermo Scientific公司。兔抗Calnexin抗体-ER Marker(ab22595)、鼠抗GM130抗体-Golgi Marker(ab169276)购自Abcam公司;Alexa Flour 555标记驴抗小鼠IgG、4′,6-diamidino-2-phenylindole(DAPI)购自碧云天生物技术有限公司,Alexa Flour 594标记羊抗兔IgG购自Thermo Scientific公司。
1.1.3 主要仪器与设备 核酸电泳仪和凝胶成像分析仪购自上海天能科技有限公司;二氧化碳培养箱和EVOS M7000智能全自动活细胞荧光成像系统购自Thermo Fisher公司;荧光正置显微镜购自卡尔ZEISS公司;热循环PCR仪为伯乐公司产品。
1.2 方法
1.2.1 靶标肽与互补肽的设计 依据PEDV S蛋白受体结合位点肽段的氨基酸组成、所带电荷种类、形成分子间氢键的能力、极性强弱、疏水性能、侧链基团的大小和结构等理化条件设计出编码靶标肽:天冬氨酸-谷氨酸-苯丙氨酸-苯丙氨酸-亮氨酸-异亮氨酸-天冬氨酸-谷氨酸-天冬氨酸-酪氨酸-苯丙氨酸-天冬氨酸(Asp-Glu-Phe-Phe-Leu-Ile-Asp-Glu-Asp-Tyr-Phe-Asp)的核苷酸序列,根据靶标肽氨基酸序列设计理论上与靶标肽互补的、可能与靶标肽发生相互作用互补肽:赖氨酸-赖氨酸-苯丙氨酸-苯丙氨酸-亮氨酸-亮氨酸-精氨酸-赖氨酸-酪氨酸-天冬氨酸-色氨酸-赖氨酸(Lys-Lys-Phe-Phe-Leu-Leu-Arg-Lys-Tyr-Asn-Trp-Lys)对应的核苷酸片段,将设计好的2条多肽按照偏爱密码子转换成核苷酸序列(表1),靶标肽与互补肽均为12位氨基酸,36个碱基;并结合对载体序列的酶切位点分析分别在多肽对应核苷酸序列的5’和3’加上合适的酶切位点,经分析无误后送上海捷瑞生物工程有限公司进行合成。

表1 设计的多肽编码的核苷酸序列Table 1 The nucleotide sequence encoding the designed polypeptide
1.2.2 双分子荧光互补(BiFC)重组质粒的构建及鉴定 真核载体pBiFC-VC155和pBiFC-VN173进行改造(图1)。pBiFC-VC155用EcoRΙ/XhoΙ进行双酶切,pBiFC-VN173用NotΙ/SalΙ进行双酶切。上述反应体系分别在37 ℃孵育4 h后,用1%的琼脂糖凝胶电泳进行回收,随后将合成的核酸序列溶解后分别在10 μL体系经95 ℃变性10 min后自然冷却至室温进行退火处理,冷却产物分别与经双酶切处理的pBiFC-VC155、pBiFC-VN173载体在22 ℃下连接2 h,连接产物转化大肠杆菌感受态细胞DH5α并37 ℃培养过夜。挑取单菌落送上海铂尚生物技术有限公司进行测序验证,对测序验证无误的菌落提取质粒后进一步进行双酶切鉴定。

图1 pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽构建图谱Fig.1 Construction map of pBiFC-VC155-target peptide and pBiFC-VN173-complementary peptide
1.2.3 靶标肽与互补肽的性质及结构预测 使用瑞士生物信息学研究所开发的ProtScale(http://web.expasy.org/protscale/)程序对靶标肽与互补肽蛋白肽链的疏水性进行分析;使用在线工具SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.plpage=/NPSA/npsa_sopma.html)进行多肽二级结构的预测分析;使用SWISS-MODLE与PDBsumGenerate(http://www.ebi.ac.uk/thornton-srv/databases/pdbsum/Generate.html)程序对靶标肽与互补肽做建模分析[17-19]。
1.2.4 重组质粒制备 对经测序验证序列正确的克隆在37 ℃培养过夜,摇菌后按照Axygen质粒小提试剂盒说明书的操作步骤进行质粒提取并测定浓度,将质量合格的质粒-20 ℃冻存备用。
1.2.5 重组质粒转染及荧光观察 将Vero细胞接种于24孔细胞培养板,每空0.5×106个细胞。培养板放入细胞培养箱继续培养至70%~80%汇合度时即可进行转染试验。转染分组如下:①重组质粒pBiFC-VC155-靶标肽单转染组;②重组质粒pBiFC-VN173-互补肽单转染组;③pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽共转染组;④pBiFC-bFos-VC155与pBiFC-bJun-VN173共转染组;⑤pBiFC-VC155与pBiFC-VN173共转染组。具体转染方法参照Lipofectamine 3000脂质体说明书上的操作进行。转染后36 h用DAPI进行细胞核染色,随后在EVOS M7000智能全自动活细胞荧光成像系统下观察绿色荧光的形成情况。
1.2.6 间接免疫荧光研究靶标肽与互补肽的亚细胞定位 为进一步明确靶标肽与互补肽的亚细胞定位,对重组质粒pBiFC-VC155-靶标肽和pBiFC-VN173-互补肽参考上述转染方法共转染Vero细胞后进行间接免疫荧光试验,研究其在内质网和高尔基体内的定位情况。操作步骤参考实验室前期建立的方法进行[20]:细胞接种于爬片上转染36 h后用4%多聚甲醛室温固定15 min,然后用0.1%的Triton-X 100室温透化15 min,3%的山羊血清室温封闭1 h,随后用兔抗Calnexin细胞内质网标记蛋白抗体(1∶200)和鼠抗GM130细胞高尔基体标记蛋白抗体(1∶200)作为一抗进行双重染色,室温孵育60 min,PBS洗3次后用Alexa Flour 555标记驴抗小鼠IgG(1∶50)和Alexa Flour 594标记羊抗兔IgG(1∶50)作为二抗,室温避光孵育60 min后用DAPI进行细胞核染色,随后在正置显微镜下观察靶标肽和互补肽的定位情况。
1.2.7 荧光显微镜观察及拍照 转染后的细胞经DAPI进行细胞核染色后在正置显微镜上观察BiFC的形成情况以及靶标肽和互补肽在活细胞内的亚细胞定位,并拍照保存。
2 结果与分析
2.1 靶标肽与互补肽的性质与结构预测
2.1.1 亲/疏水性预测结果 蛋白的亲/疏水性主要取决于其分子表面的电荷量[21]。蛋白质折叠时能形成亲水表面和疏水内核,并于潜在跨膜区出现高疏水值区域[22]。为了初步查明本研究中所设计的多肽的性质,首先利用ProtScale程序对靶标肽与互补肽序列进行亲/疏水性预测。结果表明,靶标肽的最低分值-0.511位于第10位氨基酸,表明亲水性最强;最高分值0.544位于第13位氨基酸,说明疏水性最强(图2-A),整条多肽链亲水域高于疏水域;而互补肽链第14位氨基酸具有最低分值-0.844,亲水性最强;第8位氨基酸赖氨酸具有最高分值1.200,疏水性最强(图2-B)。
2.1.2 二级结构预测结果 二级结构预测结果表明,靶标肽结构多样,66.7%为延伸股,16.6%为无规则卷曲,8.3%为β转角,8.3%为α螺旋;互补肽66.7%为α螺旋,33.3%为无规则卷曲。与靶标肽相比,互补肽结构较为简单。
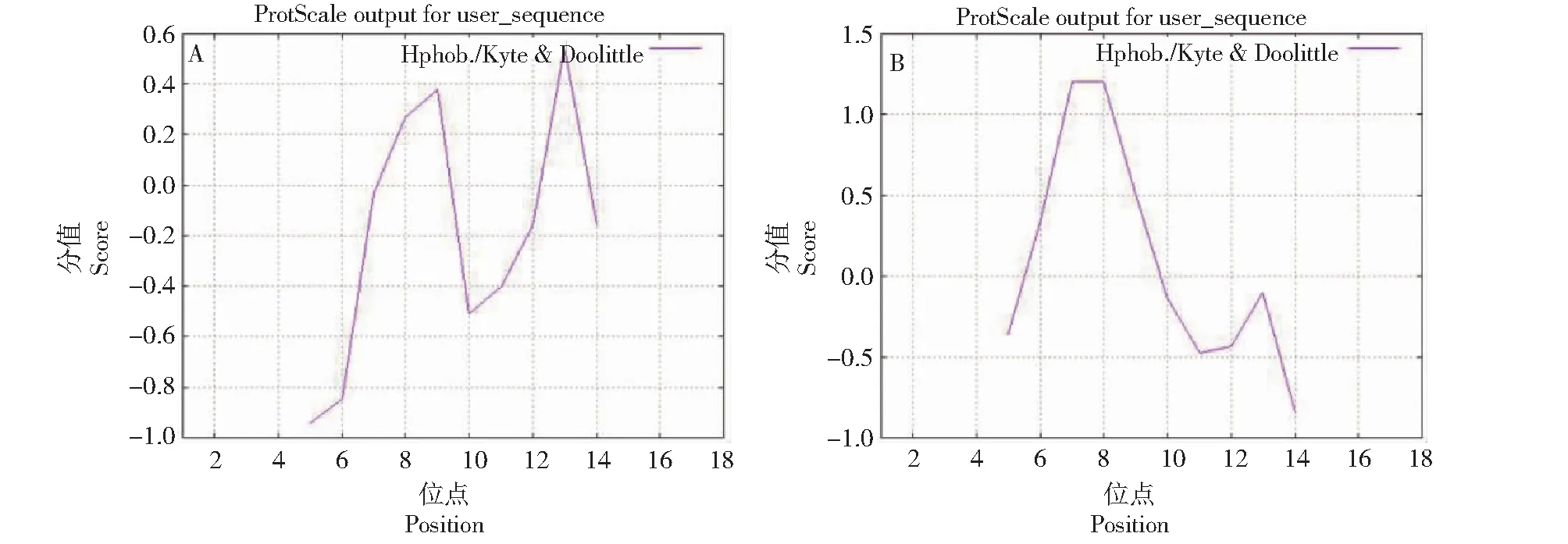
A.靶标肽亲/疏水性预测;B.互补肽亲/疏水性预测。A.Hydrophilicity/hydrophobicity prediction of target peptide;B.Hydrophilicity/hydrophobicity prediction of complementary peptide.图2 靶标肽与互补肽亲/疏水性预测Fig.2 Hydrophilicity/hydrophobicity prediction of target peptide and complementary peptide
2.1.3 三级结构预测结果 图3-A为靶标肽,红色标记从右向左依次为DEFFLIDEDYFD;同理,图3-B中红色标记从右向左依次为KKFFLLRKYNWK。结果显示靶标肽的三维空间结构存在较多延伸股,互补肽多为α螺旋,与二级结构预测结果基本一致。
2.2 酶切鉴定及测序结果
将构建好的载体提取质粒后进行酶切鉴定,电泳结果见图4。真核重组质粒命名为pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽。
重组载体pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽提取质粒后进一步进行测序,结果(图5)表明靶标肽与互补肽分别正确插入pBiFC-VC155与pBiFC-VN173载体中。
2.3 BiFC分析靶标肽与互补肽相互作用结果
按照上述实验分组进行细胞转染试验,转染36 h后利用EVOS M7000智能全自动活细胞荧光成像系统观察BiFC荧光信号表达情况。结果显示,在pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽共转染的细胞中出现BiFC荧光信号,而在pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽单独转染的细胞内均没有荧光出现(图6),证实互补肽与靶标肽在活细胞内存在相互作用。
2.4 BiFC复合物的亚细胞定位
为了进一步研究靶标肽与互补肽在活细胞内的亚细胞定位,把重组质粒pBiFC-VC155-靶标肽和pBiFC-VN173-互补肽共转染Vero细胞,用DAPI进行细胞核染色,并用内质网和高尔基体标记蛋白的抗体来对细胞内质网和高尔基体进行染色,最后用间接免疫荧光技术研究靶标肽和互补肽互作后形成的BiFC复合物在内质网和高尔基体内的定位情况。研究结果表明靶标肽和互补肽互作后形成的BiFC复合物位于细胞核内,而不在高尔基体和内质网内(图7)。
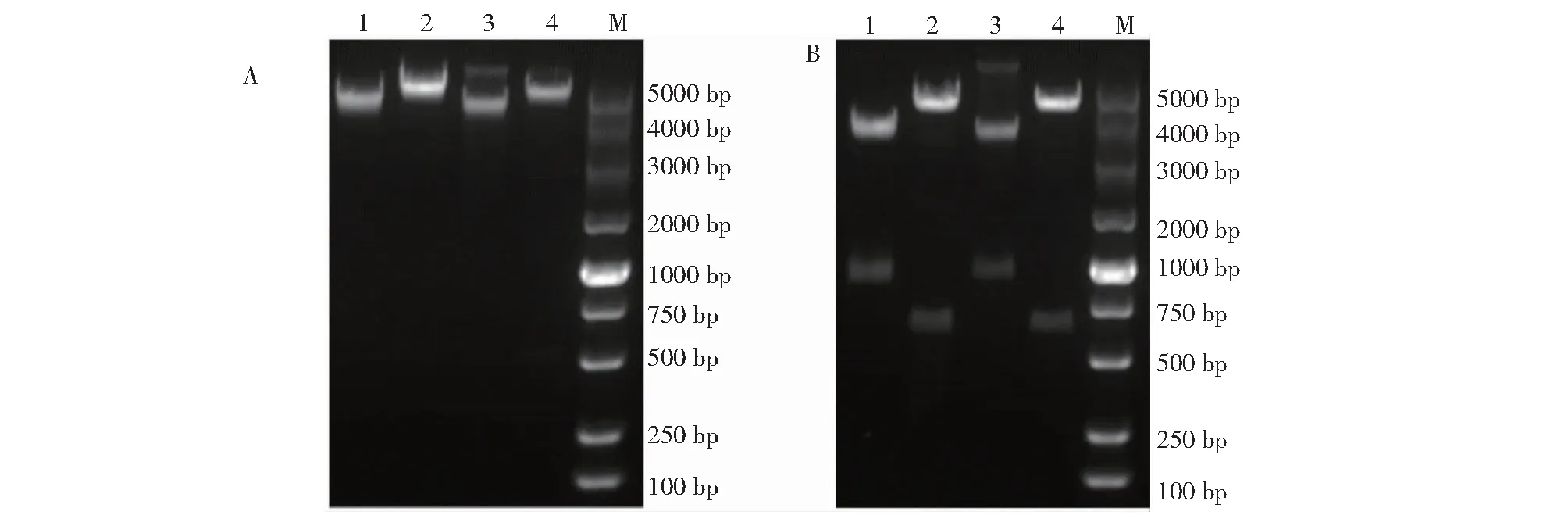
A.泳道1:pBiFC-VC155用SacI单酶切;泳道2:pBiFC-VN173用SacI单酶切;泳道3:pBiFC-VC155-靶标肽用SacI单酶切;泳道4:pBiFC-VN173-互补肽用SacI单酶切;M:Marker DL5000.B.泳道1:pBiFC-VC155 用SacI/NheI双酶切;泳道2:pBiFC-VN173用SacI/BamHI双酶切;泳道3:pBiFC-VC155-靶标肽用SacI/NheI双酶切;泳道4:pBiFC-VN173-互补肽用SacI/BamHI双酶切;M:Marker DL5000。A.Lane1:pBiFC-VC155 digested by SacI;Lane2:pBiFC-VN173 digested by SacI;Lane3:pBiFC-VC155-target peptide digested by SacI;Lane4:pBiFC-VN173-complementary peptide digested by SacI;M:DL5000 Marker.B.Lane1:pBiFC-VC155 digested by SacI/NheI;Lane2:pBiFC-VN173 digested by SacI/BamHI;Lane3:pBiFC-VC155-target peptide digested by SacI/NheI;Lane4:pBiFC-VN173-complementary peptide digested by SacI/BamHI;M:DL5000 Marker.图4 重组载体pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽的酶切鉴定Fig.4 Enzyme digestion of recombinant plasmids pBiFC-VC155-target peptide and pBiFC-VN173-complementary peptide

红色区域为靶标肽(A)或互补肽(B),蓝色区域为载体序列。The red region represented the target peptide (A) or complementary peptide (B),and the blue region represented the vector sequence.图3 靶标肽与互补肽的三维结构预测Fig.3 Three-dimensional structure prediction of target peptide and complementary peptide

A.pBiFC-VC155空载测序图;B.pBiFC-VC155-靶标肽测序图;C.pBiFC-VN173空载测序图;D.pBiFC-VN173-互补肽测序图。A.pBiFC-VC155 empty-load sequencing map;B.pBiFC-VC155-target peptide sequence scheme;C.pBiFC-VN173 empty-load sequencing scheme;D.pBiFC-VN173-complementary peptide sequence scheme.图5 pBiFC-VC155与pBiFC-VN173空载以及pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽重组质粒部分测序图谱Fig.5 Partial sequencing map of pBiFC-VC155,pBiFC-VN173,pBiFC-VC155-target peptide and pBiFC-VN173-complementary peptide
3 讨 论
通常情况下多肽是指由3个或者3个以上氨基酸分子组成的肽,寡肽是指氨基酸数目为2~10个的生物活性肽,其特点是可以像小分子一样穿越细胞膜,通过生理屏障,吸收快速。在生物医学领域主要以多肽类药物的形式参与临床应用,此外,多肽还可以诊断试剂来检测病毒、细菌、支原体、螺旋体等微生物和囊虫、锥虫等寄生虫的抗体[23]。由于氨基酸序列短,特异性强,且易于制备,因此常用作检测抗原装配的检测试剂,其检测相关病原微生物抗体的背景和假阳性都很低,易于在临床上推广应用[24]。当前随着新发人畜共患病的流行传播以及城市伴侣动物数量的不断增多,对病原的快速检测及质量提出了更高的要求,目前的常规检查方法已不能满足现阶段的需求,如不及时作出快速诊断和采取针对性的措施,将会严重威胁人类公共卫生安全[25]。
本研究基于BiFC技术研究基于猪流行性腹泻病毒S蛋白受体结合位点人工设计的靶标肽与互补肽在活细胞内的相互作用关系以及亚细胞定位,为进一步探索在临床上利用该肽段进行抗原检测提供理论基础。研究中为了初步了解目标多肽的基本理化特性,首先利用生物信息学技术对设计的靶标肽与互补肽的亲/疏水性、二/三级结构进行了预测,结果显示,靶标肽整体呈亲水性,二级结构包含延伸股、无规则卷曲、β转角、α螺旋;互补肽二级结构2/3为α螺旋,1/3为无规则卷曲,表明靶标肽和互补肽分别带有亲水性和疏水性结构域,亲水性结构域都带有正负电荷,能够产生静电引力;其次酶切鉴定和测序结果表明成功构建了pBiFC-VC155-靶标肽和pBiFC-VN173-互补肽真核表达质粒;最后细胞转染试验表明重组质粒在细胞内共转染后靶标肽和互补肽能够在Vero细胞内形成在荧光显微镜下发绿色荧光的BiFC复合物,表明两者发生了相互作用;为进一步了解该复合物的基本特性,本研究对其在细胞内的定位情况进行了初步研究,间接免疫荧光试验结果证实该BiFC复合物主要分布于细胞核中,为进一步解析其功能提供了可能。本研究针对靶标肽的局部位点人工设计出与该位点相互作用的多肽,大大提高了针对性并设计出与蛋白质不同功能域相互作用的多肽,为进一步开发基于蛋白质相互作用的病原检测新方法和筛选抗PEDV药物积累了实验数据。
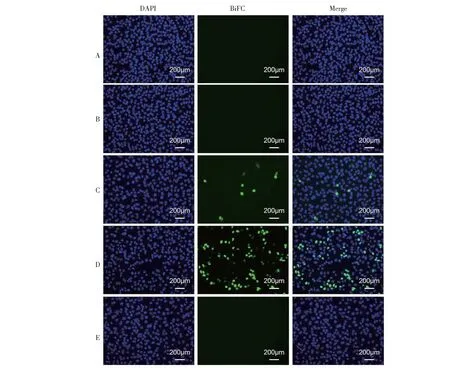
A.重组质粒pBiFC-VC155-靶标肽单转染Vero细胞;B.重组质粒pBiFC-VN173-互补肽单转染Vero 细胞;C.pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽共转染Vero细胞;D.pBiFC-bFos-VC155与pBiFC-bJun-VN173共转染Vero细胞(阳性对照);E.pBiFC-VC155与pBiFC-VN173共转染Vero细胞(阴性对照)。A.Transfection of pBiFC-VC155-target peptide into Vero cells;B.Transfection of pBiFC-VN173-complementary peptide into Vero cells;C.Co-transfection of pBiFC-VC155-target peptide and pBiFC-VN173-complementary peptide into Vero cells;D.Co-transformation of pBiFC-bFos-VC155 and pBiFC-bJun-VN173 into Vero cells(positive control);E.Co-transformation of pBiFC-VC155 and pBiFC-VN173 into Vero cells(negative control).图6 pBiFC-VC155-靶标肽与pBiFC-VN173-互补肽在Vero细胞中的双分子荧光互补Fig.6 BiFC of pBiFC-VC155-target peptide and pBiFC-VN173-complementary peptide in Vero cells

A.BiFC复合物在内质网中的定位;B.BiFC复合物在高尔基体中的定位。A.BiFC complex in the endoplasmic reticulum;B.BiFC complex in the Golgi apparatus.图7 BiFC复合物在Vero细胞内的亚细胞定位Fig.7 Subcellular localization of BiFC complex in Vero cells
4 结 论
本研究选取较为成熟的真核表达载体pBiFC-VC155与pBiFC-VN173作为骨架载体,将基于猪流行性腹泻病毒S蛋白受体结合域设计的靶标肽插入pBiFC-VC155载体中,互补肽插入pBiFC-VN173,构建一对真核重组质粒。重组质粒转染活细胞后通过观察细胞内的荧光信号,证实靶标肽与互补肽能在细胞内形成BiFC复合物,存在相互作用;进一步通过间接免疫荧光试验证实该互作复合物定位在细胞核内。综上所述,基于猪流行性腹泻病毒S蛋白受体结构位点肽段人工设计与之相互作用的多肽方法可行,这为以后利用该肽段进行猪流行性腹泻病毒抗原检测和相关诊断提供理论基础和技术支持,具有潜在的应用前景和经济价值。

