赣南脐橙黄龙病植株根际土壤微生物多样性研究
秦泰春,黄小兰,简正军,褚奇奇,欧阳乐乐
(1.东华理工大学地球科学学院,南昌 330013;2.江西师范大学地理与环境学院,南昌 330022)
【研究意义】土壤微生物是土壤生态系统中最活跃的部分,对土壤的形成发育、物质循环和肥力演变起着极为重要的作用[1-2]。根际是受植物根系机械作用及其分泌物显著影响的土壤微域[3],起着连接植物-土壤-微生物的重要作用。根际微生物是植物吸收养分的重要途径,其多样性和群落结构的变化直接影响植物生长、植物演替和其他关键功能[4-6]。因此,对植物根际土壤微生物的多样性及其群落结构进行研究,有助于揭示植物生长的微生态环境和土壤健康状况。赣南是我国著名的脐橙生产基地,被称为“中国脐橙之乡”[7],其独特的气候条件、丰富的山地资源和适宜的土壤性质,为脐橙的种植提供了良好的自然条件。脐橙黄龙病(Citrus Huanglongbing,HLB)是由寄生于韧皮部筛管细胞内的革兰氏阴性细菌引起的,该菌属-变形细菌亚纲(Alpha-Proteobacteria)根瘤菌目(Rhizonbiales)根瘤菌科(Rhizobiaceae)韧皮杆菌属(Liberibacter)[8],由于病原菌核酸序列以及对热的敏感性、昆虫媒介和地理位置的不同,可分为非洲种(Ca.L.africanus)、亚洲种(Ca.L.asiaticus)和美洲种(Ca.L.americanus)[9]。感染了黄龙病的脐橙植株的根茎表皮易脱离、腐烂,导致其根部不能从土壤中吸收养分和水分,植物代谢物也不能从根系排出,由此产生植物汁液循环障碍,引起脐橙韧皮部组织坏死和筛管堵塞,从而使叶片和果实发生病变[10],在叶片上表现出斑驳、黄化、花叶、小叶、“绿岛”等症状,果实则为“青果”或“红鼻果”[11],严重影响了脐橙的产量和品质,对赣南的脐橙产业造成了沉重打击。【前人研究进展】近年来,植物病害的发病率不断上升,有关病害与根际土壤微生物的研究也相应成为研究热点之一[12]。目前已有不少学者从微生物学角度对黄龙病进行了研究。熊大维等[13]发现脐橙患病植株和健康植株叶片内生菌有着明显差异,黄龙病的存在改变了脐橙叶片原有内生细菌的菌群结构。殷幼平等[14]从耐黄龙病植物九里香(隐症)中分离内生细菌进行功能鉴定,尝试为果树抗病育种提供理论依据。管冠等[15]采用微平板法分析柑橘黄龙病对土壤微生物群落的影响发现,与健康植株相比,黄龙病患病植株土壤中的细菌、真菌、放线菌数量显著减少。姚廷山等[16]研究发现土霉素可有效抑制黄龙病亚洲种,周应杰[17]研究发现土施钙镁硼处理能够缓解黄龙病的发病情况。目前仍未发现根治黄龙病的方法。【本研究切入点】基于高通量测序技术的脐橙黄龙病患病植株根际土壤微生物多样性的研究相对较少。【拟解决的关键问题】本研究以种植历史悠久、种植规模大的赣南为研究区域,研究分析脐橙黄龙病患病植株与健康植株根际土壤微生物群落特征,为构建黄龙病新型防控措施提供新的方向和思路,实现赣南脐橙规模化种植的可持续发展。
1 材料与方法
1.1 研究区概况
赣南位于江西省南部,地形以山地、丘陵为主,地处中亚热带南缘,属典型的亚热带湿润季风气候,水热资源丰富,气候条件优越,土壤为典型的红壤,富含各种适合果树生长的微量元素[7],为脐橙的种植提供了得天独厚的条件。本研究选择赣州市于都县仙下乡正兴农场的脐橙种植果园作为采样地,区分黄龙病典型病株(HW)、黄龙病疑似病株(HW1)、健康植株(J)以及裸地(B)的土壤分别进行采样(图1)。

图1 研究区位置示意图Fig.1 Location diagram of the study area
1.2 土壤理化性质测定
土壤理化性质的测定参考鲁如坤[18]的测定方法:土壤全磷(Total phosphors,TP)采用氢氧化钠消煮-钼锑抗比色法测定;土壤全氮(Total nitrogen,TN)采用凯氏定氮法测定;土壤全碳(Total carbon,TC)采用元素分析仪测定。
1.3 样品采集
于2019年11月赣南脐橙生长期采集土壤样品,由于根际土采样面积不大,土壤也较均匀,因而采取梅花形采样法,在赣南脐橙树干基部横向范围10~20 cm处呈梅花形设置5个采样点,去除地面枯枝落叶和表层浮土后,从根表到根区纵向范围采集5~50 cm的根际土壤,装入密封袋并置于冰盒带回实验室过筛、去杂[19-20]。每个样为混合3棵赣南脐橙植株根际土壤的混合样,将每份样品分成2份,一份用于土壤理化性质的测定,另一份置于-80 ℃冰箱保存,用于DNA提取和高通量测序。
1.4 土壤总DNA提取和高通量测序
采用E.Z.N.A.®DNA Kit试剂盒提取根际土壤样品的DNA,用2%琼脂糖凝胶电泳检测DNA的纯度和浓度[21]。细菌引物采用515F(5′-GTGCCAGCCGGTAA-3′)和907R(5′-CCGTCAATTCTTRACTTT-3′)对16S rRNA V4-V5高变区进行PCR扩增;真菌引物采用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对ITS1~ITS2区进行PCR扩增。将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HC1洗脱,并委托上海美吉生物医药科技有限公司进行测序。
1.5 数据处理与分析
对高通量测序得到的原始数据进行拼接、质控和过滤,去除嵌合体,得到优化序列。将序列相似度≥97%的序列归类为同一分类操作单元(Operational taxonomic unit,OTU),使用R语言3.3.1软件作图,以Venn图呈现各样品共有和独有的OTU数,以稀释曲线衡量样本的测序数据是否合理。利用Qiime 1.9.1软件计算Ace、Chao1、Shannon、Simpson指数研究各样品土壤微生物群落多样性和丰富度。利用Qiime 1.9.1软件计算Beta多样性距离矩阵,对样本群落距离矩阵进行聚类分析,并运用R语言3.3.1画聚类树,分析不同样品微生物群落结构的相似性和差异性。利用R语言3.3.1软件分析样品土壤各分类学水平上的群落组成及其差异性。利用SPSS 26.0软件进行Sperman相关性分析研究样品土壤微生物多样性与环境因子的相关性。利用R语言3.3.1软件中的Vegan包和Pheatmap package包进行冗余分析和相关性分析以探讨不同环境因子对土壤微生物群落组成的影响。
2 结果与分析
2.1 赣南脐橙根际土壤理化性质分析
从表1可知,4个样品的土壤TP含量均较低,黄龙病疑似患病植株根际土壤最低,为0.53 g/kg,裸地土壤最高,为0.81 g/kg;TN含量由高到低为J>HW>HW1>B;TC含量由高到低为HW>HW1>J>B。可见,与赣南脐橙健康植株根际土壤相比,黄龙病患病植株根际土壤的TP和TN含量都较低,而TC含量较高。
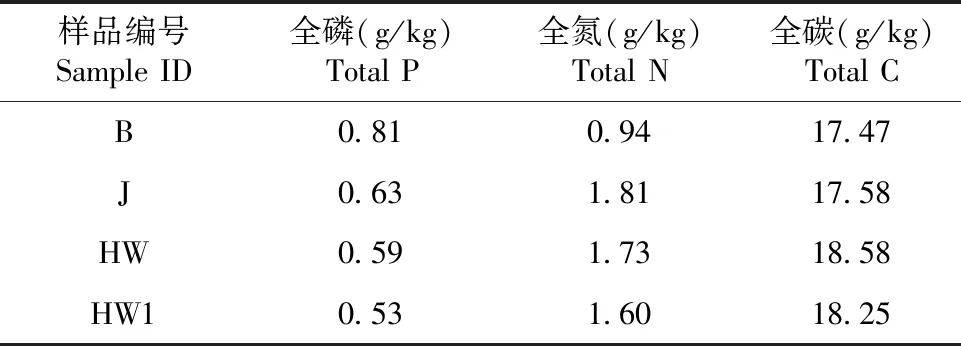
表1 根际土壤部分理化性质Table 1 Physical and chemical properties of rhizosphere soil
2.2 赣南脐橙根际土壤OTU聚类分析及稀释曲线
根据高通量测序结果对序列进行统计,土壤样品细菌16S rRNA测序得到264 450条有效序列,平均序列长度为377.12 bp,在97%的相似性水平上将OTU聚类后得到5434个细菌OTUs。真菌ITS rDNA得到295 048条有效序列,平均序列长度为233.72 bp,97%的相似水平下聚类分析得到1782个真菌OTUs。裸地、典型患病植株、疑似患病植株和健康植株根际土壤细菌(图2-a)的OTU数量分别为1527、1434、1223和1250;真菌(图2-b)的OTU数量分别为485、410、436和451。4个赣南脐橙根际土样中共有的细菌OTU数量为558个,占总数的10.27%,共有的真菌OTU数量为57,占总数的3.20%。裸地、典型患病植株、疑似患病植株和健康植株根际土壤中特有的细菌OTU数量分别为450、169、75和83,其中裸地样本最多,占总数的8.28%,疑似患病植株样本总数最少,占总数的1.38%;特有的真菌OTU数量分别为291、97、116和128,其中裸地样本最多,占总数的16.33%,典型患病植株样本最少,占总数的5.44%。
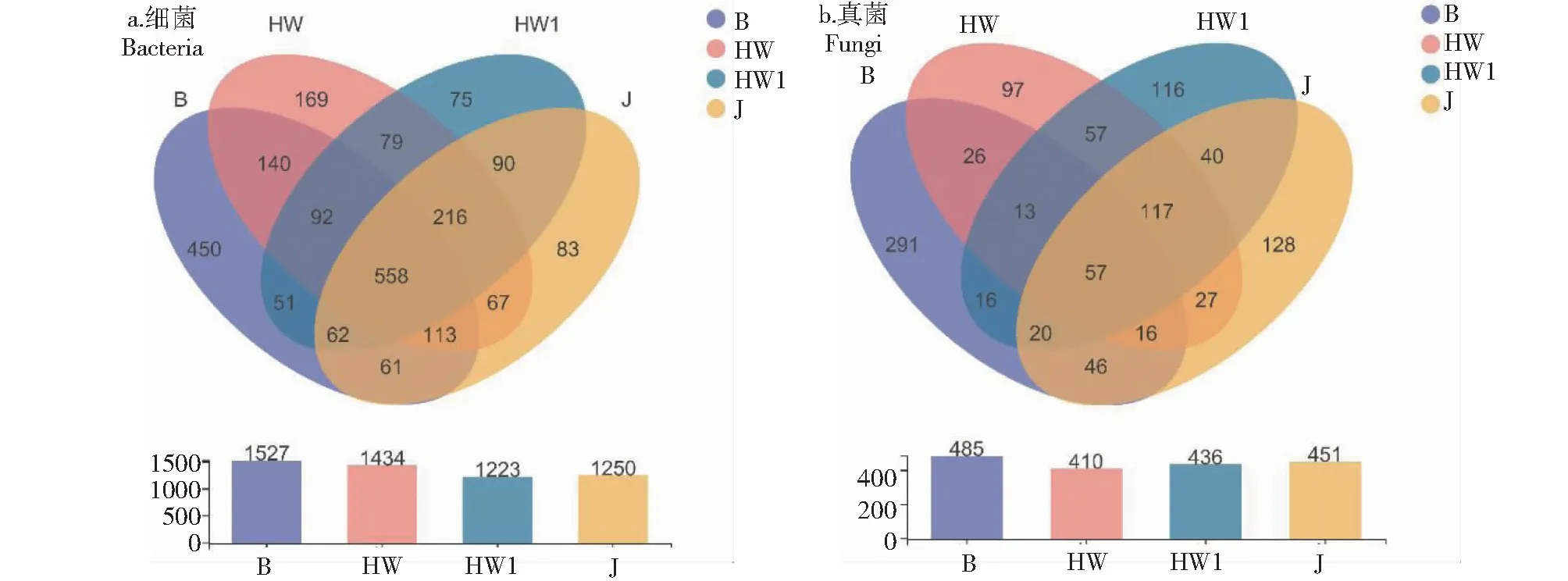
图2 样品细菌(a)和真菌(b)OTUs Venn图Fig.2 Venn diagram of OTUs of bacteria and fungi
对所有样本序列采取随机抽样的方法,以抽到的序列数与它们所能代表各分类学水平的数目分别构建细菌(图3-a)和真菌(图3-b)的稀释曲线,用以说明样本的测序数据量是否合理。所有样品的稀释曲线随着样品序列数量的不断增加,OTU数量逐渐趋于平缓,说明该研究测序数据合理,更多的数据量只会产生少量的物种。4个赣南脐橙根际土样中细菌和真菌的文库覆盖率在0.9931~0.9994(表2)。说明,本次测序结果能代表样本微生物的真实情况,能够比较有效地反映其多样性。
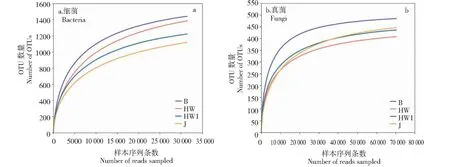
图3 土壤样品稀释曲线Fig.3 Rarefaction curves of soil samples
2.3 赣南脐橙根际土壤微生物多样性分析
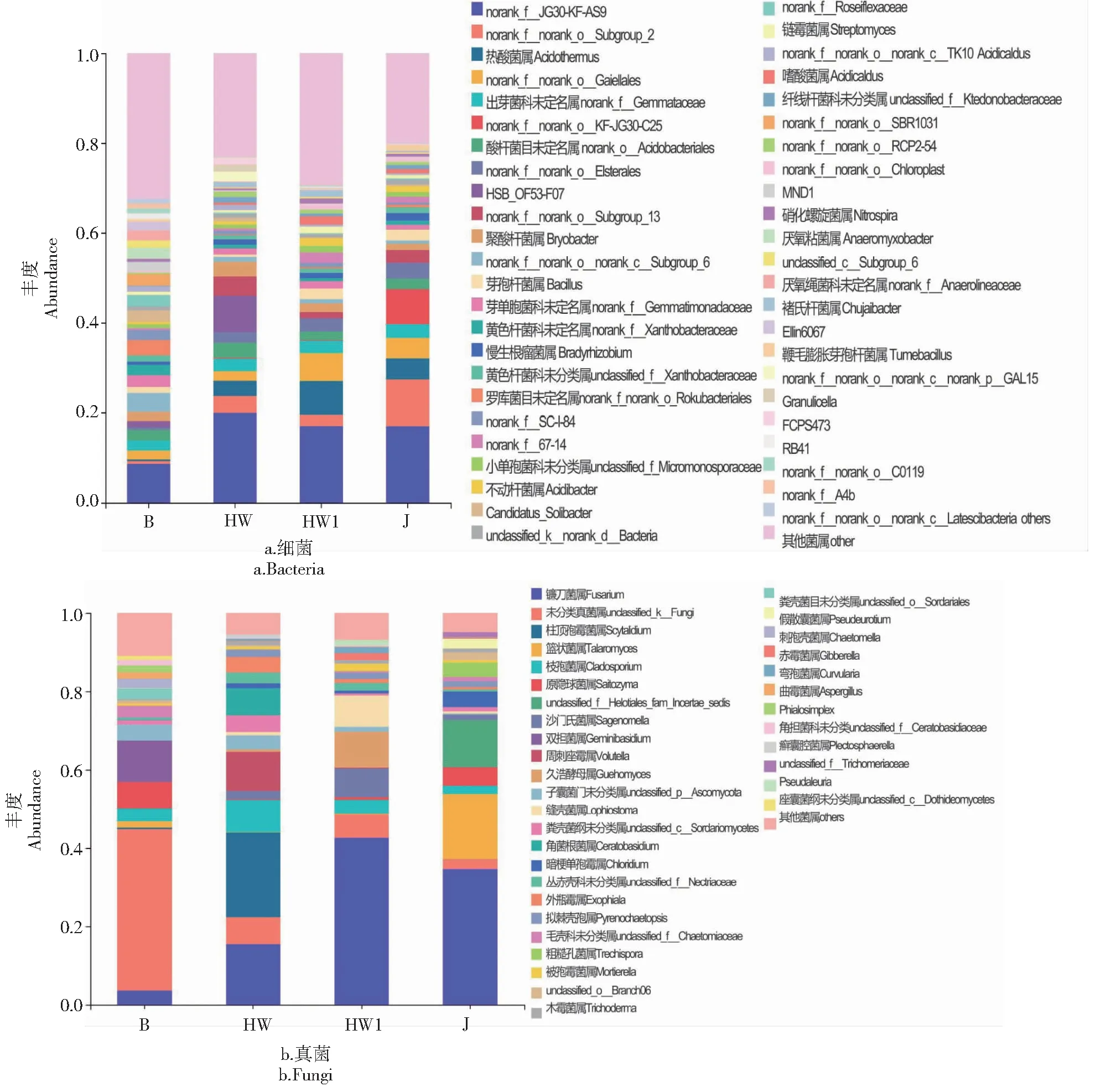
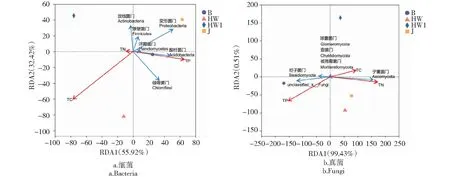
从表2可知,在土壤细菌方面,裸地和典型患病植株根际土壤的Ace指数和Chao1指数差异不明显,但整体高于健康和疑似患病植株根际土壤;典型患病和疑似患病植株根际土壤的Simpson指数和Shannon指数差异较小,裸地土壤最高,健康植株根际土壤最低。4个土样的真菌群落丰富度从高到低依次为B>J>HW1>HW,患病植株根际土壤显著低于健康植株根际土壤和裸地土壤。Shannon指数为B>HW>HW1>J,Simpson指数为HW 表2 土壤样品微生物多样性指数Table 2 Microbial diversity indexes in the soil samples 从图4-a可知,健康植株根际土壤和裸地土壤聚类在一起,并且与典型患病植株根际土壤有一定关联,说明三者的细菌群落结构相似性相对较高,而疑似患病植株的根际土壤则单独聚为一簇,说明其细菌群落组成与其他3个根际土壤差异较大。从图4-b可知,健康植株、典型患病和疑似患植病株根际土壤聚为一类,反映三者的真菌群落结构相似性相对较高,而裸地土壤单独聚为一类,说明其真菌群落组成与其他3个根际土样的差异较明显。 图4 样本间层级聚类树Fig.4 Hierarchical cluster tree between samples 2.5.1 细菌群落组成 从图5-a可知,在门水平上,细菌群落平均相对丰度≥1%的门类为绿弯菌门(Chloroflexi,22.77%~37.92%)、变形菌门(Proteobacteria,16.63%~26.40%)、酸杆菌门(Acidobacteria,11.77%~20.24%)、放线菌门(Actinobacteria,7.83%~24.03%)、厚壁菌门(Firmicutes,2.38%~8.31%)、浮霉菌门(Planctomycetes,4.81%~5.48%)、芽单胞菌门(Gemmatimonadetes,1.56%~3.50%)和棒状杆菌门(Rokubacteria,0.16%~3.38%),平均占比分别为27.25%、22.31%、17.45%、14.41%、5.42%、5.08%、2.17%和1.10%。与健康脐橙植株根际土壤相比,典型患病和疑似患病植株根际土壤中绿弯菌门、酸杆菌门和浮霉菌门的相对丰度较高,而变形菌门、放线菌门、厚壁菌门、芽单胞菌门和棒状杆菌门的相对丰度较低。与裸地土壤相比,典型患病植株土壤中除了绿弯菌门和放线菌门外,放线菌门和棒状杆菌门相对丰度也较高,而变形菌门、厚壁菌门、芽单胞菌门、浮霉菌门的相对丰度较低。 从图6-a可知,在属水平上,所有样本土壤中物种繁杂、相对丰度较低的其他类群是最主要菌群,平均占比26.23%。样本土壤的优势属大多为在属分类水平下暂时没有科学名称的菌群,其中相对丰度较高的为norank_f_JG30-KF-AS9(19.91%~8.68%)、norank_f_norank_o_Subgroup_2(10.34%~0.62%)、norank_f_norank_o_Gaiellales(2.16%~6.21%)和norank_f_Gemmataceae(2.18%~3.04%),平均占比分别为15.67%、4.29%、3.73%和2.68%。已分类的有科学名称的优势菌群为热酸菌属(Acidothermus,0.35%~7.53%)、HSB_OF53-F07(0.05%~8.09%)、聚酸杆菌属(Bryobacter,1.42%~3.26%)和芽孢杆菌属(Bacillus,0.51%~2.43%),平均占比3.98%、2.40%、2.15%和1.66%。典型病株根际土壤中相对丰度较高的菌属还有norank_f_norank_o_norank_c_norank_p_GAL15和乳杆菌属(Granulicella);健康植株根际土壤中相对丰度较高的是norank_f_norank_o_KF-JG30-C25和鞭毛膨胀芽孢杆菌属(Tumebacillus);厌氧粘菌属(Anaeromyxobacter)是裸地土壤中的特有菌属。 2.5.2 真菌群落组成 从图5-b可知,在门水平上,4个土样中真菌优势门为子囊菌门(Ascomycota,87.51%~36.03%)、unclassified_k_Fungi(2.46%~41.23%)、担子菌门(Basidiomycota,8.77%~21.26%)和被孢霉菌门(Mortierellomycota,0.64%~1.76%),平均占比分别为71.67%、14.13%、12.66%和0.93%。其中,子囊菌门在典型患病、疑似患病和健康植株根际土壤中占比最高,而裸地土壤中丰度最高的是unclassified_k_Fungi,子囊菌门和担子菌门的占比也相对较高,被孢霉菌门在4个根际土壤中的占比均较低。 图5 土壤样品在门水平上的微生物群落组成Fig.5 Composition of microbial community at the phylum level in soil samples 从图6-b可知,在属水平上,样本土壤的优势属主要是镰刀菌属(Fusarium,3.60%~42.60%)、unclassified_k_Fungi(2.46%~41.23%)、篮状菌属(Talaromyces,0.12~16.66%)、枝孢属(Cladosporium,2.09%~8.25%)、原隐球菌属(Saitozyma,0.20%~6.78%)和沙门氏菌属(Sagenomella,0.08%~7.27%),平均占比分别为24.09%、14.13%、4.68%、4.28%、3.09%和2.70%。镰刀菌属在典型患病植株根际土壤中的丰度最高,在裸地土壤中最低;unclassified_k_Fungi在裸地土壤中丰度最高,在健康植株根际土壤中最低。此外,典型患病植株根际土壤中角菌根菌属(Ceratobasidium)、外瓶霉属(Exophiala)和癣囊腔菌属(Plectosphaerella)的丰度也较高,但在其他3个土样中丰度很低甚至没有;赤霉菌属(Gibberella)和Pseudaleuria在疑似患病植株根际土壤中丰度较高;健康植株根际土壤中丰度较高的特有菌属分别是unclassified_f_Helotiales_fam_Incertae_sedis、假散囊菌属(Pseudeurotium)和unclassified_f_Trichomeriaceae;裸地土壤中丰度较高的特有菌属分别为双担菌属(Geminibasidium)、刺孢壳属(Chaetomella)和Phialosimplex。 图6 土壤样品在属水平上的微生物群落组成Fig.6 Composition of microbial community at the genus level in soil samples 2.6.1 微生物多样性指数与土壤理化性质相关性分析 从表3可知,对土壤细菌多样性而言,Simpson指数与土壤TN含量呈显著正相关;Shannon指数与土壤TN含量呈显著负相关;TP、TC与细菌多样性指数都具有一定的相关性但并未达到显著水平。对土壤真菌多样性而言,真菌丰富度ACE指数和Chao1指数与土壤TC含量呈极显著负相关,其他理化因子与真菌多样性指数的相关性均未达到显著水平,说明其与真菌多样性指数关系不大。 表3 土壤样品微生物多样性指数与土壤理化性质之间的相关分析Table 3 Correlation analysis among microbial diversity index and soil physicochemical properties 2.6.2 微生物群落组成与土壤理化性质的相关性分析 从图7可知,第一排序轴(55.92%)和第二排序轴(32.42%)累计解释土壤细菌结构变异的88.34%,真菌与土壤理化性质RDA分析的第一排序轴(99.43%)和第二排序轴(0.51%)共解释了99.94%的物种变异,表明土壤理化性质能够很好地解释对土壤微生物群落结构的影响。其中,细菌优势菌门绿弯菌门、酸杆菌门、浮霉菌门和变形菌门与土壤TP呈正相关,放线菌门、厚壁菌门与土壤TC呈负相关;真菌优势菌门子囊菌门与土壤TN呈正相关,担子菌门和未分类的某个菌门与土壤TP呈正相关。整体来说,影响赣南脐橙根际土壤细菌群落组成的重要理化因子是TC和TP,影响真菌群落结构的主要因素则是TP和TN。 图7 门水平上微生物群落结构与土壤理化性质的冗余分析Fig.7 RDA among microbial community structure at the phylum level and soil physicochemical properties 从图8-a可知,细菌优势属norank-f-norank-o-norank-c-Subgroup-6、norank-f-Gemmatimonadaceae、norank-f-SC-l-84和norank-f-Roseiflexaceae与土壤TN呈显著负相关(P<0.05),norank-f-norank-o-norank-c-Subgroup-6、念珠菌固体杆菌属(Candidatus-Solibacter)、norank-f-Gemmatimonadaceae、norank-f-norank-o-Rokubacteriales和norank-f-Roseiflexaceae与土壤TP呈显著正相关(P<0.05),而norank-f-Xanthobacteraceae与土壤TP呈极显著正相关(P=0.00428)。从图8-b可知,真菌优势属unclassified-f-Chaetomiaceae与土壤TP呈显著正相关(P=0.04783),unclassified-k-Fungi、双担菌属、unclassified-o-Sordariales、刺孢壳属和曲霉属(Aspergillus)与土壤TN呈显著负相关(P<0.05),原隐球菌属与土壤TC呈显著负相关(P=0.03505),unclassified-f-Nectriaceae与土壤TC呈显著正相关(P=0.01119)。其他微生物优势菌属与土壤理化性质也有一定的相关性但未达到显著水平。 图8 属水平上微生物群落结构与土壤理化因子的Pearson相关性分析Fig.8 Pearson correlationship analysis of microbial community structure at the genus level and soil physicochemical properties 土壤微生物的丰富度和多样性程度反映了土壤的健康状况,在农业生态系统养分循环和肥力维持等方面发挥着重要作用,对植物健康生长有着直接或间接的影响[22-23]。本研究中,赣南脐橙黄龙病典型患病植株根际土壤细菌丰富度和多样性均高于健康植株,其原因可能是采集患病植株根际土壤时,其周围滋生了大量腐生菌[24],从而增加了根际土壤细菌群落的多样性;还可能是由于病原菌的侵染破坏了微生物原有的生态平衡,导致某种微生物异常增加或减少[25-26],所以在新的生态平衡建立起来之前,患病植株细菌群落多样性可能会略高于健康植株。相关推测有待进一步研究。赣南脐橙黄龙病典型患病植株根际土壤真菌的丰富度低于健康植株根际土壤,而其多样性却略高于健康植株根际土壤,此结论与前人研究结果基本一致[10]。 从物种分类学来看,赣南脐橙黄龙病患病植株、健康植株根际土壤和裸地土壤微生物群落组成基本相似,但其相对丰度存在明显差异。门水平上,赣南脐橙根际土壤细菌群落主要由绿弯菌门、变形菌门、酸杆菌门和放线菌门等几大物种组成,这与前人的研究结果一致[27-28]。绿弯菌门、酸杆菌门是赣南脐橙黄龙病典型患病植株根际土壤中的最优势菌门,而放线菌门在健康植株根际土壤中占据显著优势。已有研究表明,酸杆菌门属于寡营养型细菌[29],能够在土壤养分匮乏的环境中生存[30];放线菌门能产生种类繁杂的抗生素,对调整土壤微生物生态平衡起着至关重要的作用[31]。这也间接说明黄龙病患病植株根际土壤较贫瘠。赣南脐橙黄龙病患病植株、健康植株根际土壤和裸地土壤中真菌检测到了子囊菌门、担子菌门、被孢霉菌门、壶菌门、球囊菌门等菌群,此结果与宋旭红等[32]在黄连根腐根际土壤检测到的真菌构成和高雪峰等[33]在短花针茅草原土壤中检测到的真菌构成类似。赣南脐橙黄龙病典型患病植株根际土壤中子囊菌门和担子菌门的相对丰度均低于健康植株,两者都是土壤中主要的真菌分解者且多为腐生菌,对分解土壤有机质和木质纤维素起重要作用[34-35]。属水平上,赣南脐橙植株根际土壤中的优势菌属依次为热酸菌属、芽孢杆菌属、镰刀菌属、篮状菌属和枝孢菌属。芽孢杆菌属可以有效抵御外界的有害因子,具有极强的抗逆性[36],属于典型的有益菌。篮状菌属作为土壤中植物残体的重要分解菌,可分泌高效的纤维素酶水解植物木质纤维素,从而增加土壤腐殖质,且对病原菌具有拮抗作用[37]。本研究中,芽杆孢菌属和篮状菌属在赣南脐橙健康植株根际土壤中的丰度显著低于患病植株,这可能是两者都对致病菌具有一定的抵抗作用。镰刀菌属可侵染植株致使植株萎蔫和根部腐烂[38],枝孢菌属可寄生于植物各部位造成坏死斑点或煤污病[39],两者都属于典型的致病菌。本研究中,镰刀菌属和枝孢菌属在赣南脐橙黄龙病患病植株根际土壤中的丰度高于健康植株,但其与黄龙病是否有直接关系还有待进一步研究。由此可见,由于黄龙病的发生,赣南脐橙根际土壤微生物群落中益生菌减少、病原菌增加,根际微生态系统功能受到破坏,推测可通过促进土壤有益菌生长繁殖提高赣南脐橙抵御病害的能力。 土壤环境因子与土壤微生物多样性及群落结构有显著或极显著的相关性[40]。本研究结果显示,黄龙病发生后,赣南脐橙根际土壤中全磷、全氮含量下降,全碳含量上升;土壤全磷是影响赣南脐橙植株根际土壤微生物群落结构的重要环境因子。据报道,土壤全碳含量高通常预示着土壤有机质含量较高[41],赣南脐橙染病后根际土壤中有机质含量提升可能是由于其根系受到破坏,土壤有机质不能正常吸收和运输,从而导致其积累在土壤中。陈杰等[42]等研究发现,马铃薯连作种植的病株土壤中全磷含量低于健株土壤,Ramirez等[43]研究发现土壤中全氮含量可以影响微生物生物量,与本研究结论较为一致,由此推测可通过增加磷、氮肥的施用量来提高赣南脐橙植株的抗病性。综上所述,赣南脐橙根际土壤微生物群落与土壤理化性质互作影响黄龙病的发生,这种互作关系和作用机制值得进一步深入研究,进而为有效防控黄龙病提供新的线索。 赣南脐橙感染黄龙病后,土壤TP、TN含量降低,其中土壤TP是影响赣南脐橙根际土壤微生物群落结构的重要环境因子;发病后赣南脐橙根际土壤中细菌群落丰富度和多样性下降,真菌群落丰富度上升;门水平上,患病植株根际土壤中绿弯菌门、酸杆菌门等菌群增加,而放线菌门、担子菌门等菌群有所减少;属水平上,患病植株根际土壤中芽杆孢菌属、篮状菌属等有益菌属减少,而镰刀菌属、曲霉属等致病菌属则有所增加。这些差异体现了黄龙病对脐橙根际微生态的影响,为生态防控黄龙病病害提供新的思路和解决办法。
2.4 赣南脐橙根际土壤微生物群落结构比较

2.5 赣南脐橙根际土壤微生物群落组成分析

2.6 赣南脐橙根际土壤微生物与土壤理化性质的关系

3 讨 论
4 结 论

