水稻基因 OsGLP1-2的克隆、表达及功能分析
李明玉,石 杨,李 斌,王若霖,肖 强,陈 龙,陈 稷,杨其亮,黄 进
(1.成都理工大学生态环境学院,成都 610059;2.四川农业大学农学院,成都 611130;3.广州永诺医学检验所有限公司,广州 510700)
【研究意义】镉(Cadmium,Cd)广泛应用于工业生产,因其具有高毒性和高流动性,极易被排放入农田中,对生态及人类造成巨大威胁[1]。因水稻对Cd具有富集性,其产量和质量均受到Cd的危害[2]。Cd通过食物链会对人体造成不可逆的损伤,如20世纪日本的“痛痛病事件”[3]。因此,降低水稻籽粒中的Cd含量成为如今所面临的重要挑战。目前,随着生物信息学和分子生物学的发展,利用该技术解决污染问题已成为一种研究热点,因此本研究利用生物信息学方法,筛选到水稻Cd响应基因OsGLP1-2,对其进行深入研究,为水稻应对重金属胁迫的分子机制提供理论基础以及为培育低Cd水稻品种提供基因资源。【前人研究进展】OsGLP1-2属于类萌发素蛋白(Germin-like proteins,GLPs)家族,该家族与小麦萌发素蛋白(Germins,GERs)具有相似氨基酸序列和结构,二者在植物逆境防御中都发挥着重要作用[4]。目前在水稻中共发现42个GLPs家族成员,Manosalva等[5]根据大麦中GLPs的命名法将水稻中的GLPs基因共分为6个亚家族(OsGER1~OsGER6),本研究中的水稻OsGLP1-2基因属于OsGER5亚家族。已有研究发现,在水稻GER 6个亚家族中,OsGER3和OsGER4亚家族主要与水稻抗瘟病的能力相关,OsGER5与干旱胁迫相关,以及OsGLP1能参与植物细胞壁交联和提高真菌的抗病性[5-6]。除此之外,有研究表明GLP家族成员具有某些酶的活性,比如草酸氧化酶(OXO,EC 1.2.3.4)、超氧化物歧化酶(SOD,EC 1.15.1.1)、ADP葡萄糖焦磷酸酶/磷酸二酯酶(AGPPase,EC 3.1.4.1)和多酚氧化酶(PPO)等[7-9]。其中OsGER5亚家族的成员与SOD相关,即该组的GLPs通过其SOD活性能将超氧阴离子转化为 H2O2,从而减少活性氧对植物的损伤,影响植物的抗旱能力[10]。因此,水稻GLPs家族成员在水稻生长发育、应对生物和非生物胁迫的过程中起着重要作用,但该基因家族在重金属胁迫中作用的研究却鲜有报道。【本研究切入点】本课题组在水稻Cd相关基因的筛选工作中发现水稻OsGER1-2基因的表达对Cd胁迫有响应,推测该基因可能参与水稻对Cd的吸收、转运或者耐受过程。因此,本研究在对OsGLP1-2基因及蛋白进行了生物信息学分析后又对该基因进行克隆并分析其组织表达。此外,通过将该基因在酵母细胞中进行异源表达,对其在酵母Cd耐受性中的影响进行分析。【拟解决的关键问题】针对OsGLP1-2基因生物学功能未知的问题,本研究通过生物信息学、分子生物学及遗传学等研究手段,对其在植物应对重金属胁迫过程中的功能进行探索,为进一步研究水稻应对重金属胁迫的分子机制提供理论基础。
1 材料与方法
1.1 材料与胁迫处理
供试的水稻为粳稻,由实验室种植、繁育,酵母菌株为Δycf1BY4741。
将经1/1000体积浓度的咪鲜胺消毒过的水稻种子用去离子水冲洗直至无农药残留,之后将种子置于37 ℃下催芽2 d。将催芽后的水稻种子用1/2 MS植物培养基在30 ℃植物培养室光照培养5 d后,选取生长状态良好且株高相近的幼苗,在浓度为100 μmol/L的CdCl2液体培养基中培养处理1、6、12 h后分别取样,每个时间点取8株幼苗,收集所有幼苗的根,地上部分则全部剪为0.5 cm左右的小段并随机取样200 mg。取完的样品立即置于液氮速冻,并于-80 ℃贮存备用。
1.2 试验方法
1.2.1 RNA提取及cDNA合成 将CdCl2处理的水稻组织参照EASYspin Plus植物RNA快速提取试剂盒的说明书进行总RNA的提取。采用1.5%琼脂糖凝胶电泳(1×TAE电泳缓冲液;100 V,18 min)检测RNA完整性。采用超微量紫外分光光度计测定RNA的OD280/OD260检测浓度和纯度,将提取成功的RNA样品取1000 ng,参照赛默飞世尔科技公司的Thermoscientific Revert Aid First Strand cDNA Synthesis Kit反转录试剂盒说明书进行反转录合成cDNA第一链,将反转录完的cDNA用无菌水稀释10倍于-20 ℃保存,用于后续实验。
1.2.2OsGLP1-2基因克隆 根据水稻OsGLP1-2基因的CDS序列设计PCR引物OsGLP1-2-F/OsGLP1-2-R和qRT-PCR引物OsGLP1-2-qF/OsGLP1-2-qR,以及根据内参基因Ubiqintin的CDS序列设计内参引物OsUBQ5-F/OsUBQ3-R(表1)。以水稻cDNA为模板,使用擎科生物科技有限公司的金牌Mix酶对OsGLP1-2基因的CDS序列进行PCR扩增。PCR反应体系50 μL:金牌Mix 47 μL,cDNA模板 1 μL,上下游引物各1 μL。扩增程序:98 ℃预变性 3 min;98 ℃ 30 s,62~54 ℃ 20 s ,72 ℃ 20 s进行20次循环,最后72 ℃延伸3 min。利用胶回收试剂盒对电泳后的PCR产物进行胶回收后,连入pGADT7载体,并转化至大肠杆菌DH5α菌株。挑取阳性克隆培养后,使用天根生化科技公司的质粒小提试剂盒提取重组质粒并进行酶切验证,验证正确的质粒送往擎科生物科技有限公司(成都)进行测序。测序结果通过NCBI的BLAST功能进行比对分析。
1.3 OsGLP1-2基因和蛋白的生物信息学分析
利用Rice Annotation Project(http://rice.plantbiology.msu.edu/)数据库检索OsGLP1-2基因的CDS和氨基酸序列;利用PlantCARE对目的基因启动子调控区域的顺式作用元件进行分析,再通过Tbtools进行可视化处理;利用ProtParam(https://web.expasy.org/protscale/)在线数据库对OsGLP1-2编码蛋白的基本理化性质进行预测和分析;利用Pfam(http://pfam.xfam.org/)对OsGLP1-2编码的氨基酸序列进行结构域分析;利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred)数据库和SWISS-MODEL在线数据库对目的基因所编码蛋白质的二、三级结构进行分析。
利用Greenphyl和Phytozome两个数据库对OsGLP1-2在水稻中同源家族基因进行检索,并从Rice Genome Annotation Project下载该家族基因的氨基酸序列。利用MEME Suit(https://meme-suite.org/meme/)在线网站分析获得的基序文件,通过TBtools软件对基序文件进行可视化分析。利用MEGA7软件构建OsGLP1-2的同源蛋白系统进化树,进一步通过Evolview(https://evolgenius.info//evolview-v2/#login)系统进化树在线修饰工具对系统进化树进行美化。
1.4 基因表达分析
在本研究中,对目的基因进行表达分析时采用4次重复。qRT-PCR反应体系:5 μL Sybr green,3 μL cDNA,上、下游引物各1 μL,引物见表1。qRT-PCR反应程序为:95 ℃ 2 min;95 ℃ 15 s;55 ℃ 15 s;72 ℃ 20 s,进行40个循环;72 ℃延伸3 min。以编码泛素蛋白的基因Ubiqintin作为内参基因。数据分析采用2-ΔΔCt相对定量法进行。

表1 扩增引物序列Table 1 Primers used for OsGLP1-2 gene cloning
1.5 转基因酵母对Cd的耐性分析
转基因酵母对Cd的耐性分析主要采用斑点实验分析。将构建成功的质粒载体转入Δycf1BY4741酵母菌株中构建转基因酵母,在SD-Leu培养基培养1 d,挑选转基因酵母单菌落于5 mL SD-Leu的液体培养基上震荡培养过夜,大约16 h,第2天再活化2 h,控OD=1。取5 μL以1、0.1、0.01、0.001浓度梯度的菌液在不同Cd浓度的固体培养基中进行点样。最后将培养基置于恒温保温箱,30 ℃培育3 d后,进行拍照分析。
2 结果与分析
2.1 基因OsGLP1-2的克隆与分析
以水稻 cDNA 为模板,根据目的基因的CDS序列设计特异引物,进行 PCR 扩增,获得大小约为651 bp DNA片段,测序结果显示序列与OsGLP1-2基因序列完全相同,表明克隆成功。
2.2 OsGLP1-2基因的生物信息学分析
2.2.1OsGLP1-2基因顺式作用元件分析 植物基因的启动子决定了基因表达的时空特性,而启动子的特性正是由组成启动子的诸多顺式作用元件决定。通过对基因启动子区域顺式作用元件的分析,可对基因的功能进行分析和预测。本研究利用PlantCARE数据库对OsGLP1-2基因的启动子(-2000~-1 bp)顺式作用元件分析并整理后,利用TBtools进行可视化分析(图2)。分析结果表明,OsGLP1-2含有与低温、光和生长素等有关的顺式作用元件。这暗示着OsGLP1-2基因可能受到以上这些与非生物胁迫激素信号通路的调控,并参与水稻对非生物胁迫的响应过程中。

图1 OsGLP1-2PCR扩增图Fig.1 Amplified CDS of OsGLP1-2by PCR

图2 OsGLP1-2蛋白的顺式作用元件分析Fig.2 Analysis of cis-acting elements of OsGLP1-2 protein
2.2.2 OsGLP1-2蛋白结构的预测与分析 蛋白的理化特性及结构决定了蛋白的功能。结果显示,OsGLP1-2蛋白含有216个氨基酸,分子式为C1016H1593N275O289S6,分子量为22.48 kDa,理论等电点(PI)为7.16,蛋白质不稳定性指数为28.42,表现为一种稳定蛋白。利用ExPASy的ProtScale软件对OsGLP1-2蛋白进行亲/疏水性分析显示该蛋白多肽链上的第109位分值最低,为-2.600;第12位分值最高,为2.900,亲水性平均系数为0.30,属于疏水性蛋白(图3)。
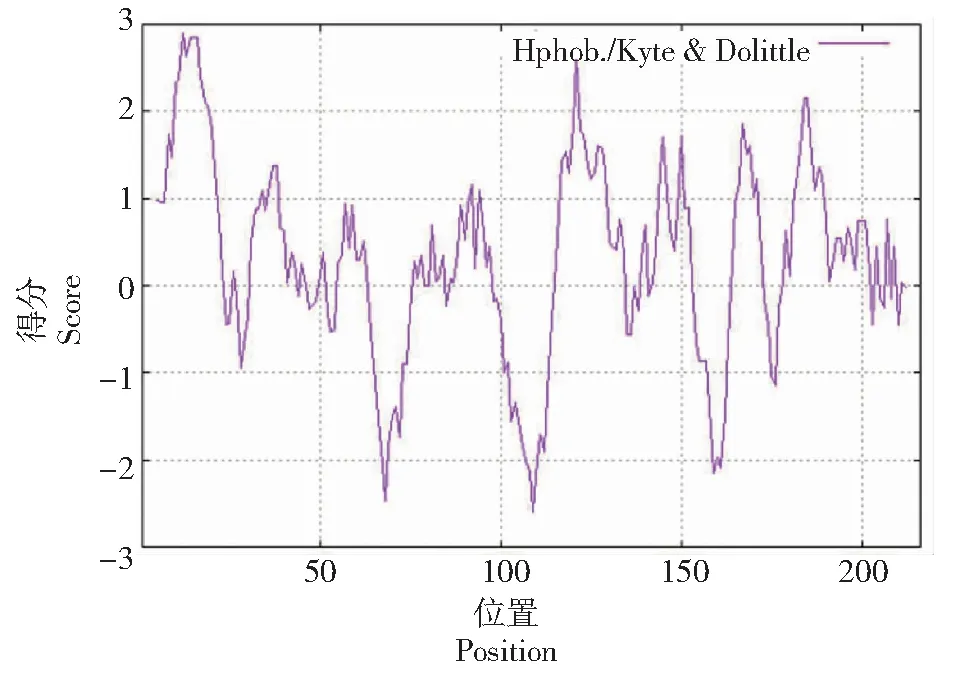
图3 OsGLP1-2蛋白亲/疏水性分析Fig.3 Analysis of affinity/hydrophobicity of OsGLP1-2 protein
利用Pfam数据库对 OsGLP1-2蛋白的结构域进行分析,结果表明该蛋白含有Cupin结构域。已有的研究表明Cupin结构域在调控植物生长发育和抗逆反应中起到多种重要作用[11]。通过Psipred在线数据库对OsGLP1-2蛋白二级结构进行分析,结果表明该蛋白含有10个β折叠、8个α螺旋和17个无规则的松散结构。根据OsGLP1-2蛋白的序列,本研究利用SWISS-MODEL构建了该蛋白的三维模型(图4)。

图4 OsGLP1-2蛋白的三级结构Fig.4 Tertiary structure of OsGLP1-2 protein
2.2.3 OsGLP1-2蛋白及其同源蛋白的保守基序及系统进化分析 蛋白结构,特别是功能域具有较高保守性的蛋白往往被归于同一蛋白家族,而这些蛋白在功能上往往也具有很高的保守性。为了进一步理解OsGLP1-2蛋白的功能,本研究通过Greenphyl和Phytozome两个数据库,利用Germin/Germin-like protein 共有且保守的Cupin蛋白结构域对水稻中具有该结构域的蛋白进行筛选,共获得42个同源蛋白,并进一步对该42个蛋白的保守基序进行分析。分析结果(图5)表明,这些蛋白共有10个保守蛋白基序(Motif 1~Motif 10)。其中基序Motif 4为所有蛋白均具有的保守基序,表明该基序为该家族蛋白共有的特征基序,且其是保证该家族保守功能的特定基序。本研究中的OsGLP1-2蛋白含有10个Motif中的1~7,表明该蛋白具备该蛋白家族的大多数保守基序,其应属于一个典型的Germin/Germin-like蛋白并可能具备该家族蛋白的典型功能。
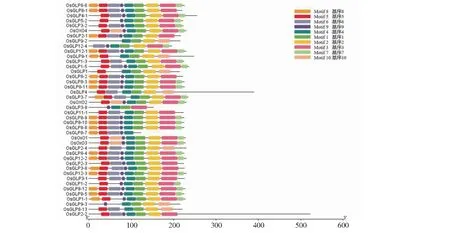
图5 水稻GLP同源蛋白家族保守基序Fig.5 The conserved motifs of GLP homologous proteins in rice
通过系统进化分析可知,水稻中的42个Germin/Germin-like蛋白,根据大麦的GLPs分类可分为6个亚家族,而OsGLP1-2与HvGER5a、OsGLP1-1、OsGLP1-2、OsGLP3-2和OsGLP5-2在进化上较为接近并组成了第5亚家族,且目的基因与HvGER5a共同组成了第3分枝(图6)。

*表示差异显著(P<0.5),**表示差异极显著(P<0.01)。*indicates significant difference(P<0.5),** indicates extremely significant difference.图7 Cd处理对水稻根部(A)和茎部(B)OsGLP1-2基因表达水平的影响Fig.7 The effect of Cd treatment on the expression levels of roots (A) and shoots (B) of OsGLP1-2

图6 OsGLP1-2同源蛋白的系统进化树分析Fig.6 Phylogenetic analysis of OsGLP1-2 homologous proteins
2.3 Cd处理条件下OsGLP1-2基因表达分析
研究结果表明,与未处理的对照组相比,在经过Cd 处理后的1、6、12 h,OsGLP1-2基因在根部的转录水平分别升高至处理前的1.5、3.1、2.7倍;而该基因在植物地上部分的转录水平则分别被上调至处理前的2.22、3.88、1.94倍(图7)。该结果表明,OsGLP1-2基因为Cd响应基因,其可能在植物应对Cd胁迫的过程中发挥作用。
2.4 转基因酵母对Cd的耐受性分析
酵母与植物细胞结构较为相似,因此常被用作模式生物。本研究为了验证转基因酵母对Cd的耐性测试,主要采用斑点实验来分析(图8),一共设置3个Cd浓度梯度,分别为0、50、100 μmol/L,由转基因酵母与空白组对照相比较,发现并无明显区别,结果表明该目的基因可能在酵母中对Cd没有耐受性或者是该基因在酵母中没有表型。

图8 转基因酵母斑点分析Fig.8 Spot analysis of transgenic yeast
3 讨 论
重金属胁迫会对水稻植株的生长发育以及光合作用等产生危害,其中Cd胁迫的危害尤为严重[12]。有研究表明,Cd胁迫不仅会对水稻植株的分蘖力、株高以及植株干物质的积累量等造成影响,也能与蛋白质中的-SH基结合,从而破坏叶绿体而影响植物的光合作用[13]。如何解决重金属Cd对水稻的影响已成为当今的研究热点,其中对水稻Cd响应基因的研究更为突出。
本研究通过生物信息学筛选并克隆得到一个水稻Cd响应OsGLP1-2基因。首先,通过结构域分析表明,该基因编码的蛋白含有Cupin_OXOX结构域,属于一个典型的Cupin家族蛋白。已有研究证实Cupin家族在植物信号传导、植物生长发育以及植物防御等方面发挥着重要作用,例如拟南芥中的AtPirin1(Cupin结构域蛋白)可以通过激活G蛋白与ABA竞争,从而促进种子的萌发和幼苗的早期发育[14]。还有研究表明含有具有槲皮素酶活性的Cupin结构域蛋白质(VdQase)能够调节大丽黄萎病菌的致病性,并有助于对抗宿主防御[15]。其次,通过对OsGLP1-2基因启动子区域的顺式作用元件分析表明,该基因启动子区域包括低温、干旱等逆境应激元件以及ABA等激素响应元件,相关研究表明,调节内源性ABA的生物合成水平可以降低水稻幼苗对Cd的吸收,因此OsGLP1-2是否可通过ABA信号通路在植物应对Cd胁迫的过程中发挥作用,仍需进一步的研究[16]。此外,系统进化树及基序分析结果表明,OsGLP1-2与HvGER5a和OsGLP1-1等亲缘关系较近。已有研究表明,HvGER5a基因编码的蛋白显示出SOD活性,能将超氧化物氧化成O2和H2O2,并且SOD已被证明与植物防御有关[11]。因此,OsGLP1-2可能具有SOD活性以应对水稻重金属胁迫压力。除此之外,GLP家族成员在蛋白基序上也具有一定差异性,表明该家族成员可能具有不同的生物学功能。
OsGLP1-2的qRT-PCR分析表明,该基因的表达量在100 μmol/L Cd处理的不同组织中总体呈上升趋势,由此推测该基因可能参与水稻应对Cd胁迫的调控过程。但是在水稻中OsGLP1-2基因以何种机制在重金属抗逆过程中发挥作用尚不明确,有待进一步的研究。转基因酵母Cd耐受性分析显示转基因酵母与对照组相比生长情况无明显差异。由于酵母细胞和植物细胞结构上存在一定差异,因此通过亚细胞定位预测发现该基因主要定位于水稻细胞壁,植物细胞壁主要由纤维素和果胶组成,而酵母细胞由β-葡聚糖、甘露寡糖、糖蛋白和几丁质组成[17-18]。因此OsGLP1-2在酵母中是否能表现出正常功能仍待进一步分析。同时,为了进一步探究OsGLP1-2在水稻中的具体功能,后续可构建水稻突变体植株,对其重金属耐受性进行进一步分析,以研究该基因在水稻中的Cd响应机制。
4 结 论
本研究筛选并克隆了一个类萌发素蛋白家族的OsGLP1-2基因。生物信息学分析表明该基因编码一个具有典型保守基序的类萌发素蛋白且属于水稻中类萌发素蛋白中的第5亚家族。OsGLP1-2基因启动子中具有与非生物胁迫相关的顺式作用元件,而通过对Cd胁迫后该基因转录水平的分析表明该基因为Cd响应基因。本研究为进一步探索水稻应对重金属胁迫的分子机制和生物学功能提供了参考。

