ANGPTL8敲除减轻DEN诱导的小鼠急性肝损伤
高玉玖 胡蓉 方晨 李盼盼 孟享 郭兴荣 冯莹
1湖北医药学院附属太和医院,基础医学院,胚胎干细胞研究湖北省重点实验室(湖北十堰442000);2湖北省十堰市太和医院肾内科(湖北十堰442000);3十堰市太和医院脐带血造血干细胞治疗临床医学研究中心(湖北十堰442000);4湖北医药学院生物医学工程学院(湖北十堰442000);5湖北医药学院第一临床学院(湖北十堰442000)
急性肝损伤是由感染、药物或酒精摄入过量等引起的以肝细胞功能受损为主要特征的临床综合征,是肝纤维化、肝硬化、肝癌等的重要诱因。由于其发病机制尚不明确,尚无特效治疗药物。进一步明确急性肝损伤发病机制,探索新型诊断标志物和治疗靶点,具有重要的临床意义。研究发现,急性肝损伤早期肝脏存在脂质代谢失衡[1],进而对细胞膜、脂蛋白及其他脂质结构产生严重损害[2],刺激炎症因子释放,引起肝细胞凋亡和坏死[3]。抑制细胞凋亡和逆转肝脏脂代谢紊乱可改善肝损伤[4]。血管生成素样蛋白8(ANGPTL8)是一种在肝脏和脂肪高表达的分泌性蛋白[5],主要参与调节糖脂代谢、炎症反应、癌细胞侵袭等过程[6]。最新研究发现,在高脂作用下,肝细胞分泌的ANGPTL8 可加速非酒精性脂肪性肝病(NAFLD)相关肝纤维化[7]。那ANGPTL8 是否在急性肝损伤中发挥作用呢?本研究致力于探索ANGPTL8 在N-二乙基亚硝胺(DEN)诱导急性肝损伤中的作用及机制。
1 材料与方法
1.1 材料
1.1.1 动物实验采用的雄性C57BL/6J小鼠(15日龄及8 周龄)由湖北医药学院实验动物中心提供,所有小鼠均饲养在SPF 级动物房[温度:20~25 ℃,湿度:(50±5)%,光照:12 h/12 h 光/暗循环]中,均可自由获取水和食物。本研究所有动物实验均按照湖北医药学院动物伦理委员会批准规程进行[批准号:SYXK(鄂)2021-0031]。
1.1.2 试剂DEN(55-18-5)购于阿拉丁生化科技公司。ANGPTL8 抗体(ab180915)购自abcam 公司。丙氨酸转氨酶(ALT)(C009-3-1)和天冬氨酸转氨酶(AST)(C010-3-1)检测试剂盒购于南京建成生物公司。活性氧(ROS)检测试剂盒(S0033S)、一步法TUNEL 细胞凋亡检测试剂盒(红色荧光)(C1089)均来源于碧云天。小鼠白细胞介素(IL)-6(ELMIL6-1)和IL-1β ELISA 检测试剂盒(ELM-IL1b-1)购自RayBiotech 生物公司。
1.2 实验方法
1.2.1 动物模型构建取8 周龄野生型(WT)和ANGPTL8 敲除(ANGPTL8 KO)小鼠分别3 只,给予单次腹腔注射DEN(50 mg/kg)诱导急性肝损伤模型。诱导3 d 后取材,利用PCR 检测肝脏组织中ANGPTL8 表达。取8 周龄WT 和ANGPTL8 KO小鼠分别3 只,给予DEN 诱导3 d 后提取肝原代细胞,利用免疫荧光技术检测ANGPTL8 表达。取15日龄WT 及ANGPTL8 KO 小鼠各32 只分为7 组:正常对照组(n= 8),DEN 24 h 组(n= 8),DEN 48 h组(n=4),DEN 72 h 组(n=3),DEN 7 d 组(n=3),DEN 10 d 组(n= 3),DEN 14 d 组(n= 3),每只小鼠给予单次腹腔注射DEN(50 mg/kg)。分离血清和肝组织标本,-80 ℃保存备用。取8 周龄WT及ANGPTL8 KO 小鼠各8 只分为两组:正常对照组(n= 4),DEN 48 h 组(n= 4),经过相同的DEN 处理,提取肝原代细胞,检测活性氧含量。
1.2.2 ALT 和AST 检测按照ALT 和AST 测试盒说明书通过微板法检测ALT和AST含量。将ALT和AST 的基质液在37 ℃预温,取20 μL 加入到96 孔板测定孔和对照孔中,取血清样本5 μL 加入到96 孔板测定孔中,37 ℃孵育30 min。加入显色液20 μL,37 ℃孵育20 min。加入终止液200 μL,室温放置15 min。酶标仪检测510 nm 的OD值,计算ALT 和AST 含量。
1.2.3 肝组织病理学HE染色分析取小鼠肝左叶,10%的甲醛固定,石蜡包埋切片,厚度为4 μm。HE染色,光学显微镜(Leica,Germany)观察,采用Suzuki 评分法对肝损伤程度进行病理学评分[8]。
1.2.4 肝细胞凋亡检测取小鼠肝右叶,4%多聚甲醛固定,30%蔗糖脱水,制备冰冻切片,采用TUNEL 试剂盒(碧云天)检测。光学显微镜(Leica,Germany)观察TUNEL 阳性细胞的数量,评估肝细胞凋亡水平。
1.2.5 肝原代实质细胞分离腹腔注射戊巴比妥钠(45 mg/kg)麻醉小鼠,无菌下开腹,暴露肝门静脉,经门静脉插管(连接装有HBSS 灌流液的蠕动泵),剪开下腔静脉,匀速灌洗肝脏,待肝脏变为土黄色后,更换为含0.05% Ⅳ型胶原酶的消化液,待肝脏表面出现条纹样纹理时终止消化。取下完整肝脏,置于DMEM 培养基中,分离肝组织,细胞筛过滤后离心,弃上清。PBS 重悬后离心,重复3 次以获取高纯度肝细胞。
1.2.6 肝细胞免疫荧光技术LPS(1 μg/mL)处理肝原代细胞,免疫固定液固定,ANGPTL8 抗体(ab180915,abcam)孵育过夜,PBS 漂洗,Alexa Fluor 488 标记山羊抗兔IgG(H+L)(A0423,碧云天)避光孵育,PBS 漂洗,显微镜观察,进行后期分析。
1.2.7 肝细胞ROS检测按ROS检测试剂盒说明书(碧云天)进行,重悬肝细胞于已稀释的DCFH-DA中,37 ℃孵育20 min,用无血清细胞培养液洗涤3次,刺激细胞20~30 min 后,利用流式细胞仪和激光共聚焦显微镜进行检测。使用488 nm 激发波长,525 nm发射波长,检测荧光强弱,并进行后期统计。
1.2.8 IL-6 和IL-1β 水平检测血清IL-6 和IL-1β通过ELISA 试剂盒进行检测。试剂平衡至室温,将血清样本加入酶标孔中,37 ℃避光孵育90 min,洗板;加入生物素化抗体,37 ℃避光孵育60 min,洗板;加入酶工作液,37 ℃避光孵育30 min,洗板;加入TMB,37 ℃避光孵育15 min,加入终止液终止反应,在波长450 nm 处检测吸光度值,根据标准曲线计算浓度。
1.2.9 实时荧光定量PCR(q-PCR)检测肝脏ANGPTL8 的mRNA 水平取10 mg 肝组织,根据Trizol 法提取RNA,逆转录为cDNA,染料法荧光PCR 检测。根据2-△△CT法计算ANGPTL8 的mRNA水平。
1.3 统计学方法本研究所有计量资料均用均值±标准差()来表示。采用GraphPad Prism 9.0分析数据。多组间比较采用单因素方差分析(One-Way ANOVA),以P<0.05 为差异有统计学意义。
2 结果
2.1 DEN上调ANGPTL8表达为了研究ANGPTL8在DEN 诱导小鼠急性肝损伤中的表达,利用DEN腹腔注射WT 小鼠3 d,诱导急性肝损伤模型,并通过q-PCR 检测肝脏组织中ANGPTL8 表达,结果发现DEN可显著上调ANGPTL8表达(图1A)。同时提取WT 小鼠肝原代实质细胞,经LPS 短期刺激诱导急性炎症反应,利用免疫荧光技术观察ANGPTL8表达情况,结果显示在LPS 刺激肝原代细胞4 h 后,ANGPTL8 表达明显升高(图1B)。以上结果表明DEN 可上调ANGPTL8 表达,提示ANGPTL8 在DEN诱导的急性肝损伤中发挥作用。
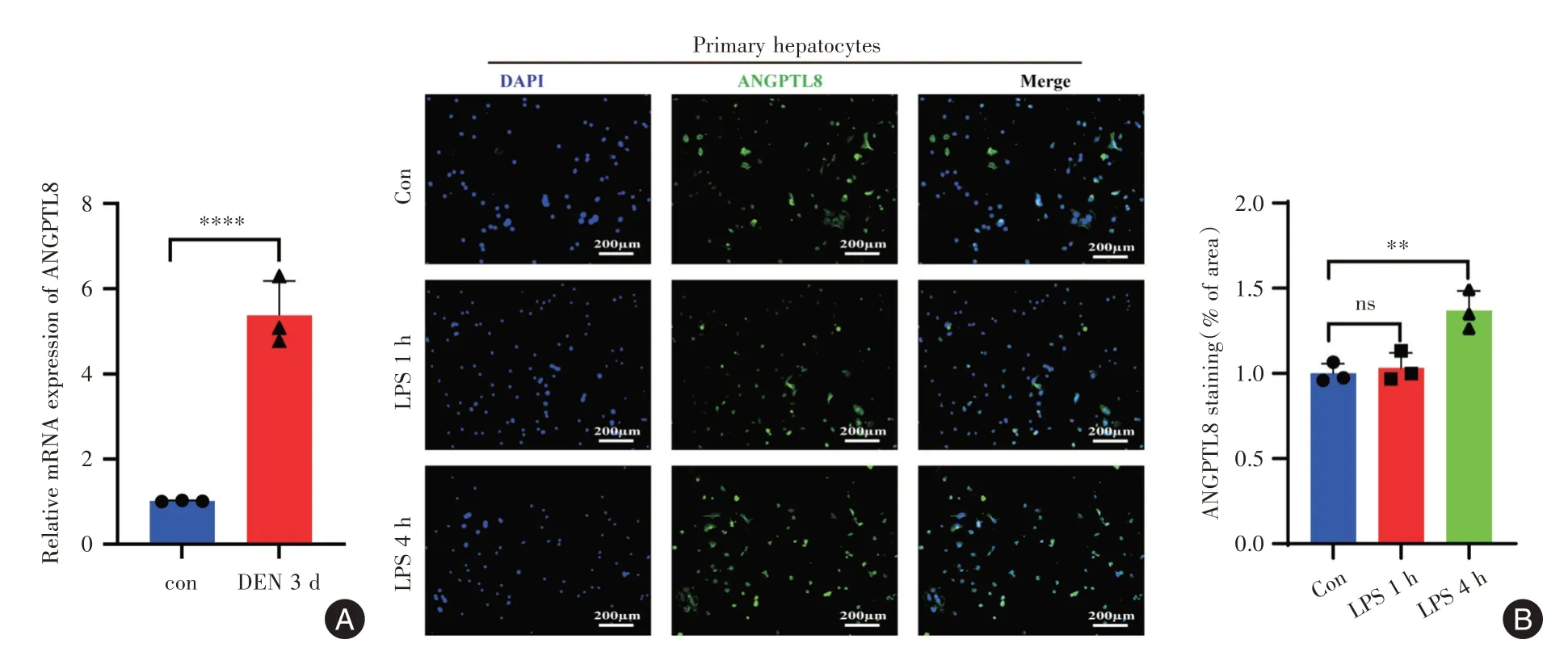
图1 DEN 上调ANGPTL8 表达Fig.1 DEN upregulates the expression of ANGPTL8
2.2 ANGPTL8 KO 减轻DEN 对小鼠急性肝细胞损伤程度血清转氨酶是反映肝损伤的敏感生物指标,检测小鼠ALT 和AST 水平可以反映小鼠肝损伤程度[9]。利用DEN(50 mg/kg)单次腹腔注射诱导急性肝损伤模型,血清检测结果发现ANGPTL8 KO 小鼠ALT 和AST 水平降低,且在DEN 诱导48 h差异最明显(图2A)。HE 染色观察肝损伤程度,结果显示,与WT 小鼠相比,ANGPTL8 KO 小鼠肝小叶紊乱程度较轻,并观察到炎症相关细胞浸润和肝细胞淤血、空泡样变、坏死程度减轻(图2B)。以上结果表明ANGPTL8 KO 可减轻DEN 对小鼠肝细胞的损伤程度。

图2 ANGPTL8 敲除可减轻DEN 诱导的急性肝损伤Fig.2 ANGPTL8 knockout attenuates DEN-induced acute liver injury
2.3 ANGPTL8 缺失抑制DEN 诱导的急性肝损伤中活性氧产生DEN 引起的肝损伤常伴有氧化应激和功能障碍,并伴随ROS 释放增多,破坏自由基和抗氧化剂之间原有平衡,导致肝细胞破坏,触发炎症反应[10]。利用流式细胞术(图3A)和激光共聚焦显微镜(图3B)分析急性炎症期WT 和ANGPTL8 KO 小鼠肝原代细胞中ROS 含量,以及加入重组ANGPTL8 蛋白(rANGPTL8)后ROS 含量。结果显示ANGPTL8 缺失可抑制DEN 诱导的肝细胞ROS 产生,而加入rANGPTL8 后肝细胞活性氧增加。

图3 ANGPTL8 敲除抑制DEN 诱导的ROS 产生Fig.3 Knockdown of ANGPTL8 inhibits DEN-induced ROS
2.4 ANGPTL8敲除减轻DEN诱导的急性肝损伤炎性因子表达大量ROS 累积会触发炎症,免疫细胞迁移到炎症部位会分泌大量炎性因子[11]。在DEN 刺激后,除可直接造成肝细胞损伤外,还可刺激IL-6 和IL-1β 等促炎因子表达,从而级联放大炎症反应、加重组织损伤[12]。检测ANGPTL8 在DEN诱导的肝脏急性炎症期对小鼠炎性因子表达的影响(图4),结果显示ANGPTL8 KO 可减轻DEN 诱导炎性因子IL-6 和IL-1β 表达。

图4 ANGPTL8 敲除可抑制炎性因子表达Fig.4 Knockout of ANGPTL8 inhibits the expression of inflammatory cytokines
2.5 ANGPTL8 促进DEN 诱导的急性肝损伤肝细胞凋亡取DEN 诱导的急性炎症期肝脏组织,冰冻切片进行TUNEL 染色检测细胞凋亡,结果发现在DEN 诱导48 h 后,ANGPTL8 KO 组中TUNEL 阳性细胞数显著低于WT 组(图5),表明ANGPTL8 可促进DEN 诱导的肝细胞凋亡。

图5 ANGPTL8 敲除抑制DEN 诱导的肝细胞凋亡Fig.5 ANGPTL8 knockout suppresses DEN-induced hepatocyte apoptosis
3 讨论
急性肝损伤指肝细胞出现急性损伤或坏死,进而引起肝功能异常,部分患者可导致肝衰竭。急性肝损伤病因复杂、发病机制尚不清楚,目前多采用消除病因或诱因、补充维生素、降酶保肝及中西医结合等对症支持治疗,但晚期预后极差。对急性肝损伤的早期预测及干预,有利于改善预后,降低其发病率和病死率。
近年研究发现,肝脏脂质代谢失调通过影响脂质过氧化、活性氧产生和炎症反应等调节肝损伤病理进程[13]。此外,长期肝细胞脂肪变性会导致肝细胞再生障碍甚至坏死,进而导致肝纤维化、肝硬化和肝癌[14]。最新研究证实,ANGPTL8 可调节肝星状细胞活性,参与高脂及炎症诱导的NAFLD相关性肝纤维形成过程,提示ANGPTL8 在肝脏脂代谢紊乱及炎症刺激引起的肝损伤中发挥作用[7]。本研究发现DEN 可增强肝脏ANGPTL8 表达,而ANGPTL8 缺失可以显著降低DEN 诱导的小鼠血清中转氨酶活性,减轻肝组织炎性病变。DEN可使肝细胞产生大量氧自由基,引起DNA 损伤,刺激炎症反应和过度增殖,导致长期慢性炎症引起肝纤维化,甚至肝癌发生[15]。因此,ANGPTL8 可能在DEN 诱导的急性肝损伤中发挥重要作用,抑制其表达具有保护作用。
在DEN 诱导的急性肝损伤发生发展过程中,活性氧迅速累积,触发炎症反应[16]。炎症反应激活后,免疫细胞迁移到炎症部位并迅速分泌大量炎症因子,导致“炎症风暴”,肝细胞通过凋亡途径,抑制炎症反应加剧[17]。本研究发现,ANGPTL8 KO 可显著减轻ROS 累积,抑制IL-6 和IL-1β表达,减少肝细胞凋亡。因此,糖脂代谢关键基因ANGPTL8 可能通过调控炎症反应促进肝损伤发生发展。
综上所述,ANGPTL8 KO 通过抗炎、抗凋亡等途径减轻DEN 诱导的急性肝损伤。ANGPTL8 作为急性肝损伤中重要致病因子,其抑制剂可能在急性肝损伤防治中具有潜在应用价值。本研究仅阐明了ANGPTL8 在DEN 短期刺激引起的急性肝损伤中的作用及机制,但其在DEN 长期诱导肝癌形成中的作用有待进一步探索。此外,ANGPTL8是分泌蛋白,其在急性肝损伤中是否与其他细胞(如枯否细胞和肝星状细胞等)协同调控免疫微环境,还需深入研究。
【Author contributions】GAO Yujiu performed the experiments and wrote the article.HU Rong,FANG Chen,LI Panpan,and MENG Xiang performed the experiments.GUO Xingrong revised the article.FENG Ying designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

