水稻PDL2的突变导致小穗外稃退化
赵梓钧,吴如会,王硕,张君,游静,段倩楠,唐俊,张新芳,韦秘,刘金艳,李云峰,何光华,张婷
水稻的突变导致小穗外稃退化
赵梓钧,吴如会,王硕,张君,游静,段倩楠,唐俊,张新芳,韦秘,刘金艳,李云峰,何光华,张婷
西南大学农学与生物科技学院/南方山地农业教育部工程中心,重庆 400715
【】小穗是禾本科植物特有的花器官。在水稻中,小穗作为花序的基本单位和独有结构,对水稻的产量和品质具有重要影响。因此,研究水稻小穗和花器官的发育,为水稻产量和品质的形成提供依据。【】使用甲基磺酸乙酯(ethyl methane sulfonate,EMS)诱变籼稻保持系西农1B,获得2个具有相似突变表型的水稻等位突变体和(和)。由于二者表型相似,选取(命名为)为材料,通过显微观察和石蜡切片技术分析其小穗突变表型;通过农艺性状考察分析小穗外稃突变对水稻产量的影响;通过图位克隆技术验证的功能;运用原位杂交技术及实时荧光定量PCR(RT-qPCR)技术分析的表达模式。【】表型分析结果表明,与野生型相比,突变体外稃明显变窄,不能与内稃紧密钩合,导致小穗开裂,内轮花器官部分裸露在外,但其雄蕊、雌蕊和浆片的形态和数量均表现正常。进一步的石蜡切片结果表明,突变体外稃硅化细胞和泡状细胞体积、数量的降低,以及维管束间距的减小,是导致外稃的宽度明显变窄的原因。农艺性状考察表明,外稃的变化最终引起籽粒呈水滴状,并使得突变体的结实率和千粒重等产量性状明显下降。遗传分析和图位克隆结果表明,是一个单隐性核基因,是位于水稻第4染色体的。该基因编码一个Dicer-like蛋白,在水稻ta-siRNA的合成途径中发挥重要作用,并且突变体是的一个新的弱等位突变。利用原位杂交技术及RT-qPCR技术进行的表达模式分析和基因功能分析结果表明,在水稻各轮花器官中组成型表达,该基因的突变不会影响水稻花器官特征的形成,但会干扰水稻ta-siRNA合成,影响水稻近-远轴极性建立相关基因的表达,从而导致突变体外稃近-远轴极性建立紊乱。【】水稻外稃退化基因的突变使得外稃近-远轴极性建立紊乱,影响小穗外稃的发育和产量性状的形成。
水稻(L.);小穗;外稃;图位克隆;功能分析
0 引言
【研究意义】水稻(L.)是世界上最重要的粮食作物之一,其小穗的发育对水稻的产量和品质至关重要[1]。在水稻中,小穗包含1个由四轮花器组成的可育顶生小花(1个外稃和1个内稃,2个浆片,6枚雄蕊和1枚雌蕊),1对护颖和1对副护颖[2-3]。其中,外稃和内稃构成水稻的颖壳,是禾本科植物独特的外轮花器官。颖壳的大小是种子大小的决定因素之一,其发育对水稻产量和品质的形成具有重要意义[4-5]。【前人研究进展】花器官特征基因的表达调控花器官的生长和发育,进而影响小花的形成。以往研究发现,在水稻花器官的发育过程中,有ABCDE五类基因参与,其功能与双子叶植物相似。其中,A类和E类基因与外稃和内稃的发育有关[6]。到目前为止,已经克隆了3个A类基因。和被证明是内稃特性所必需的,二者的双突变体表现为小穗缺失[7]。在所有组织中广泛表达,在水稻中过量表达会导致提前开花[8]。水稻中有至少5个E类基因,其中突变体具有叶状的外稃和内稃,浆片伸长,呈稃片状[9]。与之相似,突变也会使小穗转化为叶状结构[10]。和功能冗余,二者的双突变体浆片、雄蕊和心皮转化为稃片状器官[11]。突变体分枝和小穗的排列混乱,护颖和副护颖伸长,表明其对小穗发育具有重要调控作用[12]。此外,ta-siRNA的合成途径也调控颖壳的发育。在拟南芥中,ta-siRNA的产生是由特定的miRNA- AGO复合物对TAS转录本上miRNA靶位点的切割引起的。断裂的单链在RDR6和SGS3蛋白的作用下合成双链RNA,再在DCL4蛋白的切割下生成21 nt的ta-siRNA[13-14]。在水稻的ta-siRNA合成途径中,发挥了重要作用。该基因编码一个Dicer-like酶,可以对双链RNA进行切割,是ta-siRNA产生的直接作用蛋白[15]。突变将导致ta-siRNA途径受阻,进而影响miR166、等近-远轴极性发育相关调控因子的积累,最终导致水稻器官极性发育缺陷。例如,水稻编码拟南芥DCL4的同源蛋白,外稃的发育因近轴面发育缺陷而受到阻碍,从而变成棒状[16-17]。此外,水稻ta-siRNA合成途径中其他基因的突变也会造成水稻外稃发育异常。在水稻中编码拟南芥RDR6的同源蛋白,介导双链RNA的产生。在突变体中,由于雄蕊和外稃的近-远轴极性发育的缺陷,外稃退化为芒状或杆状甚至消失[18-19]。编码拟南芥AGO7的同源蛋白,它能特异性地与miRNA结合并参与ta-siRNA的合成。发芽后叶片异常,茎顶端分生组织变扁平,外稃呈芒状,内稃退化[20]。由此可见,水稻ta-siRNA合成途径可以通过调控颖壳和叶片的极性来影响其形态发育。【本研究切入点】尽管已有较多水稻小穗发育相关基因已被克隆,但这些基因的调控网络以及与水稻产量的关系仍需进一步完善。【拟解决的关键问题】本研究利用EMS诱变水稻籼稻保持系西农1B,得到2个水稻外稃退化等位突变体和,二者外稃明显变窄,不能与内稃紧密钩合,导致小穗开裂,内轮花器官部分裸露在外。由于二者表型相似,选取(命名为)进行深入研究,并通过表型分析、农艺性状考察、图位克隆、表达模式分析等方法对进行克隆和功能分析,探究在调控水稻外稃发育和产量形成中的作用,为水稻产量和品质的形成提供依据。
1 材料与方法
1.1 试验材料
试验于2018年7月至2022年6月在西南大学水稻研究所开展。水稻小穗突变体是利用化学诱变剂甲基磺酸乙酯(EMS)诱变水稻籼稻保持系西农1B获得,其经过多代自交至性状能够稳定遗传。所用试验材料均来自于西南大学水稻研究所和海南试验田。
1.2 形态学与组织学分析
取开花期野生型和突变体幼穗。在体视显微镜下进行解剖,观察小穗、花器官的形态。用扫描电子显微镜(Hitachi SU3500)在-40℃冷冻条件下观察小穗及花器官形态。
石蜡切片被用于组织学分析。分别取不同时期的野生型和突变体小穗并快速放进FAA固定液中,抽真空后置于4℃保存24 h。经乙醇逐级脱水及二甲苯进行透明处理后,再进行浸蜡和包埋。将样品切成8 μm的切片,用番红-固绿对染法进行染色后封片。42℃烘箱烘片2 d,利用光学显微镜(Nikon E600)进行观察并拍照。
1.3 图位克隆
1.3.1 遗传分析 在试验田配制突变体与籼稻56S的杂交组合,统计F1和F2性状,利用χ2检验分析正常表型和突变表型的分离比。
1.3.2 连锁分析 在开花期,从×56S的F2分离群体中随机挑选10株正常表型单株与10株突变表型单株构建正常池和突变池,用CTAB法提取2个基因池和亲本DNA。利用研究所长期保存的均匀分布在水稻12条染色体的SSR及InDel引物、Vector NTI Advance 11.5软件和Gramene数据库(http://www. gramene.org/microsat)筛选亲本间的多态性。
1.3.3 基因定位和连锁图谱构建 从试验田中挑选出F2中的突变表型单株,每个单株取幼嫩叶,采用碱煮法快速提取DNA。用1.3.2中已经筛选出的连锁引物对定位群体进行PCR扩增。随后利用聚丙烯酰胺凝胶电泳检测,进行目的基因的初步定位。在已确定的初步定位区间内进一步开发InDel标记,从而精细定位目的基因。
1.4 转基因互补验证
构建并转化候选基因互补载体,将经过GUS染色鉴定的阳性植株种植于歇马西南大学水稻研究所基地,在成熟期分析转基因植株的表型。从gramene数据库下载候选基因序列。使用Vector NYI Advance 10设计正向引物PDL2com-F和反向引物PDL2com-R,以野生型DNA为模板进行PCR扩增,PCR产物经凝胶提取试剂盒(天根生化技术公司)进行纯化。用互补载体pCAMBIA1301原菌液进行摇动复制,提取质粒,用Ⅰ和Ⅰ限制性内切酶进行酶切,用重组酶进行连接和转化,选择阳性菌株送至重庆清科公司进行测序。采用农杆菌介导法将构建的载体转入2突变体。转化和分化过程由武汉博源公司完成。引物序列见电子附表1。
1.5 RT-qPCR分析
利用RNAprep Pure Plant Kit(天根生化技术公司)提取总RNA。用带有gDNA Eraser(TaKaRa)的PrimeScript试剂盒将纯化后的RNA反转录成cDNA。以此为模板,加入引物混合物、SYBR Green荧光染料和无RNase水,每个组合设置3个重复,以为内参基因,使用Bio-Rad荧光定量PCR仪进行扩增。RT-qPCR分析所用引物序列见电子附表1。
1.6 原位杂交
设计引物,制备探针模板,使用罗氏DIG RNA Labelling Kit,体外合成带地高辛标记的RNA探针(引物序列见电子附表1)。切片的预处理、杂交和免疫学检测均按照Sang等[21]方法进行。
2 结果
2.1 开花期pdl2突变体的表型分析
与野生型相比,突变体的外稃退化,整体变窄,轻微弯折,无法与内稃钩连,形成开裂状小花,使得部分内轮花器官裸露在外(图1-A、图1-B、图1-J和图1-K)。剥去颖壳后,可以观察到花器官内部的雄蕊、雌蕊和浆片的形态和数量均表现正常(图1-C和图1-L)。扫描电镜结果显示,突变体内外稃表层细胞及毛状结构与野生型无异(图1-D—F和图1-M—O)。石蜡切片分析结果显示,虽然突变体小花的外稃与野生型一样都具有4层细胞,但突变体外稃的硅化细胞数量减少,泡状细胞的体积、数量均显著降低,维管束间距减小,从而导致外稃的宽度明显变窄,使之不能与内稃紧紧钩连,最终造成颖壳开裂,内轮花器官暴露在外(图1-G—I和图1-P—R)。综上所述,突变体的外稃退化,表明对水稻外稃发育具有重要影响。
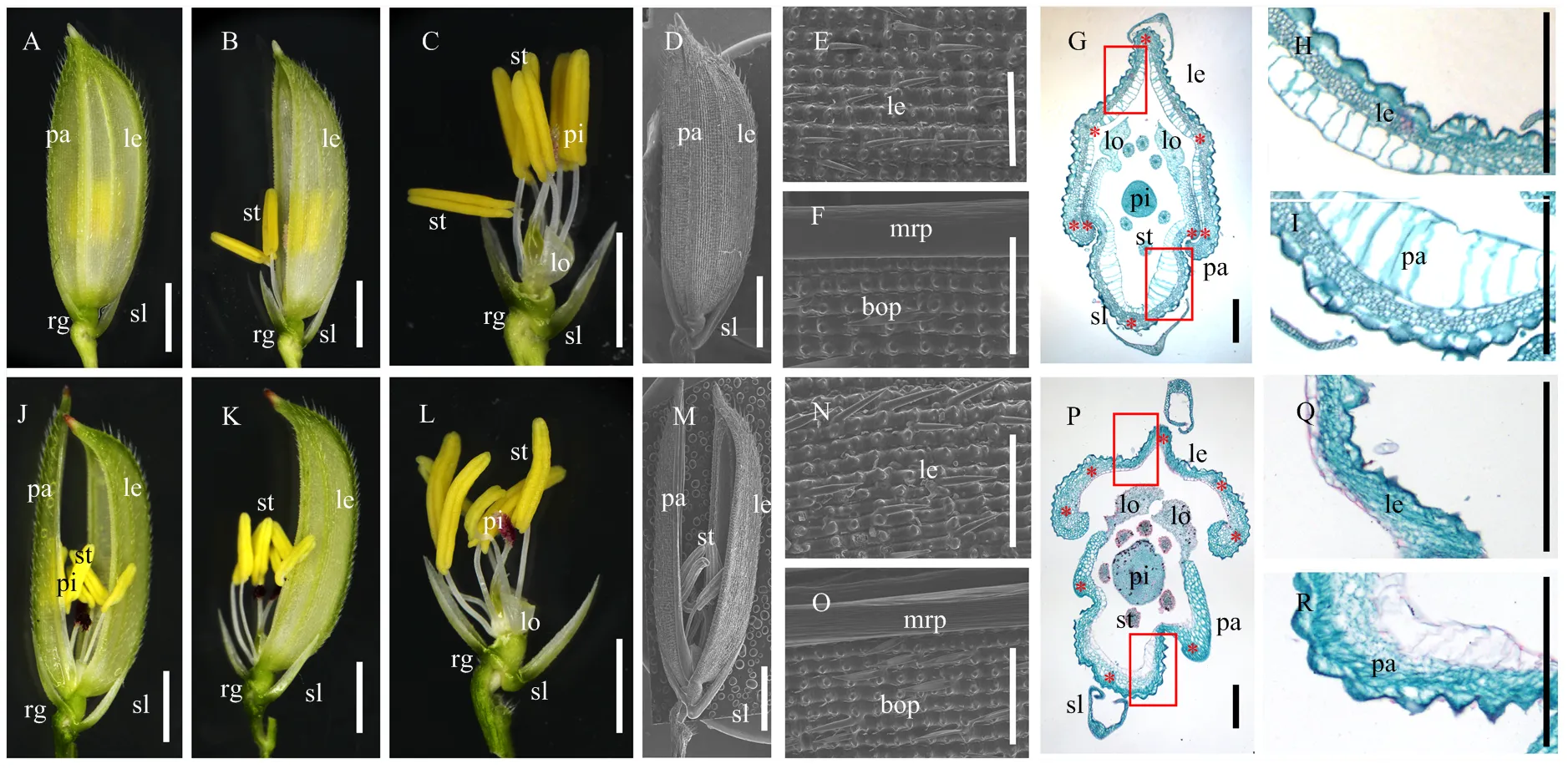
A—C:野生型小穗(A)、剥去内稃(B)、剥去外稃和内稃(C)体视镜照片;D—F:野生型小穗(D)、外稃(E)、内稃(F)扫描电镜照片;G—I:野生型小穗横切面(G)及外稃(H)、内稃(I)局部放大;J—L:pdl2小穗(J)、剥去内稃(K)、剥去外稃和内稃(L)体视镜照片;M—O:pdl2小穗(M)、外稃(N)、内稃(O)扫描电镜照片;P—R:pdl2小穗横切面(P)及外稃(Q)、内稃(R)局部放大。红色方框表示放大范围;红色星号表示维管束。le:外稃;pa:内稃;rg:副护颖;sl:护颖;st:雄蕊;pi:雌蕊;lo:浆片;mrp:内稃边缘;bop:内稃主体。下同。A—D、J—M的标尺=2 mm;E—F、N—O的标尺=400 μm;G—I、P—R的标尺=200 μm
2.2 pdl2突变体植株的农艺性状分析
在成熟期,与野生型相比,株型整体紧凑,叶片直立(图2-A);穗型较直立,且绝大部分一次分支靠近基部约1/3的长度无小穗着生(图2-A—B);成熟籽粒的颖壳开裂,糙米上窄下宽,呈水滴状(图2-C—D)。对野生型及突变体进行考种统计,发现相较于野生型,株高减少了0.03 cm,穗长增加了0.09 cm,均无显著差异(图2-E—F);一次分枝数量减少了10.7%,达到显著水平,二次分枝数量减少了12.5%,结实率降低了53.9%,均达到极显著水平(图2-G—I)。籽粒长度与野生型相差不大甚至略微增加,但其糙米粒长比野生型缩小了21.6%(图2-J—K);籽粒宽度增加了19.0%,糙米粒宽减少了22.2%(图2-L—M)。剥壳前千粒重和糙米千粒重分别减少了72.8%和78.3%(图2-N—O),均达到极显著水平。因此,在水稻小穗发育中起着重要作用,进而直接影响籽粒形成,改变水稻产量。
2.3 小穗发育早期的形态学观察
利用扫描电子显微镜对野生型和突变体小穗的发育早期进行观察。Sp4时期,野生型小穗的外稃和内稃原基先后开始发育,突变体也发育正常(图3-A和图3-E)。Sp5—Sp6时期,野生型小穗的外稃和内稃钩连在一起,此时期同时形成5个球形雄蕊原基;而突变体小穗的花器官发育正常,但外稃明显变窄(图3-B和图3-F)。Sp7时期,野生型小穗的外稃进一步发育,雌蕊原基开始发育,而突变体小穗的外稃相较于野生型和上一时期则变得更窄(图3-C和图3-G)。Sp8时期,野生型小穗的内外稃彻底钩合在一起,将内轮花器官紧紧包裹在内,而突变体小穗外稃明显变窄,内外稃无法紧密钩连,不能包裹内轮花器官(图3-D和图3-H)。整个发育阶段内,突变体小穗的内轮花器官均发育正常。综上,突变体外稃的退化缺陷在小穗发育早期就已显现出来。
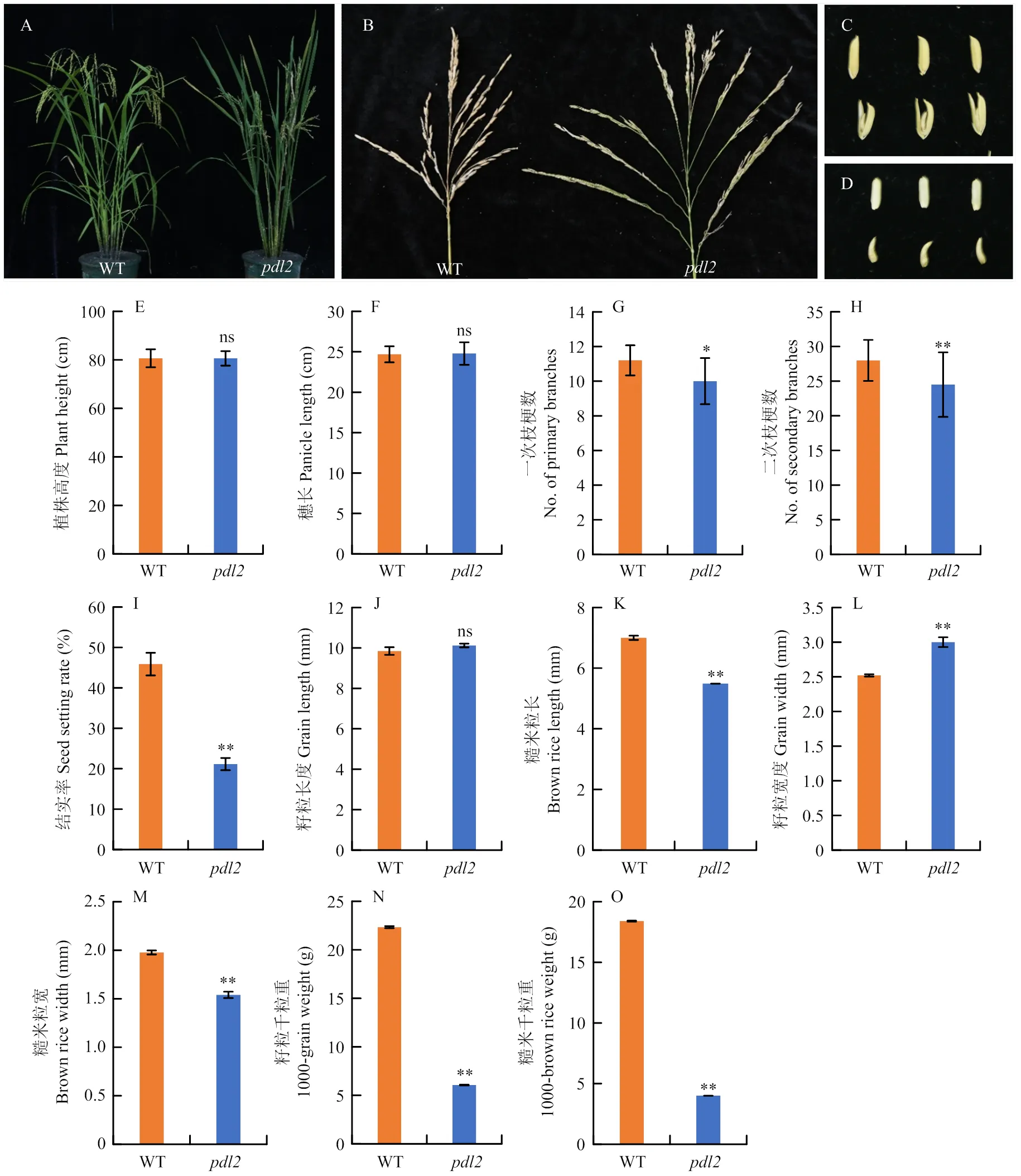
A—D:野生型和pdl2株型(A)、穗型(B)、籽粒(C)、糙米(D);E—O:野生型和pdl2相关农艺性状统计。P值通过学生氏t检验确定。*:P≤0.05;**:P≤0.01;ns:无显著性差异。下同
2.4 PDL2的图位克隆
用56S与突变体进行杂交,F1表现正常,F2群体出现突变表型分离。在2 011株F2植株中,共有正常表型1 493株,突变表型518株,经卡方检验,分离比符合3﹕1(χ2=0.58<χ20.05, 1=3.84),表明突变体的表型由一个单隐性核基因控制。以F2群体中的518个隐性单株作为定位群体,利用SSR标记进行基因初步定位,发现候选基因与第4染色体的SSR标记RM3524和RM5320连锁(图4-A)。进一步开发InDel引物(引物序列见电子附表2)对进行精细定位,最终将定位在第4染色体ln1-25.30和ln1-25.56之间约186 kb的区间内(图4-B—C)。根据Gramene网站提供的基因注释信息,在该区间内共有30个注释基因(图4-D)。通过对这30个基因进行分析,发现其中包含(),而已有研究表明,该基因编码Dicer like蛋白,参与水稻ta-siRNA的合成,进而调控水稻颖壳极性发育。因此,通过对序列进行分析,发现突变体在第14个外显子上发生单碱基替换,使得亮氨酸突变为脯氨酸;突变体第16与第17个外显子之间的内含子的边缘区域发生了单碱基替换(图4-E—F)。进一步构建包含全长序列的互补载体,并转入突变体。结果表明,阳性转基因植株小穗恢复正常,与野生型相似(图4-G)。综上,是的一个新的等位基因。
2.5 PDL2的表达模式分析
通过RT-qPCR分析,在根、茎、叶、鞘、穗等多种组织中均组成型表达,且在小穗中表达量最高(图5-A)。进一步分析在小穗各轮花器官中的表达情况,发现其在外稃、内稃、雌蕊、雄蕊和浆片中均表达(图5-B)。为了更详细地分析的表达模式,进行原位杂交试验,发现其在水稻小穗分生组织中存在强烈信号(图5-C—F)。Sp4时期,内稃开始发育,在护颖、外稃、内稃中高度表达(图5-C)。在Sp5时期,在护颖、副护颖、内外稃及分生组织中均有所表达。Sp5时期后,浆片、雄蕊、雌蕊依次开始形成,在这些部位均检测到强烈的信号(图5-D—F)。结果表明,在各轮器官中组成型表达。
2.6 花器官发育特征基因的表达分析
为了研究突变体的花器官特性,采用RT- qPCR检测花器官发育特征基因在野生型和突变体中的表达情况。是一种外稃特征基因,主要在野生型和突变体的外稃和内稃中表达(图6-A)。和是外稃和内稃特征基因,在野生型和突变体的外稃、内稃中均能检测到这两个基因的信号(图6-B—C)。以上结果表明,突变体外稃的形态和大小虽发生改变,但特征仍然存在。是内稃边缘区特征基因,其在野生型和突变体的内稃中均有表达,表明突变体的内稃特征正常(图6-D)。和在雄蕊、雌蕊及浆片的发育中发挥重要作用,这两个特征基因在野生型和突变体的雌蕊中均有显著表达,表明突变体的雄蕊和雌蕊发育正常(图6-E—F)。因此,的突变对花器官的特征发育无明显影响。
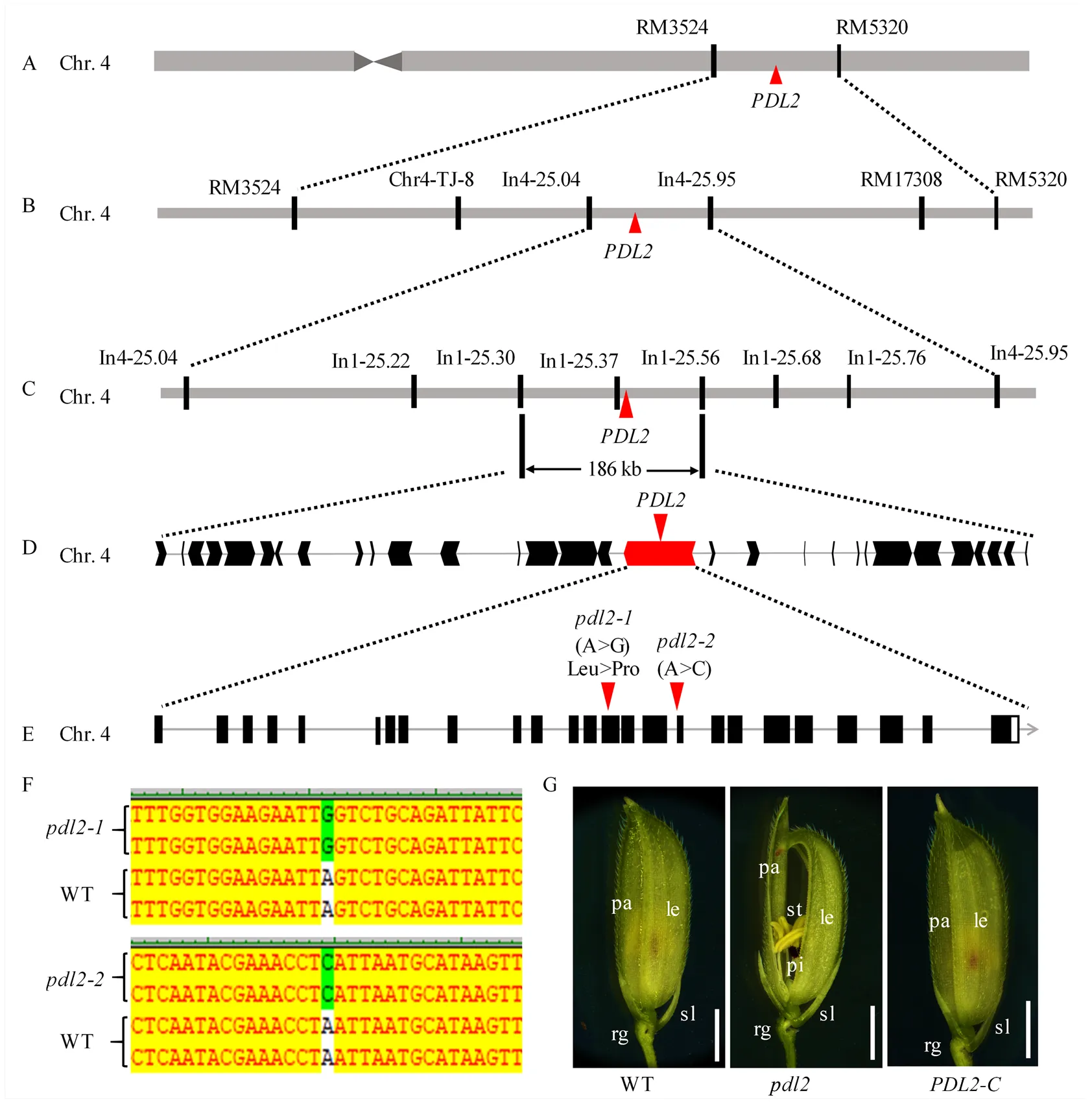
A—E:PDL2的图位克隆;F:突变位点预测;G:PDL2互补验证。标尺=500 μm
2.7 近-远轴极性建立特征基因的表达分析
图位克隆结果显示,是的一个新的等位基因。前人研究表明,是ta-siRNA合成途径的重要基因,而ta-siRNA能对ARF()基因进行负向调控,从而影响植物器官近-远轴极性建立。因此,对一些决定近-远轴极性建立的基因在野生型和突变体外稃中的表达量进行了qPCR分析。ARF基因决定远轴面特征,对该类基因的检测结果显示,///在突变体中的表达量均上调,其中,和上调明显,达到极显著水平(图7-A—D)。这表明突变后,可能阻碍了ta-siRNA合成途径,从而减少了对ARF基因的抑制,进而增强了远轴面特性。KANADI家族基因是远轴面发育所必需的,qPCR结果显示,在突变体中,-表达量上调,均达到极显著水平(图7-E—I)。因此,突变后可能导致突变体外稃近-远轴极性建立紊乱,从而引起外稃形态发育缺陷。
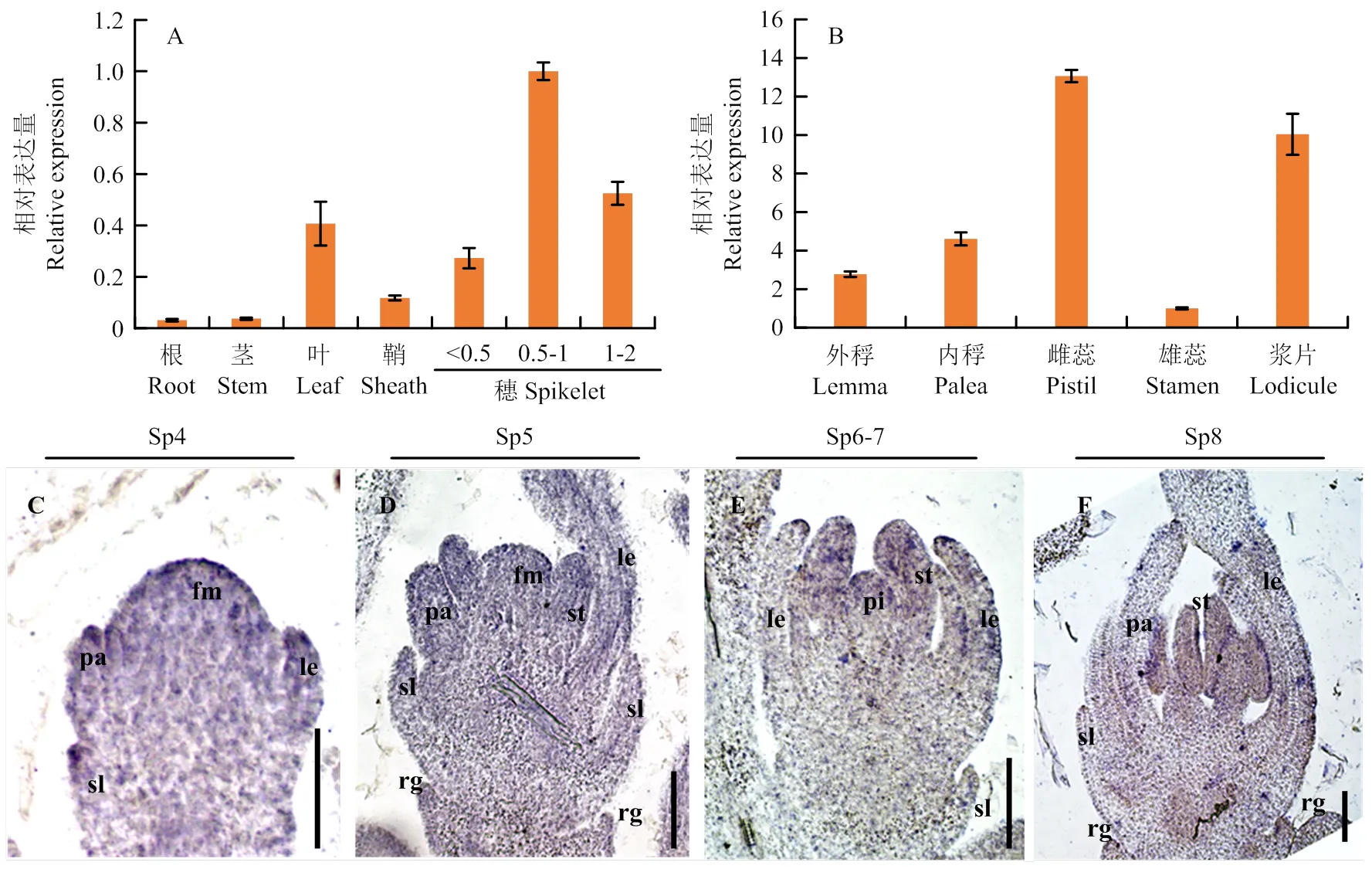
A—B:PDL2的相关表达水平;C—F:PDL2在野生型小穗中的原位杂交。标尺=50 μm
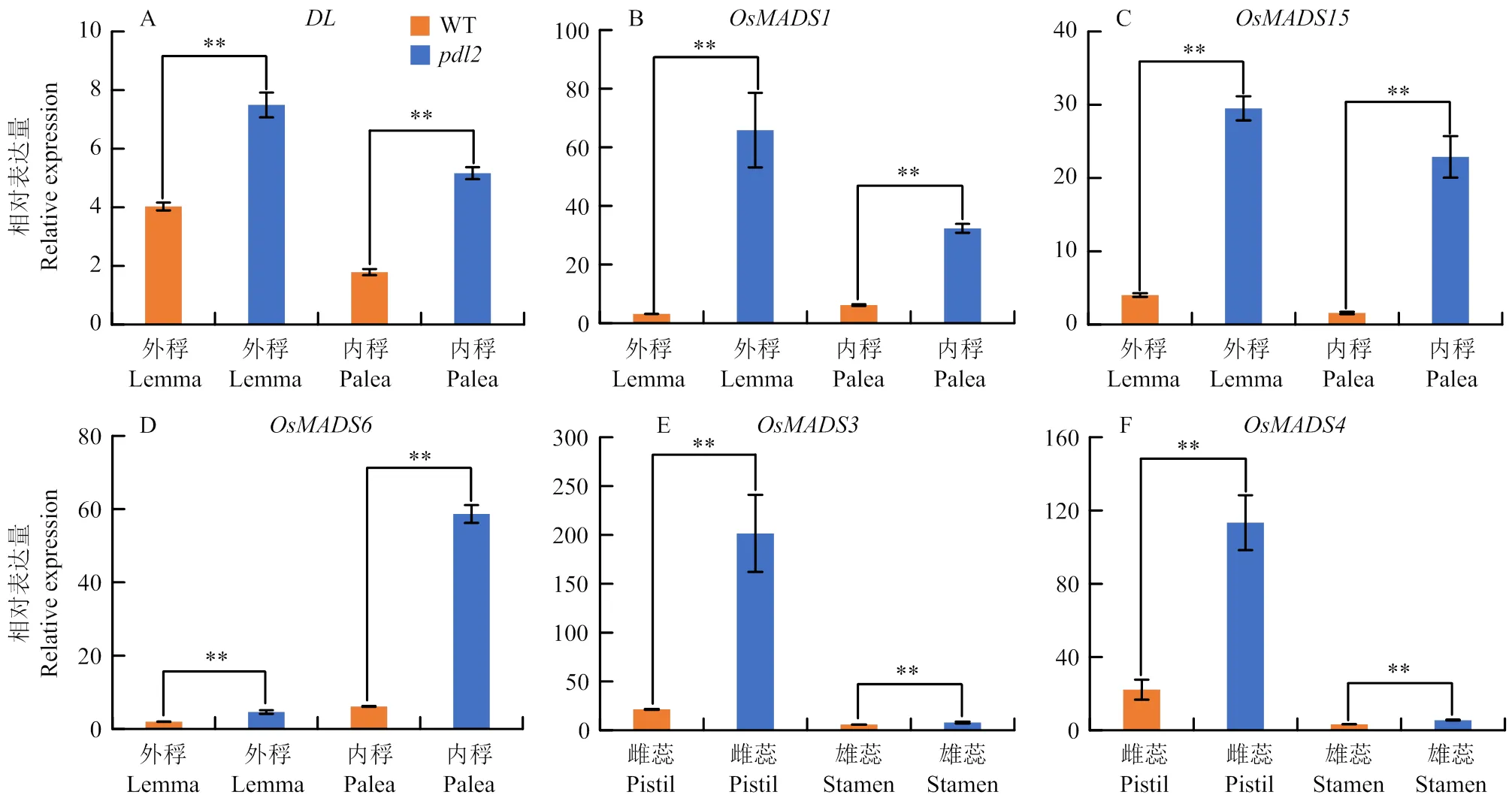
A:外稃特征基因DL的相对表达水平;B—C:外稃和内稃特征基因OsMADS1(B)和OsMADS15(C)的相对表达水平;D:内稃边缘区特征基因OsMADS6的相对表达水平;E—F:雄蕊和浆片特征基因OsMADS3(E)和OsMADS4(F)的相对表达水平

A—D:ARF家族基因的相对表达水平;E—I:KANADI家族基因的相对表达水平
3 讨论
3.1 pdl2颖壳发育缺陷影响籽粒产量
由外稃和内稃共同组成的颖壳是禾本科植物所特有的外轮花器官,其形状和大小决定籽粒的形状和大小,直接影响了水稻产量。当颖壳发育缺陷时,内外稃无法紧密钩合在一起,产生的籽粒大多比正常籽粒要小,种子生活力和发芽率也都降低。到目前为止,已经克隆了一些颖壳发育缺陷的突变体,如编码类EMF1蛋白,突变体的小穗表现为内稃萎缩和糙米畸形[22]。编码单C2H2锌指蛋白,突变体产生不同数量的、具有不同性状的心皮或心皮样组织,外稃和内稃的横向生长均受到限制,颖壳开裂而不封闭[23]。编码一个核定位的AT钩DNA结合蛋白,突变体内稃的主要结构被破坏,导致内稃退化为叶状器官[24]。编码一个DUF640蛋白,突变体的外稃弯曲,颖壳变长,不能完全关闭[25]。而本研究所讨论的突变体外稃硅化细胞体积减小,泡状细胞的体积、数量均有所降低,从而导致外稃明显变窄,使之不能紧紧钩连住内稃,最终造成颖壳开裂,内轮花器官暴露在外。这一突变也对籽粒产量产生了极大影响,导致糙米畸形,呈弯曲状,粒长、粒宽及千粒重均极显著降低。
3.2 pdl2是OsDCL4一个新的弱等位突变
本研究图位克隆结果表明,定位于编码Dicer like(DCL)蛋白的,该基因包含1个Helicase结构域、1个DUF283结构域、1个PAZ结构域、2个RNaseⅢ结构域和1-2个dsRBD结构域,分别参与双链RNA的解旋、siRNA/miRNA链的选择、RNA链的识别和结合、RNA链的切割和与其他蛋白的结合[26-27]。目前,已鉴定出数个关于该基因的等位突变体。NAGASAKI等[28]鉴定出8个水稻突变体,其中,3个突变位点位于编码Helicase结构域的序列中,1个突变位点位于编码PAZ结构域的序列中,1个突变位点位于编码RNaseⅢ结构域的序列中,1个突变位点位于编码dsRBD结构域的序列中,剩余2个突变位点位于非编码序列中。这些突变体茎顶端分生组织不完整,发芽后叶片异常。2008年,Liu等[16]鉴定了一个突变体,该突变体在的启动子区,5’非编码区和第一个外显子的前72 bp存在1 428 bp的缺失,导致其植株矮小,幼年期叶片发育异常,小穗外稃退化为棒状,并且产生远轴化特征。而本研究鉴定了2个全新的等位突变体和,其突变位点分别位于第14个外显子上以及第16与第17个外显子之间的内含子的边缘区域,其中,前者的突变位点位于编码DUF283结构域的序列中,后者的突变位点虽然不在外显子区域,但其位于内含子区域的边界处,可能影响mRNA的转录后修饰过程,从而产生突变表型。此外,与之前报道的突变体不同,表型分析结果显示,为一个全新的弱等位突变,该突变体外稃部分退化,整体变窄,但并未完全退化为棒状,仍在一定程度上保留了外稃的形态特征。因此,该突变体仍然是可育的,可以产生种子。
3.3 pdl2突变体中ta-siRNA合成途径缺陷,导致外稃近-远轴极性建立紊乱
编码的Dicer-like蛋白是植物ta-siRNA途径中必不可少的一类酶。已有研究表明,水稻ta-siRNA合成途径相关基因的突变会引起内稃和外稃发育异常。-突变体外稃退化,转变为棒状[16];突变体外稃转变为针状结构,芒显著伸长,该突变体在中存在突变,而这一基因编码水稻RdRP蛋白[18];-突变体对温度敏感,其外稃在外界气温高于32℃后退化为芒状,且随着温度升高表型会越发严重。在上述突变体中,的表达量均有不同程度上升或在近轴面异位表达,外稃均呈现出远轴化特性,表明在水稻中ta-siRNA合成途径相关基因突变会导致其对的抑制效果减弱,进而产生远轴化特征。本研究所讨论的突变体中不同表达量也都上调,表明突变体外稃呈现出远轴化特性。前人研究表明,ta-siRNA途径缺陷影响miRNA166的积累,进而影响HD-ZIPⅢ家族基因的表达[29]。而在拟南芥中,HD-ZIPⅢ家族KANADI基因家族存在拮抗作用[30],但二者关系在水稻中似乎未被讨论。最近的一项研究表明,OsKANADI1可以促进的表达,其与tasiR-ARFs(靶基因为和的ta-siRNA)共同作用,确保表达恰当[31]。而在本研究中,表达上调,且(即)在所有中上调表达最为显著,也为这一结论提供了新的证据。
4 结论
水稻突变体外稃退化,硅化细胞数量减少,泡状细胞的体积、数量降低,导致其整体变窄,轻微弯曲,两侧钩状结构发生退化,无法与内稃紧密钩合,形成开裂状小花,使得部分内轮花器官裸露在外。突变体籽粒畸形,糙米千粒重极显著降低。是的一个新的等位基因。突变体花器官特征仍然存在,而对近-远轴极性建立特征基因的表达水平分析显示突变影响外稃近-远轴极性建立。
[1] Fageria N K. Yield physiology of rice. Journal of Plant Nutrition, 2007, 30(4/6): 843-879.
[2] Zhuang H, Wang H L, Zhang T, Zeng X Q, Chen H, Wang Z W, Zhang J, Zheng H, Tang J, Ling Y H, Yang Z L, He G H, Li Y F.encodes a C2H2Zinc finger protein that regulates spikelet development in rice. The Plant cell, 2020, 32(2): 392-413.
[3] ZHANG T, LI Y F, MA L, SANG X C, LING Y H, WANG Y T, YU P, ZHUANG H, HUANG J Y, WANG N, ZHAO F M, ZHANG C W, YANG Z L, FANG L K, HE G H.induced the three-florets spikelet in rice. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(37): 9984-9989.
[4] LUAN X, KE S W, LIU S C, TANG G J, HUANG D H, WEI M Y, ZHANG Y X, QIN G, ZHANG X Q., a leucine-rich repeat extensin protein, functions in the regulation of caryopsis development and quality in rice. Crop Journal, 2022, 10(3): 704-715.
[5] YU H P, RUAN B, WANG Z W, REN D Y, ZHANG Y, LENG Y J, ZENG D L, HU J, ZHANG G H, ZHU L, GAO Z Y, CHEN G, GUO L B, CHEN W F, QIAN Q. Fine mapping of a novel() mutant, which affects vegetative and spikelet development in rice. Frontiers in Plant Science, 2017, 8: 486.
[6] YOSHIDA H, NAGATO Y. Flower development in rice. Journal of Experimental Botany, 2011, 62(14): 4719-4730.
[7] WU F, SHI X W, LIN X L, LIU Y, CHONG K, THEISSEN G, MENG Z. The ABCs of flower development: mutational analysis of-like genes in rice provides evidence for a homeotic (A)-function in grasses. The Plant Journal, 2017, 89(2): 310-324.
[8] FORNARA F, PARENICOVA L, FALASCA G, PELUCCHI N, MASIERO S, CIANNAMEA S, LOPEZ-DEE Z, ALTAMURA M M, COLOMBO L, KATER M M. Functional characterization of, a member of thesubfamily of MADS box genes. Plant Physiology, 2004, 135(4): 2207-2219.
[9] JEON J S, JANG S, LEE S, NAM J, KIM C, LEE S H, CHUNG Y Y, KIM S R, LEE Y H, CHO Y G, AN G.is a homeotic mutation in a rice MADS box gene affecting rice flower development. The Plant Cell, 2000, 12(6): 871-884.
[10] WU D, LIANG W Q, ZHU W W, CHEN M J, FERRANDIZ C, BURTON R A, DRENI L, ZHANG D B. Loss of LOFSEP transcription factor function converts spikelet to leaf-like structures in rice. Plant Physiology, 2018, 176(2): 1646-1664.
[11] CUI R F, HAN J K, ZHAO S Z, SU K M, WU F, DU X Q, XU Q J, CHONG K, THEISSEN G, MENG Z. Functional conservation and diversification of class E floral homeotic genes in rice (). The Plant Journal, 2010, 61(5): 767-781.
[12] KOBAYASHI K, MAEKAWA M, MIYAO A, HIROCHIKA H, KYOZUKA J.(), encoding a SEPALLATA subfamily MADS-box protein, positively controls spikelet meristem identity in rice. Plant and Cell Physiology, 2010, 51(1): 47-57.
[13] CHITWOOD D H, GUO M J, NOGUEIRA F, TIMMERMANS M. Establishing leaf polarity: The role of small RNAs and positional signals in the shoot apex. Development, 2007, 134(5): 813-823.
[14] YOSHIKAWA M, PERAGINE A, PARK M Y, POETHIG R S. A pathway for the biogenesis of trans-acting siRNAs in. Genes & Development, 2005, 19(18): 2164-2175.
[15] KAPOOR M, ARORA R, LAMA T, NIJHAWAN A, KHURANA J P, TYAGI A K, KAPOOR S. Genome-wide identification, organization and phylogenetic analysis of Dicer-like, Argonaute and RNA-dependent RNA Polymerase gene families and their expression analysis during reproductive development and stress in rice. BMC Genomics, 2008, 9: 451.
[16] LIU B, CHEN Z Y, SONG X W, LIU C Y, CUI X, ZHAO X F, FANG J, XU W Y, ZHANG H Y, WANG X J, CHU C C, DENG X W, XUE Y B, CAO X F.reveals a key role for small interfering RNA silencing in plant development. The Plant Cell, 2007, 19(9): 2705-2718.
[17] SONG X W, LI P C, ZHAI J X, ZHOU M, MA L J, LIU B, JEONG D H, NAKANO M, CAO S Y, LIU C Y, CHU C C, WANG X J, GREEN P J, MEYERS B C, CAO X F. Roles of DCL4 and DCL3b in rice phased small RNA biogenesis. The Plant Journal, 2012, 69(3): 462-474.
[18] TORIBA T, SUZAKI T, YAMAGUCHI T, OHMORI Y, TSUKAYA H, HIRANO H Y. Distinct regulation of adaxial-abaxial polarity in anther patterning in rice. The Plant Cell, 2010, 22(5): 1452-1462.
[19] SONG X W, WANG D K, MA L J, CHEN Z Y, LI P C, CUI X, LIU C Y, CAO S Y, CHU C C, TAO Y Z, CAO X F. Rice RNA-dependent RNA polymerase 6 acts in small RNA biogenesis and spikelet development. The Plant Journal, 2012, 71(3): 378-389.
[20] ITOH J, KITANO H, MATSUOKA M, NAGATO Y.genes regulate shoot apical meristem organization and the pattern of leaf primordium initiation in rice. The Plant Cell, 2000, 12(11): 2161-2174.
[21] SANG X C, LI Y F, LUO Z K, REN D Y, FANG L K, WANG N, ZHAO F M, LING Y H, YANG Z L, LIU Y S, HE G H., encoding a monocot-specific MADS box protein, regulates floral organ identity in rice. Plant Physiology, 2012, 160(2): 788-807.
[22] ZHENG M, WANG Y H, WANG Y L, WANG C M, REN Y L, LV J, PENG C, WU T, LIU K, ZHAO S L, LIU X, GUO X P, JIANG L, TERZAGHI W, WAN J M.() regulates floral organ identity by epigenetically repressing the expression of OsMADS58 in rice (). New Phytologist, 2015, 206(4): 1476-1490.
[23] XIAO H, TANG J F, LI Y F, WANG W M, LI X B, JIN L, XIE R, LUO H F, ZHAO X F, MENG Z, HE G H, ZHU L H., encoding a single C2H2zinc finger protein, regulates floral organ identity in rice. The Plant Journal, 2009, 59(5): 789-801.
[24] JIN Y, LUO Q, TONG H N, WANG A J, CHENG Z J, TANG J F, LI D Y, ZHAO X F, LI X B, WAN J M, JIAO Y L, CHU C C, ZHU L H. An AT-hook gene is required for palea formation and floral organ number control in rice. Developmental Biology, 2011, 359(2): 277-288.
[25] REN D Y, RAO Y C, WU L W, XU Q K, LI Z Z, YU H P, ZHANG Y, LENG Y J, HU J, ZHU L, GAO Z Y, DONG G J, ZHANG G H, GUO L B, ZENG D L, QIAN Q. The pleiotropicaffects plant height, floral development and grain yield in rice. Journal of Integrative Plant Biology, 2016, 58(6): 529-539.
[26] MARGIS R, FUSARO A F, SMITH N A, CURTIN S J, WATSON J M, FINNEGAN E J, WATERHOUSE P M. The evolution and diversification of Dicers in plants. FEBS Letters, 2006, 580(10): 2442-2450.
[27] DLAKIC M. DUF283 domain of Dicer proteins has a double-stranded RNA-binding fold. Bioinformatics, 2006, 22(22): 2711-2714.
[28] NAGASAKI H, ITOH J I, HAYASHI K, HIBARA K I, SATOH-NAGASAWA N, NOSAKA M, MUKOUHATA M, ASHIKARI M, KITANO H, MATSUOKA M, NAGATO Y, SATO Y. The small interfering RNA production pathway is required for shoot meristern initiation in rice. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(37): 14867-14871.
[29] WANG J, GAO X Y, LI L, SHI X Y, ZHANG J L, SHI Z Y. Overexpression ofta-siR2141 caused abnormal polarity establishment and retarded growth in rice. Journal of Experimental Botany, 2010, 61(6): 1885-1895.
[30] EMERY J F, FLOYD S K, ALVAREZ J, ESHED Y, HAWKER N P, IZHAKI A, BAUM S F, BOWMAN J L. Radial patterning ofshoots by class IIIHD-ZIP and KANADI genes. Current Biology, 2003, 13(20): 1768-1774.
[31] SI F Y, YANG C, YAN B, YAN W, TANG S J, YAN Y, CAO X F, SONG X W. Control ofby OsKANADI1 contributes to lemma development in rice. The Plant Journal, 2022, 110(6): 1717-1730.
Mutation ofgene causes degeneration of lemma in the spikelet of rice
ZHAO ZiJun, WU RuHui, WANG Shuo, ZHANG Jun, YOU Jing, DUAN QianNan, TANG Jun, ZHANG XinFang, WEI Mi, LIU JinYan, LI YunFeng, HE GuangHua, ZHANG Ting
College of Agronomy and Biotechnology, Southwest University/Engineering Research Center of South Upland Agriculture, Ministry of Education, Chongqing 400715
【】Spikelet is a unique floral organ of the grass family. In rice, the spikelet, as the basic unit and unique structure of inflorescence, has an important impact on the yield and quality. Therefore, studying the development of rice spikelets and floral organs can provide the foundation for the formation of rice yield and quality. 【】Two rice allelic mutants,and(and) with similar mutant phenotypes were obtained using Ethyl Methane Sulfonate (EMS) mutagenesis in therice maintenance line Xinong 1B. Because of their phenotypic similarity,(named) was selected as the material for further analysis. Microscopic observation and paraffin sectioning techniques were used to analyze their spikelet mutant phenotypes; agronomic trait examination was used to analyze the effect of lemma on rice yield; map-based cloning were used to verify the function of;hybridization and real-time fluorescence quantitative PCR (RT-qPCR) were used to analyze the expression pattern of. 【】The results of the phenotypic analysis showed that the lemma ofmutant was significantly narrower and could not be closely hooked to the palea compared with that of wild type, resulting in spikelet dehiscence and partially exposed inner whorl floral organs. However, the morphology and number of stamens, pistils, and lodicules were normal. Further paraffin section results showed that the reduced volume and number of silicified and vesicular cells in the mutant lemma, as well as the reduced spacing of vascular bundles, were responsible for the significant narrowing of the width of the lemma in. Agronomic traits examined showed that the mutation in thelemma eventually caused the seeds to be teardrop-shaped and resulted in a significant decrease in yield traits such as seed setting rate and 1000-grain weight in themutant. Genetic analysis and map-based cloning showed thatis a single recessive nuclear gene, which isgene localized on chromosome 4.encodes a Dicer-like protein that plays an essential role in the rice ta-siRNA synthesis pathway, and themutant is a novel weak allelic mutation ofgene. The expression pattern analysis showed that thegene was constitutively expressed in all whorls of floral organs. Mutation ofaffected the ta-siRNA synthesis and the expression of genes related to the establishment of adaxial-abaxial polarity, thus leading to the disorder of adaxial-abaxial polarity establishment in the lemma of. And the characteristics of floral organs were normal. 【】Mutation of lemma degeneration genedisrupts the establishment of lemma adaxial-abaxial polarity and affects the development of lemma and the formation of yield traits.
rice (L.); spikelet; lemma; map-based cloning; functional analysis

2022-09-24;
2022-11-02
国家自然科学基金青年科学基金(31900612)、高校基本科研业务费项目(SWU-KT22041)、国家级大学生创新创业训练计划(202210635082)
赵梓钧,E-mail:iszhaozijun@163.com。吴如会,E-mail:996367938@qq.com。赵梓钧和吴如会为同等贡献作者。通信作者张婷,E-mail:tingwz@163.com
(责任编辑 李莉)

