基于广泛靶向代谢组学的葡萄种子代谢物鉴定与比较分析
生弘杰,卢素文,郑暄昂,贾海锋,房经贵
基于广泛靶向代谢组学的葡萄种子代谢物鉴定与比较分析
生弘杰2,卢素文1,郑暄昂1,贾海锋1,房经贵1
1南京农业大学园艺学院,南京 210095;2江苏省农业科学院农产品质量安全与营养研究所,南京 210014
【】葡萄种子因富含多种代谢产物而具有较高生物活性。全面鉴定葡萄种子中代谢物组分,比较分析不同品种间代谢物差异,探讨葡萄种子代谢物与果皮颜色和品种起源之间的关系,为深入开发和利用葡萄种子提供参考依据。【】以紫红色欧美种葡萄‘巨峰’、浅红色欧亚种葡萄‘魏可’和黄绿色欧亚种葡萄‘黄意大利’成熟期种子为材料,利用超高效液相色谱串联质谱(UPLC-MS/MS)进行广泛靶向代谢组学分析,采用多元统计学等方法鉴定和比较代谢物。【】代谢组学数据质量好,组内样品重复性较好,组间样品存在差异。3个葡萄品种种子中共检测到514个代谢物,包括氨基酸、脂类等6类初生代谢物和原花青素、白藜芦醇等20类次生代谢物。不同品种间代谢物种类相似,但含量差异显著。大多数代谢物的相对含量在深色品种‘巨峰’种子中较高,在浅色品种‘魏可’种子中次之,在无色品种‘黄意大利’种子中较低,表明葡萄种子代谢物含量可能与果皮颜色呈正相关。‘魏可’和‘黄意大利’种子代谢物的相对含量较为相近,而均与‘巨峰’种子代谢物的相对含量差异较大,表明葡萄种子代谢物含量可能与品种起源有关。不同葡萄品种间的差异代谢物主要涉及苯丙烷生物合成、花青素合成和脂类代谢等途径。差异代谢物中酚类物质较多,且差异倍数最大的代谢物以类黄酮为主。葡萄种子中酚类和脂类物质种类非常丰富,除了单体黄烷-3-醇及其聚合物外,黄酮和黄酮醇等酚类物质的相对含量也较高;白藜芦醇在3个品种间没有显著差异;溶血磷脂酰胆碱等甘油磷脂含量较高,亚麻酸含量较低,不同品种间脂类物质的相对含量差异较小。【】不同葡萄品种种子中代谢物种类类似,但含量与果皮颜色和品种起源有关。酚类和脂类物质是葡萄种子代谢物的重要组分,可作为食品等加工行业的良好来源。
葡萄;种子;代谢组学;代谢物;酚类;脂类
0 引言
【研究意义】葡萄是世界性重要果树之一,具有鲜食、酿酒、制汁等多种用途,在果树产业中占有重要地位。种子作为葡萄加工生产的副产物,富含多种生物活性物质,包括碳水化合物、蛋白质、纤维素、脂肪酸、矿物质、维生素、原花青素和白藜芦醇等,因而具有极高的营养和保健价值[1]。葡萄种子中多酚类天然抗氧化物的种类和含量比果皮和果肉更丰富,这些多酚类化合物不仅影响葡萄酒的外观和口感,还会影响其营养保健功效[2-3]。已有大量研究证实,葡萄种子提取物,尤其是原花青素在提高人体免疫力和预防心血管疾病等方面效果显著[4-5]。因此,系统分析葡萄种子中代谢产物,为深入开发和利用葡萄种子提供指导,将会增加葡萄产业的附加值,提高社会和经济效益。【前人研究进展】前人对葡萄种子中多酚尤其是原花青素和单宁的研究相对较多。Liang等[6]采用液相色谱-质谱联用(HPLC-MS)方法在17个葡萄品种91份种质的种子中鉴定到11个多酚化合物,其中最丰富的是单体黄烷-3-醇,其次是二聚黄烷-3-醇和三聚黄烷-3-醇,占总多酚的96%以上。非生物胁迫诱导葡萄浆果种子中的次级代谢物积累[7-8];然而,GOUOT等[9]认为短期高温处理抑制果实和种子发育,导致种子单宁含量显著降低。葡萄种子中原花青素的积累独立于果皮,种子中原花青素积累主要发生在坐果后,而果皮中原花青素积累发生在坐果后1—2周,均在转色期达到最高水平;原花青素亚基组成在种子和果皮中存在差异,果皮中单宁聚合物的平均聚合程度高于种子[10]。PRIEUR等[11]从葡萄种子中分离得到5个单宁组分,所有组分均由儿茶素、表儿茶素和表儿茶素没食子酸酯单元组成,平均聚合度为2.3—15.1。葡萄果实中氮化物含量影响酒精发酵和葡萄酒品质。葡萄果肉和种子中硝态氮、氨态氮、总氮含量随果实发育逐渐升高,直至成熟时期趋于稳定;且种子中氮化物含量高于果肉,种子中总氮含量约占整个浆果总氮含量的50%[12]。尽管目前对葡萄种子中多酚等物质已有了解,但是从代谢组学的角度全面鉴定葡萄种子化合物特征的研究却鲜见报道。广泛靶向代谢组学具有高通量、超灵敏、广覆盖和高精度的特点,通过建立数据库、MRM检测和数据分析进行代谢物组分鉴定和相对含量分析[13-14]。目前,该技术已被广泛应用于枸杞[15]、甘薯[16]、茶[17]等园艺作物中。例如,闫乐乐等[18]利用广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响,发现酚酸等代谢物的变化可能与桃蚜抗性有关。ZOU等[19]利用广泛靶向代谢组学技术,发现碳水化合物、有机酸、氨基酸、酚类物质组成和丰度变化可能与枇杷果实风味有关。【本研究切入点】笔者课题组前期利用广泛靶向代谢组学技术,发现类黄酮代谢在不同着色类型的葡萄果皮和果肉中存在较大差异,花青素与其他分支类黄酮化合物的相对含量呈正相关[20]。本研究通过广泛靶向代谢组学技术,全面鉴定葡萄种子代谢物种类,并系统分析不同品种间种子代谢物差异。【拟解决的关键问题】选取3个不同果皮颜色和品种起源的葡萄品种,采用基于液质联用的广泛靶向代谢组学技术,鉴定和比较分析成熟期种子中代谢物组分和相对含量,为葡萄种子开发和利用提供理论参考。
1 材料与方法
1.1 试验材料
1.2 代谢物提取
利用研磨仪(MM400,Retsch)将真空冷冻干燥后的样品研磨至粉末状,称取100 mg粉末,溶解于1.0 mL 70%甲醇提取液中,4℃浸提过夜,期间涡旋多次,以提高提取率。提取液经10 000×离心10 min后,吸取上清液,用0.22 μm微孔滤膜过滤后,保存于进样瓶中,用于UPLC-MS/MS分析。
1.3 色谱和质谱条件
数据采集仪器系统主要包括超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(Tan-dem mass spectrometry,MS/MS)。液相色谱条件:C18色谱柱(waters ACQUITY UPLC HSS T3 1.8 μm,2.1 mm×100 mm)。流动相水相为超纯水(含0.04%乙酸),有机相为乙腈(含0.04%乙酸)。洗脱梯度0 min为水/乙腈(95﹕5,V/V),11.0 min为5﹕95,12.0 min为5﹕95,12.1 min为95﹕5,15.0 min为95﹕5。流速0.4 mL∙min-1;柱温40℃;进样量2 μL。
质谱条件:电喷雾离子源(electrospray ionization,ESI)温度500℃,质谱电压5 500 V,帘气(curtain gas,CUR)25 psi,碰撞诱导电离(colision-activated dissociation,CAD)参数设置为高。在三重四级杆(QQQ)中,每个离子对是根据优化的去族电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测[12]。

JFS:巨峰;WKS:魏可;YDS:黄意大利。标尺为1 cm。下同
1.4 代谢物定性与定量分析
定性分析:利用软件Analyst 1.6.1采集数据,基于代谢物信息公共数据库及代谢组平台标准物质数据库,根据二级谱信息进行物质定性,分析时去除同位素信号,含K+、Na+、NH4+的重复信号及本身是其他更大分子量物质的碎片离子的重复信号。
定量分析:利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子量物质对应的离子以初步排除干扰;前体离子经碰撞室诱导电离后断裂形成很多碎片离子,碎片离子再通过三重四级杆过滤选择出所需要的一个特征碎片离子,排除非目标离子干扰,使定量更为精确,重复性更好。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正。
1.5 差异代谢物筛选
采用正交偏最小二乘判别分析(OPLS-DA)模型第1主成分变量重要性值投影值(VIP≥1)、差异倍数值(FC≥2或≤0.5)以及t检验的值(-value≤0.5)来筛选差异代谢物。
1.6 数据处理和多元统计分析
采用SIMCA-P+14.1软件进行主成分分析(PCA);将代谢物含量数据采用极差法进行归一化处理后,利用R软件进行聚类分析(HCA);采用SPSS软件进行单因素方差分析(ANOVA);采用Excel 2016软件绘制相关图表;采用KEGG进行代谢通路富集分析。
随着我国对外开放不断扩大,“走出去”的中国国有企业已经成为促进中国与国际社会沟通合作的重要渠道,中国品牌成为国际社会认识中国、了解中国的重要窗口。打造世界一流品牌,塑造国企海外良好形象,是中国国家形象和企业发展的重要组成部分。在国际社会有效塑造中国国企品牌的知名度和美誉度,是国有企业海外形象塑造工程的一个长期课题。
2 结果
2.1 代谢组数据质量评估
2.1.1 样品质控分析 利用软件Analyst 1.6.3处理质谱数据。葡萄种子混样质控样品的总离子流图重叠展示如图2所示,代谢物检测总离子流曲线重叠性较高,保留时间和峰强度较一致,同一样品不同时间检测时的信号均较稳定,色谱峰基线平稳且色谱峰被有效分离,可见该仪器稳定性高,数据重复性和可靠性强。
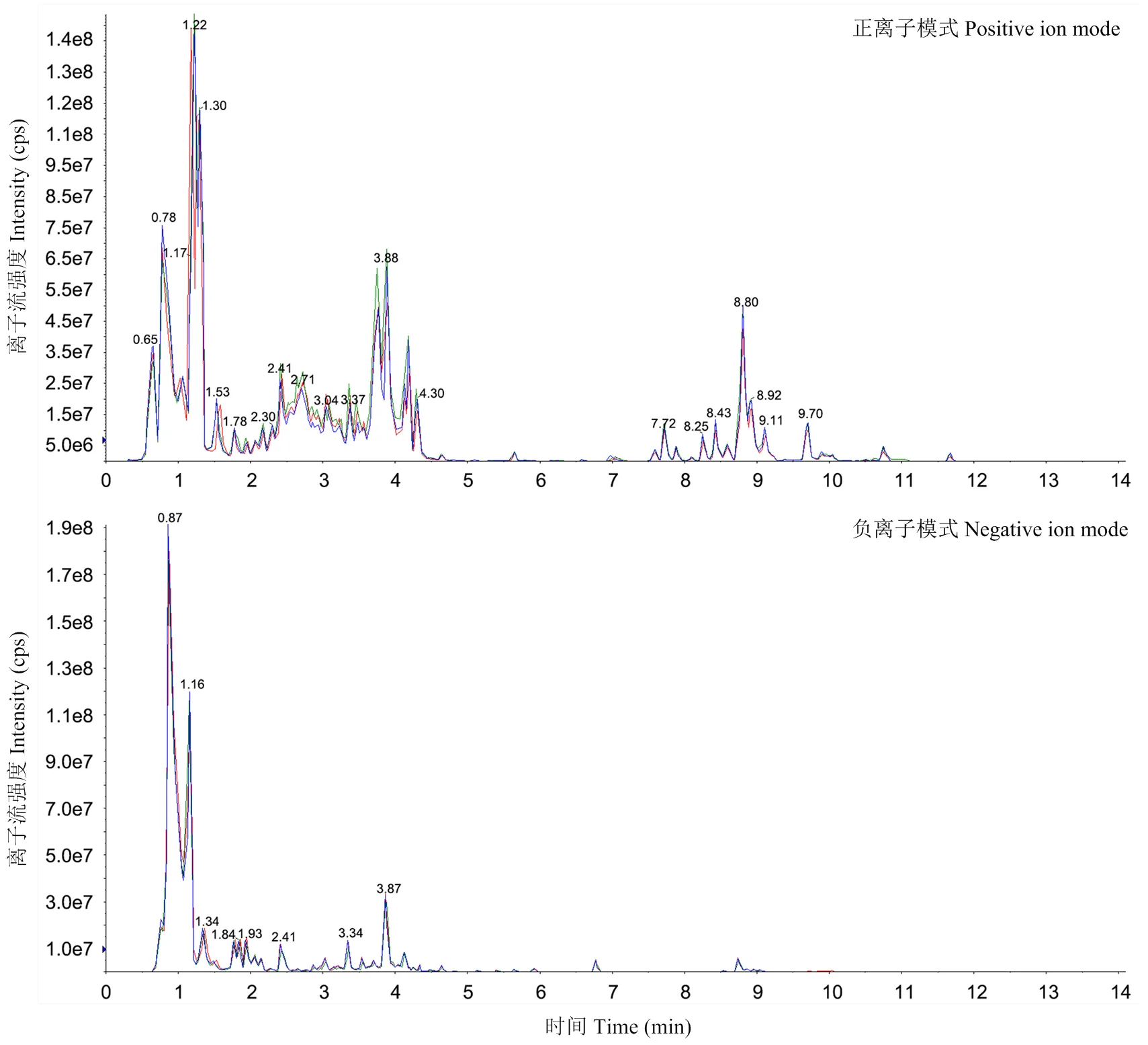
图2 葡萄种子样品质谱检测总离子流重叠图(TIC)
2.1.2 数据整体分析 用皮尔逊相关系数分析组间和组内样本间相关性(图3-A),不同样本间相关系数均在0.88以上,同时组内样品相对组间样品的相关系数较高,说明获得的代谢物可靠,不同样本间代谢物相关性较强。
将代谢物数据进行归一化处理后,对所有样品进行聚类分析。结果显示,‘魏可’和‘黄意大利’聚在一起,说明两个品种中代谢物积累模式更相似。不同品种间代谢物相对含量有较明显的差异(图3-B)。
为了解组间和组内样品之间的变异度,对样品进行PCA分析(图3-C),第一主成分PC1和第二主成分PC2的贡献率分别为43.35%和24.44%,两个主成分能基本反映葡萄种子的主要特征信息。组内样本间变异度均较小,说明组内重复性好;组间样本代谢物呈分离趋势,说明不同品种种子代谢物具有明显差异。‘魏可’(WKS)与‘黄意大利’(YDS)距离较近,均与‘巨峰’(JFS)距离较远,表明‘魏可’和‘黄意大利’种子间代谢物差异较小。质控样品mix也被一起分组,表明试验条件稳定、可重复。
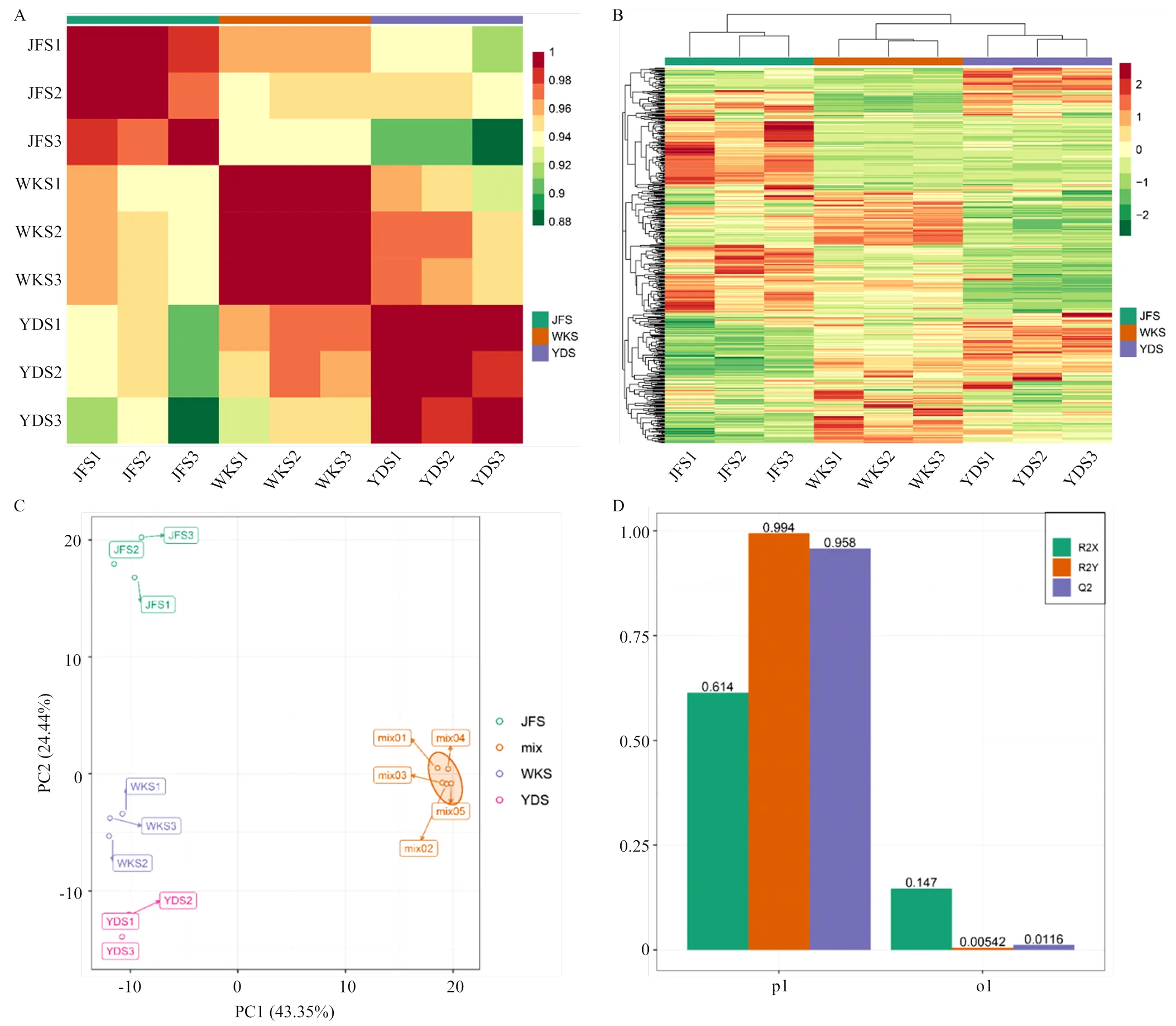
图3 样品间相关性分析(A)、聚类分析(B)、PCA分析(C)和OPLS-DA模型图(D)
根据OPLS-DA模型分析代谢组数据,用R2X、R2Y和Q2作为评价模型的预测参数,其中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力。如图3-D所示,这3个指标均接近于1,表示模型稳定可靠,且Q2>0.9,表示该模型非常出色,可根据VIP值筛选差异代谢物。
2.2 葡萄种子代谢物种类鉴定与比较分析
基于UPLC-MS/MS检测平台、代谢物信息公共数据库以及多元统计分析相结合的方法,在葡萄种子中共检测到514个代谢物,其中‘巨峰’491个,‘魏可’494个,‘黄意大利’487个。这些代谢物分为27类,包括6类初生代谢物、20类次生代谢物(包括11类多酚物质)以及其他物质。初生代谢物中氨基酸种类最多,达79种,占27.62%;其次依次是脂类、有机酸、核苷酸、糖类和醇类。次生代谢物中类黄酮物质种类最多,高达112种(黄酮38种、黄酮醇30种、黄烷酮15种、儿茶素11种、花青素8种、异黄酮6种、原花青素4种),占54.90%;其次是酚酸类化合物,包括羟基肉桂酰衍生物、苯甲酸、奎宁酸和香豆素,共44种;维生素和酚胺类物质(11—13种)也较丰富,吲哚、生物碱、色胺、胆碱、吡啶、烟酸和萜类物质种类较少,仅2—5种;此外还有24种其他物质无法归类。‘巨峰’‘魏可’和‘黄意大利’种子中代谢物种类相似,但个别有差异。例如,‘魏可’种子中能检测到8种花青素,‘巨峰’中检测到6种,而‘黄意大利’中仅检测到5种(表1)。
2.3 葡萄种子差异代谢物鉴定与比较分析
2.3.1 差异代谢物整体分析
2.3.1.1 火山图分析 对不同葡萄品种种子间代谢物相对含量进行比较分析,根据VIP≥1,且<0.05筛选组间差异代谢物,并进行变化差异倍数分析。通过火山图查看代谢物在两个样品中表达水平的差异,以及差异的统计学显著性(图4)。结果显示,‘巨峰’和‘黄意大利’之间(JFS vs YDS)差异代谢物数目最多,有189个,包括上调代谢物70个和下调代谢物119个;其次是‘巨峰’和‘魏可’(JFS vs WKS),有170个,包括上调代谢物71个和下调代谢物99个;‘魏可’和‘黄意大利’之间(WKS vs YDS)差异代谢物数目最少,有121个,包括上调代谢物40个和下调代谢物81个。3个比较组中差异代谢物均以下调为主,JFS vs YDS、JFS vs WKS和WKS vs YDS中下调代谢物分别占62.96%、58.24%和66.94%。差异不显著的代谢物均有300多个。
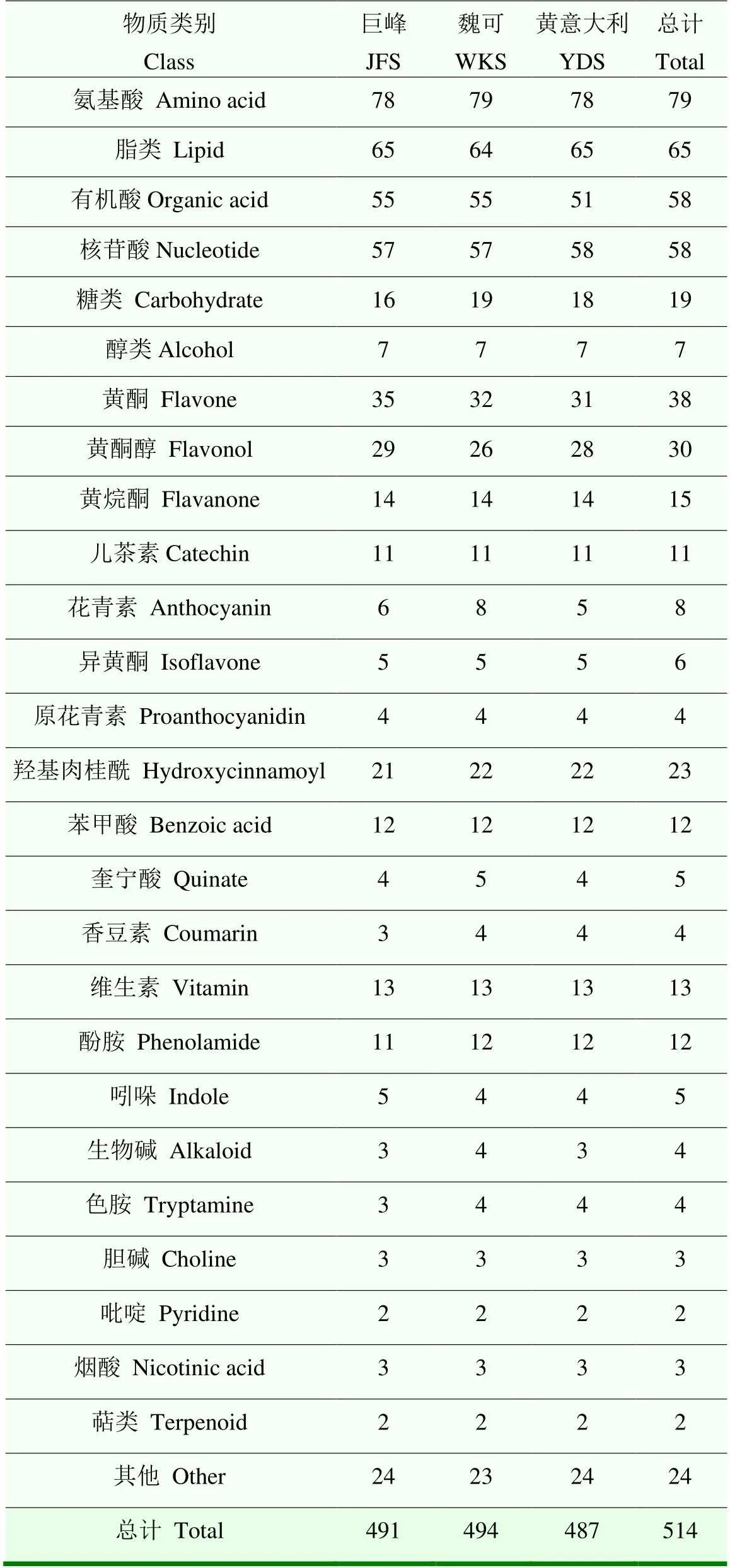
表1 葡萄种子代谢物种类及数目
2.3.1.2 聚类热图分析 对差异代谢物峰面积数据归一化处理后进行聚类热图分析,观察代谢物变化规律。如图5所示,3个比较组中差异代谢物被分为2大类,大部分差异代谢物在‘巨峰’中高积累,其次是‘魏可’,在‘意大利’中含量最低;并且‘魏可’和‘黄意大利’种子间差异代谢物相对较少。
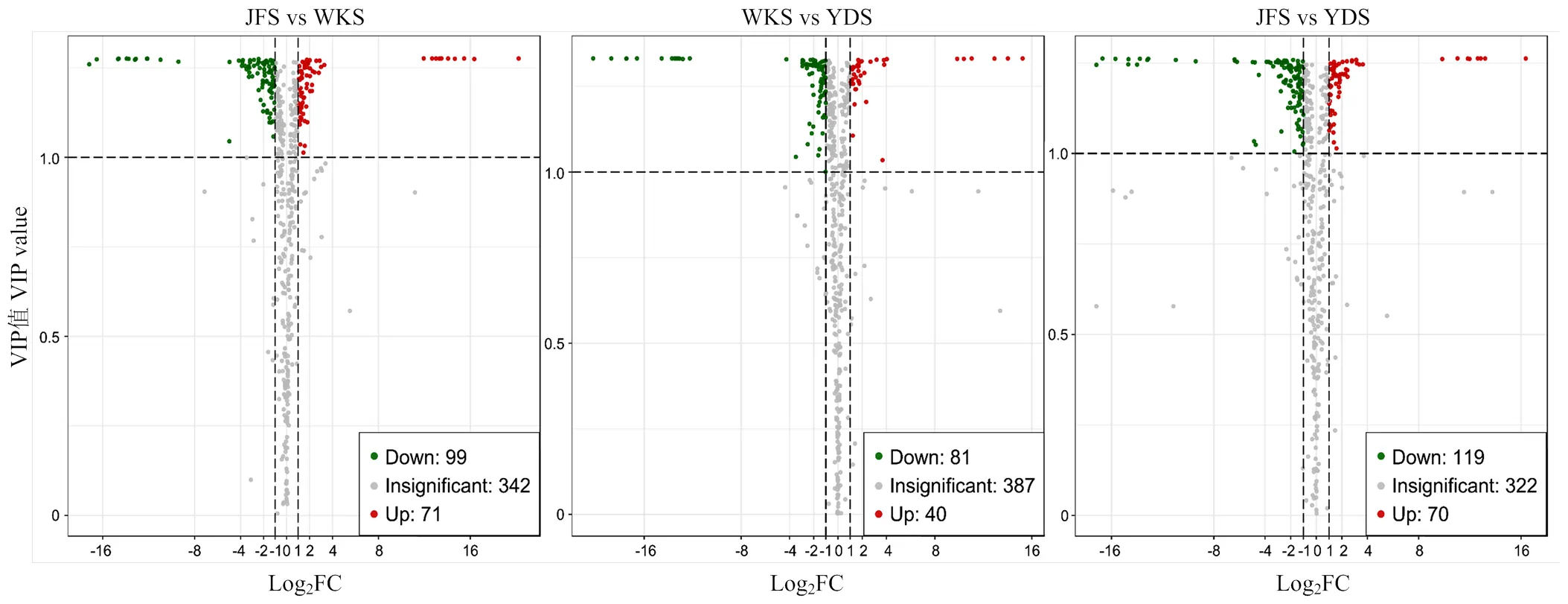
火山图中的每一个点表示一种代谢物,横坐标表示某代谢物在两样品中定量差异倍数的对数值;纵坐标表示VIP值。红色、绿色和灰色的点分别代表上调、下调和差异不显著的代谢物
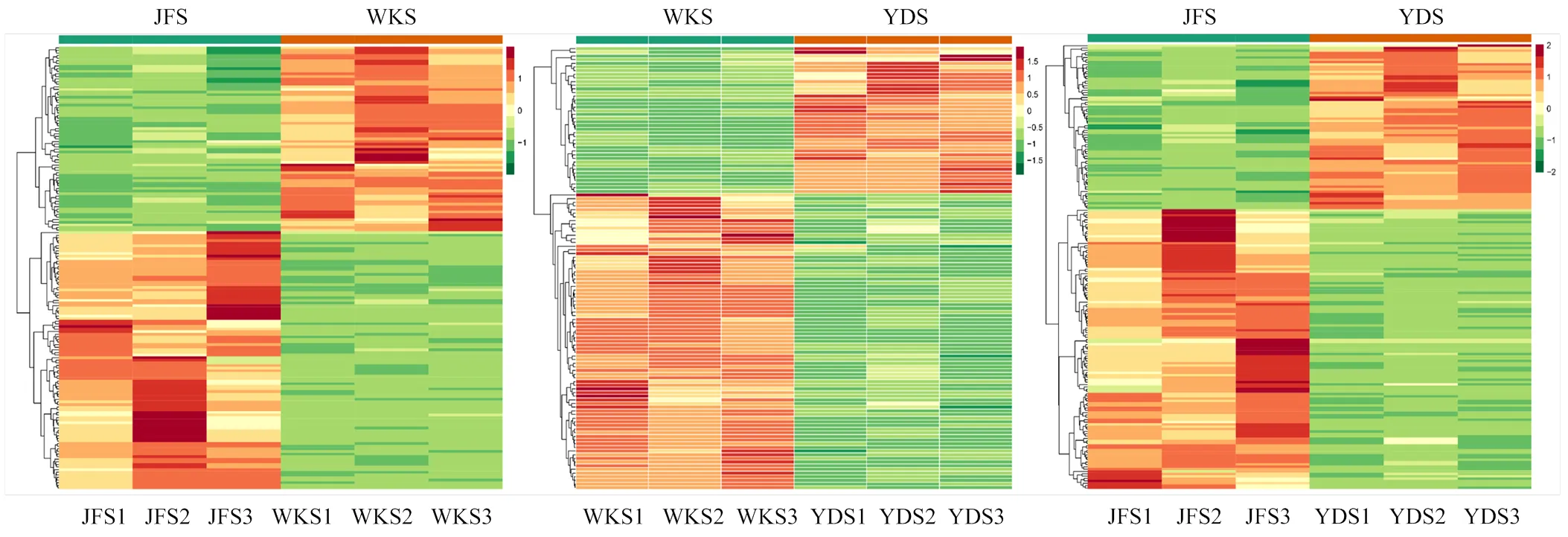
x轴表示样品,y轴表示差异代谢物。代谢物浓度的变化由色标表示
2.3.1.3 韦恩图分析 差异代谢物韦恩图分析(图6)结果显示,3个比较组之间共有差异代谢物32个,JFS vs WKS、WKS vs YDS 和JFS vs YDS分别各有28个、28个和46个特异的差异代谢物。其中,JFS vs WKS与JFS vs YDS共有差异代谢物最多(112个),JFS vs WKS与WKS vs YDS、WKS vs YDS与JFS vs YDS共有差异代谢物分别为62个和63个,进一步表明‘魏可’与‘黄意大利’之间的代谢物含量较为相近,且均与‘巨峰’差异较大。对32个共有差异代谢物进行分类,其中差异个数最多的化合物是羟基肉桂酰衍生物,有7个;其次是氨基酸类、核苷酸类和有机酸类,均有4个;花青素和黄酮分别有2个和3个,黄酮醇等其他类物质各有1个。有3个共有差异代谢物在3个比较组中均呈现出积累上调(up),有15个共有差异代谢物在3个比较组中均呈现出积累下调(down)(表2),表明这些差异代谢物的积累可能与果皮颜色存在一定的关系。
2.3.1.4 KEGG代谢通路富集分析 利用KEGG数据库对差异代谢物进行代谢通路富集分析,结果显示JFS vs WKS、WKS vs YDS 和JFS vs YDS三个比较组差异代谢物分别被注释到147、173和209条代谢途径上,其中被KEGG注释到的代谢途径(ko01100)尤其是植物次生代谢途径(ko01060)下的代谢物数目最多。差异代谢途径主要分布在氨基酸代谢(C1)、类黄酮代谢(C2)、有机酸代谢(C3)、生物碱合成(C4)、脂肪酸代谢(C5)和糖代谢(C6)等通路中。其中,苯丙烷合成和花青素合成途径在JFS vs WKS、JFS vs YDS和WKS vs YDS中均显著富集(图7)。
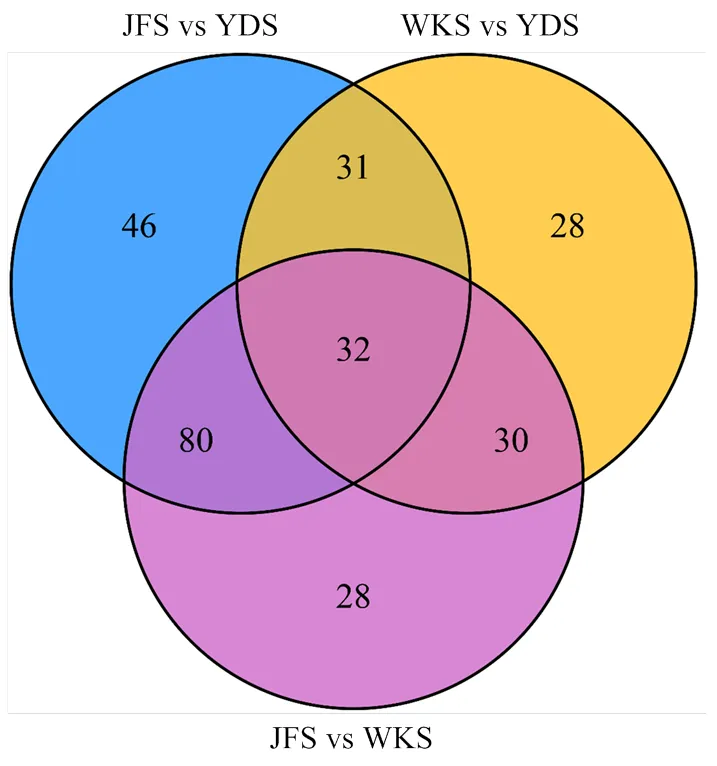
图6 差异代谢物Venn图
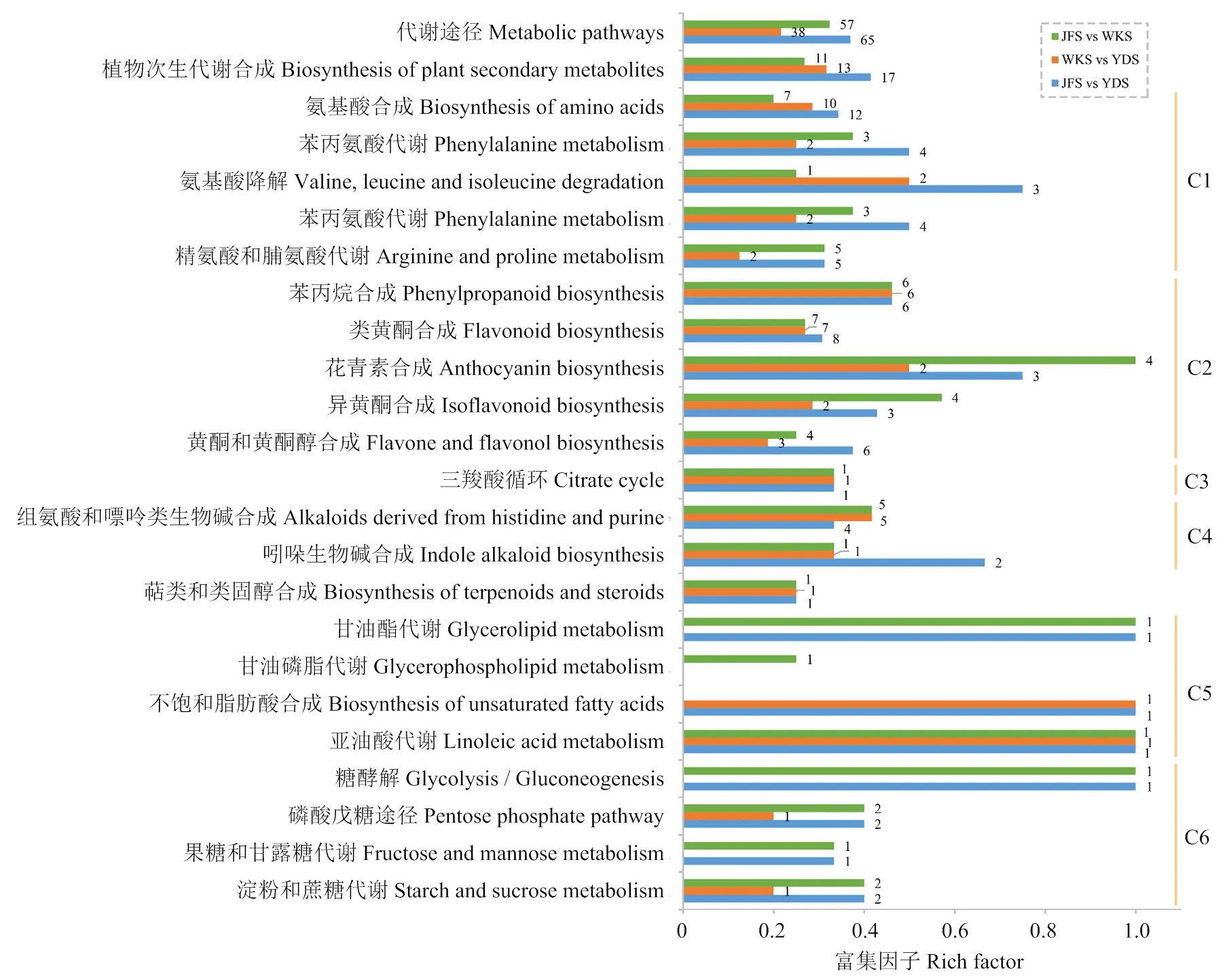
x轴为差异代谢物的富集因子,y轴为KEGG通路。富集因子表示通路中富集的差异代谢物数量与总代谢物数量之比。每个通路中富集的差异代谢物的数量显示在相应的柱上
2.3.2 差异代谢物种类比较分析 对差异代谢物的种类进行比较分析,结果显示3个比较组的差异代谢物种类分布类似,主要是氨基酸、脂类、有机酸、核苷酸、黄酮、黄酮醇和羟基肉桂酰衍生物类物质,其中多酚类物质(包括类黄酮和酚酸类)分别占JFS vs WKS、WKS vs YDS和JFS vs YDS所有差异代谢物的38.82%、38.84%和34.92%。大多数差异代谢物在3个比较组中均表现下调。例如,JFS vs WKS、WKS vs YDS、JFS vs YDS三个比较组中差异脂类物质分别有61.11%、88.89%、77.78%表现下调,差异羟基肉桂酰类衍生物分别有85.71%、88.89%、84.62%表现下调。香豆素、胆碱和吡啶的相对含量在3个品种中均没有显著差异(表3)。
2.3.3 差异代谢物相对含量比较分析 分别列举3个比较组中变化倍数最大的前10个上调和下调的差异代谢物(图8)。3个比较组中差异倍数最大的代谢物均有较多属于类黄酮(JFS vs WKS有10个,JFS vs YDS有12个,WKS vs YDS有9个),包括花青素类的天竺葵色素苷、黄酮类的麦黄酮已糖苷、黄酮醇类的甲基槲皮素以及黄烷酮类的7-氧甲基圣草酚;其次为核苷酸类和有机酸类物质。此外,JFS vs WKS和JFS vs YDS共有9个差异倍数最大的代谢物,包括天竺葵色素苷、菠菜素、氧甲基柚皮素-戊糖苷等。例如,在JFS vs WKS和JFS vs YDS比较组中,黄酮碳糖苷类6--己糖苷-芹菜素-阿魏酰己糖苷均显著下调,Log2变化倍数达17.19;而花青素类天竺葵色素苷均显著上调,Log2变化倍数达16.3倍。此外,JFS vs WKS比较组中前10个上调和下调的差异代谢物Log2变化倍数均达到10倍以上。
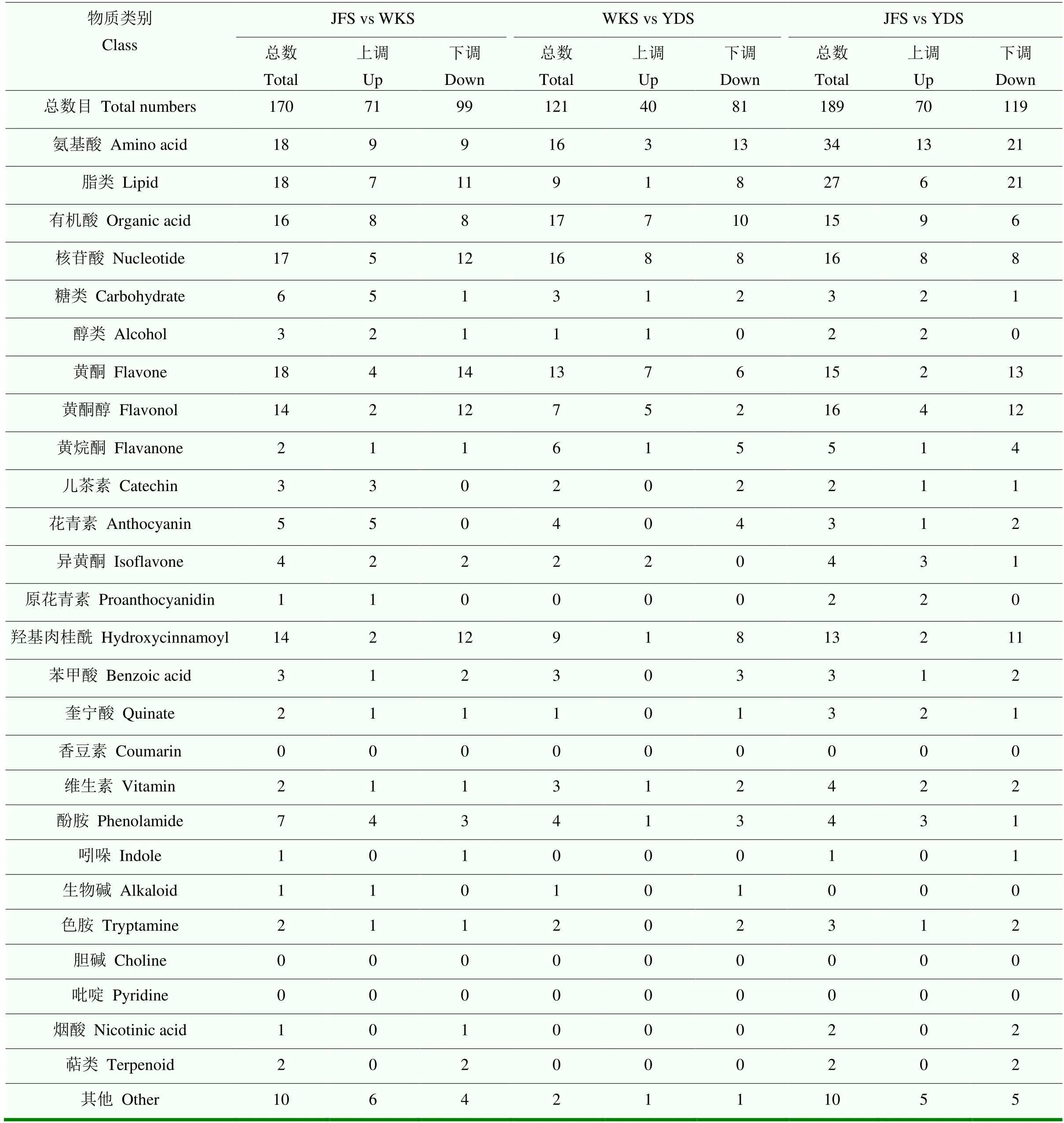
表3 葡萄种子间差异代谢物种类及数目
2.4 葡萄种子中重要代谢物种类和相对含量分析
2.4.1 多酚类物质 葡萄种子是多酚的重要来源,种子提取物以及衍生产品(如葡萄酒)的保健价值主要归因于其多酚化合物[5]。利用广泛靶向代谢组学技术,本研究鉴定到156种多酚类物质,包括112种类黄酮和44种酚酸类物质。利用热图展示3个品种间所有差异代谢物的差异倍数,结果显示大部分代谢物在品种间差异倍数较小,且在比较组中呈现出积累下调;芍药花青素-己糖苷、天竺葵色素苷等代谢物在品种间差异倍数较大;2种原花青素和4种儿茶素衍生物类物质在品种间存在显著性差异,但差异倍数均较小(图9)。表4列举了每个类别中相对含量较高的前3种物质以及一些在不同品种间差异倍数较大的多酚类物质。结果显示,矢车菊素糖苷、原儿茶醛、原花青素B2、木犀草苷、染料木苷、三叶豆甙、橙皮素 5--葡萄糖苷、2,5-二羟基苯甲酸-己糖苷、奎宁酸、松柏醛等物质在3个品种中均含量较高。此外,还有部分多酚类物质仅在某个品种中被检测到,例如天竺葵素-3--葡萄糖苷仅在‘魏可’中相对含量较高,在‘巨峰’和‘黄意大利’中几乎检测不到;花青素苷和金圣草黄素7--芸香糖苷仅存在于‘巨峰’和‘魏可’种子中,而7-氧甲基圣草酚仅存在于‘黄意大利’种子中。
白藜芦醇(3,5,4'-三羟基二苯乙烯)是一种非黄酮类多酚化合物,是葡萄种子重要的活性物质,具有较高的营养和保健价值。代谢组学结果显示,白藜芦醇在‘巨峰’‘魏可’和‘黄意大利’中的相对含量分别是8.71×105、6.19×105、和5.17×105,3个品种间没有显著差异(表4)。
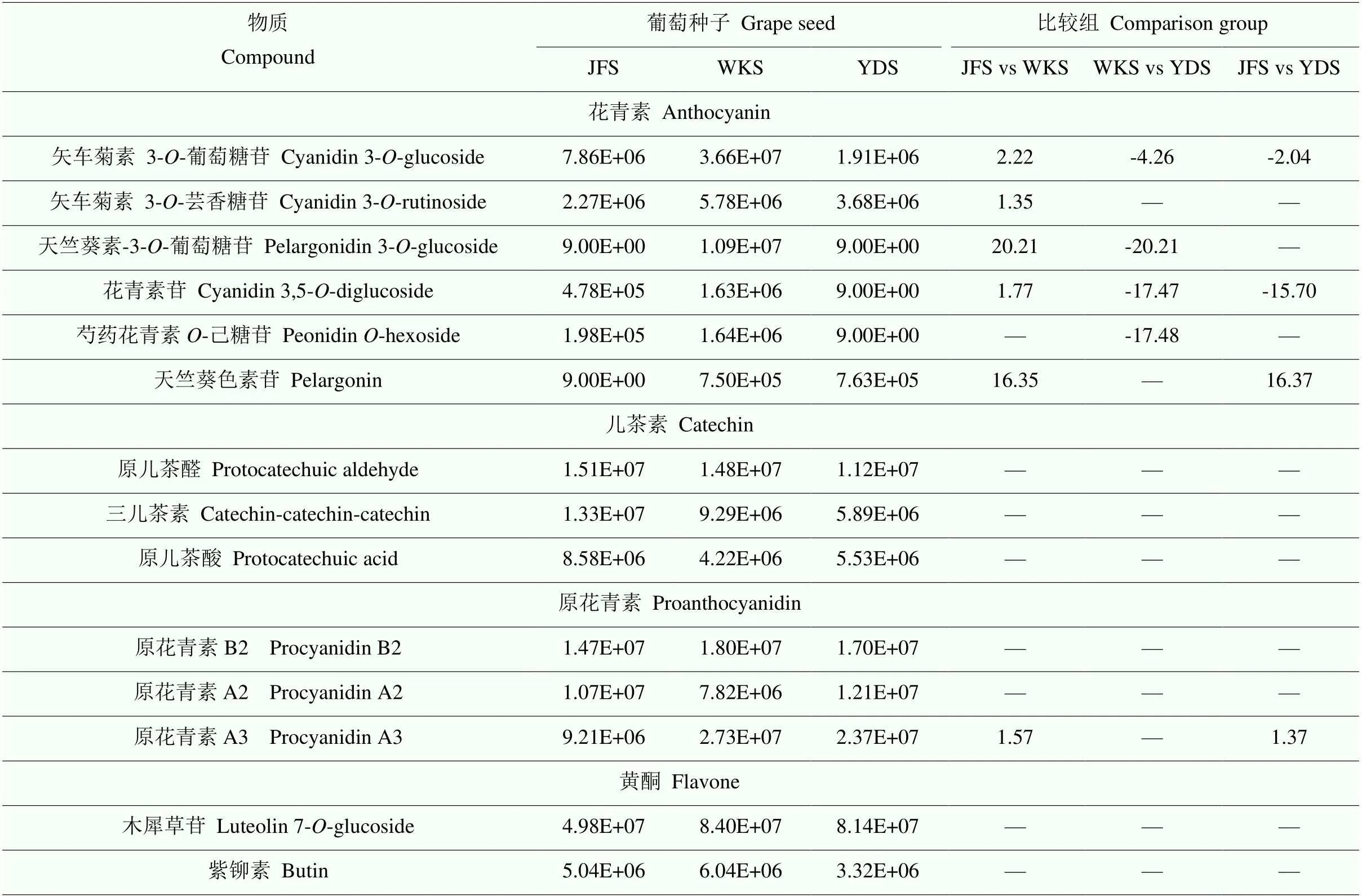
表4 葡萄种子中重要多酚类物质
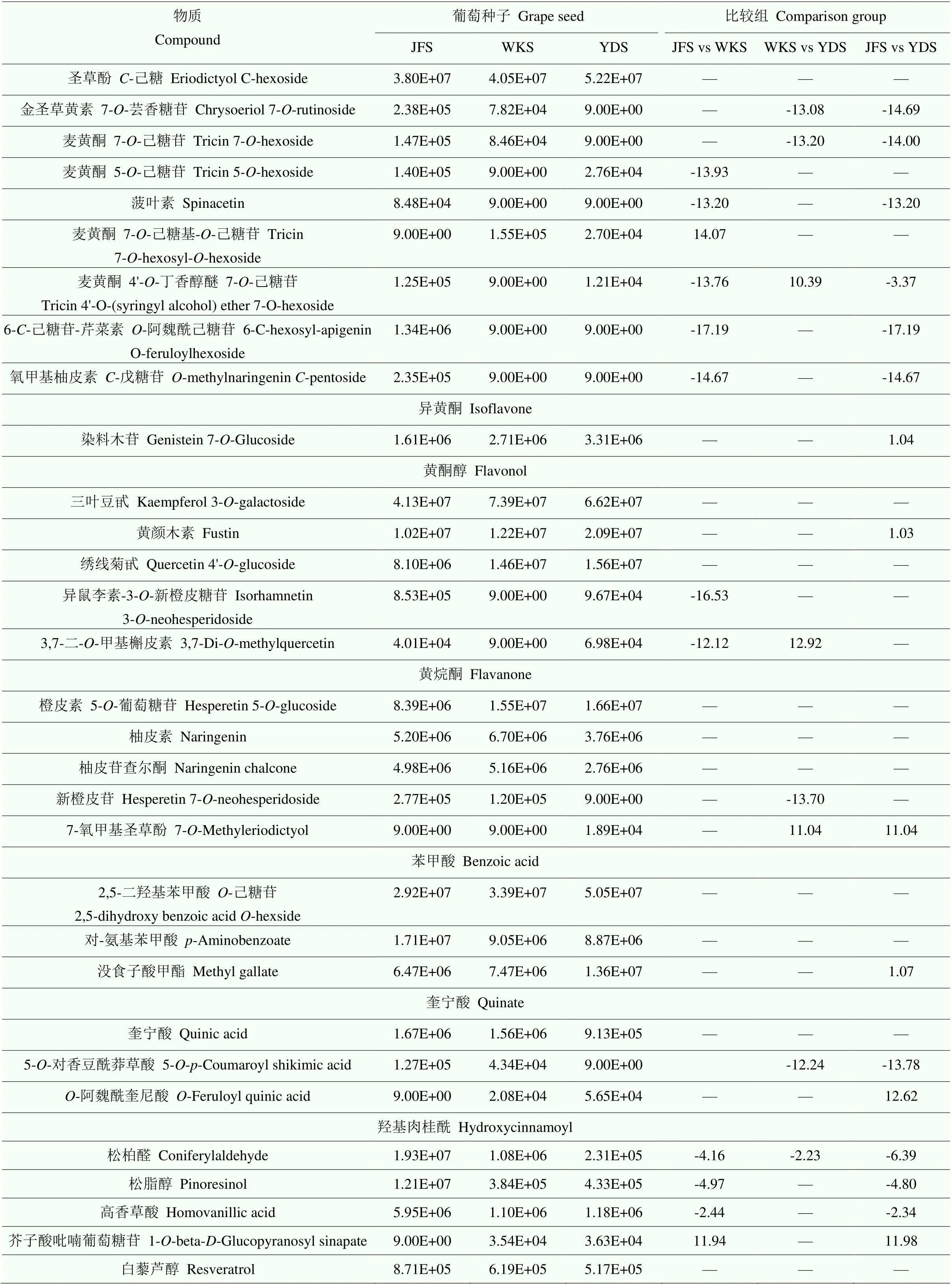
续表4 Continued table 4
“—”表示没有显著性差异。下同 “—” represents no significant difference. The same as below
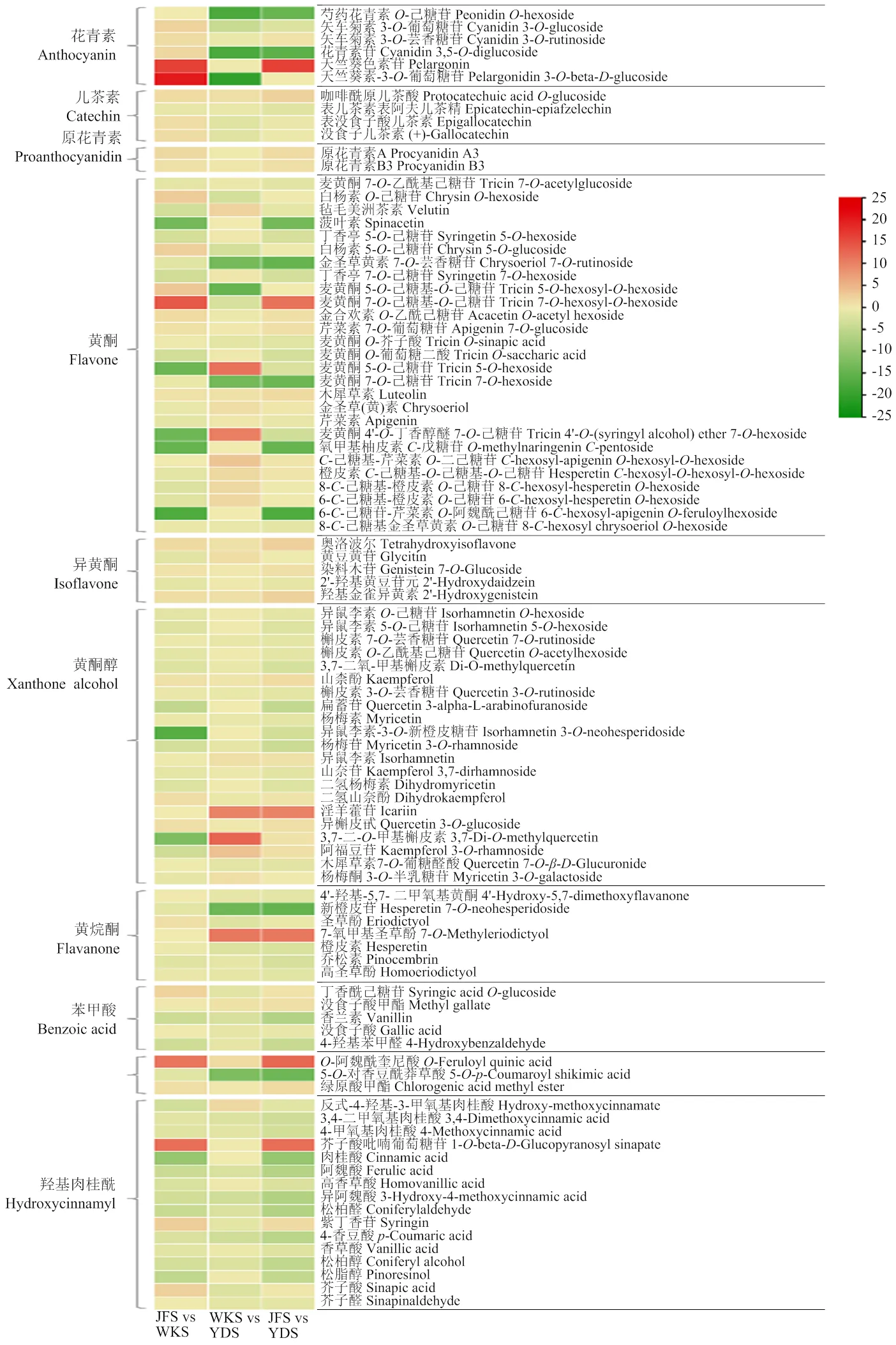
代谢物浓度的变化由色标表示 Changes in metabolite concentration is indicated by color scales
2.4.2 脂类物质 葡萄种子中含有丰富的脂肪酸类物质,含油量与玉米胚芽和大豆的含油量相近,必需脂肪酸亚油酸含量非常高,被认定是一种营养价值丰富的优质食用油[21]。本研究鉴定到65种脂类物质,包括33种甘油磷脂、15种甘油酯和17种脂质-脂肪酸。对葡萄种子中脂类物质相对含量进行比较分析,表4列举了每个类别中相对含量较高的前3种物质。结果显示,溶血磷脂酰胆碱、单酰甘油酯和十八碳三烯酸等物质在3个品种中的含量均较高,亚麻酸含量较低(104左右)。一些脂类物质的相对含量在不同品种间存在显著差异,但差异倍数均较小(表5)。
3 讨论
3.1 葡萄种子代谢物含量与果皮颜色和品种起源有关
葡萄种子中代谢物种类丰富[1,3]。本研究采用基于UPLC-MS/MS检测平台、自建数据库以及多元统计分析相结合的手段,研究不同葡萄品种成熟期种子中代谢物组分和含量的差异,方法可靠性高,准确性好,稳定性强,可以将不同品种葡萄种子代谢物组分进行有效区分。相关性分析、聚类分析、PCA分析和OPLS-DA分析结果均表明,组内样品重复性较好,组间样品存在差异。3个葡萄品种种子中共检测到代谢物27类514种,其中初生代谢物以氨基酸为主,次生代谢物以多酚类物质为主。不同葡萄品种种子中代谢物组成相似,但含量差异显著,形成葡萄品种差异化和种质资源多样化的特点。
差异代谢物分析结果显示,3个葡萄品种种子中差异代谢物主要是氨基酸、脂类、黄酮醇和羟基肉桂酰衍生物等物质,其中酚类物质占比较高。大多数代谢物的相对含量在深色品种‘巨峰’种子中积累较高,在浅色品种‘魏可’种子中次之,在无色品种‘黄意大利’种子中积累较低。这表明,葡萄种子代谢物含量可能与果皮颜色呈正相关。次生代谢物是以初生代谢物为前体合成的,本研究不仅发现‘巨峰’‘魏可’和‘黄意大利’两两比较组中大多数酚类等次生代谢物含量表现下调,还发现脂类等初生代谢物含量表现下调。GUENDEZ等[22]报道12个白葡萄品种和15个红葡萄品种种子中没食子酸的平均含量分别为0.036和0.052 mg∙g-1FW。这些结果表明,深色葡萄品种中代谢途径可能相对更活跃。另外,‘魏可’和‘黄意大利’种子代谢物含量较为相近,而均与‘巨峰’差异较大。由于‘巨峰’为欧美品种,而‘魏可’和‘黄意大利’均为欧亚品种,因而葡萄种子代谢物含量可能与品种起源有关。
3.2 酚类和脂类物质是葡萄种子代谢物的重要组分
代谢通路富集分析结果显示,差异代谢物主要以次生代谢途径为主,且苯丙烷合成途径和类黄酮代谢途径在3个比较组中均显著富集。差异代谢物和变化倍数最大的差异代谢物分析结果进一步证实,不同品种间差异代谢物均以酚类为主。这表明,酚类化合物是影响葡萄种子代谢物的重要组分。葡萄种子中含有丰富的多酚类物质,尤其是单体黄烷-3-醇和低聚原花青素[2-4]。原花青素经氧化后,使大多数葡萄种皮呈深棕色。Liang等[6]在17个葡萄种91份种质的种子中鉴定到11个多酚化合物,包括2个没食子衍生物、3个黄烷-3-醇单体、3个黄酮醇、白藜芦醇、原花青素B1和B2,以及17种二聚和三聚黄烷-3-醇,这些化合物在种间和种内都有较大差异,单体黄烷-3-醇及其聚合物是种子中最丰富的多酚。本研究采用广泛靶向代谢组学的方法,在葡萄种子中鉴定到156种多酚类物质,数量上远远增加。研究发现‘赤霞珠’‘黑比诺’‘霞多丽’等葡萄种子中原花青素B2含量高于原花青素B1[23-24]。LIANG等[6]检测发现葡萄种子中主要的二聚体类型是原花青素B1,占总二聚黄烷-3-醇的25%,原花青素B2占总二聚黄烷-3-醇的比例不超过3.5%。本研究共检测到4种原花青素,但没有检测到原花青素B1;原花青素B2在3个品种中含量均较高。这些结果的差异可能与分析方法、栽培生长条件、浆果生理条件和采样时期等因素有关,也可能是由于不同品种间的遗传差异。此外,本研究还发现,葡萄种子中除了单体黄烷-3-醇和聚合物原花青素外,黄酮和黄酮醇等酚类物质的含量也均较高。部分酚类物质仅在某个品种中特异性积累,这些特异代谢物可作为葡萄品种鉴定的依据。
单宁包括缩合单宁(多聚物)和可水解单宁。缩合单宁是黄烷醇衍生物,由于分子量太大(一般1 000 Da以上)导致广泛靶向代谢组学技术无法检测到。然而,该技术能检测到的单宁代谢通路的小分子物质包括莽草酸、1,2,3,4,6-五没食子酰基葡萄糖、没食子酸、鞣花酸、1--没食子酰基---葡萄糖、1,2,6-三--没食子酰基---葡萄糖、1,2,3,6-四--没食子酰基---葡萄糖等。本研究共检测到11种儿茶素及其衍生物,与前人研究结果一致[6,22],同时发现原儿茶醛等没食子酸衍生物在3个品种中的相对含量均较高。鞣花酸属于其他类物质,且仅在‘巨峰’和‘黄意大利’品种间存在显著性差异(数据未提供)。
白藜芦醇具有较强的抗癌和抗炎生物活性。对植物而言,白藜芦醇是一种重要的植保素,可增强植株抗病性[25],关于葡萄种子中白藜芦醇的作用目前尚没有明确阐述。多项研究表明,白藜芦醇在不同品种不同组织中含量差异较大,总体而言,白藜芦醇主要存在于叶片、果皮和种子中,且砧木品种高于其他栽培品种[26]。LIANG等[6]发现91份葡萄种质的种子中白藜芦醇含量从0—0.010 mg∙g-1FW。LI等[27]测定了120个葡萄种质果皮和种子中白藜芦醇含量,发现除少数品种含量较高外,大部分品种的果皮和种子中白藜芦醇含量小于2 μg∙g-1FW,本研究也发现3个品种种子中白藜芦醇相对含量均不高。LIANG等[6]发现每一种酚类物质含量与总酚含量呈现正相关关系,但是白藜芦醇与其他酚类物质含量之间相关性较低。本研究结果也发现3个品种种子中酚类物质的相对含量存在较大差异,但是白藜芦醇的相对含量却没有明显差异。包括白藜芦醇在内的芪类化合物是植物苯丙氨酸代谢途径的下游产物,合成过程受到苯丙氨酸裂解酶、芪合酶(STS)等多种酶的调控,其中STS是芪类化合物合成的限速酶,其表达受多种逆境胁迫诱导[28]。这些结果是否与的转录调控水平有关还需要进一步的验证。
脂类物质是植物细胞的组成部分,具有重要的生物学功能。尽管这些化合物在葡萄浆果中起着重要作用,但对葡萄脂质组成的认识尚且有限。前人研究表明,葡萄种子含有较高比例的不饱和脂肪酸(约60%),其中亚油酸在种子脂肪酸组成中占主导地位[29]。亚油酸含量高,亚麻酸含量低,-谷甾醇为主要甾醇[30]。不同葡萄品种间含油量差异较大,各基因型饱和脂肪酸值均低于单不饱和脂肪酸和多不饱和脂肪酸值;各品种脂肪酸中以亚油酸(C18:2)为主,其次为油酸(C18:1)和棕榈酸(C16:0)[31-32]。与前人研究结果一致,本研究发现葡萄种子中甘油磷脂含量较高,亚麻酸含量较低,甘油磷脂、甘油酯和脂肪酸的种类也非常丰富。
4 结论
通过对不同果皮颜色的葡萄品种成熟期种子代谢产物的鉴定和比较分析,发现不同葡萄品种种子中代谢物组分类似,但含量与果皮颜色和品种起源有关。本研究中3个品种表现为,果皮颜色越深,葡萄种子中代谢物含量越高;同一起源的品种间代谢物含量相似。酚类和脂类物质是葡萄种子代谢物的重要组分,由于其生物活性显著,葡萄籽可作为食品、制药和化妆品的良好来源。由于种子代谢物组分受多种因素综合影响,果皮颜色形成机理复杂多样,调查样本需进一步扩大,为葡萄种子代谢物差异化分析,开发和利用葡萄种子提供更多参考。
[1] JAYAPRAKASHA G K, SELVI T, SAKARIAH K K. Antibacterial and antioxidant activities of grape () seed extracts. Food Research International, 2003, 36(2): 117-122.
[2] ROCKENBACH I I, GONZAGA L V, RIZELIO V M, DE SOUZA SCHMIDT GONÇALVES A E, GENOVESE M I, FETT R. Phenolic compounds and antioxidant activity of seed and skin extracts of red grape (and) pomace from Brazilian winemaking. Food Research International, 2011, 44(4): 897-901.
[3] SHI J, YU J, POHORLY J E, KAKUDA Y. Polyphenolics in grape seeds-biochemistry and functionality. Journal of Medicinal Food, 2003, 6(4): 291-299.
[4] NUNES M A, PIMENTEL F, COSTA A S G, ALVES R C, OLIVEIRA M B P P. Cardioprotective properties of grape seed proanthocyanidins: An update. Trends in Food Science & Technology, 2016, 57: 31-39.
[5] AKABERI M, HOSSEINZADEH H. Grapes () as a potential candidate for the therapy of the metabolic syndrome. Phytotherapy Research, 2016, 30(4): 540-556.
[6] LIANG Z C, YANG Y Z, CHENG L L, ZHONG G Y. Characterization of polyphenolic metabolites in the seeds ofgermplasm. Journal of Agricultural and Food Chemistry, 2012, 60(5): 1291-1299.
[7] FERRANDINO A, LOVISOLO C. Abiotic stress effects on grapevine (L.): Focus on abscisic acid-mediated consequences on secondary metabolism and berry quality. Environmental and Experimental Botany, 2014, 103: 138-147.
[8] WRÓBEL M, KARAMA M, AMAROWICZ R, CZEK E F, WEIDNER S. Metabolism of phenolic compounds inseeds during stratification and during germination under optimal and low temperature stress conditions. Acta Physiologiae Plantarum, 2005, 27(3): 313-320.
[9] GOUOT J C, SMITH J P, HOLZAPFEL B P, BARRIL C. Impact of short temperature exposure ofL. cv. Shiraz grapevine bunches on berry development, primary metabolism and tannin accumulation. Environmental and Experimental Botany, 2019, 168: 103866.
[10] DOWNEY M O, HARVEY J S, ROBINSON S P. Analysis of tannins in seeds and skins of Shiraz grapes throughout berry development. Australian Journal of Grape and Wine Research, 2003, 9(1): 15-27.
[11] PRIEUR C, RIGAUD J, CHEYNIER V, MOUTOUNET M. Oligomeric and polymeric procyanidins from grape seeds. Phytochemistry, 1994, 36(3): 781-784.
[12] YOKOTSUKA K, FUKUI M. Changes in nitrogen compounds in berries of six grape cultivars during ripening over two years. American Journal of Enology and Viticulture, 2002, 53(1): 69-77.
[13] CHEN W, GONG L, GUO Z L, WANG W S, ZHANG H Y, LIU X Q, YU S B, XIONG L Z, LUO J. A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites: Application in the study of rice metabolomics. Molecular Plant, 2013, 6(6): 1769-1780.
[14] SAWADA Y, AKIYAMA K, SAKATA A, KUWAHARA A, OTSUKI H, SAKURAI T, SAITO K, HIRAI M Y. Widely targeted metabolomics based on large-scale MS/MS data for elucidating metabolite accumulation patterns in plants. Plant and Cell Physiology, 2009, 50(1): 37-47.
[15] WANG Y J, LIANG X J, LI Y K, FAN Y F, LI Y L, CAO Y L, AN W, SHI Z G, ZHAO J H, GUO S J. Changes in metabolome and nutritional quality offruits from three typical growing areas of China as revealed by widely targeted metabolomics. Metabolites, 2020, 10(2): 46.
[16] REN L, ZHANG T T, WU H X, GE Y X, ZHAO X H, SHEN X D, ZHOU W Y, WANG T L, ZHANG Y G, MA D F, WANG A M. Exploring the metabolic changes in sweet potato during postharvest storage using a widely targeted metabolomics approach. Journal of Food Processing and Preservation, 2021, 45(2): e15118.
[17] FAN F Y, HUANG C S, TONG Y L, GUO H W, ZHOU S J, YE J H, GONG S Y. Widely targeted metabolomics analysis of white peony teas with different storage time and association with sensory attributes. Food Chemistry, 2021, 362: 130257.
[18] 闫乐乐, 卜璐璐, 牛良, 曾文芳, 鲁振华, 崔国朝, 苗玉乐, 潘磊, 王志强. 广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响. 中国农业科学, 2022, 55(6): 1149-1158.doi: 10.3864/j.issn. 0578-1752.2022.06.008.
YAN L L, BU L L, NIU L, ZENG W F, LU Z H, CUI G C, MIAO Y L, PAN L, WANG Z Q. Widely targeted metabolomics analysis of the effects offeeding onsecondary metabolites. Scientia Agricultura Sinica, 2022, 55(6): 1149-1158.doi: 10.3864/j.issn.0578-1752.2022.06.008. (in Chinese)
[19] ZOU S C, WU J C, SHAHID M Q, HE Y H, LIN S Q, LIU Z H, YANG X H. Identification of key taste components in loquat using widely targeted metabolomics. Food Chemistry, 2020, 323: 126822.
[20] LU S W, WANG J Y, ZHUGE Y X, ZHANG M W, LIU C, JIA H F, FANG J G. Integrative analyses of metabolomes and transcriptomes provide insights into flavonoid variation in grape berries. Journal of Agricultural and Food Chemistry, 2021, 69(41): 12354-12367.
[21] MARTIN M E, GRAO-CRUCES E, MILLAN-LINARES M C, MONTSERRAT-DE LA PAZ S. Grape (L.) seed oil: a functional food from the winemaking industry. Foods, 2020, 9(10): 1360.
[22] GUENDEZ R, KALLITHRAKA S, MAKRIS D P, KEFALAS P. An analytical survey of the polyphenols of seeds of varieties of grape () cultivated in Greece: Implications for exploitation as a source of value-added phytochemicals. Phytochemical Analysis, 2005, 16(1): 17-23.
[23] FULEKI T, RICARDO DA SILVA J M. Catechin and procyanidin composition of seeds from grape cultivars grown in Ontario. Journal of Agricultural and Food Chemistry, 1997, 45(4): 1156-1160.
[24] OBREQUE-SLIER E, PEÑA-NEIRA A, LÓPEZ-SOLÍS R, ZAMORA- MARÍN F, RICARDO-DA SILVA J M, LAUREANO O. Comparative study of the phenolic composition of seeds and skins from Carménère and Cabernet Sauvignon grape varieties (L.) during ripening. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3591-3599.
[25] ALONSO-VILLAVERDE V, VOINESCO F, VIRET O, SPRING J L, GINDRO K. The effectiveness of stilbenes in resistant: Ultrastructural and biochemical events duringinfection process. Plant Physiology and Biochemistry, 2011, 49(3): 265-274.
[26] 李晓东, 何卿, 郑先波, 董建国, 范培格. 葡萄白藜芦醇研究进展. 园艺学报, 2011, 38(1): 171-184.
LI X D, HE Q, ZHENG X B, DONG J G, FAN P G. Advances in resveratrol research of grape. Acta Horticulturae Sinica, 2011, 38(1): 171-184. (in Chinese)
[27] LI X D, WU B H, WANG L J, LI S H. Extractable amounts of trans-resveratrol in seed and berry skin inevaluated at the germplasm level. Journal of Agricultural and Food Chemistry, 2006, 54(23): 8804-8811.
[28] DUAN D, HALTER D, BALTENWECK R, TISCH C, TRÖSTER V, KORTEKAMP A, HUGUENEY P, NICK P. Genetic diversity of stilbene metabolism in. Journal of Experimental Botany, 2015, 66(11): 3243-3257.
[29] PÉREZ-NAVARRO J, DA ROS A, MASUERO D, IZQUIERDO- CAÑAS P M, HERMOSÍN-GUTIÉRREZ I, GÓMEZ-ALONSO S, MATTIVI F, VRHOVSEK U. LC-MS/MS analysis of free fatty acid composition and other lipids in skins and seeds ofgrape cultivars. Food Research International, 2019, 125: 108556.
[30] PARDO J E, FERNÁNDEZ E, RUBIO M, ALVARRUIZ A, ALONSO G L. Characterization of grape seed oil from different grape varieties (). European Journal of Lipid Science and Technology, 2009, 111(2): 188-193.
[31] TANGOLAR S G, ÖZOĞUL Y, TANGOLAR S, TORUN A. Evaluation of fatty acid profiles and mineral content of grape seed oil of some grape genotypes. International Journal of Food Sciences and Nutrition, 2009, 60(1): 32-39.
[32] SABIR A, UNVER A, KARA Z. The fatty acid and tocopherol constituents of the seed oil extracted from 21 grape varieties (spp.). Journal of the Science of Food and Agriculture, 2012, 92(9): 1982-1987.
Identification and Comparative Analysis of Metabolites in Grape Seed Based on Widely Targeted Metabolomics
SHENG HongJie2, LU SuWen1, ZHENG XuanAng1, JIA HaiFeng1, FANG JingGui1
1College of Horticulture, Nanjing Agricultural University, Nanjing 210095;2Institute of Food Safety and Nutrition, Jiangsu Academy of Agricultural Sciences, Nanjing 210014
【】Grape seeds have high bioactivity because they are rich in many metabolites. The objective of this study was to comprehensively identify the metabolite components in grape seeds, to compare and to analyze the differences of metabolites among different varieties, and to explore the relationship between metabolites in grape seeds and skin color and variety origin, so as to provide a reference basis for further development and utilization of grape seeds. 【】The mature seeds of purple-skinned Kyoho (:×, JFS), pink-skinned Wink (, WKS), and yellow-skinned Italia (, YDS) were used for widely targeted metabolomics analysis by UPLC-MS/MS. The metabolites were identified and compared by multivariate statistical methods. 【】The quality of metabolomics data was good, and the data of samples within groups was repetitive and the differences in the data of samples among groups were existed. A total of 514 metabolites were identified in the seeds of three grape varieties, including 6 primary metabolites, such as amino acids and lipids, and 20 secondary metabolites, such as proanthocyanidins and resveratrol. Among different varieties, the metabolite components were similar but the metabolite contents were significantly different. The relative contents of most metabolites were high in the dark variety Kyoho, followed by the light variety Wink, but low in the colorless variety Italy, indicating that the metabolite contents in grape seeds might be positively correlated with the skin color. The relative contents of metabolites in the seeds of Wink and Italia were similar, while they were greatly different from those of Kyoho, indicating that the metabolite contents in grape seeds might be related to the variety origin. The differential metabolites among different varieties were mainly involved in phenylpropane biosynthesis, anthocyanin synthesis, lipid metabolism, etc. pathway. There were many phenolic compounds in the differential metabolites and the metabolites with the large difference were mainly flavonoids. Grape seeds were rich in phenols and lipids. In addition to monomeric flavane-3-ols and their polymers, the relative contents of other phenolic compounds such as flavones and flavonols were also high. There was no significant difference in the relative contents of resveratrol among the three varieties. The relative contents of glyceryl phosphatide such as lysophosphatidylcholine were high, while those of linolenic acid were low. There was little difference in the relative contents of lipids among different varieties. 【】The metabolite components in grape seeds of different varieties were similar, while the metabolite contents were related to the skin color and the variety origin. Phenols and lipids were important components of metabolites in grape seeds and could be used as good sources for food and other processing industries.
grape (); seed; metabolomics; metabolite; phenol; lipid

2022-05-20;
2022-08-17
国家自然科学基金(31901991)、江苏省农业科技自主创新资金项目(CX(21)3023)
生弘杰,E-mail:hjsheng@jaas.ac.cn。通信作者卢素文,E-mail:lusuwen@njau.edu.cn
(责任编辑 赵伶俐)

