水稻短宽粒基因SWG1的图位克隆
朱洪慧,李映姿,高远卓,林泓,王成洋,晏紫仪,彭瀚平,李田野,熊茂,李云峰
水稻短宽粒基因的图位克隆
朱洪慧,李映姿,高远卓,林泓,王成洋,晏紫仪,彭瀚平,李田野,熊茂,李云峰
西南大学水稻研究所/西南大学农业科学研究院/转基因植物与安全控制重庆市重点实验室,重庆 400716
【】水稻产量由单位面积有效穗数、每穗粒数和粒重3个因素构成,其中,粒重主要由水稻的籽粒形态决定。筛选和鉴定新的粒型突变材料和基因,可为产量性状的分子设计育种奠定基础。【】在籼稻保持系西大1B(XD1B)的甲基磺酸乙酯(EMS)诱变群体中鉴定到一个短宽粒突变体();分析籽粒形态和其他农艺性状,并对颖壳进行组织细胞学观察分析;运用BSA法进行基因定位;通过遗传互补试验确定候选基因;采用qRT-PCR分析该基因的表达模式及其他粒型相关基因和细胞发育基因的表达水平。【】农艺性状分析发现,与野生型相比,突变体粒长显著降低,粒宽显著增加,表现出短宽粒的表型;进一步组织和细胞学分析,发现突变体颖壳纵向细胞变短是粒长变短的主要原因,而粒宽增加是由于颖壳横向细胞数目和细胞大小同时增加。遗传分析结果表明,该突变性状受隐性单基因控制,通过图位克隆与遗传互补验证,确定候选基因为,编码一个植物特异转录因子。qRT-PCR分析发现该基因表达无明显的组织特异性,在茎、叶、幼穗中表达强烈。通过对已知粒型相关基因、细胞周期和细胞扩展相关基因进行分析,发现通过正向调控颖壳横向细胞数目和(或)细胞大小决定粒宽的和在突变体中上调明显,而正向调控纵向细胞数目和大小并负向调控横向细胞数目和大小的/在突变体明显下调;另外,部分与细胞周期和细胞扩展相关的基因也在突变体和野生型之间的表达也呈现显著差异。【】编码一个植物特异的转录因子,通过调控粒型基因(、和/等)影响颖壳的细胞增殖和细胞扩展,从而决定水稻籽粒长度和宽度。
水稻;籽粒形态;颖壳发育;图位克隆
0 引言
【研究意义】水稻(L.)是重要的粮食作物,全球有一半的人口食用水稻,目前,中国水稻产量在全球排名第一。水稻产量由单位面积有效穗数、每穗粒数和粒重3个因素共同决定,其中,粒重主要受籽粒形态的影响。水稻成熟籽粒最外层由一层坚硬的颖壳(内稃和外稃)包裹;在双受精前后,胚乳和胚开始发育之前,颖壳的细胞增殖和扩展已经完成,其大小形态已经确定;其后随着内部胚乳和胚等组织器官的发育,颖壳进一步硅化、脱水、成熟,但其大小形态不会再发生变化;换言之,虽然主要营养物质胚乳是受精后才开始发育,但是,籽粒形态在很大程度上是由受精前颖壳的发育所决定。基于颖壳的重要性,水稻颖壳发育的遗传机制研究对于改善粒型、提升产量具有重要的理论和应用价值。【前人研究进展】近年来,人们鉴定了许多与水稻粒型发育相关的基因,它们大多是通过影响颖壳细胞数目(细胞增殖)和(或)细胞大小(细胞扩展)来起作用[1-2];按照调控途径可以分为G蛋白信号、泛素蛋白酶体、MAPK信号通路、激素(BR、IAA和CK)信号和其他途径;而按照基因具体功能,即对颖壳细胞增殖和细胞扩展的具体作用,也可以将目前已克隆的与颖壳发育相关粒型基因分为三类:第一类,、、/、/、、/等只影响颖壳细胞增殖的基因。其中,编码异三聚体G蛋白中非典型的Gγ亚基,属于G蛋白途径,负向调控细胞增殖[3-5]。和/都属于泛素蛋白酶体途径,编码一个环型E3泛素连接酶,负调节细胞的分裂,突变后增加了颖壳细胞的数目,最终粒宽和粒重增加[6-7]。/编码一个泛素特异性蛋白酶,具有去泛素化活性,通过调控颖壳横向细胞增殖来正向调控水稻籽粒宽度[8]。/编码一个钙调素结合蛋白,是BR激素信号传导的正调控因子,通过影响颖壳的细胞数目来控制籽粒宽度和粒型[9-10]。同时,BR途径的/编码一个带有Kelch重复域的蛋白磷酸酶OsPPKL1,通过去磷酸化抑制BR信号转导和细胞周期蛋白Cyclin-T1;3活性,从而减少细胞分裂,抑制籽粒伸长[11-12]。属于其他途径,编码一个植物特有的PLATZ转录因子,通过籽粒的细胞增殖,正向调控籽粒长度[13]。第二类,、、、、和等只影响细胞扩展的基因。其中,属于泛素蛋白酶体途径的编码一个具有去泛素化酶活性的蛋白酶,通过影响颖壳细胞扩展来控制水稻籽粒的大小和形状;功能缺失后粒宽和粒厚增加,粒长变短[14],、和都与BR激素途径相关,其中,、编码细胞色素P450家族蛋白,是BR生物合成过程中的关键酶,通过调控细胞扩展影响颖壳的发育,正向调控籽粒大小,它们的多个功能缺失突变体都表现小粒,而过表达则增加籽粒长宽[15-18],卵形家族蛋白OFP3是BR合成和信号传导的抑制因子,负调控细胞伸长,过表达会导致籽粒变小[19],和都参与生长素途径,转录因子OsARF6受生长素信号调控,能直接与生长素输入载体OsAUX3启动子结合,正调控表达,通过改变颖壳细胞生长素的含量和分布、影响颖壳细胞的纵向伸长,进而负调控粒长和粒重[20]。第三类,、、/、、、/、/OsSPL16、SRS1/DEP2等基因可以同时影响颖壳细胞增殖和细胞扩展。其中,、、/与BR信号途径相关。编码一个丝氨酸羧肽酶,可以加强BR信号传导,通过促进水稻颖壳细胞分裂和扩展正向调控籽粒宽度[21]。GS9转录活性受BR途径OsGSK2蛋白的正调控,功能缺失突变体颖壳的纵向细胞长度增大而横向细胞数量减少,导致籽粒细长[22];模块同时受BR信号途径OsGSK2和下游转录因子OsBZR1的调控,/与通过互作促进细胞分裂和细胞膨大,正向调控籽粒大小[23-26]。编码一个膜定位蛋白,参与调节生长素的转运,是生长素响应和转运的正调控因子,通过增加颖壳细胞增殖与扩展,正向调控籽粒大小[27];编码细胞数目调控因子OsCNR1,与调控细胞周期的KRP1蛋白互作,影响细胞增殖和细胞生长,负向调控水稻粒宽和粒重[28]。GL7/GW7编码一个TONNEAU1募集基序蛋白,表达量上调能增加颖壳细胞的纵向细胞分裂并减少横向细胞分裂。GW8编码一个包含SBP结构域的转录因子OsSPL16,高表达时能促进细胞分裂和灌浆从而促进水稻粒宽增加和增产,进一步发现/OsSPL16直接与/GW7启动子结合并抑制其表达,从而增加横向细胞分裂,正向调控水稻粒宽[29-30]。编码一个植物特有的转录因子,功能缺失突变体颖壳的纵向细胞变大且细胞数目增多,横向细胞变宽,导致产生小圆粒表型[31-34]。【本研究切入点】通过颖壳发育影响水稻籽粒形态的基因数量庞大,它们位于多个调控途径并且通过几种不同的调控方式影响了颖壳发育过程中的细胞生长,进而决定最终籽粒的形态建成。然而,多数基因在籽粒长度和宽度上的影响是一致的,或仅仅调控其中一方面。目前,在籽粒形态的纵向和横向方面进行相反的调控基因仍较少。【拟解决的关键问题】本研究发现一个水稻短宽粒突变体,命名为(),通过对突变体进行详细的表型分析,明确的生物学功能;通过图位克隆和表达模式分析等,确定的基本信息,同时了解其调控籽粒形态发育的机制,为利用该基因进行水稻籽粒形态
分子设计育种奠定基础。
1 材料与方法
1.1 试验材料
水稻突变体来源于籼稻保持系西大1B(XD1B)的EMS诱变群体,经过多代自交进行分离纯化后,突变性状稳定遗传。选用正常不育系材料56S作母本,突变体作父本,两者杂交后收获F1种子,同年,在海南种植F1并收获种子。第二年种植获得F2群体,将F1、F2群体用于遗传分析和定位。
1.2 形态与组织学分析
挑取野生型和突变体成熟期的籽粒,用扫描电镜和体视镜观察表型并拍照。从和野生型处于抽穗期的花序中,选取开花前的小穗,置于酒精醋酸福尔马林混合固定液(FAA,50%无水乙醇、0.9 mol·L-1的冰乙酸和3.7%甲醛)中浸泡48 h以上,固定材料的细胞形态;然后,依次用乙醇进行梯度脱水、二甲苯透明和浸蜡处理。石蜡包埋,切出10 μm厚的蜡带。经预检查、分段后转移到涂抹多聚赖氨酸的载玻片上,经过展片、烘片后,进行番红染色,并用中性树脂封片。用光学显微镜NikonE600观察制作好的石蜡切片。
1.3 统计分析
于2022年夏季水稻抽穗期与成熟期,随机选取10株野生型和10株突变体,统计穗长、一次枝梗、二次枝梗、穗粒数、粒长、粒宽和粒重等农艺性状。随机选取野生型和突变体抽穗期10个小穗进行石蜡切片观察,每张切片统计小穗颖壳横向细胞数量与细胞面积。随机选取野生型和突变体成熟期的10个籽粒进行扫描电镜观察,统计颖壳纵向细胞数量与细胞长度。差异显著性均采用测验。
1.4 分子标记定位及连锁图谱的构建
在56S/杂交构建的F2群体中选取突变单株作为定位群体,使用BSA法进行目标基因的定位。根据F2植株表型,分别选取10株正常单株和10株突变单株,剪取等量叶片,构建正常基因池和突变基因池。用CTAB法提取亲本、基因池和定位群体单株的DNA。定位引物选用SSR引物(表1),由北京擎科生物科技有限公司合成。PCR反应体系为2.0 μL 10×PCR buffer、0.4 μL 2.5 mmol·L-1dNTPs、10.3 μL ddH2O、10 μmol·L-1前后引物各0.5 μL、1.0 μL模板DNA、0.3 μL 5 U·μL-1Taq酶。PCR程序为94℃ 5 min;94℃30 s,55℃30 s,72℃1 min,35个循环;72℃10 min。PCR产物经聚丙烯凝胶电泳后观察。将只呈现56S带型的单株记为A,只呈现带型的单株记为B,同时呈现双亲带型的单株记为H,用重组子个数进行作图,根据Gramene网站(http://www. gramene.org/)的水稻基因组信息构建物理图谱。
1.5 候选基因的克隆分析
从Gramene网站(http://www.gramene.org/)查询并下载注释基因的序列,设计突变位点扩增引物(F:5′-CAATAACTGCCACGGCAGCAAAC-3′和R:5′-CCAAGCAGCTCATCTTCCAGTCT-3′)。分别以野生型和突变体DNA为模板扩增目标序列,由测序公司进行测序分析。用Vector NTI 10.5软件中Align功能或Assemble功能查看并比对野生型和突变体之间序列找出突变基因及突变位点。使用Chromas2软件查看测序峰图。
1.6 遗传互补验证
设计扩增引物(-com-F1:5′-ATGACATGA TTACGAATTCATGCAGGGTAGATGAGTCTGATTA -3′和-com-R1:5′-GCTTGATCTCTTTTGGTTA TGTGGGTCAGTGCTGTTAAGAGCCC-3′;-com- F2:5′-GGGCTCTTAACAGCACTGACCCACATAAC CAAAAGAGATCAAGC-3′和-com-R1:5′- CGA CGGCCAGTGCCAAGCTTACAGGGAACCAACTAATCATCTG-3′),扩增序列、3 417 bp上游序列和60 bp下游序列(总长为11 327 bp),将酶切的pCAMBIA1300载体作为骨架,通过同源重组法构建互补载体,酶切位点为dⅢ和RⅠ。
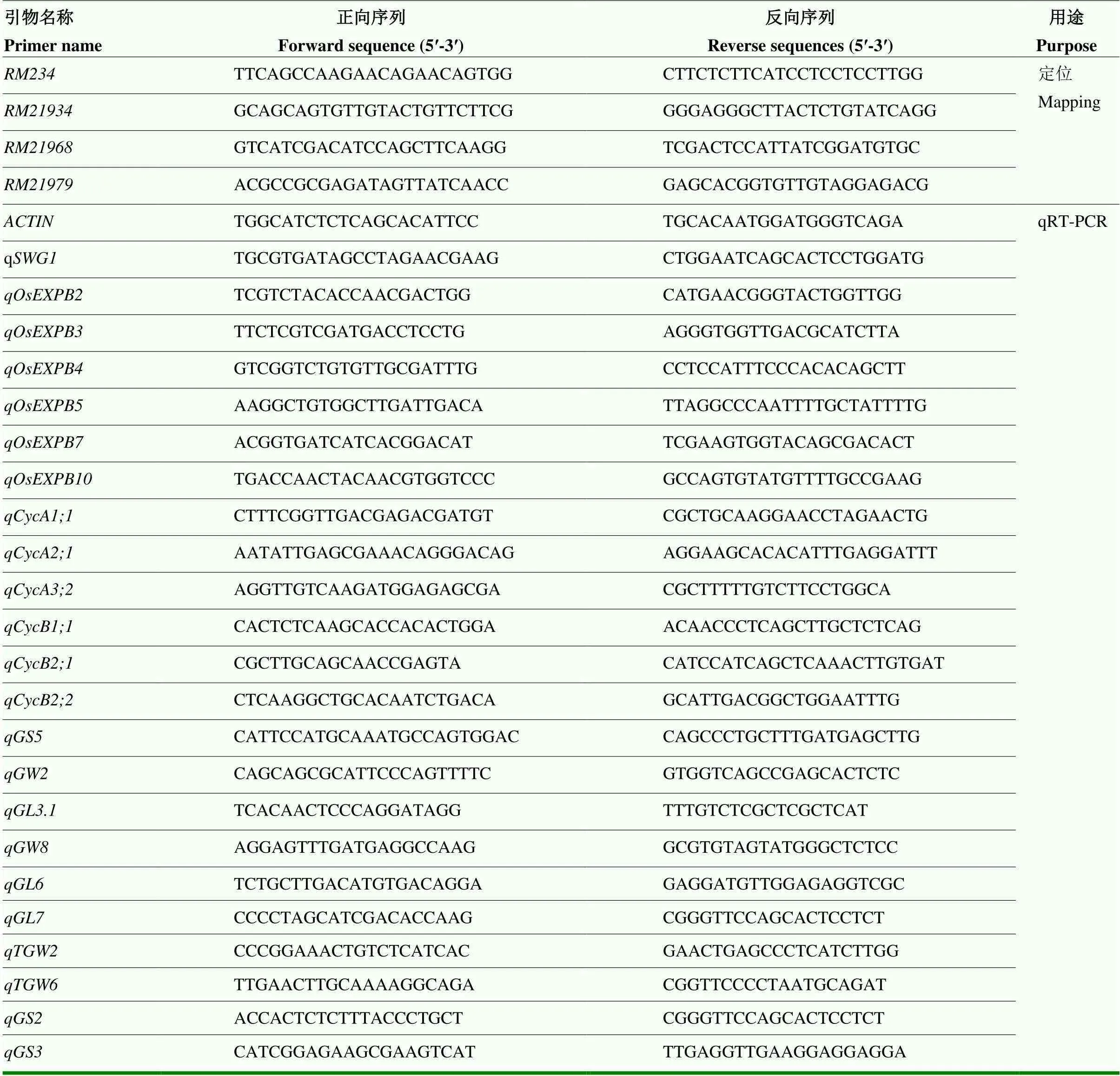
表1 引物序列
将构建好的载体质粒以及突变体种子送至武汉伯远公司进行遗传转化,获得转基因苗,先洗脱掉其根部的琼脂糖,然后室内培养数日,移至大田。提取转基因叶片的DNA,设计外源检测引物(- com-detection-F:5′-TAAGCTGCCAGTTGAGCGTTTC C-3′和-com-detection-R:5′-CACTTTATGCTTC CGGCTCGTATG-3′)进行PCR鉴定,以鉴定该遗传转化是否成功。
1.7 RNA提取及qRT-PCR分析
利用RNA提取试剂盒(TIANGEN生物公司)提取野生型和突变体RNA,并反转录成cDNA。以水稻为内参基因,使用Vector NTI 10.5软件设计引物(表1),用BIO-RAD CFX Connect Realtime Reaction System仪进行qRT-PCR,所得数据使用2-ΔΔCt法计算RQ与SD值,作图,并用检验法进行差异显著性分析。
2 结果
2.1 swg1突变体的表型分析
与野生型相比,突变体叶片直立,穗型直立,株型整体较为紧凑(图1-A)。同时,突变体穗长显著变短,比野生型短20%左右(图1-B和图1-E);虽然一次枝梗数无明显差异,但二次枝梗数显著低于野生型;由于二次枝梗数的减少和穗长的变短,突变体的每穗粒数极显著减少(图1-F—H)。
相比穗型的变化,突变体在籽粒形态上的改变也极为明显。首先,突变体籽粒的长度极显著变短,比野生型短12.3%(图1-C和图1-K),但突变体籽粒宽度极显著高于野生型9.4%(图1-C和图1-L);所以,突变体粒型表现为团粒,籽粒长宽比仅为3.0,而野生型达到3.6。可能由于长宽的相反变化,最终导致野生型和突变体的粒重无明显差异(图1-I)。进一步去除颖壳,统计野生型与突变体的糙米性状,发现突变体的糙米长极显著短于野生型10%左右,糙米宽极显著长于野生型8%左右,长宽比也极显著降低,这与籽粒变化基本一致(图1-D和图1-N—P)。
2.2 swg1突变体颖壳的细胞学分析
为进一步探究突变体出现短宽粒性状的原因,对突变体颖壳进行了细胞学分析。首先,通过扫描电镜观察分析了野生型和突变体外稃和内稃外表皮细胞特征和数量,发现野生型和突变体内外稃外表皮细胞均呈现典型的硅化特征(图2-A和图2-E),每个细胞上分布一个明显的瘤状突起,细胞纵向排列规则,横向无明显规律,野生型和突变体之间无明显差异(图2-B和图2-F);统计外稃外表皮纵向硅化细胞的总数量,发现与野生型相比并无明显差异(图2-I);进一步统计相同纵向长度的细胞数量,发现突变体的细胞数量极显著多于野生型,随后计算发现突变体外表皮硅化细胞的长度极显著小于野生型(图2-B、图2-F和图2-J)。表明突变体籽粒变短是由于颖壳细胞纵向扩展水平降低,从而导致细胞变短。
由于扫描电镜的拍摄平面和横向细胞的不规则排列问题,通过石蜡切片分析了野生型和突变体开花期小穗颖壳的横向细胞特征和数目。结果显示,外稃和内稃的细胞组成和特征在突变体和野生型之间并无明显差异,由外向内都是由4层细胞组成,包括1层硅化明显的外表皮,3—6层细胞壁染色较深、尺寸较小的厚壁细胞,2—3层染色较浅、尺寸较大的薄壁细胞,以及1层的内表皮细胞(图2-D和图2-H)。分别统计外稃横向的外表皮细胞、厚壁细胞和内表皮细胞的总数目,发现突变体横向细胞总数量极显著增多,其中,外表皮细胞、厚壁细胞增加幅度达到8.3%和9.3%(图2-K、图2-M和图2-O);进一步统计分析,发现外表皮细胞和内表皮细胞的横向宽度也均极显著高于野生型(图2-L和图2-N);随后,通过统计相同位置的细胞数目和面积,计算得出突变体横向厚壁细胞大小为125 μm2,极显著高于野生型35%(图2-P)。以上结果表明,突变体籽粒变宽是由于颖壳细胞横向细胞增殖与细胞扩展同时增加所导致。
综上所述,一方面通过正向调控颖壳纵向细胞扩展影响籽粒长度,另一方面通过同时抑制颖壳的横向细胞增殖和细胞扩展影响籽粒宽度。
2.3 swg1突变体的遗传分析
突变体与不育系56S杂交后,F1植株表现正常,F2群体植株则表现出显著的性状分离,其中,正常植株308株,突变表型植株95株,分离比为3.242﹕1,经卡平方测验其分离比符合3﹕1(2=0.438<20.05=3.84),表明的性状受隐性单基因控制(表2)。

A:野生型和突变体成熟期的株型对比;B:野生型和突变体成熟期的穗型对比;C:野生型和突变体的籽粒;D:野生型和突变体的米粒;E:穗长;F:一次枝梗数;G:每穗粒数;H:二次枝梗数;I:千粒籽粒重;J:千粒米重;K:籽粒长度;L:籽粒宽度;M:籽粒长宽比;N:米粒长度;O:米粒宽度;P:米粒长宽比。*:在p<0.05水平差异显著;**:在p<0.01水平差异极显著。下同

表2 swg1短宽粒性状的遗传分析
2.4 SWG1的定位
选用一套平均分布在水稻12条染色体的SSR引物,对56S、突变亲本进行多态性分析;随后在F2中分别随机选取野生型植株和突变体植株各10株构建基因池,用亲本间差异引物分析突变基因池和正常基因池,发现第7染色长臂端的分子标记RM21934和RM21979在2个基因池具有多态性;用这两个标记分析50个F2突变株,重组子个数分别为5和4,且目标基因位于2个标记之间。为进一步缩小定位区间,在RM21934和RM21979之间进一步筛选多态性分子标记,发现RM21968与RM234在亲本和基因池间具有多态性。继续用这两个标记分析56株F2突变株,重组子个数都为1,目的基因定位于RM21968与RM234分子标记之间(图3-A)。
2.5 SWG1候选基因分析
通过查询日本晴序列在定位区间分子标记RM21968(25.36 Mb)和RM234(25.47 Mb)(110 kb)之间的基因,共有18个注释基因(图3-B),包括、、编码含有结构域的蛋白质;、、、均编码转座子蛋白;、、、编码不同的酶类或组成酶的亚基;编码核糖体蛋白S2;、、、均编码蛋白质;编码转录因子(表3)。
为确定候选基因,对野生型XD1B和突变体进行了基因组重测序,比对定位区间重测序结果,发现_的第一个外显子第389个碱基发生了单碱基替换,由胞嘧啶(C)变成胸腺嘧啶(T),随后通过PCR进行扩增比对,确定突变体中位点的确发生了C-T的替换,从而导致翻译的蛋白质由原本的脯氨酸变成丝氨酸,因此,将暂定为的候选基因(图3-C)。

A:扫描电镜下野生型的颖壳外表面,标尺=4 mm;B:扫描电镜下野生型的外稃外表皮局部,标尺=400 μm;C:野生型小穗横切面的石蜡切片,标尺=2 mm;D:野生型小穗横切面的石蜡切片局部及细胞类型标注;E:扫描电镜下突变体的颖壳外表面,标尺=4 mm;F:扫描电镜下突变体的外稃外表皮局部,标尺=400 μm;G:突变体小穗横切面的石蜡切片,标尺=2 mm;H:突变体小穗横切面的石蜡切片局部及细胞类型标注;I:外稃纵向上外表皮细胞数目的统计;J:外稃纵向上外表皮细胞长度的统计;K:外稃横向上外表皮细胞数目的统计;L:外稃横向上外表皮细胞宽度的统计;M:外稃横向上内表皮细胞数目的统计;N:外稃横向上内表皮细胞数目的统计;O:外稃横向上厚壁细胞数目的统计;P:外稃横向上厚壁细胞面积的统计。LE:外稃;OEP:外表皮细胞;SC:厚壁细胞;PA:内稃;IEP:内表皮细胞
A: The epidermis of wild-type glume under scanning electron microscope, Bar=4 mm; B: The epidermis of lemma of wild type under scanning electron microscope, Bar=400 μm; C: Paraffin section of cross section of wild-type spikelets, Bar=2 mm; D: Partly paraffin section and cell type labeling on the cross section of wild-type spikelets; E: The epidermis of mutant glume under scanning electron microscope, Bar=4 mm; F: The epidermis of lemma of mutant under scanning electron microscope, Bar=400 μm; G: Paraffin section of cross section of mutant spikelets, Bar=2 mm; H: Partly paraffin section and cell type labeling on the cross section of mutant spikelets; I: Statistics of the number of outer epidermal cells in lemma longitudinal direction; J: Statistics of the length of outer epidermal cells in lemma longitudinal direction; K: Statistics of the number of outer epidermal cells in lemma transverse direction; L: Statistics of the width of outer epidermal cells in lemma transverse direction; M: Statistics of the number of inner epidermal cells in lemma transverse direction; N: Statistics of the number of inner epidermal cells in lemma transverse direction; O: Statistics of the number of sclerenchyma cells in lemma transverse direction; P: Statistics of the area of sclerenchyma cells in lemma transverse direction. LE: lemma; OEP: Outer epidemics; SC: sclerenchyma cells; PA: parenchyma cells; IEP: inner epidermal cells
图2 野生型和颖壳的组织细胞学分析
Fig. 2 Histocytology analysis of wild-type andmutant glumes
2.6 SWG1候选基因的遗传互补验证
包含10个外显子,开放阅读框全长7 850 bp,CDS全长4 098 bp,编码包含1 365个氨基酸的蛋白质。为了佐证的突变是导致突变体表型的原因,设计特异引物扩增野生型中的(包括3 417 bp启动子、基因组DNA 7 850 bp及60 bp下游序列),构建互补表达载体(图4-A),随后,将此表达载体运用农杆菌侵染法转入中。
共获得17株T0转基因植株,使用外源转基因检测引物进行扩增(图4-A中F1、R1),结果表明,有7株为阳性植株(图4-B);进一步用内源突变位点检测引物(图4-A中F2、R2)扩增片段进行测序分析,结果表明,7株阳性植株全部含有纯合突变体位点(图4-C)。观察分析这些转基因植株抽穗期和成熟期的表型,发现这些转基因植株中穗型、粒型性状全都与野生型类似,完全恢复正常(图4-D—H)。上述结果证明,就是。在先前的研究中被鉴定为直立密穗基因,编码一个植物特有的转录因子[32]。

A:SWG1的精细定位;B:定位区间内的18个开放阅读框;C:SWG1的基因结构及突变位点。Ser:丝氨酸;Pro:脯氨酸;Arg:精氨酸
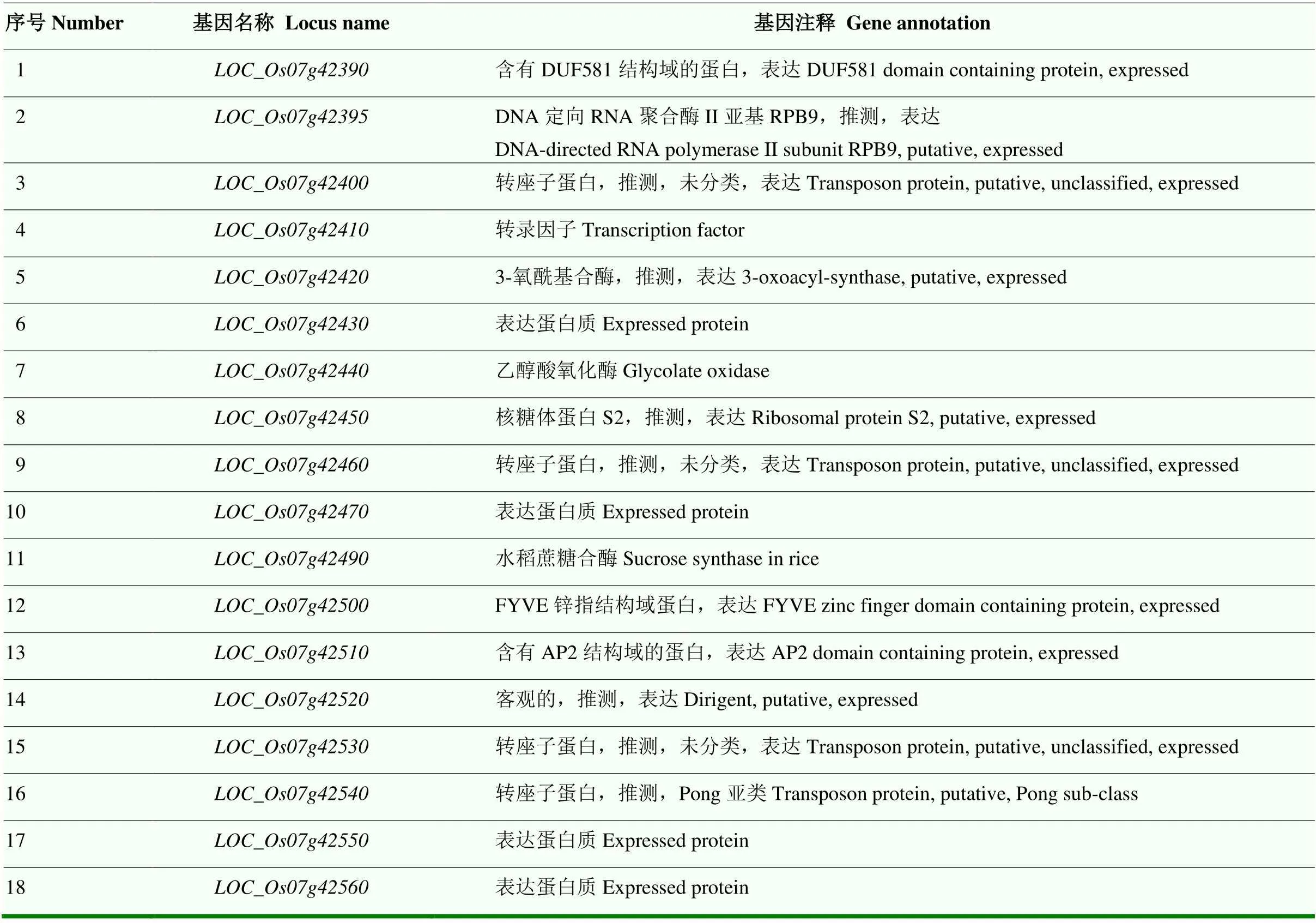
表3 定位区间内的注释基因
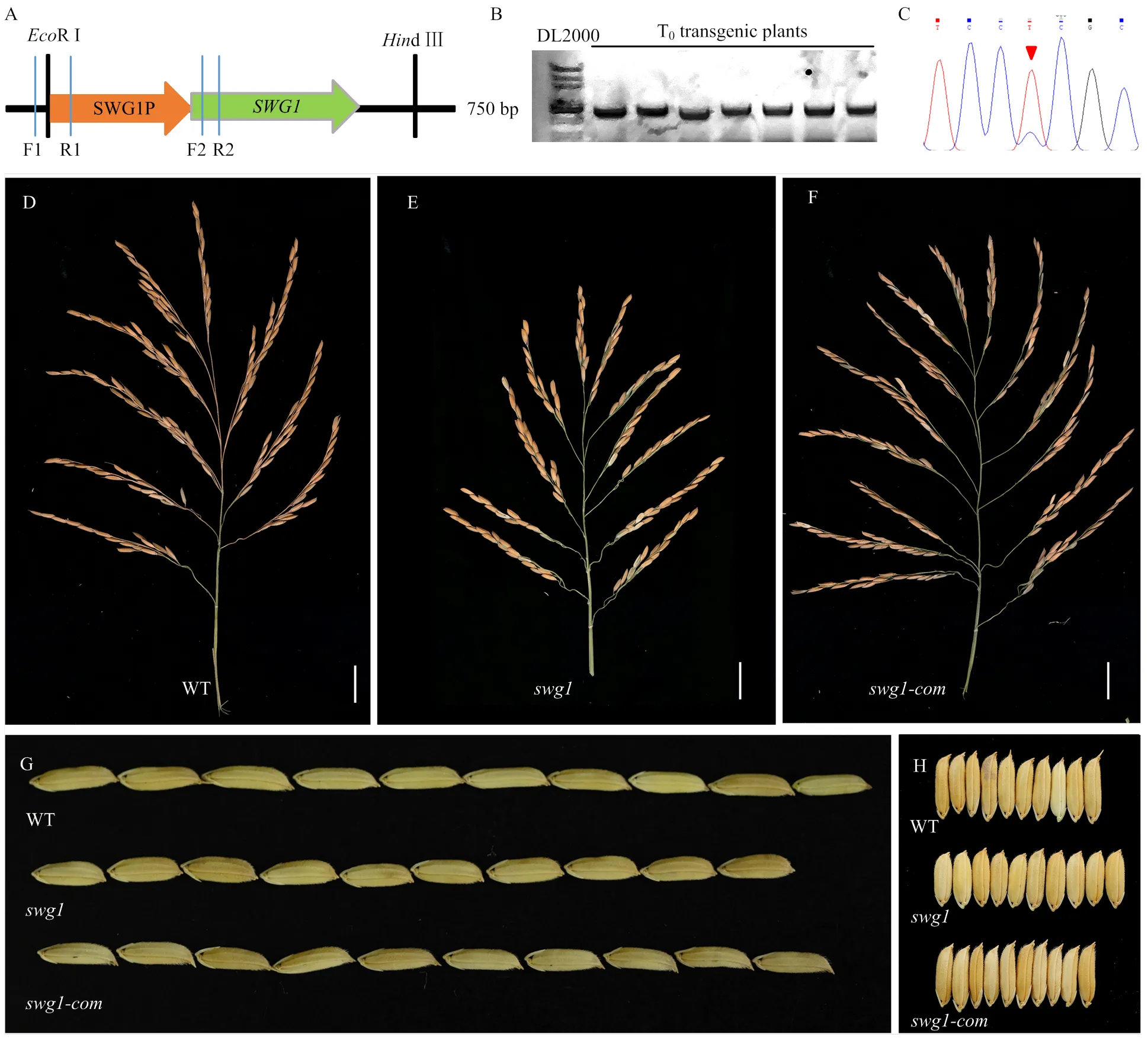
A:pCAMBIA1300-SWG1载体示意图;B:7株转基因植株的阳性结果电泳图;C:F2-R2片段的测序峰图;D—F:野生型、突变体和互补植株的穗型,标尺=1 cm;G:野生型、突变体和互补植株籽粒的十粒长;H:野生型、突变体和互补植株籽粒的十粒宽
2.7 SWG1的表达模式分析
为明确的表达部位,运用qRT-PCR对的表达进行转录水平分析。结果表明,在植株中广泛表达,在根、茎、叶、叶鞘、穗中均有表达,无明显的组织特异性。特别地,在穗中,的表达随着穗长度的增加而逐渐减少,在1和3 cm的幼穗中表达最为强烈,在7、9和11 cm的穗中也都有较高的表达(图5)。颖壳由外稃和内稃组成,作为最早起始的花器官,1—3 cm是其细胞增殖最为剧烈的时期,而7—11 cm时期应该是处于细胞的扩展阶段,因此,推测在穗发育各个阶段的表达与其功能是相适应的。

图5 SWG1在野生型中的qRT-PCR表达分析
2.8 粒型相关基因及细胞发育相关基因的表达
先前的研究认为编码一个植物特有的转录因子[30],为了了解的作用机制,通过qRT-PCR分析已知粒型调控基因在野生型和突变体之间的表达差异。由于水稻粒型的调控网络复杂庞大,选取了部分通过影响颖壳细胞增殖和(或)细胞扩展调控粒长和粒宽的代表性基因,包括、、、、、、、和。结果发现,与野生型相比,促进颖壳横向细胞分裂和扩展的、促进颖壳横向细胞分裂的在中均呈极显著上调表达;同时,(促进颖壳细胞分裂调控粒长)、/(调控细胞分裂与扩展,正向调控粒长、负向调控粒宽)、(促进细胞分裂和细胞膨大调控籽粒大小)、(负向调控籽粒大小)和(影响细胞增殖和细胞扩展、负向调控水稻粒宽)呈显著下调表达(图6-A)。总之,和的上调表达、/、及的下调表达与突变体籽粒由于颖壳细胞数目变多、细胞变大导致的籽粒变宽表型相吻合,而突变体由于细胞变小导致的粒长减少也与/、的下调表达相一致。
为进一步明确突变体颖壳细胞增殖和扩展的变化原因,检测了部分细胞周期相关基因和细胞扩展相关基因的表达。结果显示,与细胞分裂相关的大部分基因上调表达,其中,表达上调37%,表达上调29%(图6-B),揭示的横向细胞数目变多可能是由于细胞分裂增强所导致;同时,在6个检测的细胞扩展相关基因中,4个上调表达,2个下调表达,其中,、和表达量上升40%左右,表达量上升近1倍(图6-C),而和则呈明显的下调表达。结果表明,突变体颖壳细胞大小的变化的确与细胞扩展有关。
总之,可能通过转录调控部分已知的粒型基因的表达,进而影响了部分与细胞周期和细胞扩展相关基因的表达,决定了颖壳细胞数目和大小的发育,最终参与了籽粒形态的发育。
3 讨论
3.1 swg1突变体是dep2的新等位突变体,同时调控籽粒形态和穗部性状发育
本研究从XD1B的EMS诱变群体中鉴定到一个短宽粒突变体,通过图位克隆和遗传互补试验将候选基因定为,其编码一个转录调控因子。先前报道了该基因的多个等位突变体,其中,、、均表现出植株矮化、直立密穗、叶片直立等表型;Zhu等[31]认为的茎秆更粗,且最上部节间的维管束组织多于野生型,增加了节间的机械强度,从而导致植株直立。Li等[32]研究发现的一次枝梗与二次枝梗数目与野生型相比无显著变化,但细胞增殖异常导致了穗长减短,这可能是产生密穗表型的原因。Zhu等[33]研究表明OsRELA作为转录调节因子,通过调控的转录活性控制茎中细胞、近轴侧薄壁细胞、远轴侧薄壁细胞的生长,从而对叶片角度和株高有正向调节作用。另外一个等位突变体表现出小圆粒的性状,认为籽粒变短是由于细胞长度和细胞数量均下降,而籽粒变宽是由于细胞横向宽度增加[34]。本研究鉴定的同时表现出直立密穗和短宽粒等性状,这符合先前等位突变体的表型,说明是的新等位突变体。然而,虽然的短宽粒表型与先前等位突变体的小圆粒表型一致,都是长度减少和宽度增加;但这种宏观表型变化背后的细胞学表型却具有明显差异,先前研究表明突变体颖壳外表皮细胞较野生型更短更宽,籽粒的变化是由于细胞扩展异常导致[31];突变体籽粒变化可能是由于细胞增殖异常[32],籽粒颖壳纵向细胞变大且细胞数目增多,横向细胞变宽[34]。而在本研究中,颖壳在纵向上的细胞数目没有显著差异,其变短完全是由于细胞纵向扩展不足;另外在横向上,除了与一样细胞变宽变大以外,还表现出细胞数目增多,导致这种差异可能的原因是突变位点的不同,的突变发生在第6外显子区域,、均在该基因的第7外显子区域发生了突变,而本研究是的第一个外显子区域发生了突变,不同位点的突变可能导致SWG1蛋白的结构发生变化,进而改变了蛋白功能,导致SWG1蛋白所处调控途径的上下游基因出现差异,从而表现出最终表型(细胞学)上的不同。但SWG1蛋白不具有任何已知的结构域,若要明确SWG1蛋白与籽粒颖壳细胞发育的关系,需要对其蛋白结构进行深入研究。
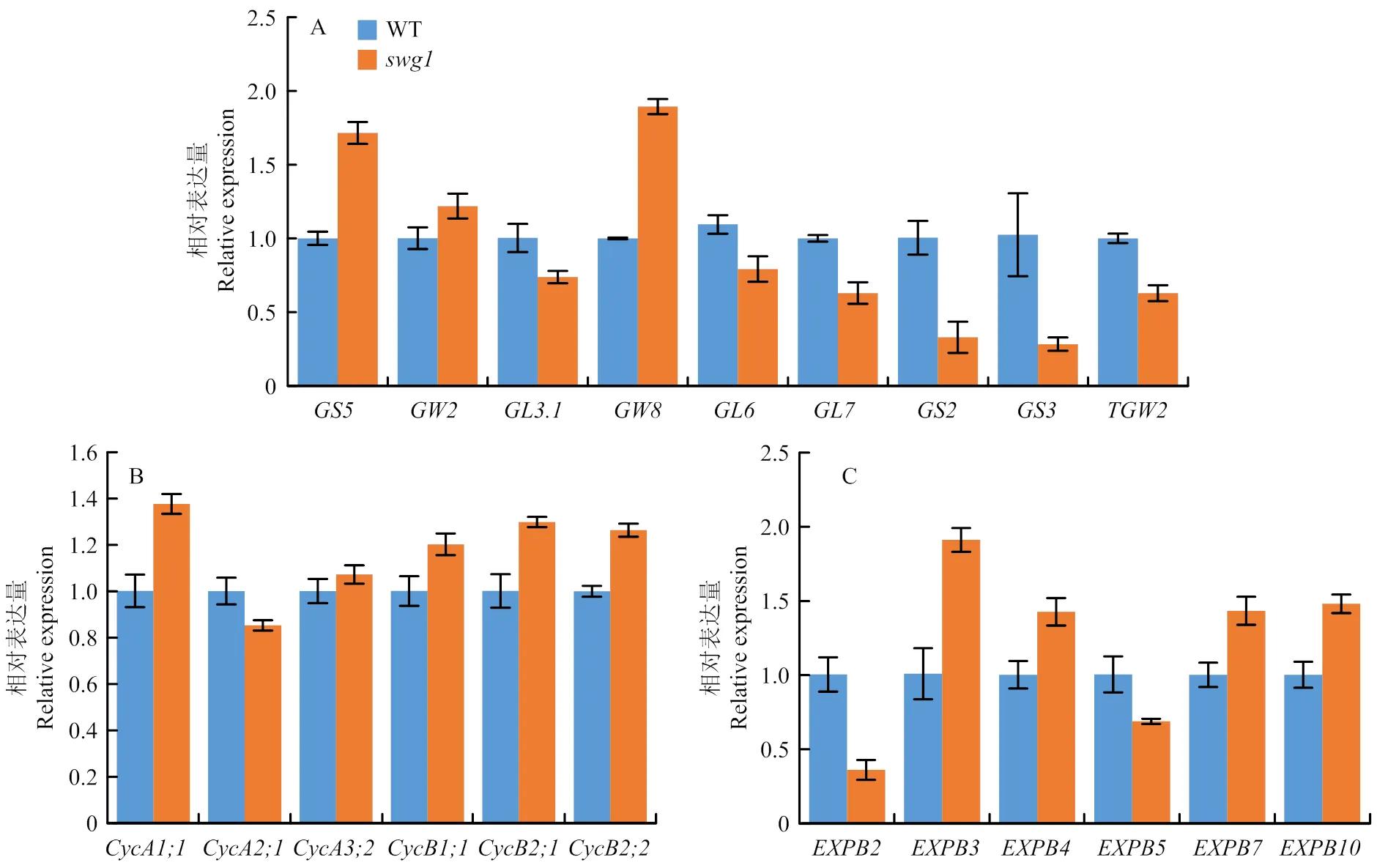
A:野生型和突变体中粒型相关基因的转录水平;B:野生型和突变体中细胞分裂相关基因的转录水平;C:野生型和突变体中细胞扩展相关基因的转录水平
3.2 SWG1在籽粒长宽上进行相反的调控
目前,已报道大量与水稻籽粒形态发育相关的基因,它们大多是通过细胞增殖或(和)细胞扩展影响颖壳发育,但多数基因对籽粒形态发育的影响都比较单一,在籽粒长度和宽度上表现出一致的调控,或仅仅调控其中一方面。本研究进行了详细的细胞学分析,发现颖壳纵向上细胞数目不变而长度减少,横向上细胞数目和大小均增加,明确了一边通过正向调控细胞扩展影响籽粒长度,一边通过负向调控横向细胞增殖和细胞扩展影响籽粒宽度,特别是在细胞扩展上呈现出纵横2个方向上相反的调控方式。本研究进一步发现的突变影响了多个籽粒大小发育相关基因的表达。其中,、的上调表达、/、的下调表达与的表型高度一致。编码一个丝氨酸羧肽酶,具有加强BR信号传导的功能,最终促进水稻颖壳细胞分裂和扩展正向调控籽粒宽度[21]。/的上调表达能增加谷粒的纵向细胞分裂和伸长,并减少横向细胞分裂和扩展,导致谷粒变得细长;而是一个包含SBP结构域的转录因子,能够直接与启动子结合并抑制它的表达[29-30]。所以,在中,/的下调表达可能是上调表达的结果,而不是突变的直接结果。TGW2编码细胞数目调控因子OsCNR1,通过与调控细胞周期的KRP1蛋白互作影响细胞增殖和细胞生长,负向调控水稻粒宽[28],所以,在中,的下调表达与颖壳细胞横向分裂和扩展增加也是高度吻合。因此,推测编码的转录因子可能直接或间接参与了、和的转录调控,从而决定籽粒的形态发育。
除了这些基因以外,籽粒大小调控基因和在突变中也表现出明显的下调表达,但是与的表型并不是十分匹配;的作用机制与相似,和BR信号途径相关,通过促进细胞分裂和细胞扩展正向调控籽粒大小[23-26],所以,在中,的下调表达与纵向细胞伸长不足是相适应的,但是与横向的细胞分裂与扩展加强是矛盾的,推测其对突变体横向细胞的影响可能有其他基因作用作屏蔽。属于G蛋白信号途径,编码一个非典型的Gγ亚基,通过与或竞争性结合Gβ亚基,从而负向调控籽粒长度[3-5],但是其表达明显下调似乎与籽粒变短表型是不匹配的;先前的研究表明不同的结构域变异会导致其功能相反,OSR结构功能的丢失会导致形成长的籽粒,而C端TNFR/NGFR和VWFC结构域功能域失活突变会产生非常短的籽粒[4]。因此,要明确的表达与表型的关系,需要进一步去分析突变体中蛋白是属于哪种类型。
4 结论
从籼稻保持系XD1B的EMS诱变群体中鉴定到一个短宽粒突变体。相较于野生型,突变体粒长变短,粒宽增加,呈短宽粒的表型;突变体颖壳纵向细胞变短是导致粒长变短的主要原因,而粒宽增加是由于颖壳横向细胞数目和细胞大小同时增加导致。该突变性状受隐性单基因——控制,其编码一个植物特异转录因子,无组织特异性表达,但在茎、叶、幼穗中表达量较高,正向调控颖壳横向细胞数目和(或)细胞大小,可能通过转录调控部分已知的粒型基因,进而影响了部分细胞周期和细胞扩展相关基因的表达,决定了颖壳细胞数目和大小的发育,最终参与了籽粒的形态发育。
[1] Horváth B M, Magyar Z, Zhang Y X, HAMBURGER A W, BAKÓ L, VISSER R G F, BACHEM C W B, BÖGRE L.regulates organ size through cell growth and proliferation in plants. The EMBO Journal, 2006, 25(20): 4909-4920.
[2] HORIGUCHI G, FERJANI A, FUJIKURA U, TSUKAYA H. Coordination of cell proliferation and cell expansion in the control of leaf size in. Journal of Plant Research, 2006, 119(1): 37-42.
[3] Fan C C, Xing Y Z, Mao H L, LU T T, HAN B, XU C G, LI X H, ZHANG Q F., a major QTL for grain length and weight and minor QTL for grain width and thickness in rice, encodes a putative transmembrane protein. Theoretical and Applied Genetics, 2006, 112(6): 1164-1171.
[4] Mao H L, Sun S Y, Yao J L, WANG C R, YU S B, XU C G, LI X H, ZHANG Q F. Linking differential domain functions of theprotein to natural variation of grain size in rice. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19579-19584.
[5] Sun S Y, Wang L, Mao H L, SHAO L, LI X H, XIAO J H, OUYANG Y D, ZHANG Q F. A G-protein pathway determines grain size in rice. Nature Communications, 2018, 9: 851.
[6] Song X J, Huang W, Shi M, ZHU M Z, LIN H X. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase. Nature Genetics, 2007, 39(5): 623-630.
[7] Hao J Q, Wang D K, Wu Y B, HUANG K, DUAN P G, LI N, XU R, ZENG D L, DONG G J, ZHANG B L, ZHANG L M, INZÉ D, QIAN Q, LI Y H. The--pathway controls grain size and weight in rice. Molecular Plant, 2021, 14(8): 1266-1280.
[8] Shi C L, Ren Y L, Liu L L, WANG F, ZHANG H, TIAN P, PAN T, WANG Y F, JING R N, LIU T Z, WU F Q, LIN Q B, LEI C L, ZHANG X, ZHU S S, GUO X P, WANG J L, ZHAO Z C, WANG J, ZHAI H Q, CHENG Z J, WAN J M. Ubiquitin specific protease 15
has an important role in regulating grain width and size in rice. Plant Physiology, 2019, 180(1): 381-391.
[9] Weng J F, Gu S H, Wan X Y, GAO H, GUO T, SU N, LEI C L, ZHANG X, CHENG Z J, GUO X P, WANG J L, JIANG L, ZHAI H Q, WAN J M. Isolation and initial characterization of, a major QTL associated with rice grain width and weight. Cell Research, 2008, 18(12): 1199-1209.
[10] Liu J F, Chen J, Zheng X M, WU F Q, LIN Q B, HENG Y Q, TIAN P, CHENG Z J, YU X W, ZHOU K N, ZHANG X, GUO X P, WANG J L, WANG H Y, WAN J M.acts in the brassinosteroid signalling pathway to regulate grain width and weight in rice. Nature Plants, 2017, 3: 17043.
[11] Qi P, Lin Y S, Song X J, SHEN J B, HUANG W, SHAN J X, ZHU M Z, JIANG L W, GAO J P, LIN H X. The novel quantitative trait locuscontrols rice grain size and yield by regulating. Cell Research, 2012, 22(12): 1666-1680.
[12] Gao X Y, Zhang J Q, Zhang X J, ZHOU J, JIANG Z S, HUANG P, TANG Z B, BAO Y M, CHENG J P, TANG H J, ZHANG W H, ZHANG H S, HUANG J. Ricefunctions with the GSK3/SHAGGY-Like kinaseto modulate brassinosteroid signaling. The Plant Cell, 2019, 31(5): 1077-1093.
[13] Wang A H, Hou Q Q, Si L Z, HUANG X H, LUO J H, LU D F, ZHU J J, SHANGGUAN Y Y, MIAO J S, XIE Y F, WANG Y C, ZHAO Q, FENG Q, ZHOU C C, LI Y, FAN D L, LU Y Q, TIAN Q L, WANG Z X, HAN B. The PLATZ transcription factoraffects grain length and number in rice. Plant Physiology, 2019, 180(4): 2077-2090.
[14] Huang K, Wang D K, Duan P G, ZHANG B L, XU R, LI N, LI Y H., which encodes an otubain-like protease with deubiquitination activity, influences grain size and shape in rice. The Plant Journal, 2017, 91(5): 849-860.
[15] Fang N, Xu R, Huang L J,ZHANG B L, DUAN P G, LI N, LUO Y H, LI Y H.controls grain size, grain number and grain yield in rice. Rice (New York, NY), 2016, 9(1): 64.
[16] Wu Y Z, Fu Y C, Zhao S S, GU P, ZHU Z F, SUN C Q, TAN L B., a new allele of, controls panicle architecture and seed size in rice. Plant Biotechnology Journal, 2016, 14(1): 377-386.
[17] Zhou Y, Tao Y J, Zhu J Y, MIAO J, LIU J, LIU Y H, YI C D, YANG Z F, GONG Z Y, LIANG G H., a novel allele of, regulates grain number and grain size in a high-yield rice variety. Rice (New York, NY), 2017, 10(1): 34.
[18] Tong X H, Wang Y F, Sun A Q, BELLO B K, NI S, ZHANG J., a novel allele of, regulates grain shape and seed germination in rice (L.). International Journal of Molecular Sciences, 2018, 19(12): 4069.
[19] Xiao Y H, Zhang G X, Liu D P, NIU M, TONG H N, CHU C C.stabilizesto suppress brassinosteroid responses in rice. The Plant Journal, 2020, 102(6): 1187-1201.
[20] Qiao J Y, Jiang H Z, Lin Y Q, SHANG L G, WANG M, LI D M, FU X D, GEISLER M, QI Y H, GAO Z Y, QIAN Q. A novel--module regulates grain length and weight in rice. Molecular Plant, 2021, 14(10): 1683-1698.
[21] Li Y B, Fan C C, Xing Y Z, JIANG Y H, LUO L J, SUN L, SHAO D, XU C J, LI X H, XIAO J H, HE Y Q, ZHANG Q F. Natural variation inplays an important role in regulating grain size and yield in rice. Nature Genetics, 2011, 43(12): 1266-1269.
[22] Zhao D S, Li Q F, Zhang C Q, ZHANG C, YANG Q Q, PAN L X, REN X Y, LU J, GU M H, LIU Q Q.acts as a transcriptional activator to regulate rice grain shape and appearance quality. Nature Communications, 2018, 9: 1240.
[23] Che R H, Tong H N, Shi B H,LIU Y Q, FANG S R, LIU D P, XIAO Y H, HU B, LIU L C, WANG H R, ZHAO M F, CHU C C. Control of grain size and rice yield by-mediated brassinosteroid responses. Nature Plants, 2016, 2: 15195.
[24] Duan P G, Ni S, Wang J M, ZENG L J, XU J, YU H P, SHI Z Y, PAN J J, ZHANG D, KANG S J, ZHU L, DONG G J, GUO L B, ZENG D L, ZHANG G H, XIE L H, XIONG G S, LI J Y, QIAN Q. Regulation ofbycontrols grain size and yield in rice. Nature Plants, 2016, 2: 15203.
[25] Hu J, Wang Y X, Fang Y X, ZENG L J, XU J, YU H P, SHI Z Y, PAN J J, ZHANG D, KANG S J, ZHU L, DONG G J, GUO L B, ZENG D L, ZHANG G H, XIE L H, XIONG G S, LI J Y, QIAN Q. A rare allele ofenhances grain size and grain yield in rice. Molecular Plant, 2015, 8(10): 1455-1465.
[26] Li S C, Gao F Y, Xie K L, ZENG X H, CAO Y, ZENG J, HE Z S, REN Y, LI W B, DENG Q M, WANG S Q, ZHENG A P, ZHU J, LIU H N, WANG L X, LI P. The--regulatory module determines grain size and yield in rice. Plant Biotechnology Journal, 2016, 14(11): 2134-2146.
[27] Liu L C, Tong H N, Xiao Y H, CHE R H, XU F, HU B, LIANG C Z, CHU J F, LI J Y, CHU C C. Activation ofsignificantly improves grain size by regulating auxin transport in rice. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(35): 11102-11107.
[28] Ruan B P, Shang L G, Zhang B, HU J, WANG Y X, LIN H, ZHANG A P, LIU C L, PENG Y L, ZHU L, REN D Y, SHEN L, DONG G J, ZHANG G H, ZENG D L, GUO L B, QIAN Q, GAO Z Y. Natural variation in the promoter ofdetermines grain width and weight in rice. The New Phytologist, 2020, 227(2): 629-640.
[29] Wang Y X, Xiong G S, Hu J, JIANG L, YU H, XU J, FANG Y X, ZENG L J, XU E B, XU J, YE W J, MENG X B, LIU R F, CHEN H Q, JING Y H, WANG Y H, ZHU X D, LI J Y, QIAN Q. Copy number variation at thelocus contributes to grain size diversity in rice. Nature Genetics, 2015, 47(8): 944-948.
[30] Wang S K, Li S, Liu Q, WU K, ZHANG J Q, WANG S S, WANG Y, CHEN X B, ZHANG Y, GAO C X, WANG F, HUANG H X, FU X D. The-regulatory module determines grain shape and simultaneously improves rice yield and grain quality. Nature Genetics, 2015, 47(8): 949-954.
[31] Zhu K M, Tang D, Yan C J,CHI Z C, YU H X, CHEN J M, LIANG J S, GU M H, CHENG Z K.encodes a novel protein that regulates panicle erectness in indica rice. Genetics, 2010, 184(2): 343-350.
[32] Li F, Liu W B, Tang J Y, CHEN J F, TONG H N, HU B, LI C L, FANG J, CHEN M S, CHU C C.Riceis essential for determining panicle outgrowth and elongation. Cell Research, 2010, 20(7): 838-849.
[33] Zhu C L, Xing B, Teng S Z,DENG C, SHEN Z Y, AI P F, LU T G, ZHANG S W, ZHANG Z G.regulates leaf inclination by repressing the transcriptional activity ofin rice. Frontiers in Plant Science, 2021, 12: 760041.
[34] Abe Y, Mieda K, Ando T, KONO I, YANO M, KITANO H, IWASAKI Y. The() gene is involved in the regulation of seed size in rice. Genes & Genetic Systems, 2010, 85(5): 327-339.
Map-based Cloning of theGenein Rice (L.)
Zhu HongHui, Li YingZi, Gao YuanZhuo, Lin Hong, Wang ChengYang, Yan ZiYi, Peng HanPing, Li TianYe, Xiong Mao, Li YunFeng
Rice Research Institute, Southwest University/Academy of Agricultural Sciences, Southwest University/Chongqing Key Laboratory of Application and Safety Control of Genetically Modified Crops, Chongqing 400716
【】Rice yield is composed of effective panicle number per unit area, grains per panicle and grain weight, in which grain weight is mainly determined by grain morphology. Screening and identification of new grain type mutation materials and genes can lay a foundation for molecular design breeding of yield traits. 【】A short and wide grain mutant() was identified in the mutant population of indica rice maintainer line Xida1B(XD1B) induced by ethyl methane sulfonate (EMS). The grain morphology and other agronomic characters were analyzed, and the glume was observed and analyzed by histocytology. Gene mapping was carried out by BSA method, and candidate genes were identified by genetic complementarity experiment. qRT-PCR was used to analyze the expression pattern of the gene and the expression level of other genes related to grain shape and cell development.【】The analysis of agronomic characters showed that the grain length ofmutant was significantly lower and the grain width was significantly higher than that of wild type, showing the phenotype of short and wide grains, and further histological and cytological analysis showed that the shortening of longitudinal cells of glume was the main reason for the shortening of grain length, while the increase of grain width was due to the increase of the number and size of transverse cells of glume at the same time. The results of genetic analysis showed that the mutation was controlled by a recessive single gene, and the candidate gene forwas determined to beby map-based cloning and genetic complementary verification, which encoded a plant-specific transcription factor. qRT-PCR analysis showed that the expression of this gene had no obvious tissue specificity, and its expression is strong in stem, leaf and young panicle. According to the analysis of the expression of known genes related to grain shape, cell cycle and cell expansion, it was found thatand, which positively regulate the number and/or size of glume transverse cells to determine grain width, were significantly up-regulated in the mutants, while/genes, which positively regulated the number and size of longitudinal cells and negatively regulated the number and size of transverse cells, were significantly down-regulated in the mutants. Some genes related to cell cycle and cell expansion also showed significant differences between mutants and wild types. 【】encodes a plant-specific transcription factor, which affects glume cell proliferation and cell expansion by regulating grain shape genes,and G/, thus determining rice grain length and width.
rice (L.); grain; development of glumes; gene mapping

2022-12-08;
2023-01-16
国家自然科学基金(32172044,31971919)、重庆市杰出青年基金(cstc2020jcyj-jqX0020)、重庆市英才计划(cstc2021ycjh-bgzxm0066)
朱洪慧,E-mail:1365358436@qq.com。李映姿,E-mail:1121962708@qq.com。朱洪慧与李映姿为同等贡献作者。通信作者李云峰,Tel:023-68251264;E-mail:liyf1980@swu.edu.cn
(责任编辑 李莉)

