手性哌啶并咪唑啉二酮类化合物的除草活性研究
张 帆,刘 克,杨辉斌,崔东亮,李 斌
(沈阳中化农药化工研发有限公司 新农药创制与开发国家重点实验室,沈阳 110021)
手性广泛存在于自然界中,是自然界的基本属性[1]。据统计,我国登记使用的手性农药约270 种,占比近40%,并且一直呈上升趋势。作为占据43.8%农药市场份额的除草剂,手性除草剂也是研发热点[2-3]。登记的手性除草剂约有70 种,如唑禾草灵、炔草酯、精2 甲4 氯丙酸、精2,4-滴丙酸、精异丙甲草胺和氯氟草醚等。原卟啉原氧化酶(PPO)是叶绿素和血红素生物合成中的关键酶[4],抑制其活性可使原卟啉原IX 不能氧化为原卟啉IX,植物细胞膜结构遭到破环,最终造成植物死亡。PPO 抑制剂因其具有高效、低毒、安全等特点[5],是新型除草剂研发热点,并有丙炔氟草胺、氟噻乙草酯和三氟草嗪等多个PPO 商品化品种上市。文献也报道了多个具有手性中心的PPO 抑制剂[6]。
课题组前期已考察了1-位杂环基以及5-位取代基对四取代苯类PPO 化合物除草活性的影响,发现2-[2-氟-4-氯-5-炔丙氧基苯基]-四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(图1,化合物a)的除草活性较高且极具成本优势[7-8]。为进一步研究光学异构体对除草活性影响,本文拟以化合物a 为先导,制备手性N 杂环,并对苯环5-位取代基进行优化,总结构效关系,为发现高除草活性PPO 抑制剂提供参考。手性哌啶并咪唑啉二酮类化合物结构通式如图1 所示。
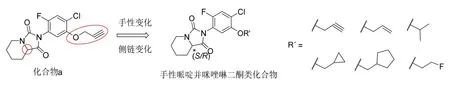
图1 手性哌啶并咪唑啉二酮类化合物的设计
本文以2-氯-4-氟-5-硝基苯酚为起始原料,经取代、硝基还原,制备异氰酸酯,再分别与手性2-哌啶甲酸乙酯环合得到目标化合物,化合物合成路线如图2 所示。
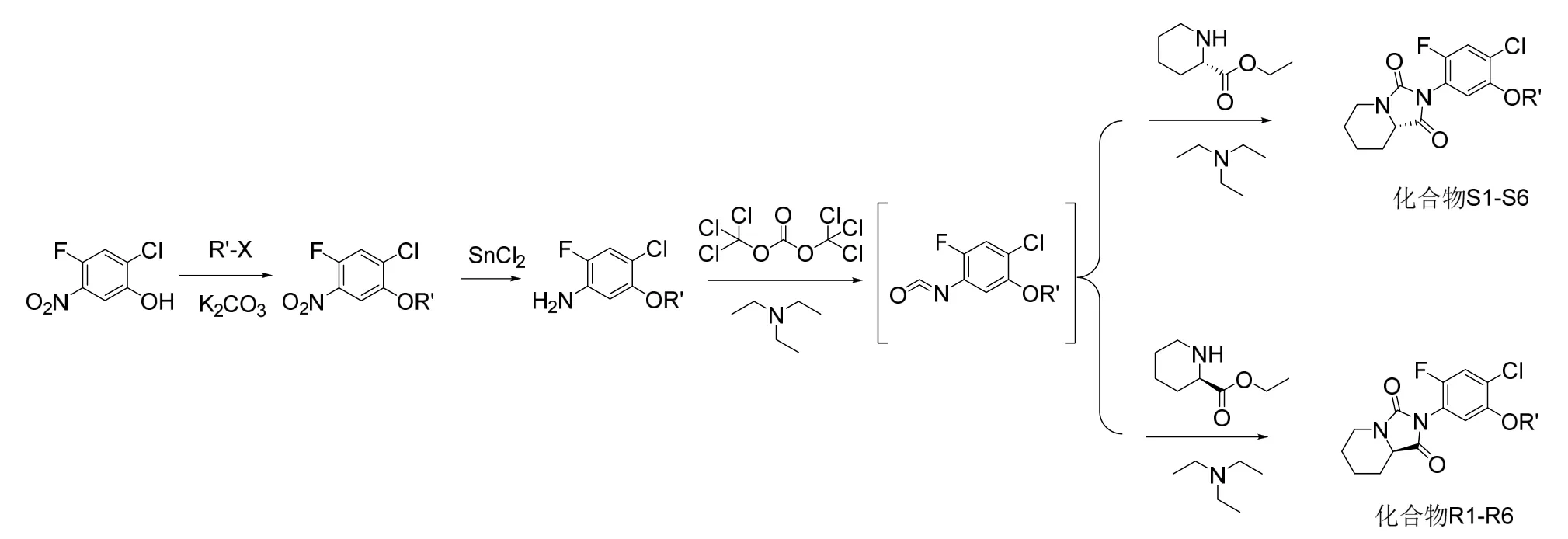
图2 手性哌啶并咪唑啉二酮类化合物的合成路线
1 材料与方法
1.1 仪器
Jeol JNM-ECZ600R 600MH 核磁共振仪(日本电子);VG ZAB-HS 质谱仪;旋光仪Autopol VI(美国鲁道夫公司);X4 型显微熔点仪(北京第三光学仪器厂),温度计未经校正。
1.2 试剂
试剂均为市购分析纯。层析硅胶(GF245)薄板(涤纶片基,5 cm×10 cm,浙江省台州市路桥四甲生化塑料厂);快速柱层析用硅胶(ZCX-II,粗孔,100~140 目,青岛海洋化工厂)。
1.3 旋光测试
采用钠光谱的D 线(589 nm)测定旋光度,测定管长度为10 cm,测定温度为20 ℃。称取1.0 g 样品用丙酮配成浓度0.1 g/mL 的供试溶液,将测定管用供试溶液冲洗数次,缓缓注入供试溶液,置于旋光计内检测读取供试液的旋光度。重复3 次,结果取平均值,按下列公式计算供试品比旋度。
式中:[α]为比旋光度;D 为钠光谱的D 线;t为测试温度,℃;l为测定管长度,dm;a为测得的旋光度;c为溶液浓度,g/100 mL。
1.4 合成方法
1.4.1(S)-2-(4-氯-2-氟-5-炔丙氧基苯基)四氢咪唑[1,5-a]吡啶-1,3(2H,5H)-二酮(S-1)的制备
1.4.1.1 中间体4-氯-2-氟-5-炔丙氧基-1-硝基苯的制备
反应瓶中加入2-氯-4-氟-5-硝基苯酚(1.0 g,5.2 mmol)、DMF(20 mL)、碳酸钾(0.90 g,6.2 mmol),滴加溴丙炔(0.62 g,5.2 mmol),室温反应6.0 h,向反应液中加入乙酸乙酯(20 mL)和水(20 mL)萃取分液,有机相用饱和氯化钠溶液(10 mL)洗涤,无水硫酸镁干燥,减压蒸尽除溶剂,得黄色固体1.1 g,含量99%。
1.4.1.2 中间体4-氯-2-氟-5-炔丙氧基苯胺的制备
反应瓶中加入上一步得到的中间体4-氯-2-氟-5-炔丙氧基-1-硝基苯(1.1 g,5.0 mmol)、水合氯化亚锡(2.8 g,12 mmol)、乙酸乙酯(20 mL),回流搅拌1.0 h,向反应液中加入氢氧化钠水溶液调节pH 为7.0,过滤,滤液用乙酸乙酯(20 mL)和水(20 mL)萃取,有机相用饱和氯化钠溶液(10 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,得褐色固体0.9 g,含量92%。
1.4.1.3 化合物S-1 的制备
反应瓶内加入中间体4-氯-2-氟-5-炔丙氧基苯胺(0.90 g,5.0 mmol)、甲苯(20 mL)、三乙胺(0.80 g,7.5 mmol),在冰浴冷却条件下缓慢滴加三光气(0.7 g,2.5 mmol)的甲苯(10 mL)溶液,加热回流3.5 h,减压蒸尽溶剂,用5.0 mL 二氯甲烷溶解备用。
向另一个反应瓶内加入S-2-哌啶甲酸乙酯(0.9.0 g,5.5 mmol)、二氯甲烷(20 mL)、三乙胺(1.0 g,10.0 mmol),滴加异氰酸酯的二氯甲烷溶液。室温搅拌1.0 h,向反应液中加入二氯甲烷(25 mL),分别用水(20 mL)、饱和碳酸氢钠溶液(20 mL)、饱和氯化钠溶液(20 mL)洗涤,有机相无水硫酸镁干燥,减压抽滤,减压蒸尽溶剂,残余物柱色谱提纯,得白色固体,收率72%,含量(HPLC 面积归一):97%,[α]D20=-63.8(c10,丙酮)。
1H NMR(600 MHz,CDCl3)δ:7.32(d,J=9.0 Hz,1H), 7.02 (d,J= 6.4 Hz, 1H), 4.76 (d,J= 2.4 Hz,2H),4.27-4.26(m,1H),4.25-4.24(m,1H),2.96-2.90(m, 1H), 2.59 (t,J= 2.4 Hz, 1H), 2.39-2.33 (m, 1H),2.10-2.06 (m, 1H), 1.84-1.76 (m, 1H), 1.59-1.44 (m,3H).
按上述操作,替换不同的卤代烃,可制备化合物S-2 至S-6;将用于环合反应的S-2-哌啶甲酸乙酯替换为R-2-哌啶甲酸乙酯,按照S-1 相似的制备方法,可制备化合物R-1 至R-6。
1.4.2(S)-2-(5-(烯丙基氧基)-4-氯-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(S-2)的制备
合成方法同化合物S-1 的制备,得黄色油,[α]D20=-62.1(c10,丙酮),收率:63%,含量(HPLC面积归一):98%。
1H NMR(600 MHz,CDCl3)δ:7.29(d,J=9.0 Hz,1H), 6.84 (d,J= 6.4 Hz, 1H), 6.07-6.01 (m, 1H),5.48-5.44 (m, 1H), 5.34-5.31 (m, 1H), 4.59-4.55 (m,2H),4.29-4.21(m,1H),3.98-3.95(m,1H),2.95-2.90(m, 1H), 2.33-2.30 (m, 1H), 2.12-2.05 (m, 1H),1.85-1.77(m,1H),1.56-1.44(m,3H).
1.4.3(S)-2-(4-氯-2-氟-5-异丙氧基苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(S-3)的制备
合成方法同化合物S-1 的制备,得黄色油,[α]D20=-49.8(c10,丙酮),收率:85%,含量(HPLC面积归一):96%。
1H NMR(600 MHz,CDCl3)δ:7.27(m,1H),6.86(d,J= 6.5 Hz, 1H), 4.50-4.44 (m, 1H), 4.27-4.26 (m,1H),4.25-4.24(m,1H),2.97-2.87(m,1H),2.33-2.39(m, 1H), 2.09-2.05 (m, 1H), 1.83-1.78 (m, 1H),1.56-1.45(m,3H),1.37(dd,J=6.1,1.7Hz,6H).
1.4.4(S)-2-(4-氯-5-(环丙基甲氧基)-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(S-4)的制备
合成方法同化合物S-1 的制备,得黄色油,[α]D20=-57.0(c10,丙酮),收率:75%,含量(HPLC面积归一):95%。
1H NMR(600 MHz,CDCl3)δ:7.27(d,J=9.7 Hz,1H), 6.82 (d,J= 6.4 Hz, 1H), 4.27-4.21 (m, 1H),3.96 (dd,J= 11.7, 4.1 Hz, 1H), 3.85 (d,J= 6.9 Hz,2H),2.94-2.90(m,1H),2.34-2.26(m,1H),2.09-2.05(m, 1H), 1.83-1.77 (m, 1H), 1.60-1.44 (m, 3H),1.34-1.26 (m, 1H), 0.67-0.63 (m, 2H), 0.38-0.34 (m,2H).
1.4.5(S)-2-(4-氯-5-(环戊基甲氧基)-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(S-5)的制备
合成方法同化合物S-1 的制备,得黄色油,[α]D20=-54.3(c10,丙酮),收率:44%,含量(HPLC面积归一):96%。
1H NMR(600 MHz,CDCl3)δ:7.27(d,J=9.0 Hz,1H), 6.82 (d,J= 6.4 Hz, 1H), 4.30-4.20 (m, 1H),3.98-3.95(m,1H),3.86(d,J=6.8 Hz,2H),2.95-2.90(m, 1H), 2.44-2.37 (m, 1H), 2.36-2.26 (m, 1H),2.12-2.02 (m, 1H), 1.90-1.76 (m, 3H), 1.71-1.42 (m,7H),1.44-1.32(m,2H).
1.4.6(S)-2-(4-氯-5-乙氧基-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)二酮(S-6)的制备
合成方法同化合物S-1 的制备,得黄色油,[α]D20=-64.9(c10,丙酮),收率:81%,含量(HPLC面积归一):96%。
1H NMR(600 MHz,CDCl3)δ:7.28(d,J=9.0 Hz,1H), 6.83 (d,J= 6.0 Hz, 1H), 4.27-4.23 (m, 1H),4.07(q,J=7.2 Hz,2H),3.98-3.96(m,1H),2.95-2.90(m, 1H), 2.33-2.29 (m, 1H), 2.09-2.06 (m, 1H),1.82-1.79(m,1H),1.60-1.47(m,3H),1.46(t,J=7.2 Hz,3H).
1.4.7(R)-2-(4-氯-2-氟-5-炔丙氧基苯基)四氢咪唑[1,5-a]吡啶-1,3(2H,5H)-二酮(R-1)的制备
以R-2-哌啶甲酸乙酯替换化合物S-1 制备过程中的S-2-哌啶甲酸乙酯制备得化合物R-1,得白色固体,[α]D20=48.4(c10,丙酮),熔点:134~136 ℃,收率:82%,含量(HPLC 面积归一):97%。
1H NMR(600 MHz,CDCl3)δ:7.30(d,J=9.0 Hz,1H), 7.02 (d,J= 6.3 Hz, 1H), 4.76 (d,J= 2.4 Hz,2H),4.27-4.26(m,1H),4.25-4.24(m,1H),2.96-2.91(m, 1H), 2.59 (t,J= 2.4 Hz, 1H), 2.39-2.33 (m, 1H),2.10-2.06 (m, 1H), 1.84-1.78 (m, 1H), 1.58-1.44 (m,3H).
1.4.8(R)-2-(5-(烯丙基氧基)-4-氯-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(R-2)的制备
合成方法同化合物R-1 的制备,得黄色油,[α]D20=32.3(c10,丙酮),收率:65%,含量(HPLC面积归一):96%。
1H NMR(600 MHz,CDCl3)δ:7.29(d,J=9.0 Hz,1H), 6.84 (d,J= 6.4 Hz, 1H), 6.07-6.01 (m, 1H),5.48-5.44 (m, 1H), 5.34-5.31 (m, 1H), 4.59-4.55 (m,2H),4.29-4.21(m,1H),3.98-3.95(m,1H),2.95-2.90(m, 1H), 2.33-2.30 (m, 1H), 2.12-2.05 (m, 1H),1.85-1.77(m,1H),1.56-1.44(m,3H).
1.4.9(R)-2-(4-氯-2-氟-5-异丙氧基苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(R-3)的制备
合成方法同化合物R-1 的制备,得黄色油,[α]D20=52.4(c10,丙酮),收率:66%,含量(HPLC面积归一):96%。
1H NMR(600 MHz,CDCl3)δ:7.27(m,1H),6.86(d,J= 6.5 Hz, 1H), 4.50-4.44 (m, 1H), 4.27-4.26 (m,1H),4.25-4.24(m,1H),2.97-2.87(m,1H),2.33-2.39(m, 1H), 2.09-2.05 (m, 1H), 1.83-1.78 (m, 1H),1.56-1.45(m,3H),1.37(dd,J=6.1,1.7Hz,6H).
1.4.10(R)-2-(4-氯-5-(环丙基甲氧基)-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(R-4)的制备
合成方法同化合物R-1 的制备,得黄色油,[α]D20=48.6(c10,丙酮),收率:61%,含量(HPLC面积归一):98%。
1H NMR(600 MHz,CDCl3)δ:7.27(d,J=9.7 Hz,1H), 6.82 (d,J= 6.4 Hz, 1H), 4.27-4.21 (m, 1H),3.96 (dd,J= 11.7, 4.1 Hz, 1H), 3.85 (d,J= 6.9 Hz,2H),2.94-2.90(m,1H),2.34-2.26(m,1H),2.09-2.05(m, 1H), 1.83-1.77 (m, 1H), 1.60-1.44 (m, 3H),1.34-1.26 (m, 1H), 0.67-0.63 (m, 2H), 0.37-0.34 (m,2H).
1.4.11(R)-2-(4-氯-5-(环戊基甲氧基)-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)-二酮(R-5)的制备
合成方法同化合物R-1 的制备,得黄色油,[α]D20=39.9(c10,丙酮),收率:51%,含量(HPLC面积归一):97%。
1H NMR(600 MHz,CDCl3)δ:7.27(d,J=9.0 Hz,1H), 6.82 (d,J= 6.4 Hz, 1H), 4.29-4.23 (m, 1H),3.98-3.85(m,1H),3.86(d,J=6.9 Hz,2H),2.95-2.90(m, 1H), 2.44-2.37 (m, 1H), 2.35-2.28 (m, 1H),2.08-2.05 (m, 1H), 1.90-1.76 (m, 3H), 1.70-1.44 (m,7H),1.43-1.33(m,2H).
1.4.12(R)-2-(4-氯-5-乙氧基-2-氟苯基)四氢咪唑并[1,5-a]吡啶-1,3(2H,5H)二酮(S-6)的制备
合成方法同化合物R-1 的制备,得黄色油,[α]D20=34.9(c10,丙酮),收率:85%,含量(HPLC面积归一):97%。
1H NMR(600 MHz,CDCl3)δ:7.29(d,J=9.0 Hz,1H), 6.82 (d,J= 6.0 Hz, 1H), 4.28-4.24 (m, 1H),4.06(q,J=7.2 Hz,2H),3.97-3.96(m,1H),2.95-2.91(m, 1H), 2.35-2.30 (m, 1H), 2.08-2.05 (m, 1H),1.83-1.80(m,1H),1.61-1.48(m,3H),1.45(t,J=7.2 Hz,3H).
1.5 除草活性
按设计剂量,分别称取1~8 mg 供试样品于称量瓶中,加入1 mL 丙酮使其充分溶解,然后加入含有1‰吐温80 静置自来水,搅拌均匀后得所需浓度样品溶液。以丙酮/水(1/3,含1‰吐温80)的处理为空白对照。
将定量苘麻种子分别播种于直径为7 cm 装有营养土纸杯中,播后覆土1 cm。种子发芽并生长10~21 d,是处理前具有一系列生育阶段的试材。然后选择大小、生育阶段一致的试材,于2~3 叶期进行处理,处理后置于温室并浇水。试验用Airbrush喷雾机进行处理(喷液量100 mL/m2)。试验设3 次重复。处理后置于温室按常规方法培养,定期观察苘麻的生长发育情况。于处理后15 d 目测调查供试药剂对苘麻的抑制生长效果,0 为无抑制,100%为完全抑制。结果见表1。

表1 哌啶并咪唑啉二酮类化合物的结构及除草活性
2 结果与讨论
根据表1 可得出如下构效关系:
⑴ N 杂环手性对阔叶杂草总防效影响为R构型>消旋体,S构型≈消旋体a。
⑵ N 杂环手性对百日草防效影响为R构型≥S构型,苯环5-位取代基对活性影响为炔基>烷基≥烯基>环烷基烷基。
⑶ N 杂环手性对苘麻防效影响与苯环5 位取代基种类有关:5-位取代基为链状烷基时,S构型>R构型;5-位为环烷烷基时,R构型>S构型。
⑷ 苯环5 位取代基对阔叶杂草总活性为:炔基>烷基≈烯基>环烷基烷基。
3 结 论
设计合成了12 个手性哌啶并咪唑啉二酮类化合物,考察了四取代苯类化合物1-N 杂环手性以及5-取代基对除草活性影响,其中化合物R-1 在2.300 g/hm2剂量时,对百日草生长抑制率为100%,化合物S-1在2.300 g/hm2剂量时,对苘麻生长抑制率为100%。
研究结果表明,哌啶并咪唑啉二酮类PPO 化合物的除草活性,相比于5-取代基种类,1-N 杂环手性对除草活性影响不显著,鉴于手性原料成本远高于其消旋体,后续研究重点将继续以杂环消旋体化合物为先导,进行新化合物的设计与合成,以发现更高除草活性的化合物。

