一种植物酵素/蜂王浆混合物的抗氧化及免疫调节活性研究
杨翠婷,周晴,屈青松,李智勋,宗浩,史新元*(.北京中医药大学生命科学学院,北京 000;.北京中医药大学中药学院,北京 000;.颍川堂健康科技有限公司,北京 0007)
“药食同源”酵素是采用药食同源的原料、水果、蔬菜、菌类等经益生菌发酵后产生的含有特定生物学功能的食品,其中既含有能调节机体生理功能的益生菌,又含有大量的活性成分,从而具有丰富的营养保健功能[1]。酵素可产生大量的植物综合酶,这些酶对人体的代谢和机能调整起着重要作用,同时还含有维生素、氨基酸、有机酸、低聚糖等营养成分,进而具有活化细胞、改善体质、提高免疫、调整肠道菌群等作用[2]。
植物酵素/蜂王浆混合物(下称酵素/蜂王浆混合物)是采用传统发酵工艺,选用新鲜的余甘子、牛蒡根两种“药食同源”原料及青梅、奇异果、柠檬,经益生菌自然发酵成酵素原浆,再与特定比例的蜂王浆混合后制成的酵素饮品[3]。其中,余甘子营养成分丰富,含黄酮和多酚化合物,如没食子酸、没食子鞣质、焦性没食子酸等[4]。黄酮类化合物具有较强的抗氧化活性,没食子酸具有提高免疫力、辅助保护肝损伤等作用[5]。蜂王浆营养成分丰富,其含有的特殊化合物10-羟基-2-葵烯酸(10-hydroxydec-2-enoic acid,10-HDA)在蜂王浆的各种活性功能和药理活性中起着关键作用,具体表现为抗菌、抗氧化、免疫调节及抗肿瘤等方面[6-8]。
本文以酵素/蜂王浆混合物为研究对象,对其活性成分进行含量测定;同时以DPPH·等三种自由基的清除力以及免疫低下小鼠的脏器指数和形态、细胞因子水平等为指标,分析酵素/蜂王浆混合物的抗氧化活性及免疫调节活性,以期为“药食同源”型植物酵素的综合性开发和功能性研究提供数据支持。
1 仪器与试药
1.1 仪器
LHS-80HC-Ⅱ 恒温恒湿培养箱(上海一恒科技);PB303-S 电子天平(波兰RADWAG);KQ-250E 超声波清洗器(昆山市超声仪器);Synergy-2多功能酶标仪(美国安捷伦);LC-20Ai高效液相色谱仪(日本Shimadzu);Sorvall ST 8R 高速冷冻离心机、CryoStar NX50 冷冻切片机(赛默飞世尔科技);TS-2 荧光倒置生物显微镜(尼康仪器)。
1.2 试药
酵素/蜂王浆混合物(10-HDA不低于3 mg·mL-1,批号:20211121,为颍川堂健康科技有限公司提供的颍川堂秘性皇浆);BCA试剂盒、芦丁(YZ-100060,HPLC>98%)、没食子酸对照品(CAS:139-91-6,HPLC>99%)(上海泸震实业有限公司);没食子酸对照品(批号:B20103)、左旋咪唑(批号:S30366)(上海源叶生物科技有限公司);磷酸(CAS:1122-001)、亚硝酸钠(CAS:Q/12GF 04-2017)、硝酸铝(CAS:13473-90-0)、硫酸亚铁(CAS:7782-63-0)(罗恩化学试剂公司);DPPH试剂(CAS:1898-66-4)、水杨酸(批号:20210531)、邻苯三酚(批号:20201014)(上海化成工业发展有限公司);Tris(CAS:77-86-1,合肥志宏生物技术有限公司);甲醇(色谱纯,Lot:207801)、乙醇(分析纯,批号:2021619)、氢氧化钠(批号:20200709A)、盐酸(批号:20190802A)、30%过氧化氢(CAS:7722-84-1)(北京化工厂);SPF级ICR雄鼠(批准号:BUCM-4-2021091306-2125,斯贝福生物技术有限公司);环磷酰胺(CTX,批号:04092113,海正辉瑞制药有限公司);ELISA试剂盒(批号:20210816-0021,爱博泰克生物技术公司)。
2 方法与结果
2.1 10-HDA含量测定
采用十八烷基硅烷键合硅胶柱;流动相为0.03 mol·L-1HCl-甲醇-水(10∶55∶35);检测波长为210 nm;流速1.0 mL·min-1;柱温35℃;进样量4 μL。具体方法参考GB 9697-2008[9],委托谱尼测试机构测定。测试结果显示酵素/蜂王浆混合物中10-HDA含量为3.30 mg·mL-1。
2.2 没食子酸含量测定
2.2.1 溶液的配制 对照品溶液:精密称取没食子酸对照品2.00 mg置5 mL量瓶中,加甲醇溶解并稀释至刻度,即得0.40 mg·mL-1的没食子酸对照品溶液,经0.45 μm微孔滤膜滤过,取续滤液,即得。
供试品溶液:按大力子发酵液∶青梅发酵液∶奇异果发酵液∶柠檬发酵液∶余甘子发酵液为10∶5∶5∶3∶2制备酵素原浆[3],备用。取10 mL酵素原浆冻干,分别超声处理3次(功率250 W,频率45 kHz),每次处理1 h,使其完全溶于5 mL甲醇。离心取上清液,合并3次滤液,置于通风橱中挥干,加15 mL甲醇复溶,经0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.2.2 色谱条件 采用十八烷基硅烷键合硅胶柱;流动相为0.10%磷酸溶液-甲醇(93∶7);检测波长为271 nm;流速1.0 mL·min-1;柱温30℃;进样量10 μL。该方法经方法学考察符合要求,将对照品溶液进样,以没食子酸质量浓度(Y,μg·mL-1)对峰面积(X)进行线性回归,得没食子酸的标准曲线方程为:Y=3.381×104X-248.62,R2=0.999。
2.2.3 样品测定 取供试品溶液1 mL测定,将测定的峰面积代入回归方程计算酵素原浆中的没食子酸含量,每个样品平行3次。
由于酵素/蜂王浆混合物中的黄酮类化合物来源于多种“药食同源”原料,为提高检测结果的准确度,采用酵素原浆进行没食子酸的测定。计算得供试品溶液中没食子酸质量浓度为(0.23±0.001)mg·mL-1,换算出酵素原浆中没食子酸含量为0.35 mg·mL-1。
2.3 蛋白质含量测定
2.3.1 样品制备 随机选取3份酵素/蜂王浆混合物,分别精密称量并采用去离子水配制成5.01、5.05和4.96 mg·mL-1的溶液,置于5 mL离心管中,即得供试品溶液。
2.3.2 样品测定 依照BCA试剂盒操作说明书进行,以吸光度值(Y)对蛋白含量(X,μg)进行线性回归。结果蛋白质含量标准曲线方程为Y=0.0292X+0.1191,R2=0.992。在标准曲线中代入样品测得的吸光度值,计算出酵素/蜂王浆混合物中蛋白含量为(145.90±5.53)mg·g-1。
2.4 黄酮类化合物含量测定
2.4.1 溶液的配制 对照品溶液制备:精确称取芦丁对照品0.020 g,置于5 mL烧杯中,加入5 mL无水乙醇溶解,30%乙醇定容至100 mL量瓶中,摇匀,即得对照品溶液。
样品溶液制备:酵素原浆制备方法同“2.2.1”项下。
2.4.2 标准曲线制作 分别依次取芦丁对照品溶液0、0.2、0.4、0.6、0.8、1 mL分别置于25 mL量瓶中,加入30%乙醇稀释至10 mL,依次加入0.12 mL的6%NaNO2溶液和10%Al(NO3)3溶液,分别混匀,室温放置6 min,再加入1.6 mL的4%NaOH溶液,最后用30%乙醇定容,混匀后放置15 min,于510 nm波长处测定吸光度值。以吸光度值(Y)对芦丁质量浓度(X,mg·mL-1)进行线性回归,得黄酮类化合物标准曲线方程为:Y=5.3X+0.0354,R2=0.9992。
2.4.3 样品测定 取酵素原浆溶液1 mL测定,将测得的吸光度值代入回归方程计算酵素原浆中黄酮类化合物含量,每个样品平行3次。
计算得酵素原浆中黄酮类化合物含量为(0.16±0.002)mg·mL-1。
2.5 DPPH·自由基清除能力测定
采用DPPH·氧化法[10]测定酵素/蜂王浆混合物对DPPH·的清除能力。用去离子水对酵素/蜂王浆混合物进行适当稀释,每个样品平行3次,计算公式如下:
DPPH·清除率(%)=[1-(Ai-Aj)/A0]×100%
式中:A0为70%乙醇的吸光度,Ai为样品溶液与DPPH·溶液反应后的吸光度,Aj为不加DPPH·溶液的吸光度。
由于酵素/蜂王浆混合物颜色较深,在测定其对不同自由基的清除能力时根据采用试剂体系大小将其稀释至合适倍数,经测定发现稀释至50%后的酵素/蜂王浆混合物对DPPH·的清除率可达85.11%。
2.6 超氧阴离子自由基清除能力测定
采用NBT显色法[11]测定,PMS/NADH体系会产生超氧自由基。用去离子水对酵素/蜂王浆混合物进行适当稀释,每个样品平行3次,计算公式如下:
超氧阴离子自由基清除率(%)=[1-Ax/A0]×100%
式中:Ax为样品与混合反应溶液的吸光度,A0为水代替样品的混合反应溶液的吸光度。
经测定发现稀释至50%后的酵素/蜂王浆混合物对超氧阴离子自由基的清除率可达72.20%。
2.7 羟自由基清除能力测定
采用水杨酸法[12]测定酵素/蜂王浆混合物对羟自由基的清除能力。用去离子水对酵素/蜂王浆混合物进行适当稀释,每个样品平行3次,计算公式如下:
羟自由基清除率(%)=[1-(Ai-Aj)/A0]×100%
式中:A0为水溶液的吸光度,Ai为样品溶液与混合反应溶液的吸光度,Aj为不加水杨酸混合反应溶液的吸光度。
稀释至2%后的酵素/蜂王浆混合物对羟自由基的清除率仍可达44.51%。
2.8 免疫功能测定
2.8.1 剂量设计 人体推荐摄入量为30.0 g·d-1,根据《中国药理研究方法学》人鼠剂量换算方法换算的小鼠体重与60 kg成人的等效剂量,其相对剂量设计为0.5 g·kg-1,根据该推荐量设置低、中、高3 个剂量组,分别为5 倍的低剂量组2.5 g·kg-1、10 倍的中剂量组5 g·kg-1、20倍的高剂量组10 g·kg-1,按 0.1 mL/10 g体积给小鼠灌胃。
2.8.2 实验分组及给药 将48 只雄性ICR小鼠,体质量(21±6)g,置于(25±2)℃、12 h/12 h光暗循环、60%相对湿度的条件下,自由饮食饮水7 d使其适应环境,记录体重。将小鼠随机分为6组(n=8),空白组、模型组、左旋咪唑阳性药组、混合物低剂量组、混合物中剂量组、混合物高剂量组[13]。各组小鼠每日定时灌胃,空白组和模型组灌胃生理盐水(0.2 mL/20 g),其余各组小鼠灌胃等量对应混合物样品,每日1 次。连续灌胃30 d[14],每日观察小鼠状态、记录体重。同时,自第24日起,空白组小鼠腹腔注射生理盐水(0.2 mL/20 g),其余各组小鼠腹腔注射等量的环磷酰胺,每日1 次,连续注射3 d。最后一日灌胃后将各组小鼠禁食24 h,摘眼球取血,快速解剖脾脏和胸腺。所有实验用鼠均按照北京中医药大学动物护理和使用委员会批准的程序进行。
2.8.3 体重变化 适应性喂养7 d后,称重记录初始体重,并且在处死前再次称量体重,记为终末体重。
由表1可知,灌胃期结束后,与空白组相比,模型组小鼠的体重增长量显著降低;与模型组相比,阳性药组和混合物样品各剂量组小鼠的体重增长量均有所提高,但差异无统计学意义。
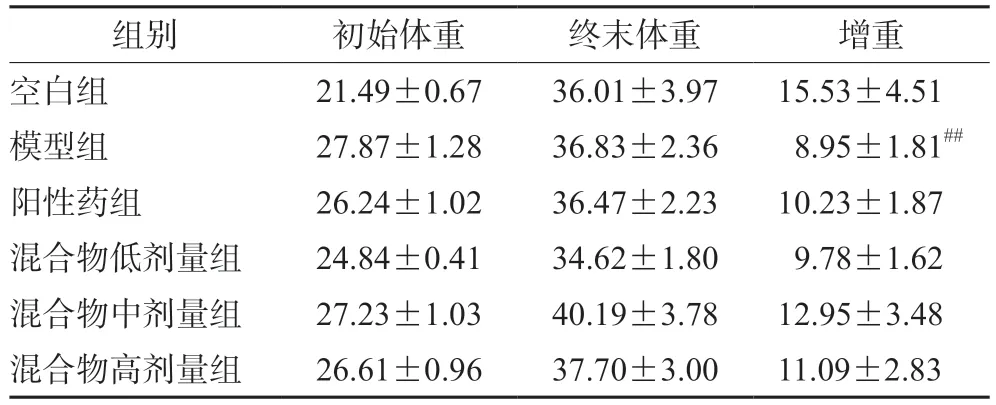
表1 酵素/蜂王浆混合物对免疫低下小鼠体重的影响(g)Tab 1 Effect of plant enzyme/royal jelly mixture on the body weight of immunocompromised mice (g)
2.8.4 免疫脏器指数 解剖摘取各组小鼠的脾脏和胸腺,去除周围结缔组织,用吸水纸吸除多余水分并称重,脏器质量(mg)/终末体重(g)即得免疫脏器指数[15]。
如图1所示,空白组、阳性药组小鼠的胸腺指数和脾脏指数均明显高于模型组,说明CTX可以抑制小鼠免疫器官的生长发育;与模型组相比,混合物样品中、高剂量组小鼠的胸腺指数和脾脏指数均有明显提高。说明酵素/蜂王浆混合物具有对抗环磷酰胺、促进免疫器官发育、提高非特异性免疫的效果。

图1 酵素/蜂王浆混合物对小鼠脾脏指数、胸腺指数的影响Fig 1 Effect of plant enzyme/royal jelly mixture on the spleen index and thymus index of mice
2.8.5 脾脏形态学观察 将称量后的小鼠脾脏浸泡在10%甲醛溶液中4℃储存,24 h后转移至20%蔗糖溶液中浸泡过夜使其沉底,再转移至30%蔗糖溶液中浸泡过夜使其沉底。取出脾脏样品,用冷冻切片机切成5 μm的薄片,通过HE染色进行处理后置于光学显微镜下观察并拍照。
结果如图2所示,空白组淋巴细胞分布集中,小梁结构清晰,红髓、白髓清楚可辨,边缘区界限清晰;模型组淋巴细胞分布稀疏,红髓与白髓界限模糊,脾组织存在破损现象。与模型组相比,阳性药组小鼠脾脏白髓中淋巴小结的数目多且相互连结,淋巴细胞密集;混合物样品低、中剂量组的修复作用不明显,高剂量组脾脏结构恢复较为明显,淋巴细胞相对密集,白髓中淋巴小结数目多、体积大、相互连结,红髓、白髓边缘区界限逐渐清晰。结果显示,酵素/蜂王浆混合物在一定程度上可以促进小鼠脾脏生长发育,起到修复免疫脏器组织的作用。

图2 酵素/蜂王浆混合物对免疫低下小鼠脾脏组织形态学变化的影响(×10)Fig 2 Effect of plant enzyme/royal jelly mixture on the histomorphological changes of the spleen in immunocompromised mice(×10)
2.8.6 细胞因子的测定 于第30日给药后,取血,分离血清,用灭菌后的生理盐水将血清稀释至10%,参考ELISA试剂盒操作说明书进行检测。根据浓度标准曲线分别计算IgM、IL-1β和TNF-α的相应含量。
各组小鼠血清中细胞因子的含量如图3所示。空白组、阳性药组小鼠血清中IgM、IL-1β和TNF-α的水平明显高于模型组,说明CTX可以抑制小鼠的体液和细胞免疫功能。与模型组相比,低、中、高剂量的混合物样品干预组小鼠血清中三种细胞因子的含量均有显著提高,说明酵素/蜂王浆混合物具有对抗环磷酰胺、促进机体体液免疫和细胞免疫的效果。结果提示,酵素/蜂王浆混合物可能通过影响细胞因子的分泌,从而起到改善机体免疫功能的作用,并在一定范围内具有量效关系。
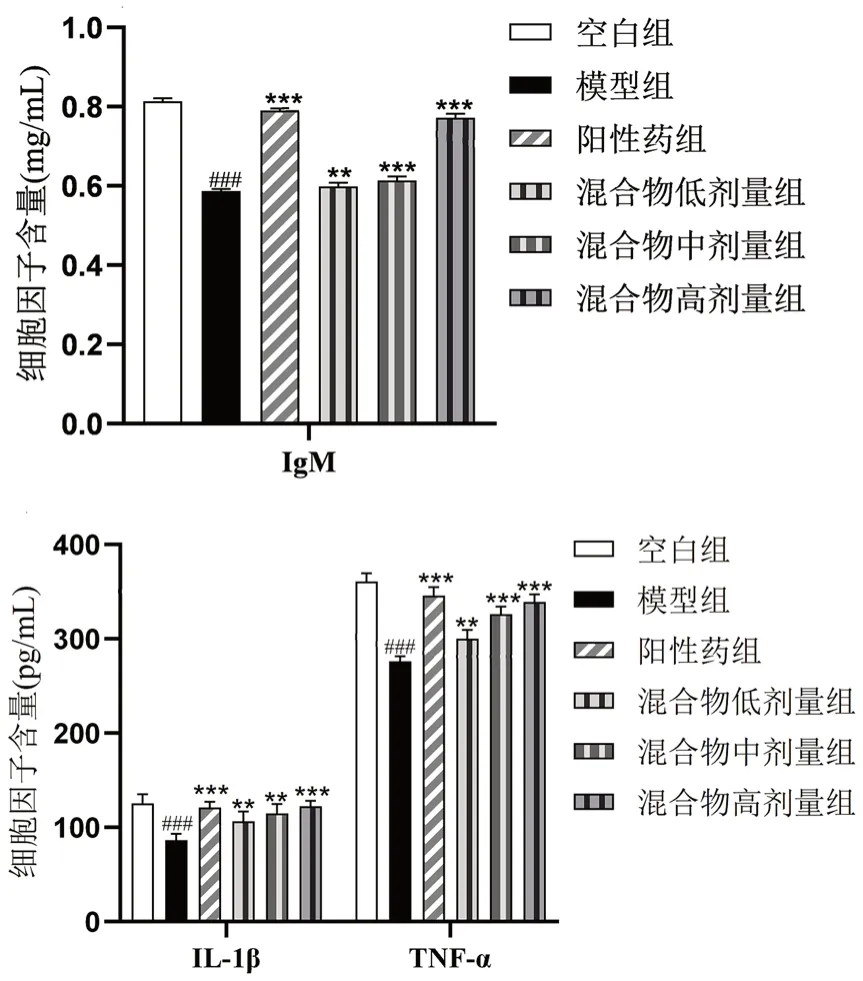
图3 血清中细胞因子含量Fig 3 Cytokine content in serum
2.9 数据处理
实验数据采用SPSS 20.0软件对数据进行统计分析,符合正态分布的计量资料以均值±标准差(±s)表示,利用单因素方差分析进行组间比较,P<0.05表示差异有统计学意义。
3 讨论
10-HDA是蜂王浆重要成分之一,性质稳定,具有优良的杀菌、抗肿瘤和提高免疫的功能[4]。没食子酸提高免疫力的功效已被证实。在犊牛饲料中添加没食子酸可以显著提高IgG、TNF-α等细胞因子的水平[16]。蛋白质是人体免疫防御能力的物质基础,人体各种免疫细胞和抗体的生成都需要蛋白质的参与。黄酮是优良的抗氧化剂。在探究沙苑子、柴胡等中药不同部位抗氧化性能时发现,黄酮含量越高其抗氧化能力越高[17-18]。本文检测出混合物样品中10-HDA、蛋白质含量分别为3.30 mg·mL-1、145.90 mg·g-1,酵素原浆中没食子酸、黄酮类化合物含量分别为0.35 mg·mL-1、0.16 mg·mL-1,提示酵素/蜂王浆混合物可能具有抗氧化及提高免疫力的潜能。
抗氧化即为清除相关自由基,在人体美白祛斑、抗衰老等方面具有积极意义[19]。抗氧化实验结果表明,稀释至50%的混合物样品对DPPH·(85.11%)和超氧阴离子自由基(72.2%)均具有较好的清除效果,稀释至2%后对羟自由基仍具有一定清除能力(44.51%),结果表明酵素/蜂王浆混合物具有较强的抗氧化性能。
免疫是人体的一种生理功能,增强机体免疫力,对于疾病的防御和治疗十分关键。胸腺和脾脏是机体重要的免疫器官,其指数一定程度上可以反映机体的免疫水平[20]。脾脏是机体内最核心的免疫器官,其形态结构是反映机体非特异性免疫的重要指标[21]。免疫球蛋白是体液免疫应答中最主要的细胞因子,在抗原刺激机体免疫系统时,IgM、IL-1β和TNF-α等细胞因子能够产生极强的抗感染能力、激活免疫系统等一系列生物学反应[22-24]。本文研究结果表明,混合物样品可以提高小鼠的免疫脏器指数,促进脾脏细胞生长发育,增加小鼠血清中IgM、IL-1β和TNF-α细胞因子的含量,具有提高机体非特异性免疫、体液免疫及细胞免疫的作用,其作用可能与提高免疫脏器指数,减少免疫器官损伤,以及提高血液中一些细胞因子(IgM、IL-1β和TNF-α)含量等因素有关,并在一定范围内具有量效关系。
4 结论
“药食同源”植物酵素结合了药食两用原料的药效作用和酵素的营养保健功能,成为近年来酵素产品研究的热点。本研究中,以“药食同源”原料与蜂王浆混合制备后,发现其具有良好的抗氧化和免疫调节能力,在抗氧化和调节免疫功能的食品及药物开发方面具有极大的应用前景,可为今后“药食同源”植物酵素的综合性开发和进一步应用提供实验基础。

