运动及饮食干预对非酒精性脂肪性肝炎小鼠肝脏自噬的影响研究
朱凯 周青 杨磊 马雪儿 李琴 何晓萱 杨雪霞 蔡雯
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是以肝细胞内脂质过多积聚为主要特征的一系列进行性肝脏疾病,疾病谱包括单纯脂肪性肝病到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)等,病理特征包括肝纤维化、肝硬化等[1]。NASH现已成为世界上第8 位死亡原因,每年约有120 万人因其相关并发症而死亡[2]。运动及饮食干预是目前防治NASH 的重要方法,《非酒精性脂肪性肝病防治指南(2018 更新版)》[3]建议对超重等NAFLD 患者实行减少热量摄入、调整膳食结构、平衡膳食、限制摄入模型高糖饮食等饮食干预和坚持长期中等强度有氧运动等运动干预。自噬与NAFLD 的发生、发展密切相关[4]。作为自噬通量研究的标志物,微管相关蛋白轻链3(microtubule-associated protein light chain 3,Lc3)和p62 蛋白在肝脏自噬被诱导时可观察到水平下降,而在自噬受到抑制时会累积。抑制信号转导和转录激活因子(signal transducer and activator of transcription,STAT)3和磷酸化的STAT3(p-STAT3)等基因的表达可增加自噬相关蛋白Beclin-1表达,后者通常被认为是自噬过程中的关键蛋白之一,通过激活自噬来改善肝脏脂肪变性[5]。一般情况下,B 细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)会与Beclin-1 紧密结合,而运动可通过解离Beclin-1 和Bcl-2 来启动自噬[6]。目前有关运动及饮食干预对NASH 动物肝脏中自噬蛋白的影响研究尚少,本研究通过构建单纯性NASH 小鼠模型,从肝脏自噬的角度出发,观察运动与饮食干预对NASH 的影响,以期为运动及饮食干预防治NASH提供参考。
1 材料和方法
1.1 材料
1.1.1 实验动物 6 周龄C57BL/6 野生型小鼠52 只,体质量(19.80±1.31)g,在新疆医科大学动物实验中心正常喂养,实验动物中心许可证号:SYXK(新)2018-003,实验动物生产许可证号:SCXK(新)2018-0001。本研究通过新疆医科大学动物实验伦理审核,批号为IACUC-20211202-8。
1.1.2 主要试剂 高果糖饲料(60.1%果糖、1.0%蔗糖、8.9%蔗糖、20.0%蛋白质、10.0%蛋白质)购于江苏协同医药生物有限公司,批号:XT704;高效RIPA 组织快速裂解液、蛋白上样缓冲液、蛋白浓度测定试剂盒、HE 染色套装、Trizol 试剂均购自北京索莱宝科技有限公 司,批号分别为R0010、P1016、PC0020、YA0031 和15596018);EasySee Western blot 试剂盒购自TRANS,批号:N21017;BSA 购自Biofroxx,批号:4240GR025;β-肌动蛋白(β-actin)抗体、Lc3-Ⅱ抗体购自Bioss,批号分别为bs-0061R 和bs-4843R;Beclin-1 抗体购自Abcam,批号:AB210498;p62 抗体购自ABclonal,批号:A11247;鼠抗兔二抗、驴抗兔二抗购自santa cruz,批号分别为sc-2358 和sc-2315);One Step RT-qPCR 专用试剂盒购自艾科瑞,批号:AG11708。
1.2 方法
1.2.1 动物造模与分组 小鼠适应性喂养7 d 后,编号、称质量,随机分为正常对照组(对照组)10 只、NASH 模型组(模型组)12 只、有氧跑台运动干预组(运动组)10 只、单纯饮食干预组(饮食组)10 只、有氧跑台联合饮食干预组(联合组)10 只。本试验共进行20 周,对照组全程给予普通饲料喂养,模型组与运动组全程给予高果糖饲料喂养,饮食组及联合组前12 周给予高果糖饲料喂养,后8 周给予普通饲料喂养。小鼠采用高果糖饲料喂养,常规8~10 周成模[7]。于第11 周末随机抽取2 只模型组小鼠验模,其余小鼠20 周末取材。
1.2.2 运动干预方案 小鼠运动方案参考Ahn 等[8]。运动组与联合组第12 周开始进行为期1 周的适应性训练,小鼠每天持续跑步30 min,3 次/周,速度为10~18 m/min。随后进行为期8 周正式训练,每天持续跑步35~64 min,5 次/周,速度为14~20 m/min,运动强度为心率达到60%~75%最大心率。训练时间为除周二、周四外的15:00~17:00。运动训练时间内,其余组均置于静止跑台。
1.2.3 样本处理 第20 周末最后1 次训练后,全体小鼠禁食不禁饮12 h,测量小鼠体质量,麻醉后心脏取血,低温离心取上层血清并置于-20 ℃冰箱冷藏。打开腹腔,心脏灌流后取肝脏,测量肝湿质量并计算肝指数,分离部分肝脏固定在10%甲醛中,常温保存,其余组织分装置于-80 ℃冰箱冻存。
1.3 指标测定
1.3.1 血清生化指标检测 采用全自动血液生化分析仪检测血清ALT、AST、TC、TG、HDL-C、LDL-C 等血脂与肝功指标。
1.3.2 肝脏病理学检测 取甲醛固定的肝脏组织,常规石蜡包埋后,切成4 μm 厚切片,HE 染色后光镜下观察肝脏组织细胞脂肪变性、肝小叶炎症和气球样变性程度,并计算肝脏NAFLD 活动性评分(NAFLD activityscore,NAS)[7]。视野中肝细胞脂肪变细胞数<5%为0 分,细胞数占5%~33%为1 分,细胞数占34%~66%为2 分,细胞数>66%为3 分;肝小叶内20 倍镜下无坏死灶炎症得分为0 分,<2 个坏死灶为1 分,2~4 个为2分,>4 个为3 分;视野总肝细胞无气球样病变为0 分,气球样病变细胞少见为1 分,多见为2 分。NAS 由此3个指标得分相加而成,<3 分排除NASH,>4 分则诊断为NASH,3~4 分为可能NASH。肝细胞脂肪变细胞数>33%但不存在肝小叶内炎症、气球样变和纤维化则为单纯性NAFLD。
1.3.3 肝脏组织中Beclin-1、Lc3-Ⅱ、p62 蛋白表达的检测 采用Western blot 法。取冻存肝脏加入RIPA 裂解液裂解,超声细胞破碎仪破碎后取上清液。根据蛋白浓度测定试剂盒说明书方法测定蛋白浓度,随后经聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜湿转法转膜,TBST 洗膜,加入Beclin-1、Lc3-Ⅱ、p62 一抗,4 ℃孵育过夜。取膜后TBST 洗涤,加入二抗,室温孵育2 h,TBST 再次洗涤。加入增强型化学发光(enhanced chemiluminescence,ECL)液,化学发光成像系统曝光,以β-actin 为内参,根据条带的灰度值计算Beclin-1、Lc3-Ⅱ、p62 蛋白相对表达量。
1.3.4 肝脏组织Beclin-1、Lc3-Ⅱ、p62 mRNA 表达的检测 采用荧光定量PCR(qRT-PCR)法。使用Trizol提取肝脏总RNA,按照qRT-PCR 试剂盒说明书方法生成cDNA,引物序列:Beclin-1(正向5'-ATAGAGGCAGGGCTAGTC-3',反向3'-TAGGTAATGGTCTCGGTAAGA-5');Lc3-Ⅱ(正向5'-GATGTCCGACTTATTCGAGAGC-3',反 向5'-TTGAGCTGTAAGCGCCTTCTA-3');p62(正向5'-GACCCAACACAGGCGATGG-3',反向3'-ACTGCGACCCACGTTATATCA-5')。反应体系为2×缓冲液10 μl、参比染料1 μl、上下游引物各0.4 μl、cDNA 模板0.8 μl、单蒸水补足20 μl。扩增程序为95 ℃、10 min,95 ℃、15 s,59 ℃、1 min,共40 循环。采用2-ΔΔCt法计算Beclin-1、Lc3-Ⅱ和p62 mRNA 相对表达量。
1.4 统计学处理 采用SPSS 19.0 统计软件,用Graph-Pad Prism 7.00 进行绘图。正态分布的计量资料用表示,多组间比较采取单因素方差分析。偏态分布的计量资料用M(P25,P75)表示,组间比较采用Mann-Whitney U检验。采用Spearman秩相关进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 5 组小鼠体质量、肝指数及血清生化指标比较与对照组相比,模型组体质量、肝指数、TC、TG、AST、ALT、LDL-C 均显著增高(均P<0.05),HDL-C 显著降低(P<0.05);与模型组相比,仅联合组肝指数显著下降(P<0.05),运动组、饮食组及联合组小鼠体质量、TC、TG、AST、ALT、LDL-C 均显著降低(均P<0.05),HDL-C 显著增高(P<0.05);与联合组相比,运动组及饮食组体质量、TG、AST 、ALT、LDL-C 均显著增高(均P<0.05),运动组TC、肝指数显著增高(均P<0.05),饮食组HDL-C 显著降低(P<0.05),见表1。

表1 5 组小鼠体质量、肝指数及血清生化指标比较
2.2 5 组小鼠肝脏组织病理学变化 对照组肝细胞形态正常,肝组织结构完整,肝小叶结构清晰且排列整齐,无炎症细胞浸润及脂质沉积,见图1A;模型组肝细胞形态异常,有大量脂滴出现,肝细胞损伤严重,有大量脂质沉积及气球样变,大量炎症细胞浸润,见图1B;运动组肝细胞部分细胞核的周围可观察到大小不等的脂滴,部分有假小叶形成,见图1C;饮食组部分肝脏出现炎性细胞浸润,伴有气泡样变,见图1D;联合组肝组织肝小叶基本正常,轻度肝细胞脂肪变性及少量炎症细胞浸润,见图1E。相比对照组,模型组在肝细胞脂肪变性、肝小叶炎症、肝细胞气球样变和NAS 均增高,差异均有统计学意义(均P<0.05);相比模型组,运动组、饮食组NAS明显下降,差异均有统计学意义(均P<0.05),运动组肝细胞脂肪变性明显下降,差异具有统计学意义(P<0.05),肝小叶炎症、肝细胞气球样变比较,差异均无统计学意义(均P>0.05),饮食组肝细胞脂肪变性、肝小叶炎症、肝细胞气球样变均有下降,但差异均无统计学意义(均P>0.05)。联合组肝细胞脂肪变性、肝小叶炎症、肝细胞气球样变及NAS 均显著降低(均P<0.05);运动组与饮食组间肝细胞脂肪变性、肝小叶炎症、肝细胞气球样变及NAS 比较,差异均无统计学意义;相比联合组,运动组肝细胞脂肪变性、NAS 显著增多(均P<0.05),饮食组肝细胞脂肪变性、肝小叶内炎症、NAS 均明显增多(均P<0.05),见表2。
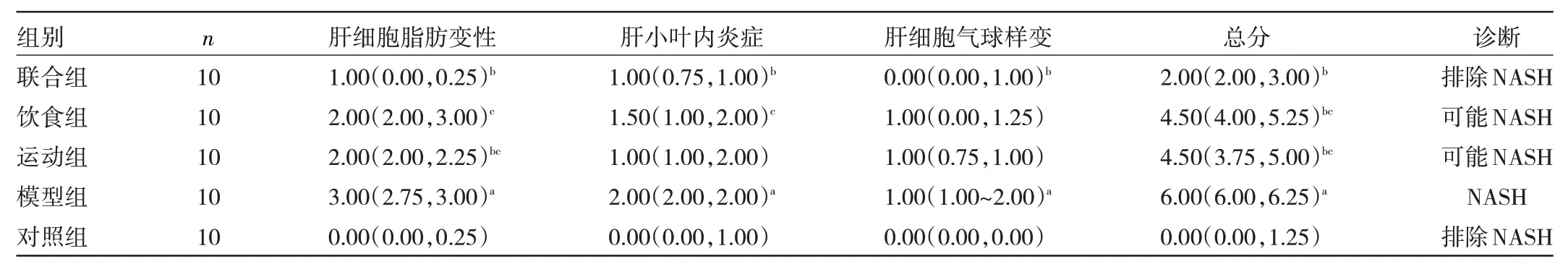
表2 5 组小鼠肝脏组织NAS 比较(分)

图1 5 组小鼠肝脏组织病理学检查所见(A-E 依次为对照组、模型组、运动组、饮食组、联合组)
2.3 5 组小鼠肝脏Beclin-1、Lc3-Ⅱ、p62 蛋白表达的比较 Western blot 结果显示,5 组小鼠肝脏均检测到自噬相关蛋白的表达,Beclin-1、Lc3-Ⅱ、p62 蛋白分子量依次为52、14 和47 kDa,见图2。相比对照组,模型组的Beclin-1 蛋白相对表达量显著降低(P<0.05),p62 显著升高(P<0.05),相比模型组,运动组、饮食组、联合组的Beclin-1 蛋白相对表达量均显著升高(均P<0.05),p62均显著降低(均P<0.05),Lc3-Ⅱ仅在饮食组和联合组显著升高(P<0.05)。运动组与饮食组自噬相关蛋白相对表达量比较,差异均无统计学意义(均P>0.05)。运动和饮食联合干预后,Beclin-1和Lc3-Ⅱ蛋白相对表达量均显著升高(均P<0.05),p62 显著降低(P<0.05),见表3。
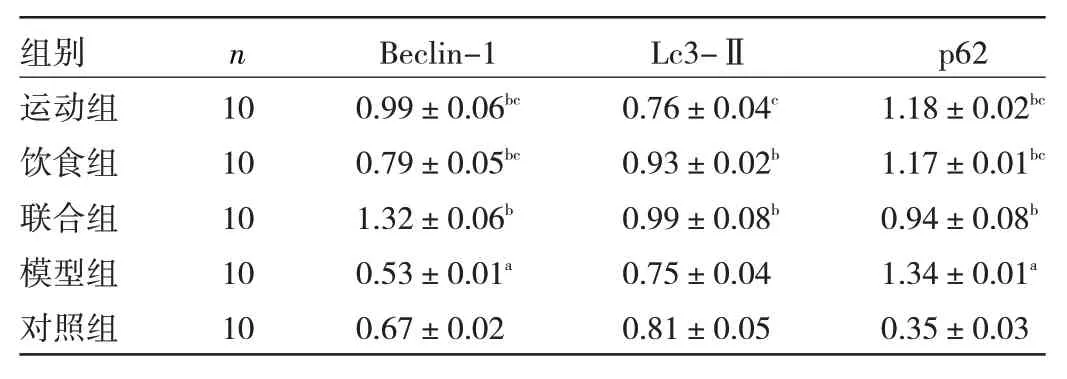
表3 5 组小鼠肝脏自噬相关蛋白相对表达量比较

图2 5 组小鼠肝脏自噬相关蛋白电泳图
2.4 5 组小鼠肝脏Beclin-1、Lc3-Ⅱ、p62 mRNA 表达的比较 qRT-PCR 结果显示,相比对照组,模型组的Beclin-1 mRNA 相对表达量显著降低(P<0.05),p62显著升高(P<0.05。相比模型组,运动组、饮食组、联合组的Beclin-1 mRNA 相对表达量均显著升高(均P<0.05),p62 均显著降低(均P<0.05),Lc3-Ⅱ仅在饮食组和联合组显著升高(P<0.05)。运动和饮食联合干预后,Beclin-1 和Lc3-ⅡmRNA 相对表达量均显著升高(均P<0.05),p62 则显著降低(P<0.05),见表4。

表4 5组小鼠肝脏Beclin-1、Lc3-Ⅱ、p62 mRNA相对表达量比较
2.5 肝脏病理形态指标与自噬相关基因相对表达量的相关性分析 NASH 小鼠肝脏NAS 与肝脏组织Beclin-1 mRNA 相对表达量呈正相关(r=0.487,P<0.01),与p62 mRNA 相对表达量呈负相关(r=-0.442,P<0.05),与Lc3-ⅡmRNA 相对表达量无相关性(r=0.241,P>0.05)。NASH 小鼠肝指数与肝脏组织Beclin-1、Lc3-Ⅱ和p62 mRNA 相对表达量,均无相关性(均P>0.05)。
3 讨论
自噬现象广泛存在于真核细胞生物体的新陈代谢中,它是细胞自我更新的过程,也是机体组织的一种自我防御机制[9]。多项研究表明,自噬参与肝脏脂质代谢,长期高果糖饮食可导致肝脏细胞自噬失调[10-12],但自噬与NAFLD 间的关系仍有分歧,一些研究表明,NASH 模型小鼠Beclin-1、Lc3-Ⅱ蛋白相对表达量降低,自噬活性减弱[11-13];也有研究发现Beclin-1、Lc3-Ⅱ蛋白在NASH 小鼠模型中的表达明显增强,自噬活性增强[14-15]。本研究发现,模型组中Beclin-1 mRNA 及蛋白表达水平降低,而p62 mRNA 及蛋白表达水平升高,提示NASH 小鼠自噬活性减弱,与Liu 等[16]结果一致。但值得关注的是,本研究中模型组小鼠Lc3-ⅡmRNA及蛋白表达并无明显变化,这可能与实验选用的小鼠、喂养时长及Lc3-Ⅱ的动态变化有关。Lc3-Ⅱ作为一种蛋白轻链,是自噬过程的标志物之一,主要参与自噬小体的形成,当Lc3前体分子被自噬相关4同源物(Bautophagy related 4 homolog,ATG4)B 剪去C 端5 肽后裂解形成Lc3-Ⅰ,可被ATG7激活,转移至ATG3 并偶联脂酰乙醇胺以形成膜结合形式的Lc3-Ⅱ,成为自噬体的结构蛋白[17]。随着NAFLD 疾病进展,脂质在肝细胞大量沉积,大量炎症细胞浸润,机体自噬活性受到抑制,Lc3-Ⅱ处于动态平衡状态,呈现无明显变化。本研究使用C57BL/6野生型小鼠并喂养20周,与既往研究使用SD大鼠喂养8 周等存在差异,需要进一步排除动物品系及喂养时长对自噬蛋白的干扰。
自噬的激活受多种因素共同影响,饮食与运动均能影响细胞的自噬作用[4]。Guarino 等[18]对小鼠实施8周速度为12.5 m/min 的跑台运动,结果发现小鼠Beclin-1、Lc3-Ⅱ基因及蛋白表达显著升高,小鼠骨骼肌自噬激活。Gao 等[19]研究同样证明了该结论,大鼠跑台运动后骨骼肌自噬激活,肝脏内脂肪变性缓解,提示运动可通过激活肝脏脂噬来改善肝脏衰老。Li 等[20]对小鼠进行16 周游泳训练后发现,游泳运动可激活骨骼肌和肝脏自噬来改善NAFLD。本研究结果发现,运动可通过增加Beclin-1 及减少p62 的表达,从而激活肝脏自噬,且单纯饮食或运动干预激活小鼠肝脏自噬的效果远不如联合干预。与本研究不同的是,冯燕[21]对NAFLD 小鼠进行10 周饮食干预联合高强度有氧跑步运动后检测其内脏脂肪组织自噬活性,结果显示饮食干预联合高强度有氧运动训练组内脏脂肪组织中Beclin-1 蛋白水平明显下降,p62 蛋白水平明显升高,自噬活性受到抑制。这可能是不同研究检测的组织部位、小鼠运动强度及时长不同,而过度运动可能抑制小鼠内脏脂肪组织的自噬[22-23]。以上研究均显示,运动联合饮食干预对减轻小鼠肥胖及延缓NAFLD 疾病进展较单一干预更佳。
另本研究还发现,NASH 小鼠肝脏组织NAS 与自噬相关蛋白Beclin-1 mRNA 的相对表达量呈正相关,与p62 呈负相关,提示运动及饮食干预可通过调节NASH 小鼠肝脏自噬相关基因相对表达量激活肝脏自噬,改善肝细胞脂质沉积与炎症浸润程度,减少肝脏气球样变,降低NAS,延缓NASH 疾病进展。
综上所述,NASH 小鼠肝脏组织Beclin-1 mRNA 及蛋白相对表达量降低,p62 mRNA 及蛋白相对表达量增多,自噬活性受抑制,导致肝脏出现大量脂质沉积和炎性浸润。运动和饮食干预可促进Beclin-1 mRNA及蛋白表达、抑制p62 mRNA 表达及分解p62 蛋白来激活肝脏自噬,延缓NASH 疾病进展,相比之下,联合干预效果最佳。这一发现可为NASH 防治提供依据,为探究自噬的调节对NAFLD 的作用提供思路。

