弥漫大B细胞淋巴瘤中p-STAT3的表达与临床预后及肿瘤相关巨噬细胞的关系
闻照凤,黄绮堂,胡泉泉,李 雨,朱 俊,王 弦,3,李延莉,4
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是最常见的成人非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL),占NHL的30%~40%,临床表现为高度侵袭性,在分子生物学、临床特征及预后等方面存在高度异质性,虽然其标准治疗方案R-CHOP的应用大幅度提高患者的存活率,但仍有近1/3的患者发生耐药或复发导致死亡[1]。因此,寻找新的指标预测患者预后及评估治疗反应是亟待解决的问题。信号转导及转录活化因子(signal transducer and activator of transcription, STAT)家族是一类具有细胞信号转导及转录双重功能的因子,参与调控正常细胞的多种活动,如细胞分化、增殖、血管生成等[2]。STAT3是STAT家族重要的一员,可被多种因素激活成为磷酸化STAT3(p-STAT3),进而参与各种正常或异常细胞活动。近年,越来越多的研究发现STAT3和p-STAT3在多种肿瘤中过表达且与临床预后密切相关[3-6]。肿瘤相关巨噬细胞是肿瘤微环境的主要组成成分之一,参与多种肿瘤的增殖、侵袭、血管生成和转移等过程[7]。Li等[8]证实肿瘤相关巨噬细胞与DLBCL预后相关,肿瘤相关巨噬细胞标志物CD68和CD163表达越高,患者总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)越低。目前,用p-STAT3预测DLBCL患者预后及p-STAT3与肿瘤相关巨噬细胞相关性的报道较少。本文采用免疫组化法检测228例DLBCL中p-STAT3的表达,分析其与预后、肿瘤相关巨噬细胞的关系,以期为DLBCL患者的治疗提供新参考。
1 材料与方法
1.1 临床资料收集2004~2015年安徽医科大学第一、二附属医院确诊的228例DLBCL,其中女性107例,男性121例;<60岁者134例,≥60岁者94例;ECOG-PS评分≤1分者140例,>1分者88例;淋巴结外累积部位≤1处者181例,>1处者47例;Ann Arbor分期:Ⅰ+Ⅱ期者129例,Ⅲ+Ⅳ期者99例;LDH正常165例,升高63例;IPI评分≤2分者159例,≥3分者69例。
1.2 免疫组化采用免疫组化EnVision法检测DLBCL组织中p-STAT3的表达。组织标本均经10%中性福尔马林固定,石蜡包埋,切片厚4 μm。一抗为兔抗人p-STAT3单克隆抗体(Tyr705)(稀释比1 ∶200),购自DAKO公司。石蜡切片常规脱蜡至水,用pH 6.0的柠檬酸盐溶液高压修复抗原,室温冷却后PBS冲洗,滴加3%H2O2阻断内源性过氧化物酶,加一抗4 ℃过夜,恢复至室温滴加二抗,37 ℃孵育10 min,DAB显色,经苏木精染色,梯度乙醇脱水,二甲苯透明,中性树胶封固。阴性对照切片的一抗使用PBS替代。
1.3 结果判断p-STAT3染色定位于肿瘤细胞胞质和胞核,主要表达于细胞核。根据阳性细胞数和着色强度进行评分:(1)按阳性细胞百分比进行评分:阳性细胞数<10%为0分,10%~30%为1分,31%~80%为2分,>80%为3分[9];(2)按细胞着色程度进行评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分相乘:≤2分为低表达,≥3分为高表达[10]。CD68主要表达于巨噬细胞胞质,CD163表达主要定位于巨噬细胞胞膜。首先在低倍(100倍)镜下初步观察整张切片,再随机选择5个代表性的高倍视野(400倍),计数CD68和CD163阳性细胞数。所有切片计数在1个月后重复,取2次计数的平均值作为该样本表达的最终结果。以ROC曲线分析确定最佳截断值分为CD68、CD163强阳性组和弱阳性组[8]。
1.4 统计学分析应用SPSS 20.0软件进行统计学分析;采用χ2分析p-STAT3表达与临床病理特征的关系;Spearman分析两指标间的相关性;Kaplan-Meier绘制患者生存曲线;Cox风险比例回归模型进行预后的单因素和多因素分析。以P<0.05为差异有统计学意义。
2 结果
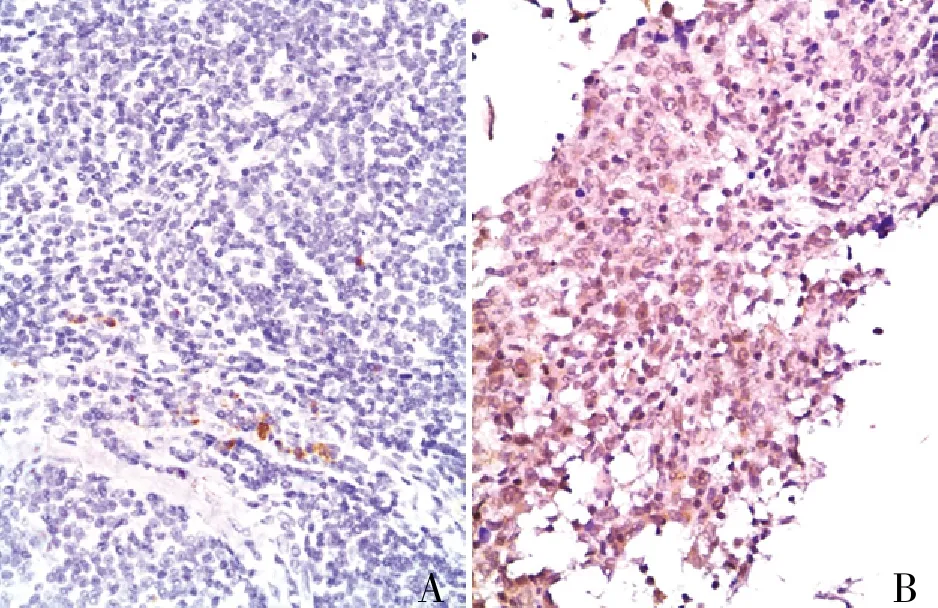
2.1 DLBCL中p-STAT3的表达p-STAT3表达主要定位于DLBCL胞质和胞核,呈棕褐色(图1)。在228例DLBCL患者中,p-STAT3阴性136例(59.6%)、阳性92例(40.4%)。
2.2 DLBCL中p-STAT3表达与临床特病理征、肿瘤相关巨噬细胞的关系本组CD68弱阳性143例,强阳性85例;CD163弱阳性126例,强阳性102例。免疫分型:GCB型65例,non-GCB型61例;BCL-2阳性33例,阴性15例;BCL-6阳性25例,阴性23例。结果显示:p-STAT3的表达在ECOG-PS评分、结外累积部位、Ann Arbor分期、LDH水平、IPI评分、治疗反应、CD68、CD163、BCL-2表达和免疫分型方面差异有显著性(P<0.05,表1)。
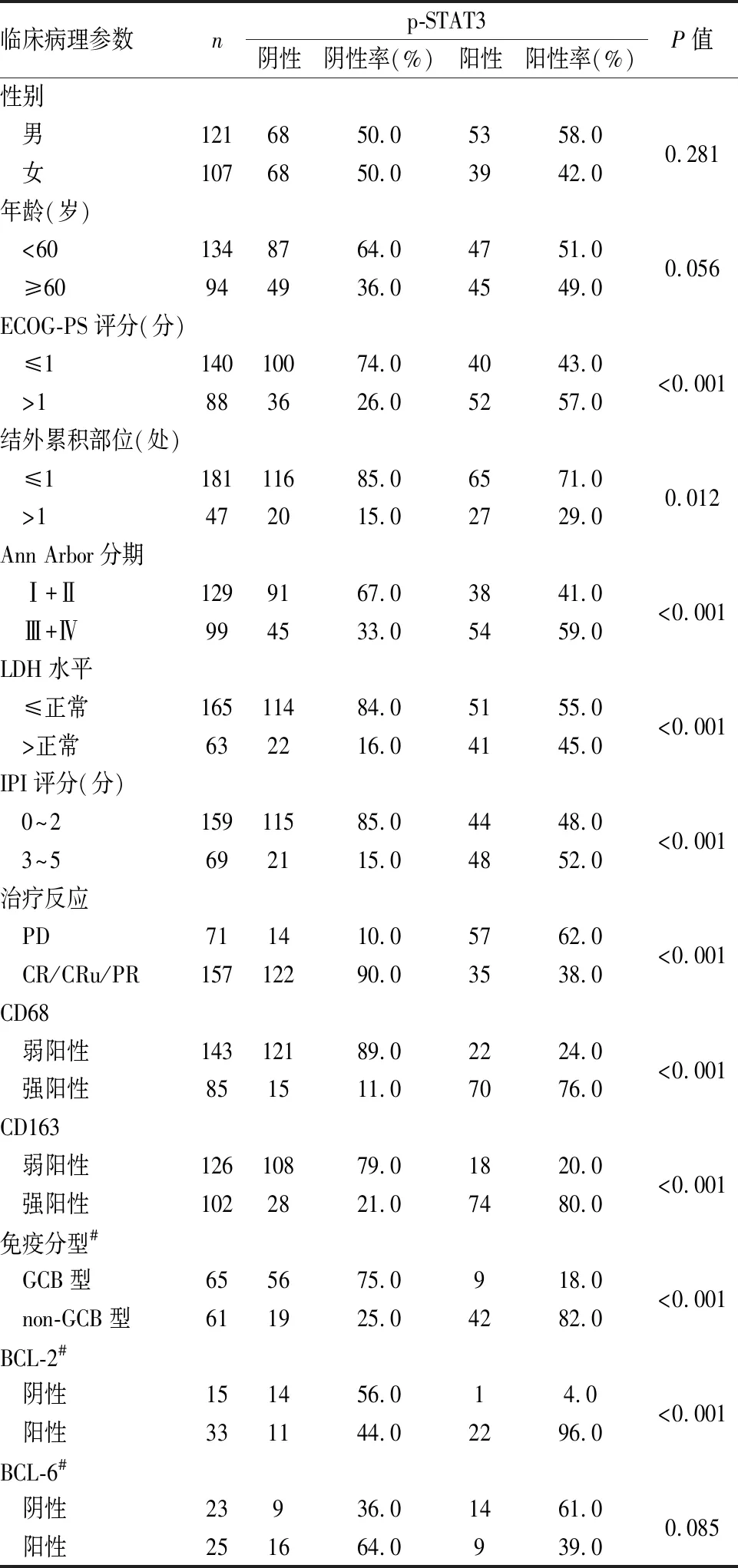
表1 弥漫大B细胞淋巴瘤中p-STAT3表达与临床病理特征及肿瘤相关巨噬细胞的关系
AB
2.3 DLBCL中p-STAT3表达与预后的关系Kaplan-Meier生存曲线分析:IPI评分0~3分的低风险和中风险DLBCL患者中,p-STAT3阳性患者的OS和PFS与阴性患者相比显著降低,而在IPI评分4~5分的高风险患者中p-STAT3阳性患者的OS显著降低,PFS未出现显著差异(图2)。本组采用标准化疗方案(CHOP或R-CHOP)治疗后,疾病进展71例,缓解157例。Cox单因素分析显示:患者年龄、ECOG-PS评分、结外累积部位、Ann Arbor分期、LDH水平、IPI评分、治疗反应、CD68、CD163和p-STAT3均是DLBCL预后的影响因素。Cox多因素回归分析显示:LDH水平、治疗反应、CD163表达和p-STAT3表达是DLBCL预后的独立影响因素(表2、3)。
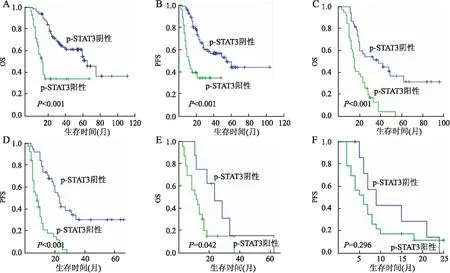
图2 IPI不同评分中p-STAT3表达与OS、PFS的关系:IPI评分0~1分中p-STAT3阳性组与阴性组的OS(A)和PFS(B);IPI评分2~3分中p-STAT3阳性组与阴性组的OS(C)和PFS(D);IPI评分4~5分中p-STAT3阳性组与阴性组的OS(E)和PFS(F)

表2 弥漫大B细胞淋巴瘤患者总生存期的Cox单因素和多因素分析

表3 弥漫大B细胞淋巴瘤患者无进展生存期的Cox单因素和多因素分析
2.4 DLBCL中肿瘤相关巨噬细胞标志物CD68与CD163表达的相关性在DLBCL中,CD68、CD163共同强阳性率为53.7%(121/228),共同弱阳性率为35.1%(80/228)。Spearman相关分析结果显示:DLBCL中CD68与CD163表达呈正相关(r=0.766,P<0.001,表4)。

表4 弥漫大B细胞淋巴瘤中CD68和CD163表达的相关性分析
2.5 DLBCL中p-STAT3表达与CD68/CD163表达的相关性Spearman相关分析结果显示,DLBCL中p-STAT3表达与CD68呈正相关(r=0.660,P<0.001);与CD163呈正相关(r=0.590,P<0.001,表5)。

表5 弥漫大B细胞淋巴瘤中p-STAT3与CD68/CD163表达的相关性分析
3 讨论
STAT3包含STAT3ɑ、STAT3β、STAT3γ、STAT3δ四种亚基[11],是信号转导与转录活化因子STAT家族中的重要一员,具有信号转导及转录双重功能,可被多种细胞因子、生长因子和基因激活,参与各种生理及病理过程。近年,越来越多的研究证明STAT3和p-STAT3在多种肿瘤中过表达且对预后起一定预测作用。Zhao等[12]通过分析202例食管鳞状细胞癌组织中STAT3表达发现,STAT3是食管鳞状细胞癌患者的独立预后因素,阳性患者的OS和PFS明显降低。Tang等[13]发现肝癌组织中STAT3阳性与肝癌患者的复发及预后密切相关;王凡夫等[14]也发现与癌旁肝组织和肝硬化组织相比,原发性肝癌组织中STAT3高表达,且与原发性肝癌的发生、发展密切相关。此外,有研究发现STAT3在胃癌中高表达,并且是胃癌患者的独立不良预后因素[15];p-STAT3也被证实是雌激素受体阴性乳腺癌患者的独立不良预后因素[16]。
肿瘤相关巨噬细胞是肿瘤微环境的主要组成成分,分为抑制肿瘤进展的M1型和促进肿瘤进展的M2型[17]。近年,多个研究发现在不同的肿瘤中STAT3表达与肿瘤相关巨噬细胞之间存在相互联系。如乳腺癌肿瘤微环境中的肿瘤细胞通过p38-MAPK通路诱导肿瘤相关巨噬细胞分泌IL-6,进而激活肿瘤细胞的STAT3通路促进肿瘤干细胞增殖及肿瘤进展[18]。用肿瘤相关巨噬细胞的培养上清作用非小细胞肺癌细胞后,肿瘤细胞的STAT3被激活,诱导肿瘤细胞增殖、发生免疫逃逸和耐药,而IL-6受体拮抗剂则抑制肿瘤相关巨噬细胞上清对肿瘤细胞产生影响[19];Zhang等[20]证实肺癌微环境中肿瘤相关巨噬细胞分泌的IFNγ可激活肺癌细胞的JAK/STAT3信号通路,使肿瘤细胞表达PD-L1,进而促进肺癌进展。
本组228例DLBCL患者中p-STAT3阳性92例(40.4%),p-STAT3阴性136例(59.6%)。p-STAT3阳性与ECOG-PS评分、结外累积部位、Ann Arbor分期、LDH、IPI评分、治疗反应、CD68和CD163和BCL2表达均有关。在不同IPI评分的患者中,STAT3阳性患者的OS明显降低,而在IPI评分4~5分患者中STAT3是否表达与PFS无显著差异。Cox单因素和多因素分析发现,p-STAT3是DLBCL患者不良预后的独立影响因素;Spearman相关分析发现,p-STAT3的表达与肿瘤相关巨噬细胞呈正相关,以上结果均表明p-STAT3在肿瘤微环境中起重要作用。Tamma等[21]发现DLBCL组织中p-STAT3高表达且与CD163/CD4表达呈正相关。Ling等[22]发现DLBCL细胞分泌的外泌体促进肿瘤相关巨噬细胞的STAT3活化,并激活下游通路促进肿瘤相关巨噬细胞向M2型极化,最终促使肿瘤进展。Hashwah等[23]发现DLBCL细胞表达IL-6受体,被肿瘤微环境中的IL-6激活IL-6R/gp130/p-STAT3通路,进而促进DLBCL的进展。Stirm等[24]证实一种DLBCL细胞亚群分泌IL-10作用于自身表达的IL-10受体,进而激活肿瘤细胞自身STAT3促进肿瘤增殖。
综上所述,p-STAT3阳性是DLBCL患者的独立预后不良因素,与肿瘤微环境中的肿瘤相关巨噬细胞呈正相关,可以有效预测患者预后,其在肿瘤微环境中的作用则需要深入分析。

