老年2型糖尿病患者甘油三酯葡萄糖指数与体重指数乘积与糖尿病发病率关系
雷庆华,李军华*,霍燕飞,段丽华,胡艳艳,王闪闪
(1.邯郸市中心医院健康体检中心,邯郸 056000; 2.邯郸市中心医院超声科,邯郸 056000)
2型糖尿病(type 2 diabetes mellitus, T2DM)是由于葡萄糖代谢紊乱引起的,在全球范围内广泛流行,是心血管疾病和全因死亡的危险因素,对患者和社会造成了很大的负担[1]。近几十年来,T2DM的患病率越来越高,与发达国家相比,发展中国家增高得更快[2]。根据国际糖尿病联盟的一项调查,2019年全球有4.63亿人患有T2DM,其中中国有1.16亿人(30.45%),印度有1.01亿人(21.81%),美国有3 400万人(21.3%)。预计到2045年,全球T2DM患者将达到7亿人[3]。T2DM在老年人群中发病率也很高,并且与年轻患者相比,老年患者并发症较多,比如慢性肾功能不全、痴呆、认知功能不全,这些并发症增加了T2DM患者的血糖管理难度和T2DM并发症的发生率。因此,定期体检,采用简单、易行的检测指标,尽早发现T2DM,对于老年T2DM患者防止并发症的发生,提高生活质量有很大的意义。
胰岛素抵抗(insulin resistance, IR)参与了包括T2DM在内的许多代谢性疾病的发生和发展[4],评估机体的IR水平,就能预测健康的机体进展为T2DM的概率大小。关于胰岛素功能评价的方法较多[2],但是最经典的胰岛功能是依靠葡萄糖钳夹技术(hyperinsulinemic-euglycemic clamp, HIEC)[5],但是由于时间和经济的原因,该技术不能广泛应用于临床,故需要在临床上利用易采集的指标来判断机体的IR水平。甘油三酯-葡萄糖指数(triglyceride glucose index, TyG index)是由空腹甘油三酯和血糖水平计算而得,可以反映IR[6]。IR的发生和肥胖有很大关系,体重指数(body mass index, BMI)是反映机体肥胖的一个指标。所以将二者联合起来可能能够更好地反映机体的IR程度[7]。但是老年人群作为一个特殊的群体,目前没有研究表明老年人群中TyG指数×BMI (TyG-BMI)与T2DM发病率之间的关系,因此,现探讨老年人群中TyG-BMI与T2DM发病率之间的关系,以期为老年人群中T2DM的早期预防提供一定的参考依据。
1 对象和方法
1.1 研究对象
该研究是对中国瑞慈集团进行的一项队列研究的二次分析,之前的文献已经对设计进行了详细说明[8]。简而言之,这些数据包括2010—2016年在该机构体检的中国人口数据,所有参与者的年龄都在20岁以上,所有参与者都进行了至少2次的随访,共计685 277人。排除在基线时缺少体重和身高测量值(n=103 946)、缺少性别、极端 BMI 值(<15 kg/m2或>55 kg/m2)(n=152) 或缺少空腹血糖值 (n=31 370)。进一步排除了访问间隔小于 2 年的参与者(n=324 233)、基线时诊断为糖尿病的参与者(2 997 名自述诊断为糖尿病和 4 115 名空腹血糖大于等于7.0 mmol/L)以及随访时未确定的糖尿病状态(n= 6 630)。健康检查指标包括身高、体重、血压、空腹血糖(fasting blood glucose, FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白(low-density lipoprotein cholesterol, LDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase, AST)、血尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine, Cr)。纳入了有BMI和FPG且年龄大于等于60岁的人群,最终共纳入24 665名研究对象,随访结束时,共有1 533人诊断T2DM。由于数据的匿名性和研究伦理在之前的研究中已经被批准,因此不需要重新申请。
1.2 诊断标准
新发T2DM的诊断定义为在随访期间空腹血糖大于等于7.00 mmol/L和/或患者自述患T2DM或口服T2DM药物治疗。患者随访时间的终点为诊断为T2DM的日期或最后一次体检时间,并记录这两个时间较早的时间。
1.3 研究方法
收集研究对象的性别、年龄、身高、体重、T2DM病程、合并高血压、T2DM家族史、是否抽烟及饮酒等一般临床资料。体重指数(BMI)、甘油三酯-葡萄糖指数(triglyceride glucose index, TyG)、TyG-BMI计算公式[9-10]如下。
BMI=w/h2
(1)
TyG=ln(FPG·TG/2)
(2)
TyG-BMI=TyG·BMI
(3)
式中:w为体重,kg;h为身高,m;FPG为空腹血糖,mg/100 mL;TG为甘油三酯,mg/100 mL。
1.4 统计学分析

为了探讨不同TyG-BMI与T2DM发病风险的相关性,根据所有参与者TyG-BMI指数的四分位值,将所有患者分为4组,即Q1、Q2、Q3和Q4组。通过Cox比例风险模型评估TyG-BMI作为连续变量或分类变量(Q1、Q2、Q3和Q4组)对T2DM发病风险的独立影响。原始(单变量)模型仅包括TyG-BMI。模型Ⅰ根据性别和年龄进行调整。模型Ⅱ(完全调整模型)对性别、年龄、SBP、ALT、Cr进行调整。记录并给出Cox回归分析的P值和相应的95%置信区间的风险比。采用log-rank检验比较TyG-BMI四分位数组的T2DM风险,采用Kaplan-Meier曲线分析累积事件发生率。考虑到性别和年龄潜在的混杂效应,分析性别分层和年龄分层(临界值为75岁)多变量Cox回归比例风险模型,并对性别、年龄、SBP、ALT、Cr进行调整。使用R语言软件4.0.3进行数据分析,采用双侧检验,P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料比较
排除不符合标准的受试者后,最终分析24 665名符合条件的受试者。其中男性13 980人,女性10 685人,平均年龄(67.21±6.55)岁。在本研究中,根据随访结束时是否患T2DM将病人分为两组,两组中尿素氮、肌酐、是否饮酒无统计学差异,其余均有统计学差异,如表1所示。
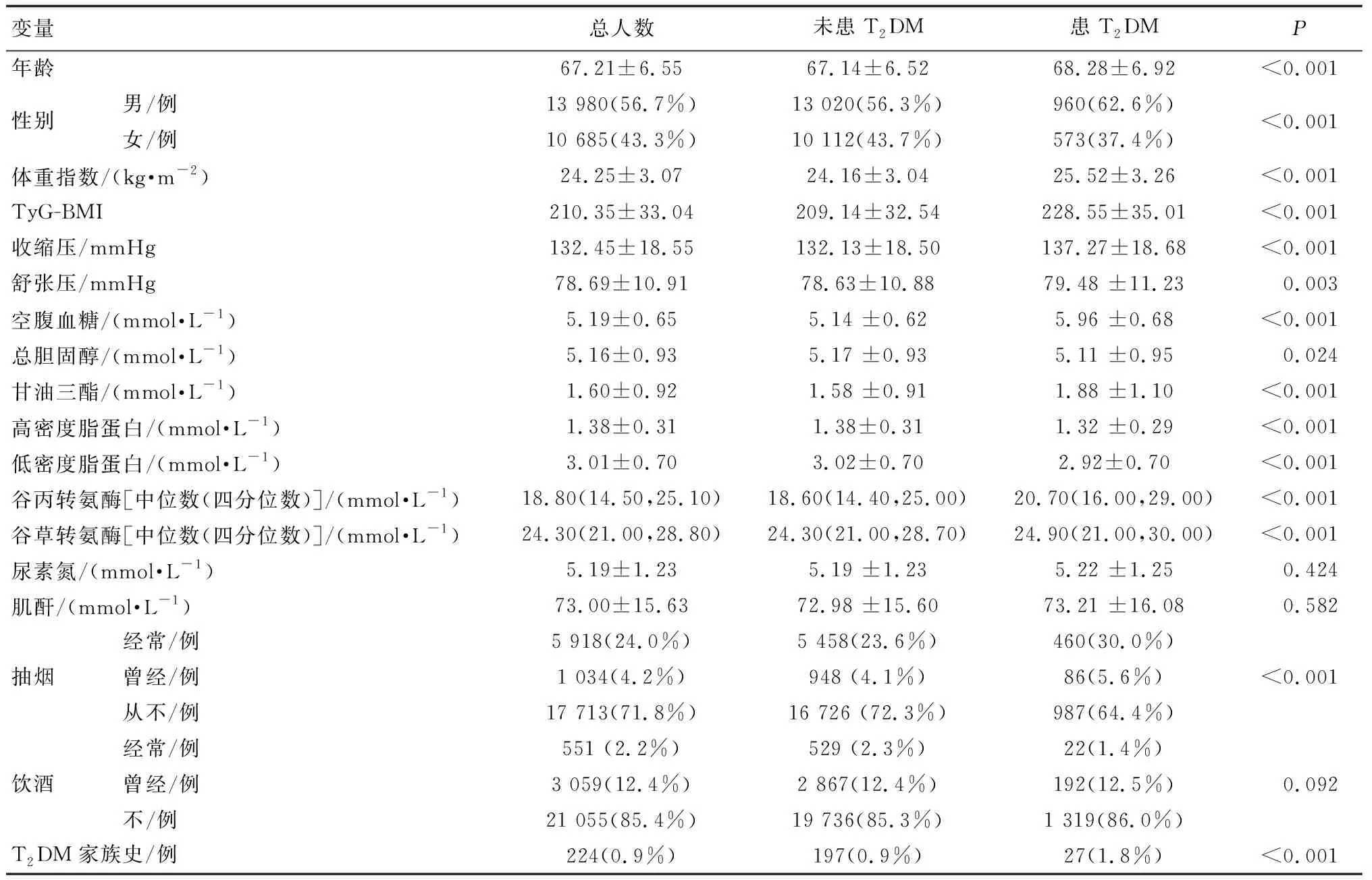
表1 人群基线资料描述Table 1 Comparison of baseline data of the subjects
2.2 随访的生存分析
在平均(3.10±0.95)年的随访中,1 533(6.2%)人新诊断为T2DM。T2DM累积发生率Q1组为2.5% (157/6 166),Q2组为4.6% (282/6 166),Q3组为6.7% (414/ 6 166),Q4组为11.0% (680/6 167),基于TyG-BMI四分位数的Kaplan-Meier分析结果显示Q4组的T2DM发生率明显高于其他组,各组T2DM的发病率有明显差别(P< 0.001),如图1所示。
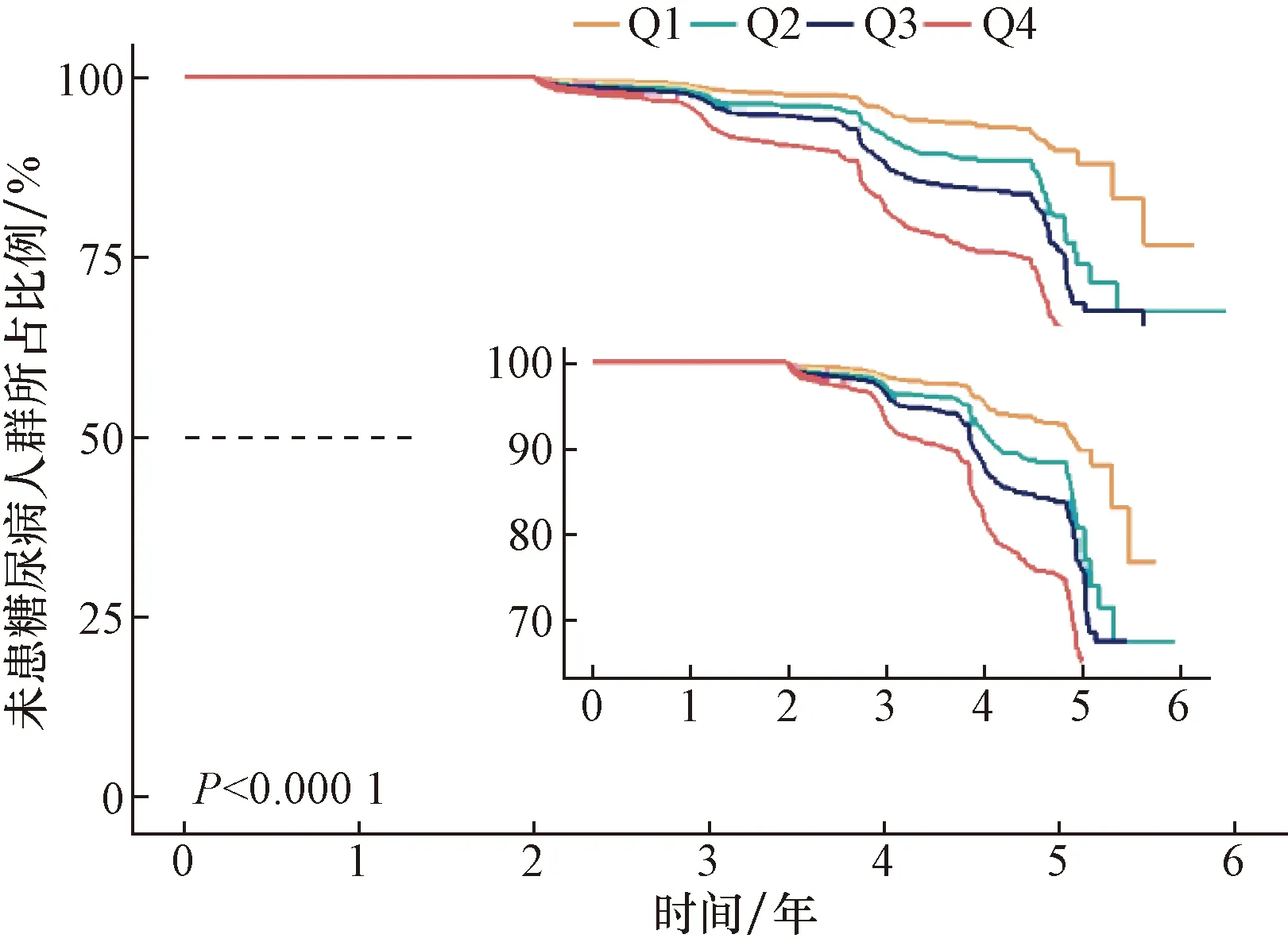
图1 随访的生存分析Fig.1 Survival analysis of follow-up
2.3 多因素分析
使用未调整的单因素模型和调整的多因素评估TyG-BMI与T2DM发生风险的关系。结果表明,不调整任何因素的情况下,TyG-BMI与T2DM发病率呈正相关(HR=1.014,95% CI: 1.013 ~ 1.015),与最低1/4组相比,TyG-BMI每增加1/4,T2DM患病风险逐渐增加(P<0.001)。模型I调整性别和年龄,结果表明随着TyG-BMI的增加,T2DM的发病率逐渐上升(HR=1.033,95% CI: 1.029 ~ 1.036)。模型II在模型I的基础上进一步调整了SBP、ALT、Cr,不论TyG-BMI是作为连续变量还是四分类变量,均表明随着TyG-BMI的增长,T2DM的发病率逐渐上升。总之,TyG-BMI是新发T2DM的独立危险因素,如表2所示。

表2 TyG-BMI与T2DM的回归分析Table 2 Cox regression of TyG-BMI and T2DM
2.4 TyG-BMI分组变量的亚组分析
根据性别(男性和女性)和年龄(< 75岁和≥ 75岁)对人群进行亚组分析,在调整性别、年龄、SBP、ALT、Cr后(性别亚组不调整性别,年龄亚组不调整年龄),TyG-BMI与T2DM发生相关性的亚组分析结果表明:随着TyG-BMI组别的增加,在各亚组T2DM的发病率均增加,如表3所示。
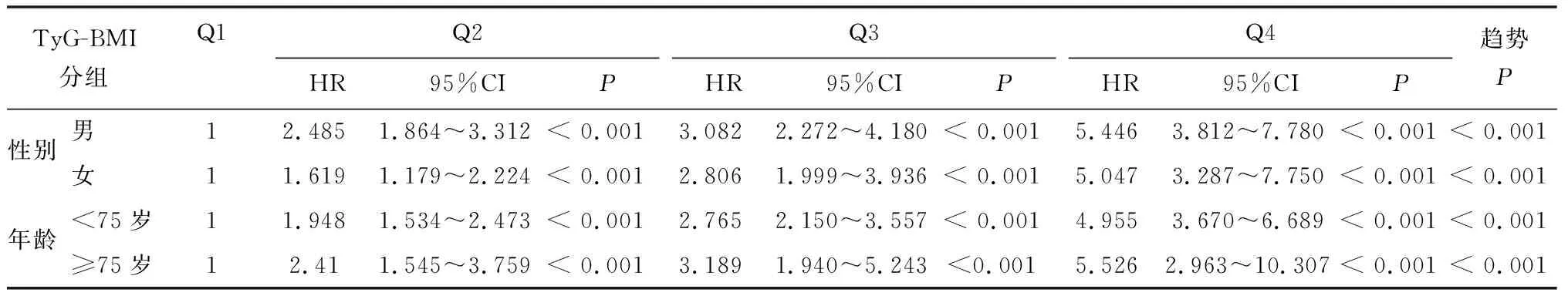
表3 TyG-BMI分组变量根据性别和年龄的亚组分析Table 3 Subgroup analysis of TyG-BMI grouping variables by sex and age
2.5 TyG-BMI连续变量的亚组分析
根据性别(男性和女性)和年龄(< 75岁和≥ 75岁)对人群进行分亚组分析,调整性别、年龄、SBP、ALT、Cr(性别亚组不调整性别,年龄亚组不调整年龄),结果表明:随着TyG-BMI组别的增加,在各亚组T2DM的发病率均增加。在不同性别和年龄的各亚组中,男性、年龄≥75岁风险更高(交互P< 0.001),如图2所示。
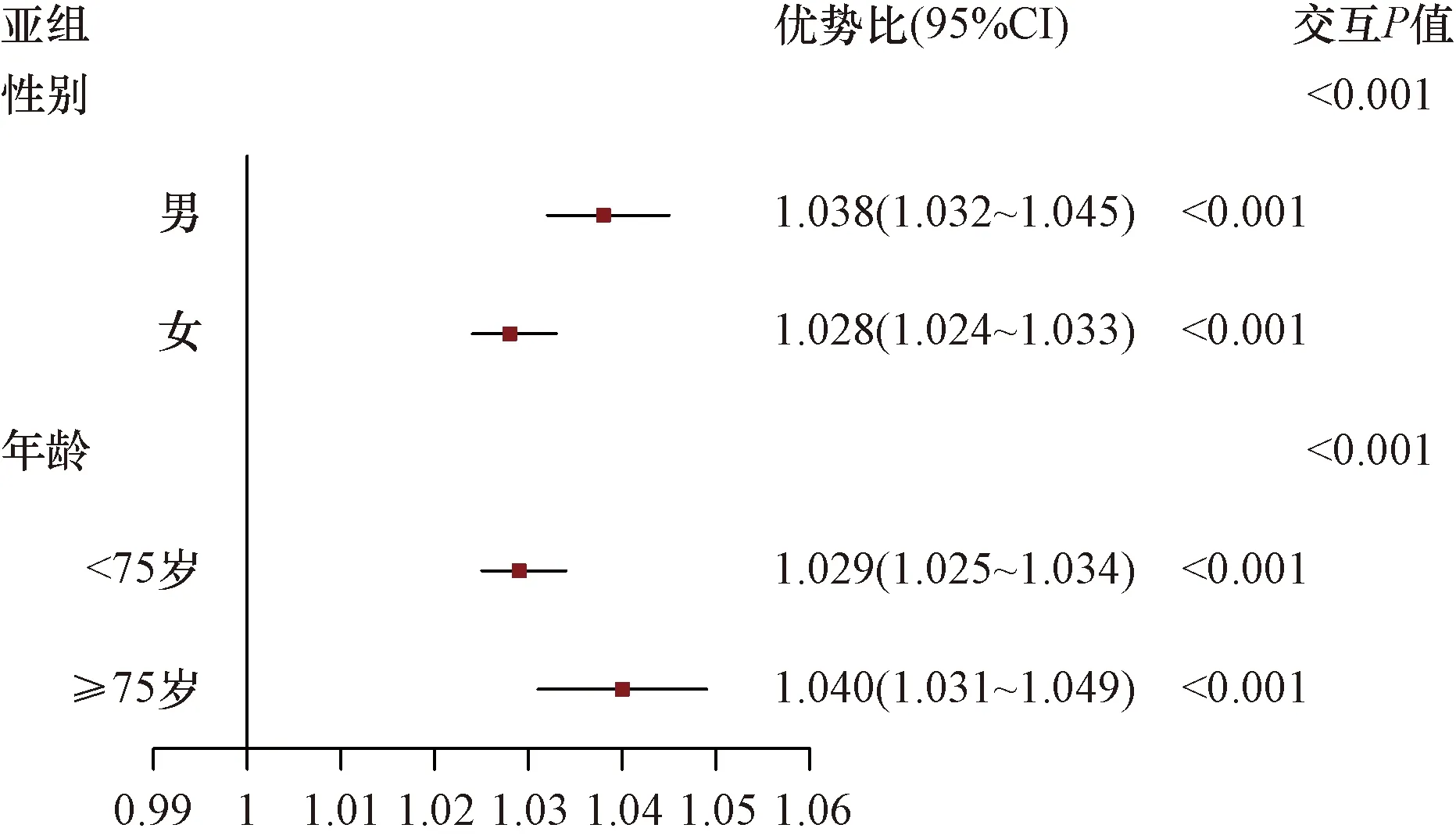
图2 TyG-BMI连续变量的亚组分析森林图Fig.2 Subgroup analysis of TyG-BMI as continuous variable
3 讨论和结论
二次分析研究表明,在中国60岁以上的老龄健康人群中,TyG-BMI的升高与T2DM发病率的升高独立相关(HR = 1.032; 95% CI: 1.028 ~ 1.035;P< 0.001)。与TyG-BMI指数最低四分位的个体相比,TyG-BMI指数最高四分位的研究对象T2DM发病风险高出5.187倍(Q4vsQ1;95% CI: 3.959~6.794;P< 0.001)。此外,亚组分析结果显示,无论性别(男性或女性)或年龄(< 75岁或≥75岁),这种关联都存在,提示结论是稳定的,TyG-BMI可以用来预测老年人群的T2DM的发病率。此外,在男性个体和年龄≥75岁的人群中风险更高。
T2DM的特征是胰岛β细胞功能障碍和胰岛素抵抗[4]。由于抗氧化酶能力有限,胰岛β细胞易受氧化应激的影响,氧化应激参与了T2DM的发病和进展[11]。此外,长期接触甘油三酯也可引起胰腺β细胞功能障碍,其原因可能是游离脂肪酸水平持续升高[12]。TyG指数是一种由甘油三酯和葡萄糖计算得出的产物,是衡量胰岛素敏感性的一种现成指标[6]。新的研究表明,TyG指数可能是糖尿病前期患者的重要预后指标,并可以独立预测新的心脑血管不良事件[13]。也有研究证明,随着TyG指数的增加,患糖尿病的风险也显著增加,是胰岛素抵抗的危险标记物[14]。因此,TyG指数在一定程度上反映了机体生理调节和代谢调节的转化,与T2DM发病和进展的可能性密切相关。但是IR与BMI有很大关系,不同BMI人群的IR程度不同,故Er等[15]于2016年首次研究TyG-BMI与IR的关系。在比较传统血脂、血糖、TyG指数等相关指标后,发现TyG-BMI识别IR的AUC最高。此外,近期的研究一些进一步发现TyG-BMI与高血压前期和卒中密切相关[16-18]。这些结果表明,TyG-BMI作为代谢性疾病的预测指标具有一定的价值。
将研究的人群根据TyG-BMI分成4组,分别绘制4个组的生存曲线,发现随着观察时间的延长,每组未患T2DM的人数均下降,其中TyG-BMI高的组下降最快。更进一步,不论TyG-BMI是作为连续变量还是四分类变量,单因素和多因素分析均表明随着TyG-BMI的增长,T2DM的发病率逐渐上升。根据性别和年龄分为不同的亚组,在各个亚组中,随着TyG-BMI的增长,T2DM的发病率均呈上升趋势,TyG-BMI对T2DM的发病率影响比较稳定。Wang等[19]针对中国人群的一项关于TyG-BMI与T2DM发病率关系的研究,发现TyG-BMI的升高与T2DM发病率的升高正相关。但是该研究是针对所有成年人的研究,并且没有发现性别与TyG-BMI的交互作用。本研究针对老年人群,发现了男性和年龄大于等于75岁这两组特殊人群。身体成分和新陈代谢速度在不同的性别和年龄的人群中差异很大,男性通常肌肉质量更高,新陈代谢更快,可能这是不同的性别TyG-BMI与T2DM发病率差异的原因[20]。随着老年人的衰老,男性肝细胞内脂质沉积的模式可能与女性不同[21]。并且老年人群的脏器功能下降,均可能对血脂代谢产生影响。换句话说,年龄会影响TyG-BMI与T2DM的发病风险。这和交互作用显示的结果是一致的。因此,TyG-BMI可能是一个很有前途的生物标志物,用于监测T2DM发病风险,尤其是在大于或等于75岁的男性人群中。
探讨了在老年人群中TyG-BMI与T2DM之间的因果关系,提示TyG-BMI与T2DM发病率为正相关,尤其在男性和年龄大于等于75岁人群中,为老年T2DM的高危个体的早期识别提供了可靠的标志物。近年来发现内脏脂肪指数对人体健康的意义重大[22],下一步将使用血脂和内脏脂肪指数或腰围等来联合预测T2DM发病的风险,以期获得更好的预测模型。
研究是基于公共数据库的二次分析,有些项目如身高、体重、腰围、腹围等原始数据无法获得,故在统计分析调整混杂因素时无法纳入。此外,诊断研究对象是否患T2DM仅根据一次的空腹血糖或患者自述患T2DM或使用降糖的药物治疗,没有根据患者症状或复查血糖,诊断标准欠完善,有待进一步深入研究。

