不同运动方式对心梗心脏的保护效应研究
王叶秋 申艳
(1.西藏民族大学高原体育与健康研究中心高原低氧环境与生命健康重点实验室 陕西咸阳 712082;2.中国人民解放军空军军医大学第二附属医院心内科 陕西西安 710032)
近年来,心肌梗死(myocardial infarction,MI)发病率和死亡率呈显著上升趋势,MI以其难治愈、康复效果差、死亡率高和多种并发症等特点已成为临床医学上的一大难题[1-2]。目前研究显示,以运动疗法为核心的康复治疗在纠正心血管疾病的危险因素、改善患者的生活质量和运动耐力、降低心血管疾病的死亡率方面具有显著优势[1]。先前,关于MI 心脏康复的研究主要集中于持续有氧运动。近年来,随着运动防治心血管疾病研究的逐步深入,更多学者发现间歇运动、抗阻运动及机械振动等也对MI 患者心脏保护起着不可忽视的积极作用[3]。因此,该文就国内外文献中不同运动方式对MI心脏的保护作用进行论述,旨在为安全有效防治MI、制订科学合理的运动处方提供线索与参考。
1 不同运动方式对心梗心脏的保护
1.1 持续有氧运动对心梗心脏的保护
对于MI患者而言,有氧运动仍是应用最多的运动康复方法。研究发现,心力衰竭患者进行步行训练可显著增大其摄氧量及射血分数[4];对冠脉旁路移植术患者进行八段锦干预,可明显改善其MI 症状[5]。梳理文献发现,MI大鼠通过中等强度的持续有氧运动,可提高机体抗氧化酶活性,防止氧自由基对心肌细胞产生损害。MI大鼠通过中等强度的递增负荷有氧运动,可增加左心室β3肾上腺素能受体(β3-AR)表征,上调内皮型一氧化氮合酶(eNOS)、神经元型一氧化氮合酶(nNOS)、血管内皮生长因子(VEGF)及热休克蛋白27(HSP27)等因子表达水平,减小梗死面积。MI 大鼠通过中等强度的爬坡运动,可上调肉毒碱棕榈酰转移酶(CPT-1)表达水平,改善心脏脂质过度沉积与脂毒性心脏异常,提高副交感神经胆碱乙酰基转移酶(CHAT)和囊泡乙酰胆碱转移体(VACHT)表达水平,保护受损神经,降低心肌细胞凋亡率,减轻心肌纤维化程度(见表1)。
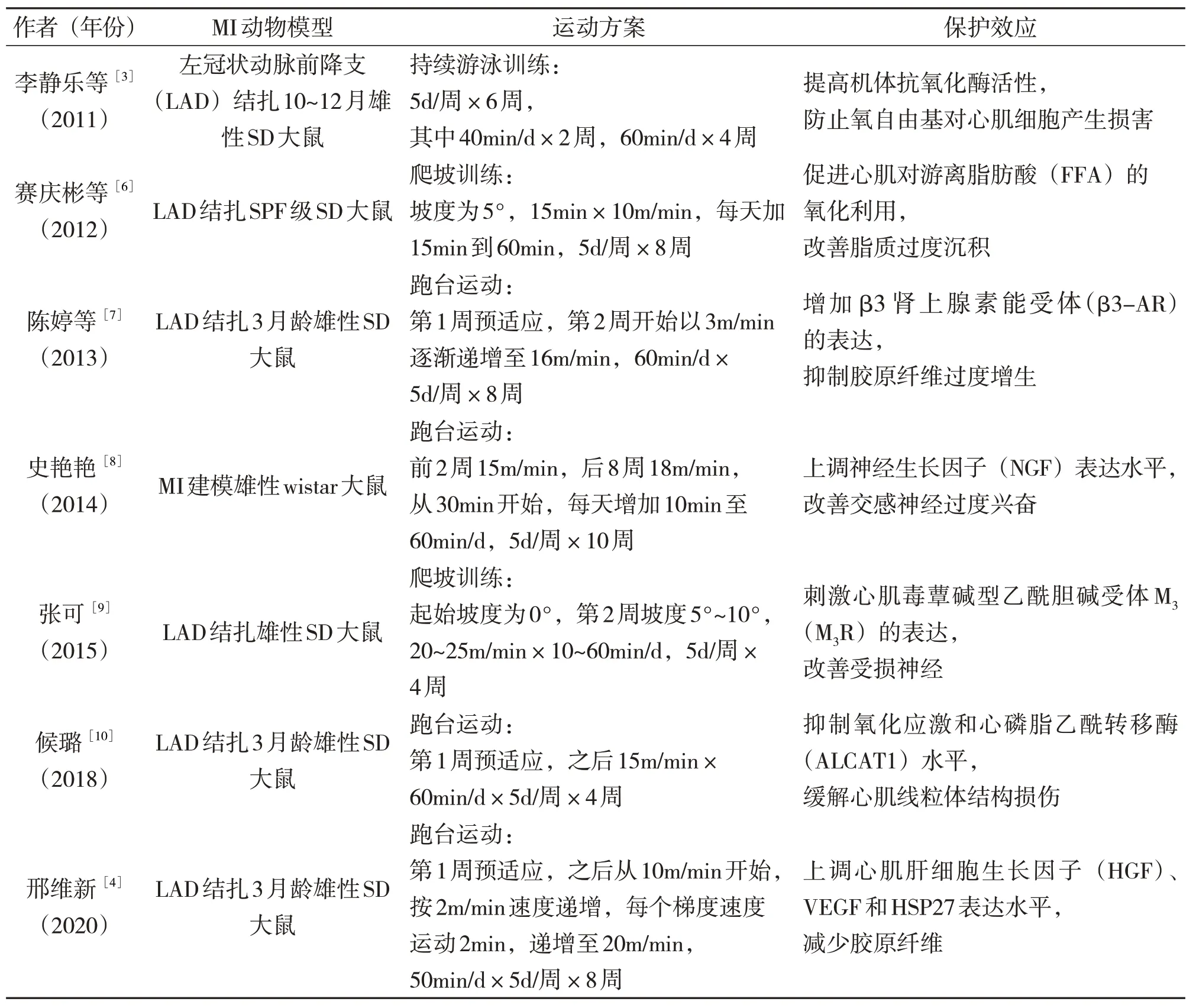
表1 持续有氧运动干预MI动物模型的实验研究
1.2 间歇运动对心梗心脏的保护
近年来,学者对于心梗后间歇性运动方案的干预研究较多。目前间歇运动大多分为两种,即高强度—休息—高强度和高强度—低强度—高强度交替运动[3]。临床研究发现,老年充血性心力衰竭患者长期进行间歇运动可显著提高左心室射血分数、心输出量以及舒张末期及收缩末期容积[11],表明间歇运动可显著改善MI患者心脏功能。动物实验中,MI大鼠通过高、低强度间歇运动,可显著上调心肌M3R、白血病抑制因子(LIF)蛋白表达,降低梗死边缘区促凋亡基因(Bax)表达水平,抑制心肌细胞凋亡;可上调eNOS、nNOS、微小RNA(miR-101a/miR-29a)蛋白表达水平,降低心肌间质胶原沉积,减小梗死面积;可提升心肌平滑肌肌动蛋白抗体(α-actin)、心肌肌球蛋白抗体(α-myosin)表达水平,增加兴奋收缩耦联,促进心肌收缩蛋白合成。递增性间歇运动可促进MI 后心脏神经调节蛋白1(NRG1)表达,增强心肌收缩力;诱导内源性干细胞动员归巢,促进心肌细胞增殖(见表2)。

表2 间歇运动干预MI动物模型的实验研究
1.3 抗阻训练对心梗心脏的保护
抗阻训练作为有氧运动的一种辅助训练,近年来逐渐受到关注。在心血管疾病患者中,抗阻训练可以显著增加其24%~90%的肌肉力量,提高患者心脏功能[18]。对心衰患者进行抗阻与有氧混合训练,结果发现,其比单纯有氧训练更能增强受试者心脏功能。研究显示,抗阻训练可提高MI 及心衰患者最大摄氧量,提升左心室射血分数[4]。动物实验表明,MI 大鼠通过爬梯训练干预,可升高血清和心肌NRG1蛋白水平,上调比目鱼肌质量与心肌横截面积,减轻心脏压力;可提高心肌卵泡抑素样蛋白1(FSTL1)、DIP2A 蛋白表达水平,激活磷脂酰肌醇3激酶(PI3K)-Akt/MEK-Erk1/2信号通路,促进细胞增殖;可改善血流动力学特征,增强副交感神经活性,降低氧化应激和炎症反应,改善心脏重塑能力(见表3)。
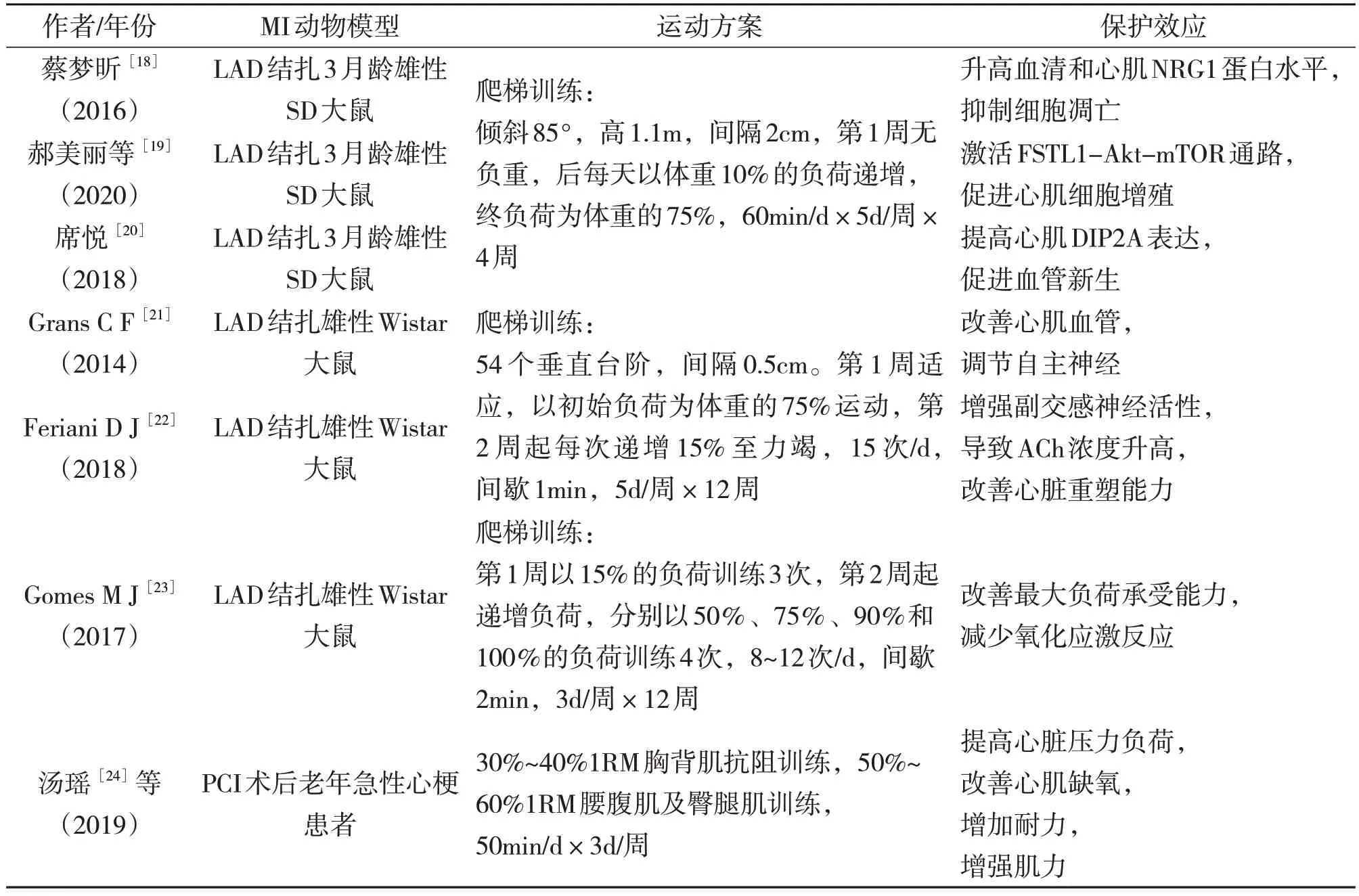
表3 抗阻运动干预MI动物模型的实验研究
1.4 机械振动对心梗心脏的保护
机械振动作为一种干预手段,主要作用于运动员肌肉力量训练、骨折愈合及疲劳消除等方面[25]。机械振动的频率和振幅不同,对人体的影响也不一样。目前在体育训练和运动康复中,机械振动最广泛的振动频率在10~60Hz 之间,振幅在1~10mm 间,加速度可达15.0g[26]。有文献报道,对自行车运动员机械振动后,其VEGF 和内皮素(ET)水平升高,说明机械振动可促进血管生成,改善心脏微循环[27]。目前研究发现,较低频率的机械振动可促进心肌NRGI 及其受体酪氨酸激酶受体(ErbB2/4)表达,激活无翅型MMTV 整合位点家族成员(Wnt)通路,缓解病理性肥大,促进血管生成;可诱导骨骼肌及心肌FSTL1 表达,降低心肌胶原容积(CVF%),降低心肌纤维化,还可提高心肌心肌生长因子(MGF)表达水平,引起存活心肌生理性肥大,有效保护心脏功能(见表4)。
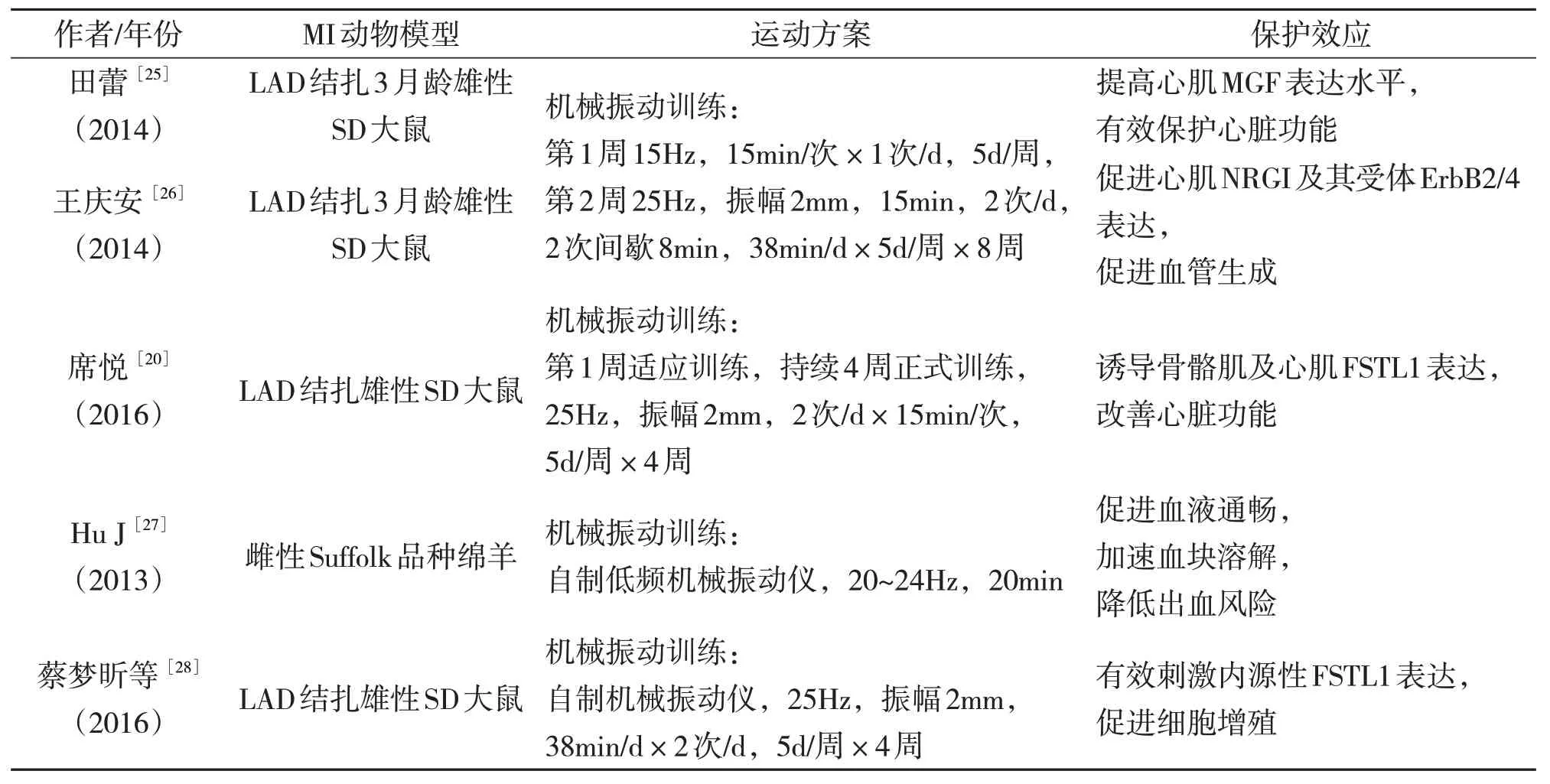
表4 机械振动干预MI动物模型的实验研究
2 运动对心梗心脏的保护作用机制
2.1 运动降低炎症反应的机制
运动锻炼具有抗炎效应,但其具体机制尚不清楚。现阶段研究认为,其可能机制主要包括以下方面。(1)减少内脏脂肪。运动可通过减少腹部和内脏脂肪含量,减少促炎性脂肪因子的分泌,如肿瘤坏死因子(TNF)、视黄醇结合蛋白(RBP)4、脂质运载蛋白2 等,降低系统性或低程度炎症[24]。(2)促进骨骼肌收缩时释放抗炎细胞因子。运动可刺激抗炎细胞因子如白细胞介素(IL)IL-1受体拮抗剂和IL-10水平增加,抑制促炎症因子TNF-α 释放[17]。(3)降低巨噬细胞Toll 样受体(TLR)表达[25],抑制炎性因子产生[26]。(4)激活迷走神经,降低淋巴结、肝脏、心脏等组织器官分泌炎性因子。运动可调节心脏自主神经活性,降低交感神经兴奋性[21],从而影响心梗患者预后。
2.2 运动抑制心肌细胞凋亡的机制
运动可通过调节相关凋亡因子,抑制心梗心肌细胞凋亡。研究表明,心肌细胞凋亡受多种因素影响,如缺血、缺氧刺激,细胞因子调控等。运动可使心脏形态结构产生良好适应,具体机制如下。(1)运动可显著提高AMP 激活蛋白激酶(AMPK)磷酸化水平,沉默信息调节因子2相关酶1(SIRT1)和过氧化物酶增殖激活受体γ 转录共激活因子-1α(PGC-1α)表达,下调半胱氨酸蛋白酶-3(Caspase-3)、Caspase-9表达和Bax/Bcl2比值,降低左心室原位末端标记(TUNEL)阳性细胞百分比,抑制心肌细胞凋亡[5]。(2)运动可通过激活PGC-1α和蛋白激酶B(Akt)信号通路,抑制小鼠心肌细胞凋亡[17]。(3)运动可减少ROS诱导的细胞色素C从心肌线粒体释放,增加线粒体抗氧化酶和HSP70表达,进而抑制心肌细胞凋亡[13]。(4)运动可上调锰超氧化物歧化酶(MnSOD)表达,改善ROS 清除系统[11]。适宜运动强度可抑制心肌细胞死亡率,在此过程中,各种细胞因子均发挥重要调控作用。
2.3 运动促进心肌细胞增殖的机制
运动中通过miRNA 表达,多种干细胞动员和多种细胞因子在心肌细胞增殖中起重要作用。(1)miRNA表达可促进心肌细胞增殖,运动可以调节miRNA的表达,急性或慢性运动可以引起其不同程度的变化[15]。(2)多种干细胞动员在心肌细胞增殖中具有重要作用。相关文献显示,长期的规律性运动可使MI患者的体内软骨祖细胞(CPC)数量增加,并提高其迁移能力,使后循环主干中CD34+/CD45+以CD133+/CD45 标记的干细胞数量增加[20]。(3)各种细胞因子和信号分子可以促进心肌细胞的增殖。研究表明,运动可以上调心肌中各种心肌细胞增殖因子的表达水平,如胰岛素样生长因子1(IGF-1)、成纤维生长因子1(FGF1)和NRG1[16],从而促进心肌肥大和肿瘤干细胞(CSCs)增殖。运动可有效动员干细胞和多种细胞因子,调控miRNA表达,在细胞增殖、心肌分化中发挥作用。
2.4 运动促进心肌血管再生的机制
运动可通过多种途径促进心肌血管再生。(1)运动通过增加血管的剪切应力,增强对血管生成的刺激。研究发现,在分子水平上,剪切应力和氧需求的增加会引起VEGF依赖性的血管生成。运动可通过Akt信号,促进心脏VEGF 表达和eNOS 磷酸化,激活血管生成信号,提高心肌血流灌注[14]。(2)运动训练通过调节神经功能,增加毛细血管密度和数量,改善血液循环和新陈代谢。长期有氧运动可显著降低交感神经兴奋性,减慢交感神经传导,促进周围血管扩张,促进内皮型eNOS mRNA表达和磷酸化增加,提高NO生物利用度,改善动脉弹性,使动脉血压降低。
3 结语
近年来,动物和临床实验及循证医学文献表明,运动干预作为重要手段可用于心血管疾病的预防与治疗。该文重点从间歇运动、持续有氧运动、抗阻运动和机械振动4 种运动方式入手,对近几年运动保护心梗心脏的相关文献进行整理分析,归纳总结不同强度运动方式对心梗心脏的保护效应,探索其具体机制,为今后运动训练在心血管疾病预防和康复应用方面提供一些思路与参考。

