N添加对西南亚高山红桦林根系分泌物及其介导的养分转化过程的影响
徐正刚许 航彭修涛梁时军刘 榕罗尚华肖 娟*
(1.西华师范大学环境科学与工程学院,南充 637000;2.四川省南充生态环境监测中心站,南充 637000)
在植物根系—土壤—微生物交互界面信息传输与能源转换过程中根系分泌物扮演着重要的角色,其在植物植株被动抵御、适应外部条件和调节土壤生物地球化学循环中有着很关键的意义和功能[1-3]。根系分泌物主要是从植株根部排出后进入根际环境中产生的可溶性有机物质,含有多糖、有机质以及次生代谢物等[1,4]。据估算,根系分泌物虽只占植物光合产物的5%~10%,但其通过增强微生物和胞外酶活性对温带森林土壤C/N 矿化过程的贡献却高达33%[5]。另外,由于根系生理和代谢活性对环境变化(增温、大气CO2浓度升高等)的响应极其敏感,这将不可避免地影响根系分泌物的数量和质量及其介导的一系列土壤关键生态过程[6-7]。因此,深入理解和探究全球环境变化对根系分泌物及其介导的地下土壤养分转换过程的影响已成为地下生态学领域关注的热点之一[5,8]。
近年来,大气氮(N)沉降速率的急剧变化对陆地森林地下C 分配格局及其土壤生物地球化学循环过程带来一系列深刻的影响[9-11]。随着大气N沉降的不断加剧,土壤N 养分状态的变化将直接影响森林根源C 输入的数量与质量,并深刻调控其所关联的根际土壤微生物活性和胞外酶特征,驱动根际区土壤养分动态过程的方向和速率发生改变[5,12],从而加剧根际土壤养分调控过程的复杂性和不可预知性。近年来,发表在《Nature》等国际顶尖刊物的研究均提出,未来地下生态学的研究重点应着眼于树木的生理视角,尤其是根系活动及其介导的根际养分动态过程的偶联效应[1,13-14],从而更深入地认识森林群落结构和生态功能对全球气候变化的反馈及养分调控机制。然而,受研究方法及森林地下生态过程模糊性的限制,目前关于地下根系生理过程介导的根际养分转化机制的研究仍较为欠缺,且在N 沉降条件下野外原位研究森林地下根系土壤生态养分转化过程也较少[6,15-16]。
红桦(Betula albosinensis)林在唐家河国家级自然保护区内主要分布于海拔1 200~2 400 m的低山和亚高山地区,其在水土保护、生态维持等方面有重要的生态学意义[17-19];是天然林(中山、亚高山)被破坏后次生林恢复的先锋树种,在森林生态植被更新与山体植物分布结构中占据重要地位[20]。目前关于红桦林的研究主要是在红桦地上生物量变化、林分组成及更新等方面[21],而对红桦林地下根系生态、土壤养分循环过程方面的相关研究还存在空白。本研究试验区域位于唐家河国家级自然保护区,青藏高原东南部边缘西南亚高山林区,为横断山脉北段向青藏高原的过渡地带,是我国成立最早的国家级自然保护区之一,也是“两屏三带”中“川滇生态屏障”的重要组成部分[22],是我国西南山地生物多样性的热点区域和举世闻名的动植物“基因库”,其森林覆盖的植被不仅有利于我国中西部区域生态保护和维持其生物多样性,也是研究全球森林生态系统对环境变化响应过程的热点区域[23]。
本研究从根际碳氮转化过程入手,围绕根系分泌物为中心,模拟大气N 沉降背景,聚焦于不同N处理下,红桦林根系分泌物C输入通量变化及其介导的根际土壤养分循环过程的响应,并同步分析与这些过程密切相关的土壤微生物和胞外酶活性,尝试探究不同N 处理下红桦林根系分泌物在生态系统尺度上的C 输入通量变化,阐明红桦林根系分泌物输入与土壤C-N 养分循环过程的偶联效应。本试验期望从根系—根际的这种特殊角度,丰富和提升该区域森林根际生态过程的调控机理及其生态反馈效应的认知水平,同时也为该区域在全球气候变化背景下的森林生态保护及生物多样性提供理论指导依据和科学参考。
1 材料与方法
1.1 试验区域概况
本试验区域位于四川省广元市青川县唐家河国家级自然保护区内(32°38′N,104°49′E),海拔2 164 m。本区域属亚热带湿润季风气候,全年温度变化大,不同海拔气温差异显著,夏季凉爽短促,冬季寒冷漫长,年平均温度12 ℃,年平均降水量1 021.7 mm,5—10 月降水较多且集中[24]。土壤垂直带谱发育完整,低海拔至高海拔土壤类型依次为黄壤、黄棕壤、暗棕壤和亚高山草甸土。植被的种类较为丰富,高等植物约1 988种,低等植物约434种,乔木层优势树种为糙皮红桦林,还有少量五尖槭(Acer maximowiczii)、疏花槭(A.laxiflorum)、华西枫杨(Pterocarya insignis)等;灌木以糙花箭竹(Fargesia scabrida)为优势种,常见有红花蔷薇(Rosa moyesii)、少花荚蒾(Viburnum oliganthum)、巨魁杜鹃(Rhododendron grande)等灌木;草本层以圆齿碎米荠(Cardamine baishanensis)和糙苏(Phlomis umbrosa)为优势种,其他常见物种有西南变豆菜(Sanicula chinensis)、丝叶薹草(Carex capilliformis)、山酢浆草(Oxalis acetosella)等[19,22]。
1.2 试验设计
1.2.1 样地布置
本研究团队于2017 年3 月在保护区内选择具有代表性的、群落结构和生长境况相近的红桦纯林,设置了3 个试验区(见图1,表1),每个试验区3个试验样方,共建立9个15 m×15 m的试验样方,邻近样方间距超过10 m。西南亚高山林区是典型的N沉降区,其大气总N沉降量7.55~12.48 kg·hm-2·a-1,最高可达26 kg·hm-2·a-1,根据西南地区N沉降临界值50 kg·hm-2·a-1[9,25],设定空白对照0 kg·hm-2·a-1(CK)、25 kg·hm-2·a-1(N25)、50 kg·hm-2·a-1(N50)3 个氮处理梯度,每个氮处理梯度设置3 个重复(见图1)。自2017年3月开始进行人工氮添加,在植物生长季(5—10 月)每月定期施氮1 次,根据不同的氮沉降设置量准确称取硝酸铵(分析纯NH4NO3≥99.0%)溶于12 L 水中均匀喷洒对应样地中,同时为保证不同施N 水平处理下林下各试验样方土壤水分状况一致,在对照组(CK)样地内喷洒等量的纯净水。

图1 试验样区设置Fig.1 Setting diagram of test sample area
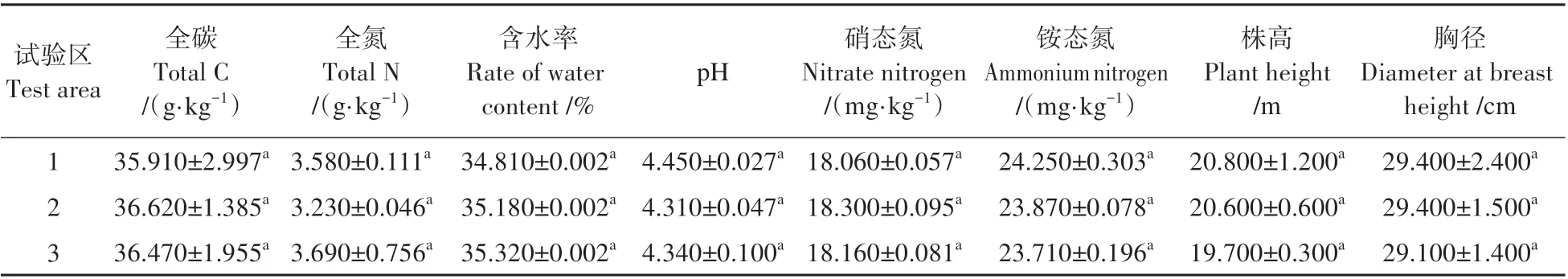
表1 红桦纯林土壤理化性质与样地基本信息Table 1 Soil physical and chemical properties and basic plot information(mean±SE,n=6)
1.2.2 根系分泌物收集
试验于2020 年6、8、10 月采用野外原位收集装置收集红桦根系分泌物[26]。收集方法主要步骤如下:(1)提前配制好无碳混合营养液(主要成分为NH4NO3、KH2PO4、K2SO4、MgSO4和CaCl2)[27]作为根系培养液以收集根系分泌物;(2)在红桦根部土壤挖寻未受损伤的完整活根(直径≤2 mm,长度10~15 cm),并用纯水小心清洗根表面附着的土壤,洗净后将根缓慢移入底部垫有棉花的玻璃针筒中,之后将无菌玻璃砂装入玻璃针筒使其完全覆盖根系(棉花、无菌玻璃砂经2 mol·L-1盐酸浸泡24 h),注入20 mL 营养液于玻璃装置中进行润洗并抽出,最后再注入20 mL营养液培养24 h;(3)培养完成后连续收集3 d 根系分泌物,当天完成收集并用0.22 μm 滤膜进行抽滤,然后放入-20 ℃冷冻保存待测。
1.2.3 根系分泌物C输入速率的测定
根系分泌物收集的最后一天将原位收集装置与根系一并低温保存带回,编号与装置标签对应,将根系用超纯水小心清洗后放入扫描仪中进行扫描,之后用WinRhizo 软件对扫描图像进行相关参数(根系根长、根面积等)分析,随后用烘箱在60 ℃下烘至恒质量得出其根系对应生物量。另外,将根系分泌物样品放入总有机碳(TOC)/总氮(TN)分析仪进行TOC 浓度测定。根据测定得到的根系分泌物TOC 浓度,结合每个根系对应的总的生物量、根长、表面积等参数定量计算红桦林单位根表面积根系C输入分泌速率(μg·cm-2·h-1)、单位根长根系C输入分泌速率(μg·cm-1·h-1)、单位细根生物量根系C 输入分泌速率(μg·g-1·h-1)。根系分泌物速率计算公式如下[28-29]:
1.2.4 根系分泌物C输入通量估算
采集土壤及土芯样品时,随机抽取样方内6个样点,将采样点位土壤表面的杂草与其他干扰物去除,然后利用3.5 cm 直径的土钻去钻取0~15 cm深的土芯样品,用自封袋装好混匀后带回并放于0~6 ℃条件下保存。依据根表皮颜色、形状等特点挑选红桦树活根(直径≤2 mm)并用纯水小心清洗表面杂质,随后放入烘箱在60 ℃下烘至恒质量得出其对应的红桦林生态系统水平上的细根生物量(g·m-2)。基于此,根据植物生长期内的单位面积根生物量、单位根生物量根系C 输入分泌速率和生长时间(统计分析唐家河近3 年平均冬季日均温并计算其连续5 d 滑动日均温大于5 ℃的时间[30],以此计算其生长期时间约为202 d),来计算红桦树根系分泌物年C 输入通量。其计算公式如下[28]:
1.2.5 土壤样品的采集与分析
在收集根系分泌物的过程中,随机选取样地中较为分散的几个点,寻找直接连接红桦树的鲜活根系,小心抖落采集细根表面附着的土壤(根际土),收集未附着于根表面或未受根系影响的土壤(非根际土)[29]。同时,用土钻(直径6 cm)采0~15 cm土层土样,每6钻土样混合均匀成一个样品,过2 mm筛后存入低温冰箱4 ℃保存,以测定土壤N 矿化、微生物生物量及相关酶活性指标。本研究选取β-D-葡糖糖苷酶(BG)、β-N-乙酰葡糖胺糖苷酶(NAG)、多酚氧化酶(PPO)和过氧化物酶(POD)这4 种与土壤C-N 循环过程密切相关的土壤胞外酶(EEAs)进行测定,并分析在不同N 添加水平下测定土壤胞外酶的根际效应的差异。①土壤N 矿化速率测定:取15 g新鲜土样装入200 mL三角瓶,加蒸馏水混合均匀并用保鲜膜封口,在20 ℃的恒温生物培养箱内恒温培养20 d,分别测定培养前和培养后的NH4+-N 和NO3--N 浓度,并计算净N 矿化速率,净N 矿化速率=[(培养后的NH4++NO3-)-(培养前的NH4++NO3-)]/培养时间。②采用氯仿熏蒸法测定微生物生物量C(MBC)的浓度[28,31]:取15 g 新鲜土壤样品置于50 mL 烧杯并用无醇氯仿对土壤进行熏蒸,同时称取等量的新鲜土壤作为对照,熏蒸完成后,分别加入50 mL K2SO4溶液(0.5 mol·L-1)并震荡过滤,吸取2.5 mL 并定容至50 mL,用总有机碳/氮分析仪测定TOC 含量,通过熏蒸与对照土壤的差值以及转换系数(Kec=0.45)计算土壤中MBC 浓度[28,32]。③土壤胞外酶活性测定:采用多孔板荧光光度法测定与根际土壤养分循环过程密切相关的4种胞外酶活性变化[33]。
1.3 根际效应计算
根际效应是植株通过脱落的细胞、根和菌根渗出物从根向土壤释放活性C 使得根际土壤理化性质发生变化的结果。根际效应计算是成对的根际和非根际土壤样品之间给定响应变量的百分比差异,分析其与零的统计差异(即正或负根际效应),以及对照和施肥处理之间的差异,计算公式如下[6]:
式中:Pre表示根际效应;Crs表示根际相关响应指标;Cbs表示非根际相关响应指标。
正的根际效应表明根际土壤中的C/N 矿化与微生物活性等相对于非根际土壤的大小有促进效果(Pre>0),而无根际效应(与零无显著差异)表明根际和非根际土壤之间的C/N 矿化与微生物活性等没有差异(Pre=0),负根际效应表明根际土壤中的C/N 矿化与微生物活性等相对于非根际土壤的大小有抑制效果(Pre<0)。
1.4 根系对土壤C/N矿化贡献率计算
目前关于根系对土壤转化的贡献率研究甚少,这也间接导致了对根系主要功能特性认知上的不足。所以,本试验通过对根际土壤体积和土壤相关的C-N 根际效应耦合分析,得出了根系对C-N 转化的相对作用。采用土钻收集法在样方0~15 cm 处采集了细根及土样,并通过后续的试验进行细根的形态参数分析,计算出其体积,最终确定根际土在根表面1 mm 处的面积,由此求出根际土在土壤中的比例,最终以根际土百分数乘以土壤C-N 矿化速度根际效应,最后得出根系对土壤C-N转化的贡献率。
1.5 相关数据处理及分析
使用IBM SPSS Statistics 26 对试验数据进行统计分析,采用单因素方差分析(One-way ANOVA)比较不同N 添加水平下红桦林根系分泌物C输入速率与年C 输入通量、土壤N 矿化速率、微生物生物量与胞外酶根际效应大小差异。采用重复测定方差分析(repeated measures ANOVA)对不同施N 水平、采样时间以及二者交互作用对根系分泌物C 输入通量的影响效应。此外,利用一元线性相关分析揭示不同N 处理下红桦林根系分泌C输入变化与根际土壤养分转化过程相关指标激发效应强度之间的生态偶联关系。本研究中所有图形制作利用Origin 2021软件绘制。
2 研究结果
2.1 不同N处理下根系分泌物C输入速率响应
试验结果表明,氮添加对红桦树单位根生物量、根长、根表面积根系分泌物输入速率有抑制作用,且随氮处理浓度的升高其抑制作用越显著。通过重复测量方差分析结果发现,N 添加对红桦林的单位根生物量速率、单位根长速率、单位根表面积速率均具有显著影响(P<0.05)(见表2),进一步表明红桦林的根系分泌物输入过程在N 添加下呈现出消极的响应;不同的采样时间对根系分泌物输入无显著影响,采样时间与氮添加交互作用对根系分泌物输入过程无显著性影响。具体地,低氮和高氮均会引起红桦树单位根生物量、根长和根表面积分泌速率的降低,其中,与对照相比,6月份3 种分泌速率(见图2)分别降低了9.33%、32.54%、45.70%和58.63%、34.44%、21.83%,8 月份分别降低31.79%、32.55%、41.60%和44.89%、54.21%、54.88%,10 月份分别降低3.49%、37.69%、35.03%和15.05%、45.39%、65.10%。

图2 不同水平N添加处理下根系分泌率差异A.单位根生物量根系分泌速率;B.单位根长根系分泌速率;C.单位根表面积根系分泌速率;不同小写字母表示同一采样时间不同施N 处理根系分泌物C 输入速率变化显著(P<0.05);CK.对照组;N25.低N组;N50.高N组Fig.2 Difference of root exudation rate under different levels of N addition A.Root exudation rate per unit root biomass;B.Root exudation rate per unit root length;C.Root exudation rate per unit root surface area;Different lowercase letters indicated that the C input rate of root exudation changed significantly at the same sampling time under different N treatments(P<0.05);CK.Control group;N25.Low N group;N50.High N Group

表2 N 添加和采样时间对红桦林分泌速率影响的重复测量方差分析Table 2 Repeated measurement analysis of variance on the effects of N addition and sampling time on the exudation rate of B.albosinensis Burk forest
2.2 N 处理下细根生物量和根系分泌物年C 输入通量响应
试验结果表明,根系分泌物年C 输入通量对于N 添加处理表现出消极的响应趋势。具体而言,红桦林的细根生物量在不同氮添加水平下存在显著差异(P<0.05)(见表3),红桦树CK、N25 氮倍增、N50 氮倍增试验组的细根生物量均值分别为136.730、90.190、57.720 g·m-2,较对照组相比,N25氮倍增下降了34.03%(P<0.05),N50氮倍增下降了57.78%(P<0.05);对照、N25、N50 处理下,红桦树根系分泌物年C 输入通量均值分别为70.448、38.742、18.777 g·m-2·a-1,N25、N50 施N 处理后其根系分泌物年C 输入通量分别降低了45.01%(P<0.05)和51.53%(P<0.05)。

表3 红桦林根系分泌物C输入通量对N添加的响应差异Table 3 Differences in response of C input fluxes of root exudates to N addition in B.albosinensis Burk forest
2.3 N处理对根际N矿化速率根际效应的影响
试验结果表明,红桦林的N转化过程对于各N添加处理表现出不同的响应趋势。在生长期内,N25 氮倍增和N50 氮倍增均显著抑制了红桦林的N 矿化速率根际效应值,相比空白对照处理(110.62%),N25 氮倍增的降幅达 13.88%(P<0.05),N50 氮倍增的降幅达到27.04%(P<0.05)。具体地,N25 氮倍增和N50 氮倍增均引起红桦林N矿化根际效应值的降低(见图3),其中,与对照相比,6 月份分别降低了19.79%和34.00%(P<0.05),8 月份分别降低13.51%和27.40%(P<0.05),10 月份分别降低8.78%和19.68%(P<0.05)。
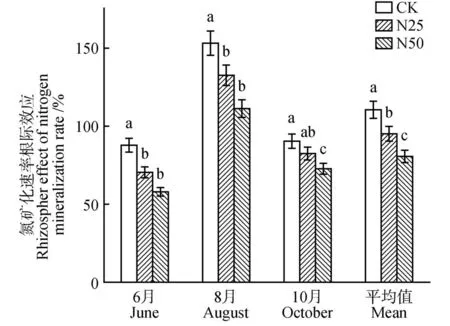
图3 不同施N处理对土壤N矿化速率根际效应的影响Fig.3 Rhizosphere effects of different N additions on soil N mineralization rate
基于根际土壤体积并耦合土壤N 矿化根际效应得到的根系对于土壤N 转化的相对贡献。如表4 所示,对照处理下,红桦树根系对土壤N 矿化的贡献率为7.44%,而N25 氮添加处理下,根系对土壤N 矿化的贡献率为4.94%,较对照处理显著降低了33.59%(P<0.05);N50 氮添加处理下,根系对土壤N 矿化的贡献率为3.00%,较对照处理显著降低了59.67%(P<0.05)。
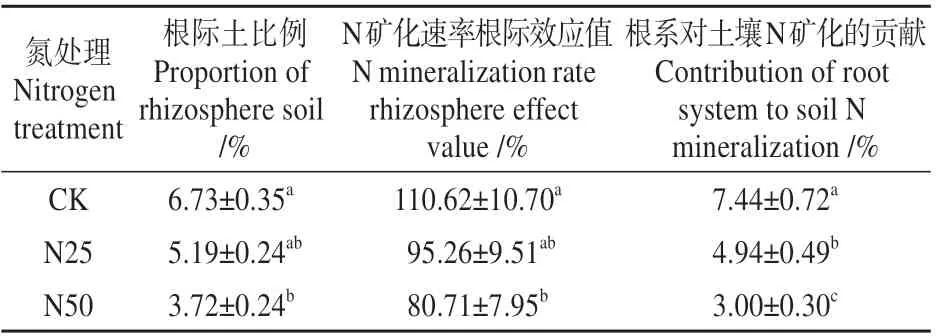
表4 不同N 处理下红桦林N 矿化速率根际效应和根系对土壤N矿化的贡献评估Table 4 Rhizosphere effect of N mineralization rate ofB.albosinensis Burk forest under different N treatments and evaluation of contribution of roots to soil N mineralization
为区分N 添加和采样时间及其交互作用对红桦林根际土壤N 转化过程的影响差异,对其进行了重复测量方差分析。分析结果表明,N 添加对红桦林根际N 矿化速率具有显著影响(P<0.05)(见表5),不同采样时间对土壤N 矿化速率无明显影响,氮添加和采样时间的交互作用对土壤氮矿化速率亦无明显影响。

表5 不同红桦林样地根际土壤N 矿化与N 添加和采样时间重复测量方差分析Table 5 Variance analysis of N mineralization,N addition and repeated measurement of sampling time in rhizosphere soil of different B.albosinensissample plots
2.4 土壤微生物量根际效应对不同水平N 添加处理的差异化响应
试验结果表明,与对照相比,施N 处理下红桦林的土壤MBC 和MBN 根际效应表现出降低的响应趋势。在生长期内,N25氮倍增和N50氮倍增均显著降低了红桦林的MBC 根际效应值,且抑制作用随着N 添加浓度的增大而增强,与对照处理(93.86%)相比,N25 氮倍增的降幅达33.14%(P<0.05),N50氮倍增的降幅达50.53%(P<0.05)(见图4A)。类似地,N25 氮倍增和N50 氮倍增均显著降低了红桦林的MBN 根际效应值,与对照处理(97.58%)相比,N25氮倍增的降幅达30.38%(P<0.05),N50氮倍增的降幅达34.80%(P<0.05)(见图4B)。

图4 不同施N处理对土壤微生物生物量C根际效应(A)、土壤微生物生物量N根际效应(B)大小的影响Fig.4 Effects of different N application treatments on the magnitude of rhizosphere effect of soil microbial biomass C(A)and rhizosphere effect of soil microbial biomass N(B)
2.5 土壤胞外酶根际效应对不同水平N 添加处理的差异化响应
整体而言,红桦林土壤BG、NAG 酶活性高峰期出现在8 月,PPO 和POD 酶活性高峰期出现在6月。红桦林根际土壤4 种胞外酶活动均高于非根际土,表明根系活动诱导了胞外酶的正根际效应。且与前面土壤C-N转化微生物过程参数类似,N处理下均显著抑制土壤胞外酶的根际效应值(P<0.05),且其降低幅度随N处理浓度升高而增加(见图5)。

图5 不同施N处理对β-D-葡萄糖苷酶(A)、β-N-乙酰葡糖胺糖苷酶(B)、多酚氧化酶(C)、过氧化物酶(D)根际效应大小的影响Fig.5 Effects of different N treatments on the size of rhizosphere effect of β-D-glucosidase(A),β-N-acetylglucosaminidase(B),polyphenol oxidase(C)and peroxidase(D)
具体而言,N25氮倍增和N50氮倍增均显著降低了红桦林的BG 酶、NAG 酶、PPO 酶根际效应值,与对照处理相比,N25 氮倍增的降幅分别达到了23.72%(P<0.05)、18.66%(P<0.05)、23.19%(P<0.05)(见图5),N50 氮倍增的降幅分别达到了28.36%(P<0.05)、38.29%(P<0.05)、38.36%(P<0.05)(见图5)。与对照相比,低N 使POD 根际效应平均值增加了14.87%,高N 处理使POD 根际效应平均值降低了9.84%(见图5D)。整体而言,高N 处理下4 种胞外酶根际效应值降幅是低N 处理的1~2 倍,表明高N 添加对根际土壤胞外酶活性的抑制效果更明显。
2.6根系分泌物分泌速率—土壤相关酶活性特征—土壤C/N转化过程的偶联效应
对红桦林的根系分泌物输入速率—土壤C/N转化过程—土壤相关酶活性进行线性拟合分析,结果表明根系分泌物输入速率与土壤C/N 矿化速率、MBC、MBN、3 种酶(BG 酶、NAG 酶、PPO 酶)存在显著的正相关关系,但POD 酶根际效应与其呈负相关关系。具体如图6所示(每个点对应的数据是样地中样树的数据),单位根生物量根系分泌物输入速率的增加时,土壤N 矿化速率(R2=0.532 1,P<0.001)(见图6A)和C 矿化速率(R2=0.872 2,P<0.001)(见图6B)根际效应均呈现显著增加的趋势。单位根生物量根系分泌物输入速率的增加时,MBC(R2=0.260 5,P=0.006)(见图6C)、MBN(R2=0.000 8,P=0.029)(见图6D)、PPO 酶(R2=0.115 2,P<0.001)(见图6E)、NAG 酶(R2=0.848 7,P<0.001)(见图6F)、BG 酶(R2=0.532 1,P<0.001)(见图6H)根际效应均呈现显著增加的趋势,而POD 酶(R2=0.089,P<0.001)(见图6G)根际效应呈下降的趋势。

图6 根系分泌物输入—土壤C/N转化—土壤酶活性特征的相关性A.N矿化;B.C矿化;C.微生物C;D.微生物N;E.多酚氧化酶;F.β-N-乙酰葡糖胺糖苷酶;G.过氧化物酶;H.β-D-葡萄糖苷酶Fig.6 Correlation analysis of root exudates input soil C/N conversion soil enzyme activity characteristics A.N mineralization;B.C Mineralization;C.Microbial C;D.Microbial N;E.Polyphenol oxidase;F.β-N-acetylglucosaminidase;G.Peroxidase;H.β-D-glucosidase
3 分析与讨论
3.1 根系分泌物C 输入速率对不同施N 水平的差异化响应
根系分泌物是植物释放到土壤中刺激微生物活性加快养分矿化的关键活性物质,其数量和质量受到多种生物和非生物因素的综合调控[34-38]。外部环境变化诱发的根源活性C 输入的改变将不可避免的影响根际C—养分循环过程,这也是植物在长期适应环境过程中形成的一种重要的生理适应机制[39-40]。在本研究中,N 添加显著降低了根系分泌物输入速率,且在高水平N 添加下对根系分泌速率的抑制作用更强(见图2)。根据已有的文献,我们推测N 添加下根源C 输入降低的原因可能归因于土壤N 素有效性的增加和植物生理过程的改变[36]。一方面,基于N 限制理论,土壤氮素有效性和植物氮素限制状的平衡对根系分泌物C 输入量的影响较为突出[37]。特别是对于本研究区域这种N 受限的生态系统,外源N 输入,特别是高N输入水平,可以极大地缓解植物的N 限制程度,从而导致植物急剧减少根源C 的投入转而投资地上部分的构建,相应的降低根系分泌速率。以往的类似研究也发现,植物接收到外源N 输入后会相应减少根系分泌物输入,因为植物可以直接从土壤获取有效N,而不是增加根系C投资成本来提高土壤N 矿化能力[38]。另一方面,植物光合能力,尤其是光合作用相关酶的活性和浓度,对N 添加以及添加量有不同的响应[39],可以积极或消极地影响光合产物C 的地下分配(如根系生物量和根系分泌物)[40]。因此,与低N 添加量相比,高N 添加下根系分泌物输入量显著减少,可能与高N 输入后红桦的生理反应较为灵敏和迅速有关。
3.2 N处理对红桦林根系分泌物年C输入通量影响
在本研究中,N 添加对红桦的根系分泌物年C通量具有显著的负效应,而且这种抑制效应在高N 添加水平下表现得更加强烈(见表3)。这与前人在草地和高寒灌丛中的研究结果[28,41]一致。根据根系分泌物年C通量的计算方法,这一结果与N添加后细根生物量和根系分泌物C 输入速率的降低密切相关。红桦林土壤N 限制状态在外源N 输入后得到一定程度的缓解,直接改变了植物体内光合产物C 的地上—地下分配模式,一方面减少了单位面积内的细根生物量(见表3),取而代之的可能是增加了用于有效N 直接获取的比根长和比表面积;另一方面显著降低了根系分泌物C 输入量(见图2),而将更多地光合产物用于植物地上部分的构建。此外,需要说明的是,由于本研究仅测定了一个树种在生长季3 个时间点的根系分泌物输入速率,而且未考虑植物在不同土壤深度可能选择的不同的根源C 投入模式[42],所以,考虑到不同树种间以及不同土层间根系分泌速率及其对N添加的响应趋势存在的不确定性,这可能对评估N 沉降背景下森林根系分泌物年C 输入通量变化的准确性产生一定影响。此外,在未来的研究工作中应加强N 沉降下多个树种、不同土壤深度以及多时间点的根系分泌物输入特征的系统性采样和联网研究来提高结果的普适性。
3.3 根系分泌物C 输入与根际土壤微生物过程的偶联效应对N添加的响应
根系分泌物作为主要的C 源和关键驱动因子促使根际土壤C—养分循环过程表现出与非根际截然不同的强度,而根际展现出的这种效应强度可以用根际效应来形象的表示和衡量[43]。长期以来,众多国内外学者对根系—土壤—微生物互作过程及其核心驱动力进行了深入研究,根系分泌物的桥梁和纽带作用也不断得到验证[44]。在本研究中,我们发现在施氮肥和对照处理下,红桦林土壤N 转化微生物过程均表现出积极的根际效应,表明根际土壤C-N 转化过程受根系分泌物的调控作用,根系分泌物输入对土壤微生物过程存在一定的增强作用。这一方面证实了根系—土壤—微生物之间的偶联效应,也进一步验证了根系分泌物在驱动森林根际土壤C-N 转化过程的中心地位。基于相关性分析结果表明,红桦林根系分泌物C 输入速率与土壤MBC/MBN、胞外酶活性及其诱导的N 矿化速率的根际效应均表现出正相关关系。以往的研究表明,根系活动对土壤生态过程的调控受到外源N 输入的强烈影响,而且影响幅度与N 添加水平密切相关。N 添加后根系分泌物C 输入的降低直接抑制了土壤微生物与胞外酶活性,从而诱导了较低的根际土壤N 转化过程激发效应强度(见图3)。植物在长期进化过程中建立了一种最优的经济策略,即植物通过调节光合固定C对根系分泌物的分配(即C成本),以促进土壤有机质的分解和提高土壤有限养分的获取(即养分效益)[45-46]。N 处理后,土壤有效N 增加使得土壤N 养分限制状况解除,植株对土壤养分转化的微生物依赖驱动降低。这种环境下,红桦林根系分泌物向地下C 输入减少,同时根际土壤及微生物相关酶等生理活动减慢,以使植物自身生长效益达到最优。以往学者的研究中有证实这种理论模型:当土壤N 素养分充盈时,植物改变新鲜有机物的输入量,从而改变土壤可用性碳含量,影响微生物活性,进一步调节根际碳流动与土壤中碳周转过程和自身资源分配[47]。
4 结论
外源N 添加后显著降低了红桦林根系分泌物C输入通量,并抑制了根际土壤微生物胞外酶活性及其关联的土壤N 转化过程,并且这种抑制效应随着N 添加水平的增加而增强。这一现象主要归因于外源N 添加显著提高了土壤N 养分有效性,使得该区域森林生长的养分限制得到一定程度的缓解。相应地,根系分泌物作为一种C 源和能源投入,红桦树在养分得到有效缓解时,通过自身生理机制调节降低地下C 投入成本,即N 沉降条件下红桦林适时地更变“低C 投入—低N 收益”的养分获取策略以保证最优的生长适应策略。

