通窍活血汤对创伤性脑损伤大鼠HMGB1、IL-6的影响*
张晓宁,张高炼,高玉广,梁炜斌,郭建辉,曾敬,陈锐,陈云鹏
广西中医药大学第一附属医院,广西 南宁 530023
创伤性脑外伤(traumatic brain injury,TBI)是神经外科常见的急危重症[1],是导致死亡和永久性残疾的主要原因之一。目前,创伤性脑外伤的治疗主要以手术为主,经过治疗后,患者的生命得以救治,但是大多数患者都会留下后遗症,如偏瘫、继发性癫痫、头痛等,甚至生活不能自理,因此,研究其发病机制和治疗靶点对新药开发、针对性治疗、提高患者生存率至关重要。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种新型促炎性细胞因子,为真核细胞核内的一种高度保守的非组蛋白,具有调节基因转录、稳固胞核结构、介导炎症反应等生物学功能,为炎症反应的关键调控分子。研究表明,HMGB1通过介导炎症反应调控炎性因子白细胞介素-6(interleukin-6,IL-6)[2-3],影响创伤性脑损伤的发生发展过程。基于此,本文拟通过动物实验观察通窍活血汤对创伤性脑损伤大鼠HMGB1、IL-6的影响,以期为创伤性脑损伤的治疗靶点和新药开发提供思路。
1 材料
1.1 动物90只18周龄健康雄性无特定病原体(specific pathogen free,SPF)的SD大鼠自长沙市天勤生物技术有限公司购买,许可证号:SCXK(湘)2019-001。动物饲养温度20~25 ℃,相对湿度50%~65%,12 h光照、12 h黑暗昼夜变化周期。动物实验经广西中医药大学伦理委员会批准,伦理批号:DW20201011-7。实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2 药物及试剂依达拉奉注射液(规格:20 mL:30 mg,国药集团国瑞药业有限公司,国药准字:H20080056)。TUNEL试剂盒(瑞士ROCHE公司,货号:116848202010);HMGB1 ELISA试剂盒(Arigo Biolaboratories公司,货号:ARG81351);IL-6 ELISA试剂盒(武汉赛培生物科技有限公司,货号:SP12279)。
1.3 仪器脑立体定位仪(成都仪器厂,型号:ST-4ND);电子分析天平(奥豪斯仪器常州有限公司,型号:AR224CN);高速低温组织研磨仪(武汉赛维尔生物科技有限公司,型号:KZ-III-F)。
2 方法
2.1 药物制备通窍活血汤组方中药(丹参 30 g,红花、川芎、生姜、菊花、牛膝、天麻各10 g,生地黄、赤芍、桃仁、柴胡、枳壳、郁金各15 g,甘草6 g,葱白、大枣各5 g,石菖蒲20 g)由广西中医药大学第一附属医院中药房代煎,每剂煎得药液150 mL。药物根据《现代医学实验动物学》进行换算,通窍活血汤低、中、高剂量组大鼠灌胃浓度分别相当于成人等效剂量的1倍、2倍、4倍,根据大鼠灌胃体积 10 mL·kg-1将通窍活血汤配成浓度为2.25 g·mL-1、4.5 g·mL-1、9 g·mL-1(生药量)的溶液。
2.2 创伤性脑损伤大鼠模型制备采用改良的Feeney′s重物自由落体撞击法建立创伤性脑损伤大鼠模型[4],具体如下:大鼠于术前禁食禁水8 h后,以2 mL·kg-1的体积腹腔注射2%戊巴比妥钠溶液进行麻醉后,对大鼠头部进行剃毛,并固定于立体定位仪上,用碘伏消毒大鼠头部,沿头顶中线纵行切开皮肤全层(长度为2.0~3.0 cm)。将颅骨表面皮下组织与骨膜推向两侧后,在大鼠人字缝与冠状缝连线的中线及矢状缝右侧磨开骨质缺损区(直径 5 mm),操作中注意保持硬脑膜的完整性,调整50 g打击砝码的下落位置,使其与大鼠头部骨质缺损区重合,并升高至20 cm处后,打击砝码沿外周导管自由坠落,打击撞杆从而撞击大脑硬膜,使大鼠右侧顶叶重度挫裂伤。最后将大鼠转移至恒温板上,使用明胶海绵及骨蜡封闭颅骨缺损及手术区,用线缝合头皮并使用碘伏消毒。
2.3 动物分组及给药采用SPSS 23.0产生的随机序列对实验动物进行分组,首先将大鼠随机分为空白组(n=15)和造模组(n=75),空白组大鼠不予任何处理,而造模组大鼠按2.2项所述方法制备创伤性脑损伤模型。造模完成后,采用SPSS 23.0产生的随机序列将造模组大鼠分为模型组、通窍活血汤高剂量组、通窍活血汤中剂量组、通窍活血汤低剂量组及依达拉奉组,每组15只。分组完成以后进行药物干预,通窍活血汤低剂量组、通窍活血汤中剂量组、通窍活血汤高剂量组大鼠的灌胃浓度分别为2.25 g·mL-1、4.5 g·mL-1、9.0 g·mL-1(生药量),依达拉奉组灌胃给予依达拉奉注射液,空白组和模型组灌胃给予生理盐水,每日2次,灌胃体积为 10 mL·kg-1,连续干预7 d。
2.4 大鼠神经功能评分本研究使用 改良的Garcia JH(mGarcia JH)评分来反映创伤性脑损伤后大鼠的行为变化及神经功能损伤程度。mGarcia JH评分从大鼠自主运动、体态对称性、前肢伸展功能、攀爬运动、身体双侧触觉、双侧胡须碰触反应6个方面进行评估,分值为3~18分,数值越大,神经功能损伤越轻,18分为正常。选取3次重复检测而得的平均分,每次检测应间隔至少5 min。
2.5 ELISA法检测脑组织HMGB1、IL-6的水平取部分脑组织匀浆后根据ELISA试剂盒说明书进行操作,于波长490 nm处分别测定各孔的吸光度值,采用GraphPad Prism4.0软件计算HMGB1、IL-6的水平。
2.6 TUNEL染色检测大脑皮质神经细胞凋亡情况根据TUNEL染色试剂盒说明书的程序完成操作步骤,切片准备完毕后,随机选取大鼠受伤脑组织部位,显微镜观察细胞凋亡情况,同时计算细胞凋亡率。
2.7 HE染色观察脑组织病理变化从储存冰箱中取出大鼠的脑组织标本,在分析天平上分别称取100 mg,采用甲醛进行固定,然后修剪、脱水、透明,采用石蜡对组织进行包埋,制成5μm厚度的切片,然后展片、脱蜡至水、染色,在荧光显微镜下对比观察大鼠大脑组织病变情况。
2.8 湿干比法测定脑水肿含量麻醉并处死大鼠后,打开颅骨,取各只大鼠相同部位的部分脑组织,用滤纸吸干表面水分后,立即称其质量即为脑组织湿质量。将称量过的脑组织标本放置在70 ℃烘干箱中高温72 h直至恒质量,称其质量得到干质量,计算湿干比评估大鼠脑组织含水量。

3 结果
3.1 各组大鼠神经功能评分比较与空白组比较,模型组大鼠的 mGarcia JH评分显著降低(P<0.05);与模型组比较,各给药组大鼠的mGarcia JH评分显著升高(P<0.05);与通窍活血汤低剂量组比较,通窍活血汤高、中剂量组及依达拉奉组大鼠的mGarcia JH评分显著升高(P<0.05)。见表1。

表1 各组大鼠神经功能评分比较
3.2 各组大鼠脑组织HMGB1、IL-6水平比较与空白组比较,模型组大鼠脑组织HMGB1、IL-6水平显著升高(P<0.05);与模型组比较,各给药组大鼠脑组织HMGB1、IL-6水平显著降低(P<0.05);与通窍活血汤低剂量组比较,通窍活血汤高、中剂量组及依达拉奉组大鼠脑组织HMGB1、IL-6 水平显著降低(P<0.05)。见表2。

表2 各组大鼠脑组织HMGB1、IL-6水平比较
3.3 各组大鼠大脑皮质神经细胞凋亡水平比较与空白组比较,模型组大鼠神经凋亡细胞数量显著升高(P<0.05);与模型组比较,各给药组大鼠神经凋亡细胞数量显著降低(P<0.05);与通窍活血汤低剂量组比较,通窍活血汤高、中剂量组及依达拉奉组大鼠神经凋亡细胞数量显著降低(P<0.05)。见表3,图1。

表3 各组大鼠大脑皮质神经细胞凋亡水平比较
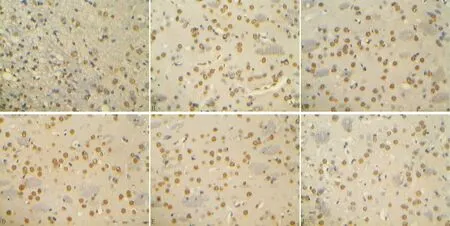
注:A:空白组;B:模型组;C:通窍活血汤高剂量组;D:通窍活血汤中剂量组;E:通窍活血汤低剂量组;F:依达拉奉组图1 各组大鼠大脑皮质神经细胞凋亡水平比较(TUNEL染色,×100)
3.4 各组大鼠脑组织病理变化比较HE染色显示:空白组可见清晰的细胞膜和细胞核,未见明显细胞坏死及增生等情况发生;模型组脑组织的血肿周围呈充血肿胀,出血,细胞坏死,有胶质细胞增生;通窍活血汤中剂量和依达拉奉组脑组织血肿、出血的范围及胶质细胞增生数量等明显减少。见图2。

注:A:空白组;B:模型组;C:通窍活血汤高剂量组;D:通窍活血汤中剂量组;E:通窍活血汤低剂量组;F:依达拉奉组图2 各组大鼠脑组织病理变化比较(HE染色,×100)
3.5 各组大鼠脑组织含水量比较与空白组比较,模型组大鼠脑组织含水量显著升高(P<0.05);与模型组比较,各给药组大鼠脑组织含水量显著降低(P<0.05);与通窍活血汤低剂量组比较,通窍活血汤高、中剂量组及依达拉奉组大鼠脑组织含水量显著降低(P<0.05)。见表4。

表4 各组大鼠脑组织含水量比较
4 讨论
TBI的特征是损伤部位的持续性神经炎性反应,最终导致广泛的神经元死亡[5]。HMGB1是创伤性脑损伤后释放的最早的促炎细胞因子之一,是神经炎症的主开关[6]。HMGB1是一种位于细胞核中的染色质相关蛋白,是高度保守的非组蛋白DNA结合蛋白,可在生理条件下稳定染色质结构、控制转录和DNA 修复[7]。但是,在病理条件下,HMGB1可损伤相关分子蛋白。HMGB1由坏死神经元和募集到损伤部位的其他免疫细胞在细胞外释放,然后与相应的靶受体结合,从而上调包括HMGB1在内的其他促炎细胞因子的释放[8]。一旦HMGB1被释放到细胞外,它就会成为一种重要的促炎因子[9]。鉴于HMGB1在介导神经炎症和神经发生中的双重作用,它有望成为治疗TBI的潜在靶点。Gao等[10]通过脑损伤大鼠实验发现,甘草素通过调节小胶质细胞/巨噬细胞的激活来减轻TBI,该作用至少部分是通过抑制HMGB1实现的。因此,靶向HMGB1以调节小胶质细胞/巨噬细胞极化应该是TBI 的一种潜在治疗方法。Yang等[11]研究了HMGB1 A-box片段(一种与全长HMGB1竞争受体结合的拮抗剂)对抗TBI的治疗效果发现,HMGB1 A-box可逆转TBI后小鼠的脑损伤,还可通过保护血脑屏障的完整性,改善细胞变性,减少TBI后受损脑组织促炎细胞因子的释放,显著减轻脑水肿,因此,HMGB1 A-box片段可能具有治疗TBI继发性脑损伤的潜力。从中药甘草中分离得到的甘草甜素治疗TBI模型小鼠发现,其可抑制TBI小鼠中HMGB1的水平,从而降低脑水肿[12]。
脑外伤患者的脑脊液中存在高水平的IL-6 和可溶性IL-6 受体。为应对损伤,IL-6 充当创伤后炎症发生和发展的重要介质,进一步导致细胞死亡和神经功能障碍。中枢神经系统中IL-6 的过度产生会增加炎性细胞因子的产生,当中枢神经系统失调时,IL-6 可能具有促炎作用,因此IL-6可能是治疗干预脑损伤的靶点[13]。吡格列酮是过氧化物酶体增殖物激活的受体-γ的激活剂,可改善TBI后大鼠的神经损伤,减轻脑水肿,并且吡格列酮的保护作用是通过调控PPARγ/NF-κB/IL-6信号通路来实现的[14]。Hergenroeder 等[15]对比健康志愿者和严重 TBI 患者血清中炎性细胞因子的水平发现,血清IL-6可用于TBI中升高的颅内压的鉴别诊断。Aisiku 等[16]发现,血浆细胞因子IL-6与严重颅脑外伤患者的急性呼吸窘迫综合征有关。去甲肾上腺素可通过阻断ERK、MAPK和IL-6对幼猪的脑损伤发挥脑部自动调节功能改善的作用,并减少海马坏死[17-18]。
中医古籍中没有对创伤性脑损伤的明确描述,大部分医家根据创伤性脑损伤后出现的学习认知能力、记忆能力、情感障碍等把其归属于中医的“头痛”“头部内伤”等范畴。临床上病人头部外伤后多呈现明显头痛,故而医者认为本病病机主要为跌扑闪挫、头部外伤,气血滞涩,瘀血阻于脑络,其代表性方药常选用通窍活血汤,此方活血化瘀、通窍止痛,临床效果确切。
通窍活血汤由清代医家王清任所创,原记载于《医林改错》,是活血化瘀的名方、验方,其方选丹参、赤芍、川芎行血活血,桃仁、红花活血化瘀,生地黄、当归生血养血,葱白、生姜通阳散结,牛膝活血且可导瘀下行,柴胡疏肝解郁,枳壳行气,菊花清热且可载药上达,甘草、大枣益气和中。通窍活血汤治疗脑组织及脑血管疾病方面的临床及实验研究广泛,为创伤性脑损伤的临床治疗及动物实验提供了良好的基础。刘昌亚等[19]研究通窍活血汤对动脉瘤破裂蛛网膜下腔出血的患者早期脑损伤的作用发现,加用通窍活血汤患者比单纯动脉瘤栓塞治疗的患者血清细胞内黏附分子-1、IL-1β的水平更低。安聪[20]发现,通窍活血汤对重型颅脑损伤大鼠急性期的神经损伤有一定的治疗效果,其作用可能是通过降低IL-6的含量,从而减轻继发性炎症反应实现的。金正龙等[21]发现,采用通窍活血汤联合丁苯酞治疗的老年慢性脑缺血患者的HMGB1水平显著低于单纯丁苯酞治疗患者。以上研究从炎症反应角度说明了通窍活血汤对脑损伤相关性疾病的作用。此外,也有研究发现,通窍活血汤能降低脑缺血再灌注损伤小鼠脑中伊文思蓝的含量,提高脑损伤后单胺类神经递质的水平,对脑缺血再灌注模型小鼠神经功能有一定的保护作用[22]。通窍活血汤还可通过激活PI3K/AKt/mTOR通路抑制脑缺血损伤后大鼠的神经细胞自噬,发挥神经保护的作用[23]。薛广团等[24]对中重度创伤性脑损伤患者在对症治疗基础上增加针灸和通窍活血汤加味治疗,为期8周,用格拉斯哥昏迷评分、残疾分级评分、日常生活能力评分和格拉斯哥预后评分比较临床疗效发现,增加针灸和通窍活血汤加味组患者的相关评分和有效率更佳。本研究采用通窍活血汤治疗脑外伤大鼠发现,通窍活血汤组大鼠的神经功能评分显著升高,HMGB1、IL-6含量、神经细胞凋亡数量、脑组织含水量显著降低,提示通窍活血汤可通过降低HMGB1、IL-6的含量,减少神经细胞凋亡和脑组织含水量,促进创伤性脑损伤的神经恢复。
综上所述,通窍活血汤可以降低HMGB1、IL-6的含量,减少神经细胞凋亡和脑组织含水量,促进创伤性脑损伤的神经恢复。本研究存在一定的局限性,尚缺乏相关机制研究,后续需要通过细胞学、动物学方面的实验研究阐明相关机制。

