半枝莲乙醇提取物对高低转移性肝细胞癌细胞生长和侵袭的影响*
王倩,陈亭亭,王守梅,张树辉
上海中医药大学附属岳阳中西医结合医院,上海 200437
原发性肝癌是我国第4位常见恶性肿瘤及第2位致死肿瘤,严重威胁人民的生命安全和健康,其中75%~85%原发性肝癌为肝细胞癌(hepatocellular carcinoma,HCC),常由慢性乙型或丙型肝炎病毒感染所致[1]。大多数HCC在中晚期才被确诊,选择合理和规范化的多学科综合治疗可获得最佳疗效[2]。肝癌以气血亏虚为本,肝失疏泄为基本病机,气血湿热瘀毒互结为标,蕴结于肝,渐成症积,HCC不同病期分别采用疏肝理气、活血化瘀、清热解毒等扶正祛邪、标本兼治的辨证论治法恢复肝主疏泄之功能,使气血流畅,祛湿热瘀毒之邪,对控制症状、提高免疫力、预防复发转移及提高生存质量等优势明显。以往研究显示,清热解毒药半枝莲在原发性肝癌的治疗中使用频率较高[3-5]。半枝莲为唇形科黄芩属植物半枝莲的全草,具有清热解毒、散肿消痈等功效。药理学及临床研究表明,半枝莲及其活性成分具有良好的抗肿瘤作用,常用于肺癌、乳腺癌、胃癌、肝癌、结直肠癌等恶性肿瘤的治疗[6-9]。本研究采用高、低转移性HCC细胞系MHCC-97H和MHCC-97L探究半枝莲乙醇提取物对细胞增殖、迁移和侵袭的抑制作用,并分析其作用机制。
1 材料
1.1 动物及细胞株SPF级4周龄雄性BALB/c裸鼠16只,体质量18~20 g,购自上海西普尔-必凯实验动物有限公司,动物生产许可证号:20180003007216。所有小鼠均饲养于恒温(25±2) ℃,湿度50%~ 60%的SPF环境中,高压灭菌后的水和饲料随意进食。所有实验方案均按照实验动物治疗和使用委员会的指南进行,并获得上海中医药大学附属岳阳中西医结合医院伦理委员会批准,伦理批准号:YYLAC-2019-036-4-2。人高、低转移性HCC细胞株MHCC-97H和MHCC-97L购自北京北纳创联生物技术研究院。
1.2 试剂半枝莲(产地:浙江,上海中医药大学附属岳阳中西医结合医院药剂科,货号:0306901);5-氟尿嘧啶(美国MCE公司,货号:HY-90006,规格:1 g/瓶);DMEM高糖型培养基(美国Hyclone公司,货号:SH30243.01);胎牛血清(美国GIBCO公司,货号:16000-044);青链霉素混合液、结晶紫、RNase A(北京索莱宝科技有限公司,货号:P1400-100、C8470、R8020-25);CCK-8 试剂盒(美国Signalway Antibody公司,货号:CP002);BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司,货号:PICPI23223);PI染液(上海七海复泰生物科技有限公司,货号:C001-200);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,货号:C1063);CD133、EpCAM抗体(美国Invitrogen公司,货号:11-1339-42、A15782);CycinD1、P27抗体(美国Cell Signaling Technology公司,货号:2922、3686);Bcl-2、Bax、Ki-67抗体(英国Abcam公司,货号:Ab194583、Ab32503、Ab209897);E-cadherin、GAPDH抗体(美国Proteintech公司,货号:20874-1-AP、60004-1-Ig);Vimentin抗体(英国Affinity公司,货号:AF0292);二抗(上海誉源有限公司,货号:70678)。
1.3 仪器精密电子天平(德国Sartorius公司,型号:CP225D);高速离心机(上海卢湘仪离心机仪器有限公司,型号:TDZ4-WS);CO2恒温培养箱(美国Thermo Fisher Scientific公司,型号:Thermo Forma 3111);酶标分析仪(北京普朗新公司,型号:DNM-9602);显微镜(上海蔡康光学仪器有限公司,型号:XDS-500C);Transwell小室(美国COSTAR公司,型号:3422);流式细胞仪(美国BD公司,型号:Accuri C6);凝胶成像系统(上海天能生命科学有限公司,型号:5200);Leica石蜡切片机、全自动免疫组织化学仪(德国Leica公司,型号:RM2235、Bond Max)。
2 方法
2.1 药物的制备参考文献[10]介绍的方法制备半枝莲乙醇提取物,取半枝莲1 000 g,按1 g10 mL 的固液比加入体积分数70%乙醇,加热回流提取3次,过滤后合并滤液,60 ℃真空干燥3 d,最后减压浓缩得到粉末,将得到的粉末制成浓度为100 g·L-1的半枝莲乙醇提取物储备液,4 ℃冰箱备用。
2.2 细胞培养人高、低转移性HCC细胞株MHCC-97H和MHCC-97L复苏后置于含 100 U·mL-1青链霉素混合液和10%胎牛血清的DMEM培养基中,5% CO2、37 ℃的培养箱中传代培养。
2.3 CCK-8实验取MHCC-97H和MHCC-97L细胞,制成3×104mL-1的细胞悬液,接种于96 孔培养板中,每孔100 μL,置于5%CO2、37 ℃培养箱中培养过夜,每孔加入100 μL不同浓度(0.25 g·L-1、0.5 g·L-1、1.0 g·L-1、2.0 g·L-1和3.0 g·L-1)的半枝莲乙醇提取物,对照组加入等体积完全培养液,每组3个复孔,分别处理0 h、24 h、48 h、72 h、96 h后弃培养液,每孔加入100 μL含10%CCK-8溶液的无血清必需培养基,5%CO2、37 ℃培养箱中孵育1 h后,采用酶标仪检测450 nm波长处的吸光度值(optical density,OD),计算细胞生长抑制率。以50%最大抑制浓度(half maximal inhibitory concentration,IC50)作为半枝莲乙醇提取物组的实验浓度进行后续实验。根据实验设计,后续实验设对照组、半枝莲乙醇提取物组和5-氟尿嘧啶组(10 mg·L-1)。
细胞生长抑制率=(1-实验组OD值/对照组OD值)×100%
2.4 平板克隆实验取MHCC-97H和MHCC-97L细胞,制成3×103mL-1的单细胞悬液,接种于37 ℃培养皿中,每皿1 mL,培养24 h。按照2.3项所述进行分组及给药,每组3个复孔,5% CO2、37 ℃ 培养箱中继续培养2周,每隔3 d换液1次并观察细胞状态,克隆完成后,PBS洗涤2次,4%甲醛固定15 min,加1%结晶紫染色30 min,流水冲洗、干燥,显微镜下观察并按文献介绍的方法计算细胞克隆形成率[11]。
2.5 细胞周期和凋亡实验取MHCC-97H和MHCC-97L细胞,制成3×105mL-1的单细胞悬液,分别接种在6孔板中,每孔1 mL,培养24 h。按照2.3项所述进行分组及给药,每组3个复孔,继续培养72 h后。细胞周期实验:胰酶消化细胞,离心 5 min 后,PBS洗涤2次,加入-20 ℃预冷的无水乙醇700 μL,于4 ℃固定24 h,继续离心5 min,PBS重悬细胞,加入浓度为100 mg·L-1的RNase A溶液 100 μL,重悬沉淀细胞,避光下37 ℃温浴30 min,每管加入浓度为50 mg·L-1的PI溶液400 μL,避光下4 ℃孵育10 min,进行流式细胞术检测和分析。细胞凋亡实验:胰酶消化细胞,离心5 min后PBS洗涤2次,计数10×104个重悬细胞,离心5 min,弃上清,分别加入195 μL Annexin V和5 μL FITC结合液混匀,避光下4 ℃孵育15 min;再加入PI染色液 5 μL 混匀,避光下4 ℃孵育5 min,进行流式细胞术检测和分析。
2.6 细胞划痕、Transwell迁移和侵袭实验根据文献[12]记载的方法进行实验。细胞划痕实验:取对数生长期MHCC-97H和MHCC-97L细胞,胰酶消化后计数8×105个细胞接种于培养皿中,细胞分组同2.3项所述,培养24 h后弃培养液,用枪头划去皿中细胞,PBS冲洗,按实验分组给药处理后,置于37 ℃培养箱中培养24 h。分别在划痕0 h、24 h取出培养皿,在倒置显微镜下拍照,使用Image J软件测量划痕面积和宽度,计算细胞迁移率。细胞Transwell小室迁移和侵袭实验:先将MHCC-97H和MHCC-97L细胞进行血清饥饿培养24 h,在各组Transwell小室的上室中加入细胞密度为2×105mL-1的细胞悬液0.3 mL(侵袭实验另需在小室的上室中加入80 μL基质胶),分组同2.3项所述,对照组在transwell小室的下室中加入0.7 mL含10%FBS的完全培养液;半枝莲乙醇提取物组在transwell小室的下室中加入0.7 mL含2 g·L-1半枝莲乙醇提取物和10%FBS的完全培养液;5-氟尿嘧啶组在transwell小室的下室中加入0.7 mL含 10 mg·L-15-氟尿嘧啶和10%FBS的完全培养液,37 ℃培养72 h后甲醛固定,结晶紫染色后PBS洗涤,晾干,显微镜下计数迁移细胞数和侵袭细胞数。
细胞迁移率=(1-24 h划痕宽度/0 h划痕宽度)×100%
2.7 细胞成球实验取MHCC-97H和MHCC-97L细胞,制成1×104mL-1的细胞悬液,接种于96孔培养板中,每孔100 μL,每组3个复孔,按2.3项所述进行分组给药后,用无血清成球培养基培养 14 d,期间每隔3 d换液1次,观察细胞成球状态,并计算球体形成率。
球体形成率=(成球细胞数/接种细胞数)×100%
2.8 干细胞标记EpCAM+和CD133+细胞比例检测取MHCC-97H和MHCC-97L细胞,按2.3项所述进行实验分组给药后计数(5~10)×104个重悬细胞,加入200 μL PBS、5 μL EpCAM和5 μL CD133抗体混匀,4 ℃避光30 min,随即进行流式细胞仪检测并分析结果。
2.9 Western Blot检测按2.3项所述进行实验分组给药后,参考文献的方法提取MHCC-97H和MHCC-97L细胞蛋白质[11],用BCA蛋白试剂盒测定蛋白浓度,制备PAGE胶、上样和电泳、转膜,用5%脱脂奶粉封闭,加一抗CyclinD1、P27、Bcl-2、Vimentin、Ki-67(稀释比例为11 000)、Bax(稀释比例12 000)、E-cadherin(稀释比例15 000)、GAPDH(稀释比例18 000))和膜4 ℃孵育过夜,TBST洗膜,加二抗(稀释比例110 000)与膜37 ℃孵育1 h,洗膜后加入配制的ECL发光液,放入凝胶成像系统检测蛋白表达,再用灰度分析软件进行结果分析。
2.10 裸鼠成瘤实验将16只BALB/C裸鼠分为半枝莲乙醇提取物组和对照组,每组8只。在每只裸鼠左侧腋窝皮下注射100 μL(约2×106个)MHCC-97H细胞,SPF级条件下喂养,按文献介绍的方法[11],每日观察裸鼠及移植瘤情况,待移植瘤直径>0.5 cm时开始给药治疗,给药剂量参考文献[9],半枝莲乙醇提取物组灌胃给予0.97 g·kg-1的半枝莲乙醇提取物溶液,对照组每天灌胃给予2.0 mL的9 g·L-1生理盐水,隔5 d记录移植瘤的长径(a)和短径(b),计算移植瘤的体积(体积=1/2×a×b2)[9]。灌胃35 d后处死裸鼠,取出肿瘤、肝和肺组织置于10%中性甲醛液固定。
2.11 形态学和免疫组织化学检查将移植瘤、肝和肺组织进行取材,常规石蜡包埋,3~5 μm厚石蜡切片行HE染色和Ki-67免疫组织化学染色。免疫组化染色在全自动免疫组织化学仪中进行。显微镜下进行形态学观察,免疫组织化学染色结果判读参考文献进行[13]。

3 结果
3.1 不同浓度半枝莲乙醇提取物对肝癌细胞增殖和克隆形成的影响与对照组比较,不同浓度半枝莲乙醇提取物可明显抑制MHCC-97H和MHCC-97L细胞的增殖,且呈剂量-时间依赖性(P<0.05),见图1A,其中半枝莲乙醇提取物作用72 h的抑制作用最明显,通过SPSS软件分析显示半枝莲乙醇提取物组干预MHCC-97H和MHCC-97L细胞 72 h 的IC50值分别为 2.490 g·L-1及2.243 g·L-1,见图1B,后续实验选取2.0 g·L-1为半枝莲乙醇提取物组药物浓度。与对照组比较,半枝莲乙醇提取物可使MHCC-97H和MHCC-97L细胞的克隆数目明显减少(P<0.01),见图1C。
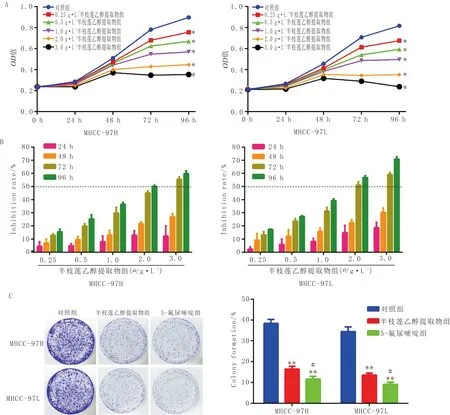
注:A:细胞生长曲线;B:细胞抑制率;C:细胞平板克隆形成。与对照组比较,*P<0.05,**P<0.01;与半枝莲乙醇提取物组比较,#P<0.05;n=3图1 不同浓度半枝莲乙醇提取物对MHCC-97H和MHCC-97L细胞生长的影响
3.2 半枝莲乙醇提取物对细胞周期和细胞凋亡的影响与对照组比较,半枝莲乙醇提取物组 MHCC-97H和MHCC-97L细胞中G0/G1期细胞比例显著增加(P<0.01),S期和G2/M 期细胞比例显著减少(P<0.01),表明半枝莲乙醇提取物将细胞周期停滞于G0/G1期。此外,与对照组比较,半枝莲乙醇提取物显著促进MHCC-97H和MHCC-97L细胞凋亡(P<0.01),见图2。
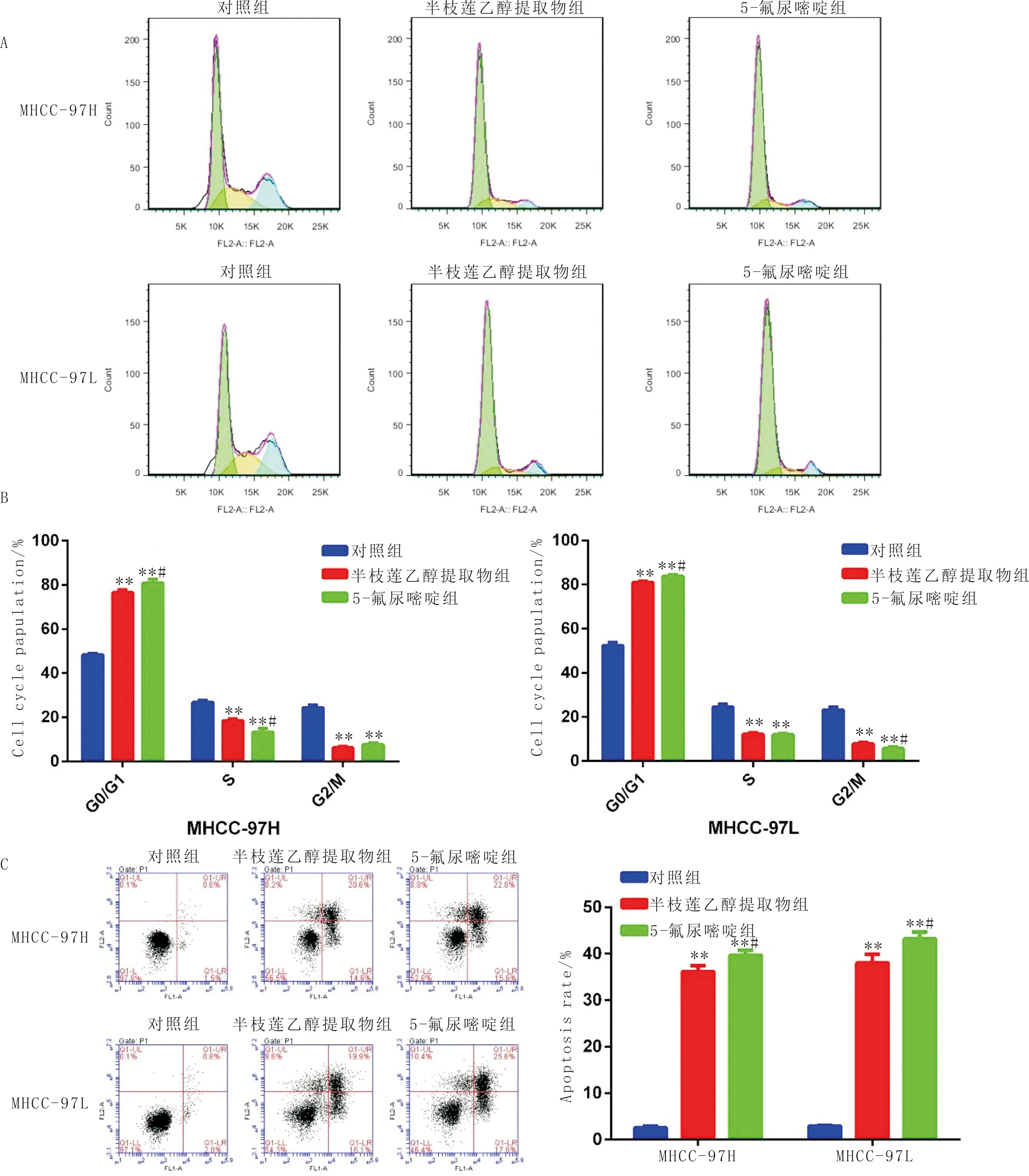
注:A:细胞周期流式检测图;B:细胞周期分布比较;C:左侧为细胞凋亡流式检测图,右侧为细胞凋亡指数比较;与对照组比较,**P<0.01;与半枝莲乙醇提取物组比较,#P<0.05;n=3图2 半枝莲乙醇提取物对MHCC-97H和MHCC-97L细胞周期和凋亡的影响
3.3 半枝莲乙醇提取物对细胞划痕愈合、迁移和侵袭的影响与对照组比较,半枝莲乙醇提取物组MHCC-97H和MHCC-97L细胞的划痕愈合进程明显缩短(P<0.05),细胞侵袭的数目明显减少(P<0.05);MHCC-97L细胞迁移数目明显减少(P<0.05)。见图3。
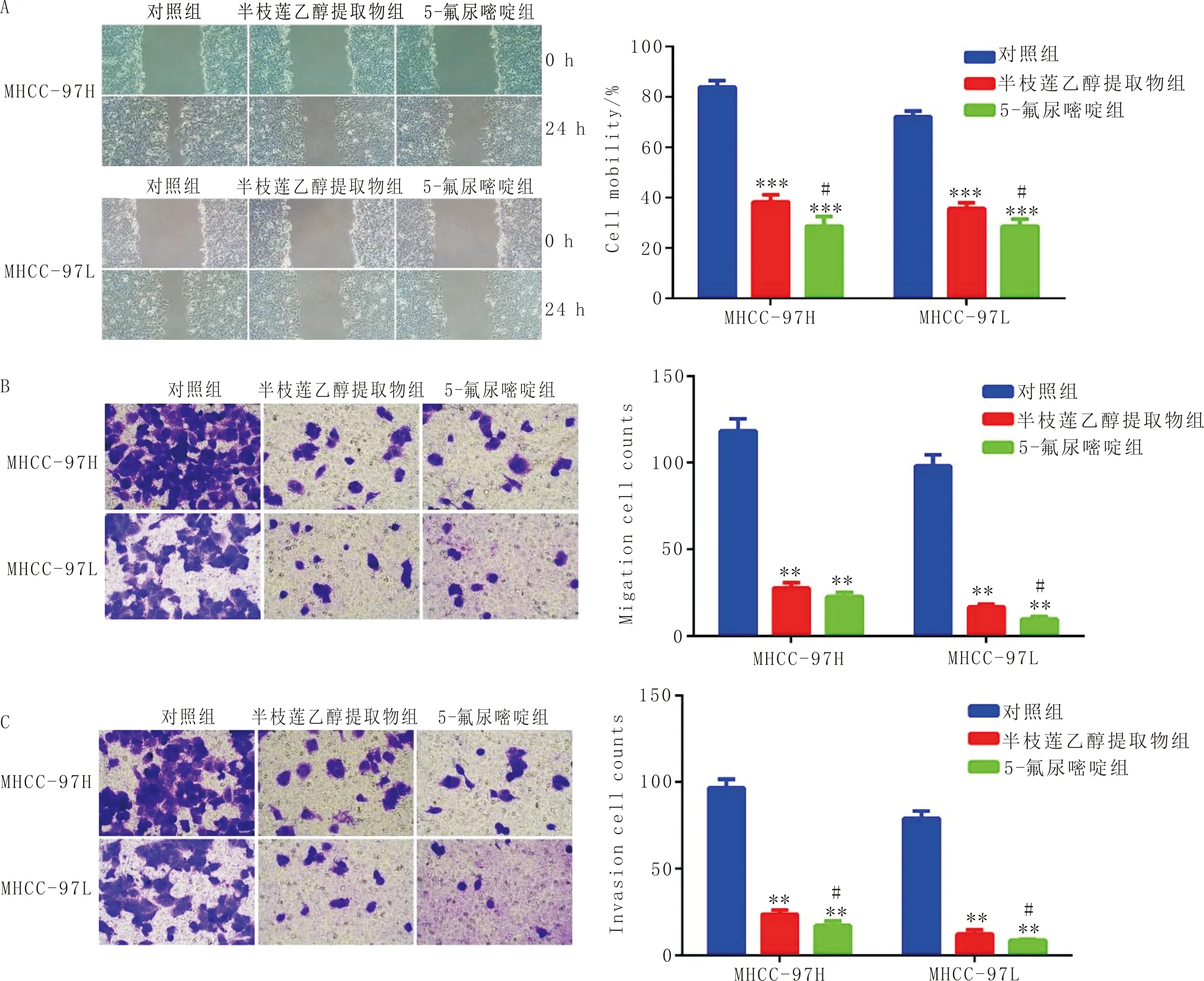
注:A:细胞划痕试验;B:细胞迁移实验;C:细胞侵袭试验。左侧为光镜下观察得到的图片(×200),右侧为计数资料比较;与对照组比较,**P<0.01;与半枝莲乙醇提取物组比较,#P<0.05;n=3图3 半枝莲乙醇提取物对MHCC-97H和MHCC-97L细胞划痕、迁移和侵袭的影响
3.4 半枝莲乙醇提取物对细胞成球和干细胞特性的影响与对照组比较,半枝莲乙醇提取物组MHCC-97H和MHCC-97L细胞成球体积明显变小,细胞球体形成率明显降低(P<0.01),见图4A。流式细胞术分析显示,与对照组比较,半枝莲乙醇提取物组EpCAM+与CD133+细胞比例显著下降(P<0.01),见图4B。
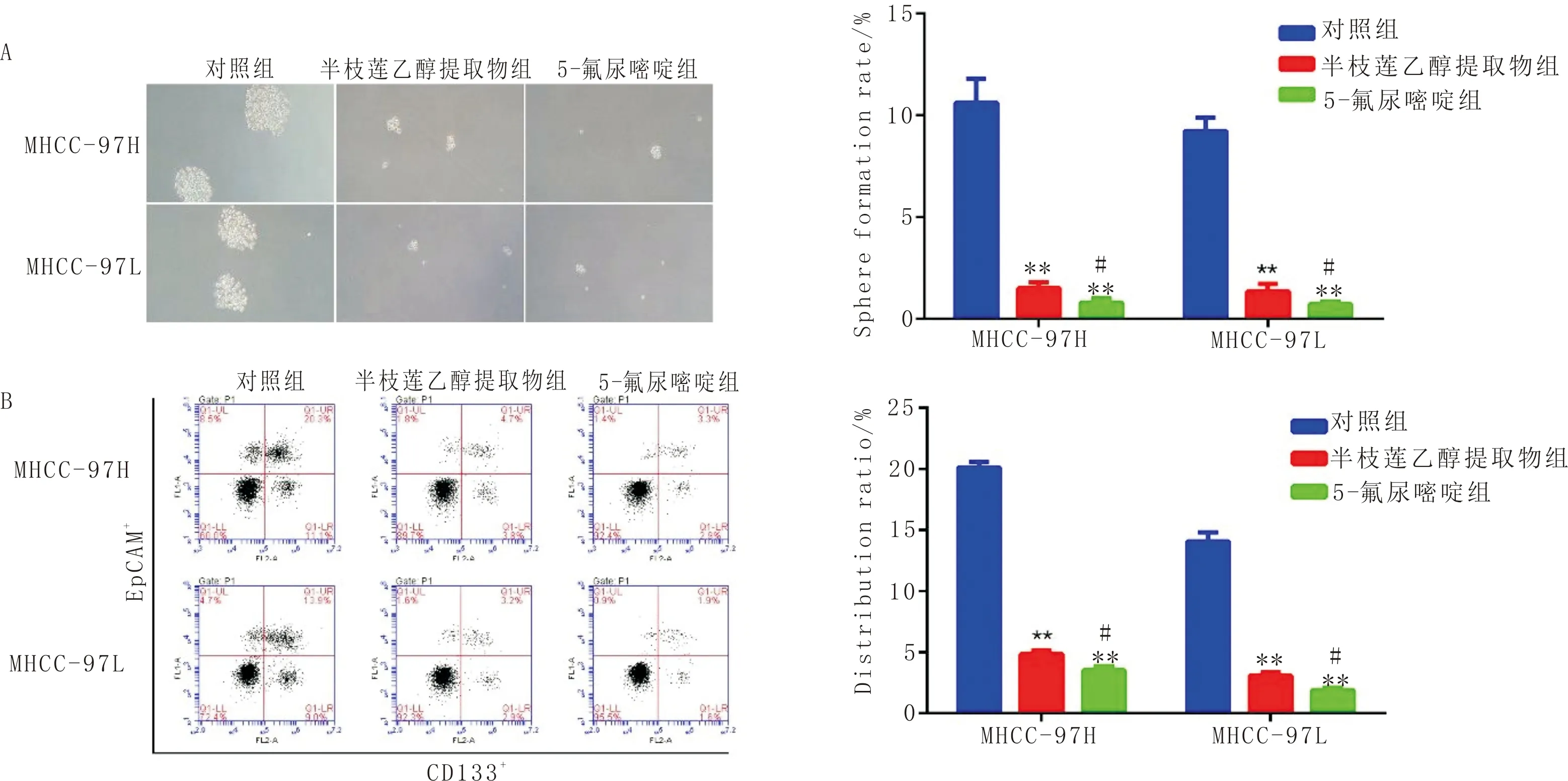
注:A:细胞成球情况(×200);B:干性标记EpCAM+和CD133+流式细胞术分布图;左侧为代表性图片,右侧为计数资料比较。与对照组比较,**P<0.01;与半枝莲乙醇提取物组比较,#P<0.05;n=3图4 半枝莲乙醇提取物对MHCC-97H和MHCC-97L细胞成球和干细胞特性的影响
3.5 半枝莲乙醇提取物对细胞周期、凋亡及上皮间质转化相关蛋白表达的影响与对照组比较,半枝莲乙醇提取物组MHCC-97H和MHCC-97L细胞周期和凋亡相关蛋白Cyclin D1、Bcl-2、Ki-67表达水平明显降低(P<0.05),P27、Bax表达水平明显上调(P<0.05);上皮间质转化相关蛋白E-cadherin表达水平明显上调(P<0.05),Vimentin表达水平明显下调(P<0.05)。见图5。
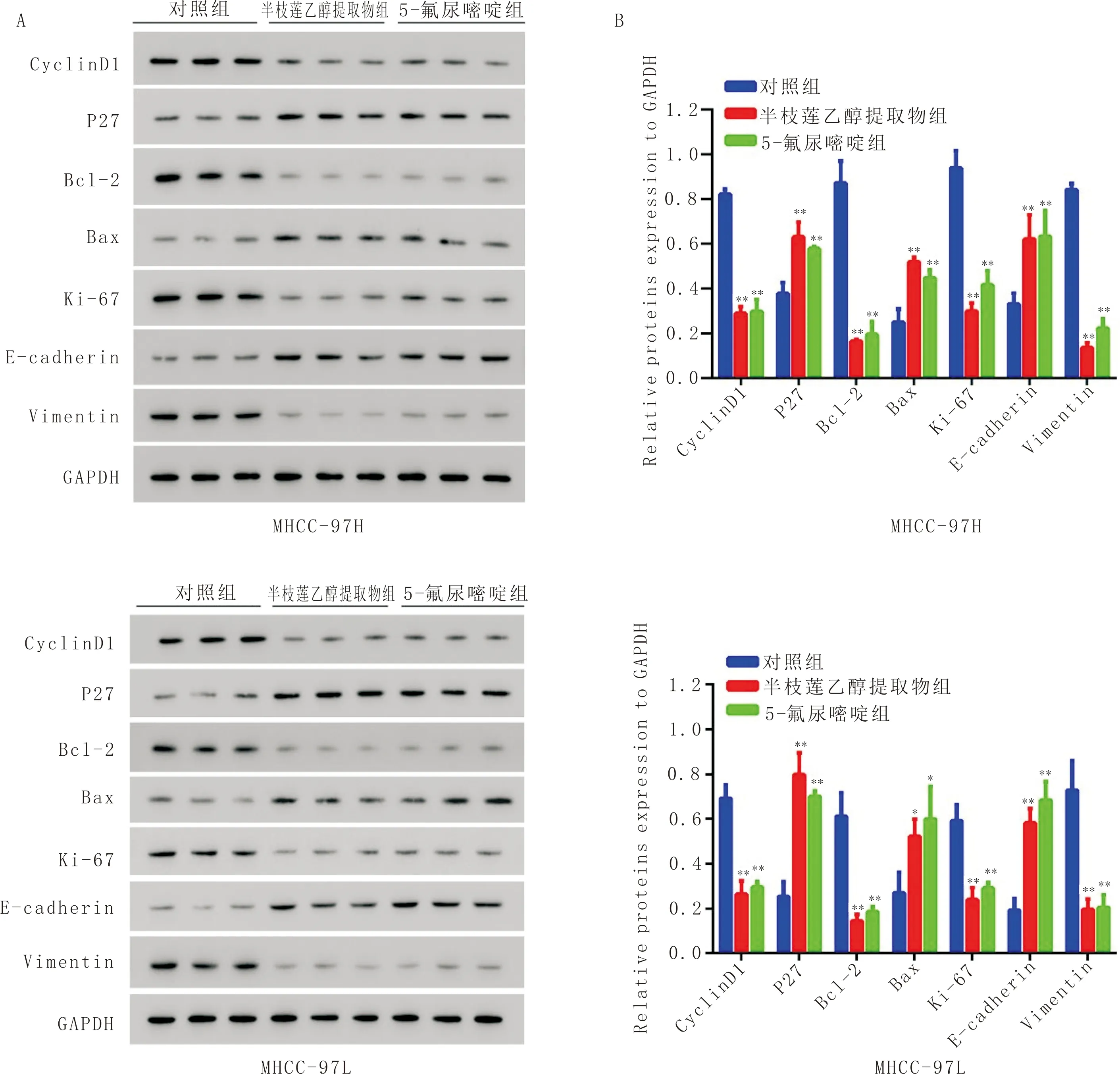
注:A:Western Blot蛋白条带图片;B:蛋白表达定量分析。与对照组比较,*P<0.05,**P<0.01;n=3图5 半枝莲乙醇提取物对MHCC-97H和MHCC-97L细胞周期、凋亡及上皮间质转化相关蛋白表达水平的影响
3.6 半枝莲乙醇提取物对裸鼠移植瘤生长及肝、肺转移的影响与对照组比较,半枝莲乙醇提取物组MHCC-97H细胞移植瘤体积明显缩小(P<0.05)。见图6A。移植瘤组织形态学检查显示,对照组肿瘤细胞呈弥散致密排列、有不同程度有丝分裂活性;半枝莲乙醇提取物组肿瘤组织可见明显的坏死和凋亡。见图6B。免疫组织化学分析表明,与对照组比较,半枝莲乙醇提取物组Ki-67蛋白染色减少,见图6C。肝、肺组织形态学检查显示,与对照组比较,半枝莲乙醇提取物组移植瘤肝、肺转移灶的大小和数目明显降低(P<0.05)。见表1,图7。
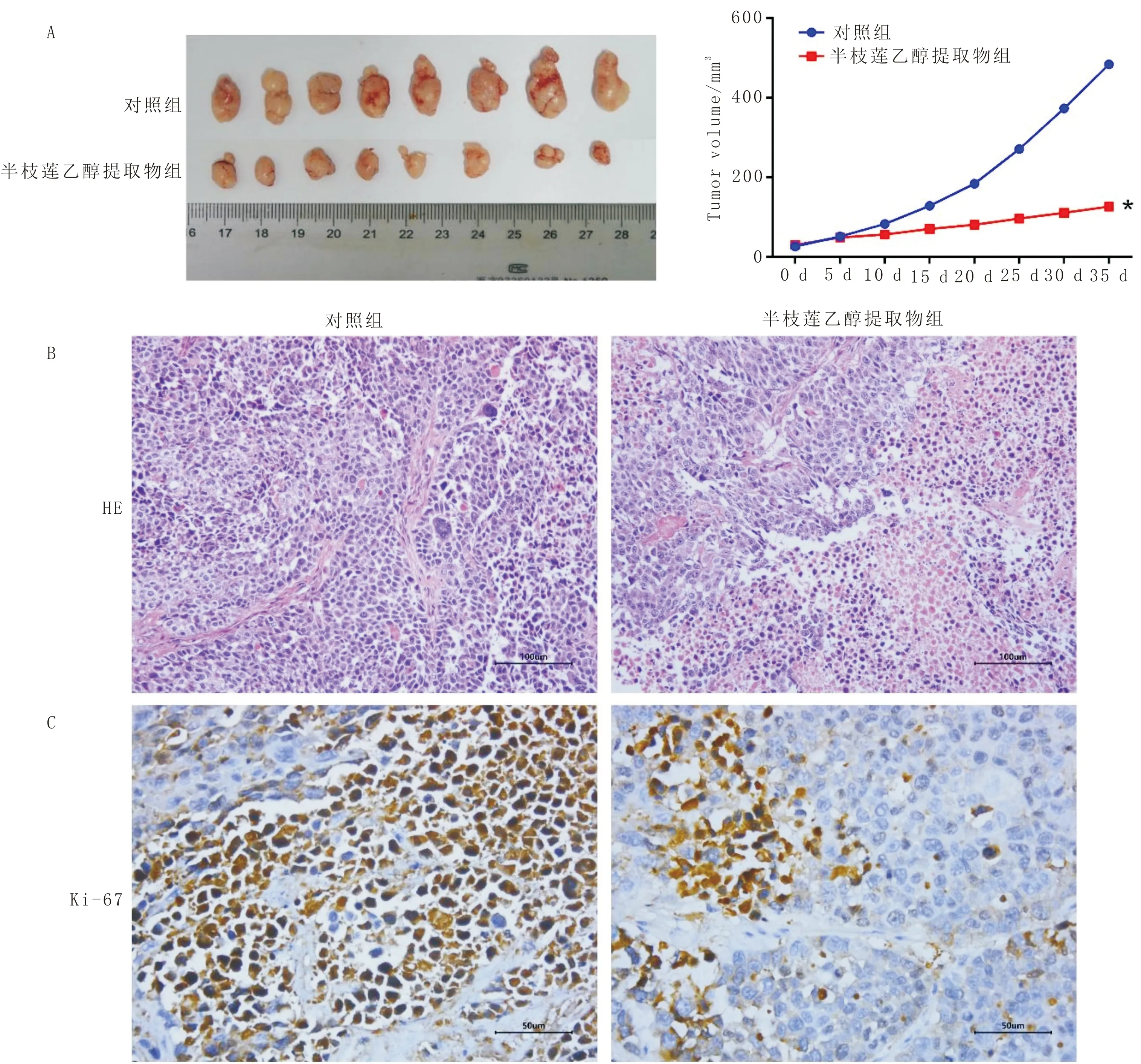
注:A:移植瘤的大体形态和生长曲线;B:移植瘤组织形态学(HE染色,×200);C:移植瘤Ki-67免疫组化染色(×400)。与对照组比较,*P<0.05;n=8图6 半枝莲乙醇提取物对MHCC-97H细胞裸鼠移植瘤生长、肝肺转移的影响
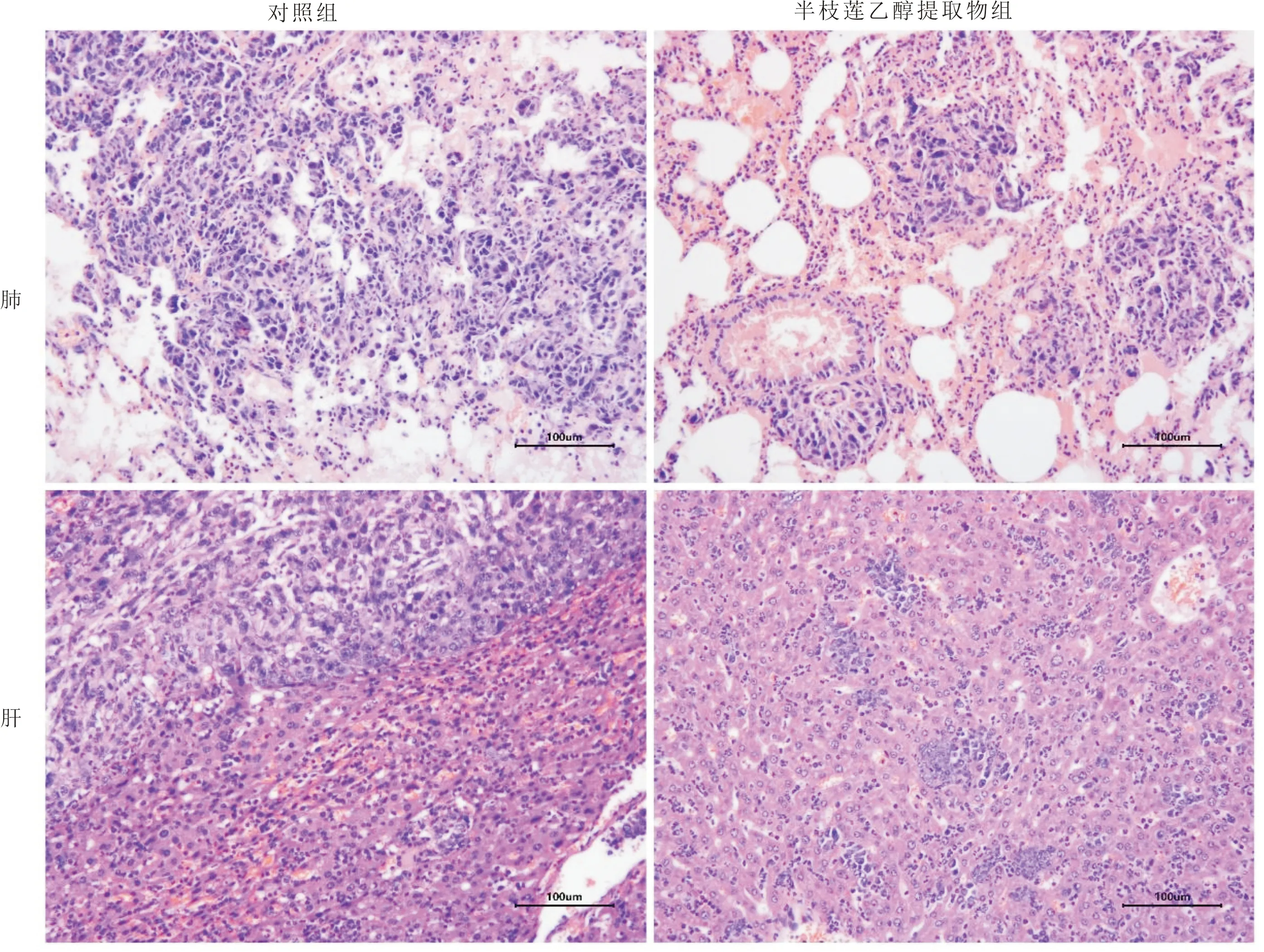
图7 半枝莲乙醇提取物对MHCC-97H细胞裸鼠移植瘤肺和肝转移的影响(HE染色,×200)

表1 半枝莲乙醇提取物对移植瘤肝、肺转移的影响
4 讨论
肝细胞癌恶性程度较高,易发生侵袭和转移,术后较高的复发和转移率是治疗肝癌的重大障碍。中医上无“肝癌”这一病名,肝癌的“积聚”“癥瘕”“臌胀”“胁痛”“黄疸”等临床症状与中医经典著作《内经》中的“积”病相似,因此,众多中医专家采用扶正祛邪、活血化瘀、疏肝理气、解毒抑瘤等法治疗肝癌[14-15],发挥了中草药独特的功效和协同干预作用,在临床广泛应用于抑制肿瘤进展和转移。半枝莲是中医学领域中常用的抗肿瘤组方药物,已有研究报道,半枝莲可抑制多种肿瘤如非小细胞肺癌、结直肠癌、胰腺癌、肝癌和胃癌的增殖和侵袭转移[16-20]。
细胞增殖与凋亡的稳态失衡是肿瘤的发病机制之一,因此,可通过抑制细胞增殖,阻滞细胞周期的进展,促进细胞凋亡,从而减缓肝癌细胞的发展。研究显示,半枝莲乙醇提取物作用Hep-G2细胞72 h后,可促使早期凋亡细胞增多,G0/G1期细胞增多,S期细胞减少,阻滞细胞周期进展,抑制肝癌细胞生长[21]。半枝莲主要活性成分木犀草素通过促进细胞凋亡和阻滞细胞周期G0/G1期(Huh 7细胞)或G2/M期(HepG2),调控多个细胞周期和凋亡相关基因包括cyclinA、cyclinB1、cyclinD1、cyclinE、CDK1、CDK2、CDK4、CDK6、p21、p27、Bax和Bcl-2等的表达[13],抑制肝癌细胞生长。细胞周期的相关蛋白,特别是CyclinD1在很多肿瘤细胞中高表达,加速了细胞周期进展,在细胞增殖中起到癌基因的作用[22-23]。Bcl-2和Bax是调控凋亡的蛋白,两者形成二聚体而又互相拮抗,当机体受到外界异常刺激后,若Bcl-2表达高于Bax时,抑制细胞凋亡;若Bax表达高于Bcl-2时,激活Caspase-3蛋白表达,从而促进细胞凋亡[24]。半枝莲乙醇提取物作用人肝癌SMMC-7721细胞后,使得Caspase-3蛋白表达显著上升,Bcl-2和Survivin蛋白表达明显下降,促进细胞凋亡[25]。本研究结果显示,半枝莲乙醇提取物显著抑制MHCC-97H和MHCC-97L细胞的体外增殖和体内移植瘤生长,其机制与降低CyclinD1、Bcl-2、Ki-67蛋白表达水平,提高P27和Bax蛋白表达水平,阻滞细胞周期于G0/G1期,促进细胞凋亡等有关。
恶性肿瘤细胞的侵袭与转移在肿瘤相关死亡中起着关键作用。EMT标志物E-cadherin和Vimentin是HCC进程和侵袭的决定性分子[12]。研究显示,半枝莲乙醇提取物通过阻断TGF-β/Smad/AMPK信号通路,上调E-cadherin蛋白表达水平,下调N-cadherin和Vimentin蛋白表达水平,逆转TGF-β诱导的上皮间质转化,抑制肝癌 HepG2细胞迁移及侵袭[26]。课题组前期的研究显示,半枝莲提取物可降低HBV阳性肝细胞癌HepG2.2.15和Hep3B细胞的划痕愈合率,抑制细胞的迁移和侵袭[9]。此外,半枝莲乙醇提取物也可抑制HepG2肝癌细胞侵袭和迁移,诱发细胞自噬,该作用与半枝莲提取物抑制Raf/MEK/ERK信号通路有关[27]。本研究结果显示,半枝莲乙醇提取物可下调Vimentin蛋白表达水平,上调E-cadherin蛋白表达水平,降低细胞划痕愈合率,减少迁移和侵袭细胞数目。
肿瘤干细胞具有较强的增殖和自我更新能力,与肿瘤细胞耐药、复发、转移和不良预后密切相关。研究显示,肿瘤干细胞标志物EpCAM和 CD133参与肝癌恶性进程的发展,通过免疫组化检测到这两个指标在肝癌组织中的阳性表达率明显高于癌旁组织[28],EpCAM和CD133的高表达可提示肝癌患者预后不良。本研究也显示,半枝莲乙醇提取物可降低干细胞EpCAM+与CD133+细胞数量及球体形成,与Liu等[29]的研究报道相同,提示半枝莲乙醇提取物可通过调控干细胞特性相关分子,抑制肝癌MHCC-97H和MHCC-97L细胞的侵袭和转移能力。
综上所述,半枝莲乙醇提取物可通过抑制细胞增殖、阻滞细胞周期进程、促进肝癌细胞凋亡、调控上皮间质转化和干细胞特性相关基因表达抑制肝癌MHCC-97H和MHCC-97L细胞体内外生长和侵袭,为临床上半枝莲乙醇提取物治疗HCC提供理论依据。

