基于生物信息学探讨中药调节软骨细胞铁死亡干预膝骨性关节炎*
余鹏,王咪,沈锦涛,刘洪飞,程韶,李慧英
1.河南中医药大学,河南 郑州 450046; 2.上海中医药大学,上海 201203; 3.河南省中医院/河南中医药大学第二附属医院,河南 郑州 450002; 4.河南中医药大学第一附属医院,河南 郑州 450000
膝骨性关节炎(knee osteoarthritis,KOA)作为常见的慢性骨关节疾病,使无数患者深受病痛折磨。随着对KOA研究的深入,研究人员对其复杂的发病机制也有了新认识。由于关节软骨自我修复与损伤的动态平衡被打破,软骨细胞合成与分解失衡,最终导致关节结构破坏,其基本病理变化为异常的软骨细胞分化或肥大、衰老及死亡[1]。关节软骨由致密的细胞外基质(extracellularmatrix,ECM)构成,仅包含一种细胞类型——软骨细胞,因缺乏神经、血管及淋巴管的穿行,关节软骨的自我修复与内在愈合能力有限。
铁死亡作为铁依赖性的新型细胞程序性死亡方式,主要包括铁离子累积与脂质过氧化两个生物过程[2]。铁离子过载会加速软骨细胞分解代谢相关因子基质金属蛋白酶-13(matrix metalloproteinases-13,MMP-13)等的表达上调,降低软骨细胞合成代谢因子聚集蛋白聚糖的表达[3],并抑制Ⅱ型胶原蛋白的表达[4]。白细胞介素-1β(interleukin-1β,IL-1β)导致脂质过氧化物及其降解产物的积累,从而诱导铁死亡,促使软骨细胞的死亡[5]。缺氧诱导因子(hypoxia inducible factor-1,HIF-1)是软骨分化过程中重要的调节因子,可以诱导间充质干细胞向软骨细胞分化,而铁离子可以导致HIF-1失活,降低软骨细胞的分化[6]。软骨细胞的异常肥大是KOA病变的开始,基础实验表明过量的铁离子可以导致软骨细胞优先向肥大表型分化,从而加速软骨退变[3]。因此,铁死亡可以加速软骨细胞的死亡,对KOA的发生发展产生了重要影响。
目前,治疗早中期KOA,外用或口服非甾体类消炎药是首选[7],但长期服用后可能会引起胃肠道及心血管疾病等不良事件的发生。目前治疗KOA的中药在临床中虽然暂时没有权威的循证医学证据支持,但根据中医辨证论治与遣方用药,可以快速缓解症状,改善病情,且不良反应小,显示出独特的优势[8]。研究表明,铁过载诱导软骨细胞的退变,黄芪提取物刺芒柄花素可以降低软骨细胞内铁浓度,通过靶向Nrf2/GPX4信号通路防止脂质过氧化,调节铁稳态,延缓KOA的进展[9]。淫羊藿苷通过激活Xc-/GPX4轴抑制铁死亡,保护脂多糖诱导的滑膜细胞免于死亡[10]。目前关于中药调节KOA患者软骨细胞铁死亡的研究较少,需要进一步探索其治疗机制。本研究基于铁死亡对软骨细胞的重要影响,运用生物信息学与数据挖掘,探索在KOA中调节软骨细胞铁死亡的中药靶点、化合物及用药规律,为今后临床及实验研究KOA铁死亡的用药提供一定帮助。
1 资料与方法
1.1 差异靶点收集及富集分析从GEO数据库(https://www.ncbi.nlm.nih.gov/gds/)中下载关于膝骨性关节炎的转录组学数据。搜索标准:①膝骨性关节炎;②人类;③软骨细胞[11]。获得转录组数据GSE114007。GSE114007数据包含18个正常软骨组织,20个KOA软骨组织。运用软件fastQC对数据进行质控,Hisat2+featurecounts进行数据比对与计数,DESeq2进行数据分析,筛选软骨细胞差异基因的标准为|log2FC|>1,p-adj<0.05,获得软骨细胞差异基因。从FerrDb数据库(http://www.zhounan.org/ferrdb/)下载铁死亡相关靶点。通过R语言将获取的软骨细胞差异基因与铁死亡相关靶点取交集,得到软骨细胞铁死亡表达差异基因靶点,通过蛋白质数据库UniProt(http://www.uniprot.org),将得到的差异基因靶点进行映射,获得相应的基因靶点全称,将没有映射到的基因靶点剔除,余下的为潜在基因靶点。运用R语言中“clusterProfiler”包进行基因本体(gene ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析。
1.2 构建靶点-化合物网络运用TCMSP数据库(http://tcmsp-e.com)检索潜在基因靶点所对应的化合物,根据ADME参数常用指标:口服利用度(OB)≥30%,类药性(OL)≥0.18和Lipinski三规则[12]:相对分子质量(MW)<500、脂水分配系数(AlogP)<5、氢键给体数目(Hdon)<5,筛选出候选化合物。利用cytoscape 3.9.1软件构建潜在靶点-候选化合物网络,对该网络节点进行拓扑分析,得出干预软骨细胞铁死亡的关键靶点。
1.3 构建靶点-化合物-中药网络根据候选化合物,通过TCMSP数据库,检索相应的中药,运用cytoscape 3.9.1软件构建潜在靶点-候选化合物-中药网络,通过网络拓扑学分析得出调节软骨细胞铁死亡的主要中药及中药调节软骨细胞铁死亡核心化合物。
1.4 统计中药性味归经和用药规律将收集到的中药,与《中华人民共和国药典》《中国临床药物大辞典》《中药学》进行匹配,获取每味中药的性味归经及治疗作用,利用Excl统计纳入中药的性味归经及药物作用类别。
1.5 分子对接验证通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取1.3项下得到的核心化合物的3D分子结构作为配体。将1.2项下获取的关键靶点通过RCSB PDB数据库(https://www.rcsb.org/)筛选后得到与之相对应的PDB ID号,作为蛋白受体,利用PyMOL软件与 ADFR 软件对蛋白受体进行去水、加氢预处理。将预处理后的蛋白受体与化合物配体利用SailVina final软件转化为pdbqt格式文件,通过AutoDock Vina进行分子对接。在PyMOL软件中将分子对接的文件进行可视化展示,利用R包pheatmap对分子对接的结果进行可视化处理,并进行数据分析验证。
2 结果
2.1 软骨细胞与铁死亡差异靶点通过软件DESeq2分析得到软骨细胞差异靶点4 004个,从FerrDb数据库获取铁死亡相关靶点487个,取二者交集之后得到63个靶点,通过UniProt数据库匹配后,删除未匹配到的3个靶点,最终获得60个软骨细胞铁死亡差异靶点。运用R包对差异靶点进行GO富集分析,结果显示生物过程(biological Process,BP)有783条目,主要涉及细胞对营养水平、外界刺激、化学应激及氧化应激的反应;细胞组分(cellularComponent,CC)有51条目,主要涉及分子细胞膜(过氧化物酶体膜、细胞基膜等)及因子复合物(转录调节复合物、丝氨酸/苏氨酸蛋白激酶复合物等);细胞功能有96条目,主要涉及铁离子结合、转录因子活性与结合等,详见图1A。对差异靶点进行KEGG信号通路分析,结果显示共有45个信号通路,主要涉及铁死亡、HIF-1信号通路、破骨细胞分化、IL-17信号通路等,详见图1B。
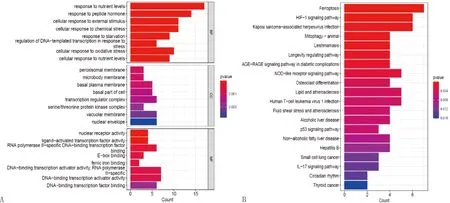
注:A:GO分析;B:KEGG分析图1 软骨细胞铁死亡差异靶点分析
2.2 潜在靶点-候选化合物网络将60个差异靶点通过TCMSP数据库进行匹配,有16个差异靶点可以匹配到相应化合物,根据ADME参数和Lipinski三规则,最终符合纳入标准的有993个化合物,将其作为候选化合物,对应9个软骨细胞铁死亡相关靶点,将其作为潜在靶点,潜在靶点信息详见表1。构建潜在靶点-候选化合物网络,通过网络拓扑学分析发现,关联靶点最多的化合物为汉黄芩素、漆黄素、川陈皮素、尼泊尔鸢尾异黄酮、异鼠李素,分别对应的靶点为5、5、4、4、4,关联化合物的潜在核心靶点为PTGS2、DPP4、PPARG、CDKN1A、RELA、NQO1。选取度值>1的潜在靶点及其候选化合物构建潜在靶点-候选化合物网络,详见图2。
2.3 潜在靶点-候选化合物-中药网络在TCMSP数据库中,根据候选化合物匹配筛选中药,统计中药386味,将中药与潜在靶点和候选化合物构建网络,进行网络拓扑学分析。分析结果显示关联化合物度值排名前7位的中药为甘草、丹参、延胡索、降香、钩藤、黄芩、苦地丁,度值依次为80、48、46、27、26、25、21,详见图3A。关联中药的化合物,根据度值中位数及经验判断,选取候选化合物度值>10的为核心候选化合物,总共有17个化合物,前5位化合物分别为山柰酚、木樨草素、异鼠李素、刺槐素、芒柄花黄素,详见表2。通过候选化合物的桥接作用,统计得到作用于5个靶点的中药有骨碎补、半枝莲、枳实、麻黄、女贞子,详见图3B,因此推测这5味中药可能对软骨细胞铁死亡干预效果较好,可尝试将其作为研究治疗KOA的作用药物。以中药及候选化合物度值>4为标准,构建潜在靶点-候选化合物-中药网络,详见图4。
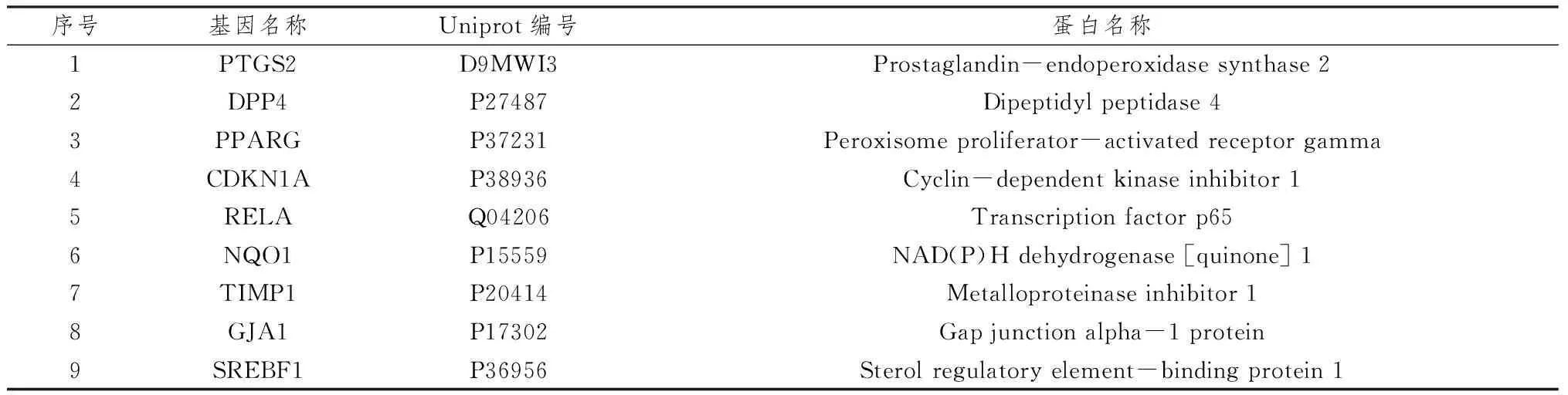
表1 软骨细胞铁死亡潜在靶点

图2 潜在靶点-候选化合物网络图
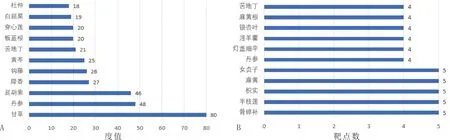
图3 调节软骨细胞铁死亡的中药
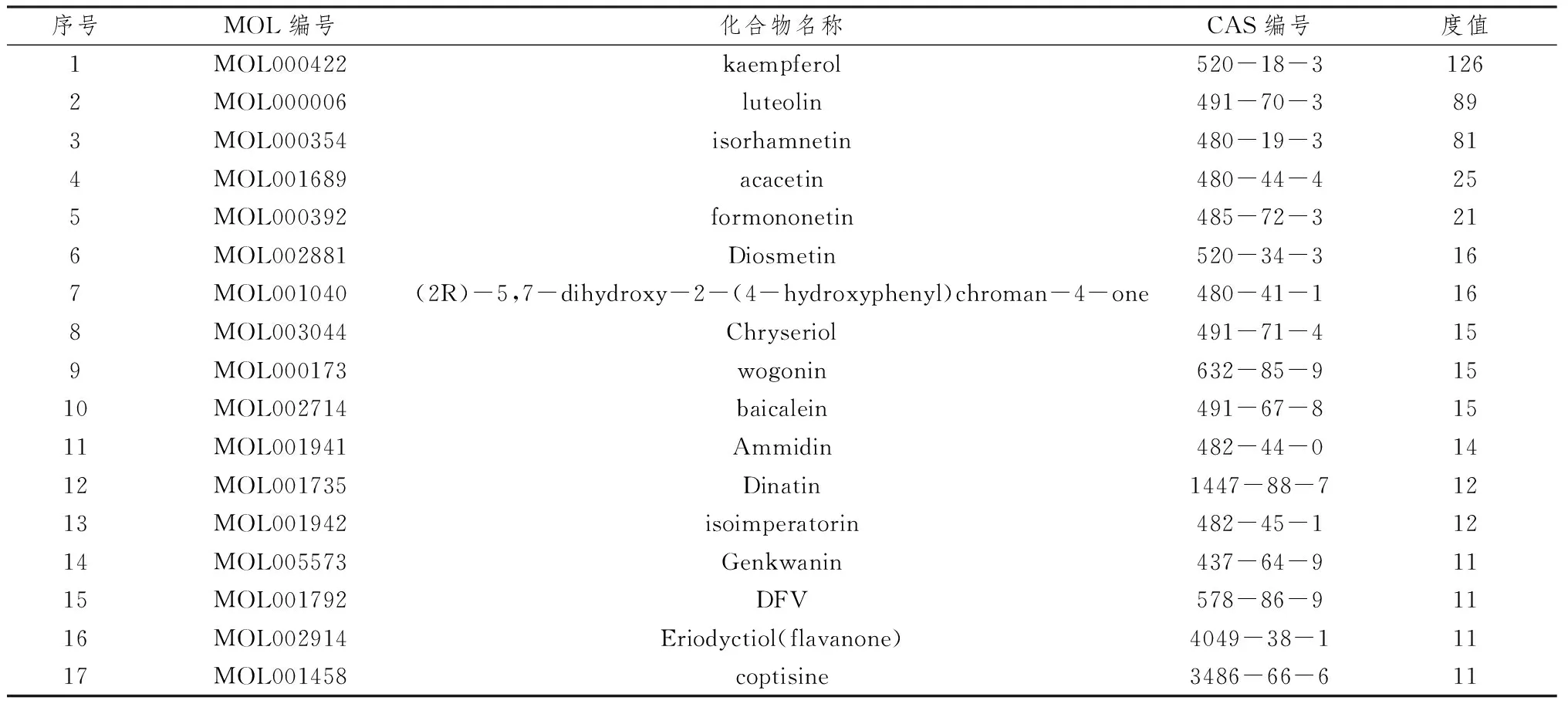
表2 中药调节软骨细胞铁死亡核心化合物(度值>10)
图4 潜在靶点-候选化合物-中药网络图
2.4 中药性味归经及用药规律将2.3项下统计到的386味中药,根据《中华人民共和国药典》《中药学》及《中国临床药物大辞典》进行性味归经及治疗作用统计,剔除未收录的中药38味,最终统计348味中药。结果表明纳入的中药性味以寒温并重,苦、辛、甘味药为主,归肝、肺、脾胃经的中药为主,详见表3。以清热类中药最多(70味),其次是补虚类和活血化瘀类中药,详见图5。
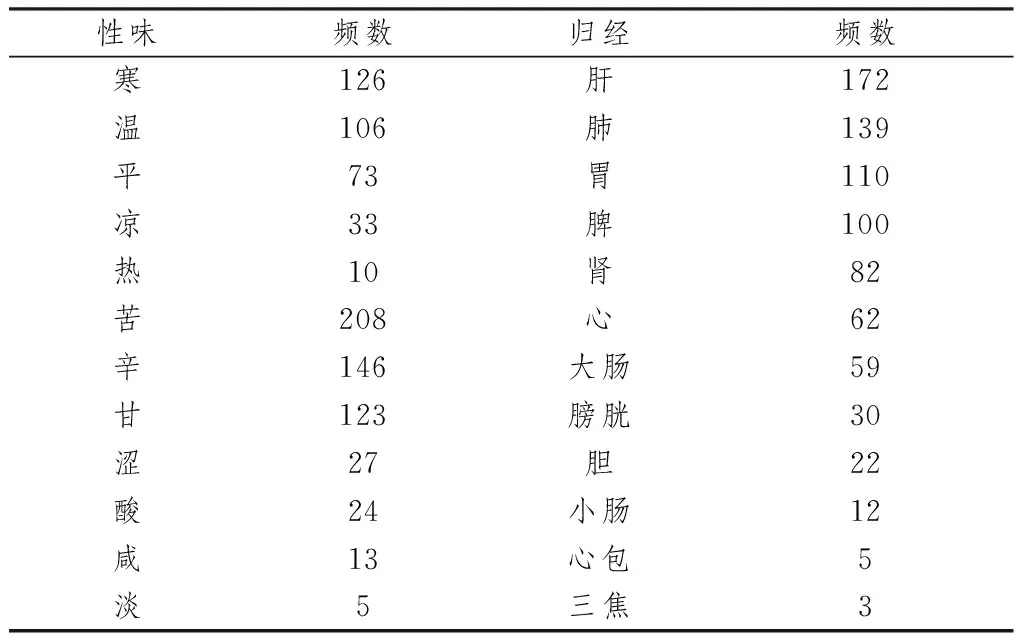
表3 中药性味归经频数统计表 (次)
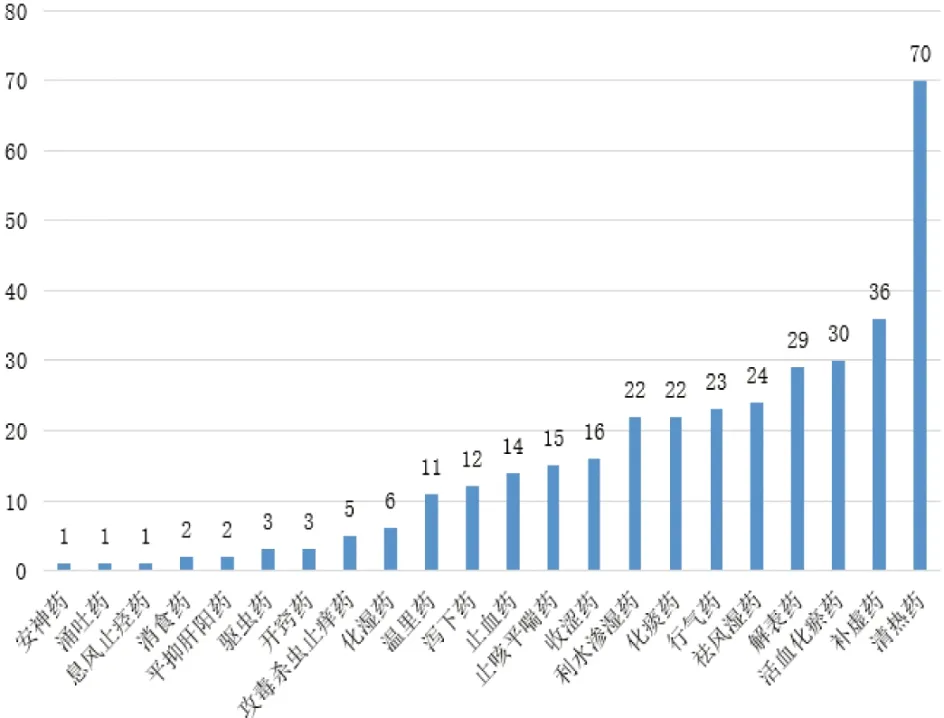
图5 调节软骨细胞铁死亡的中药作用类别频数分布
2.5 分子对接验证结果6个潜在关键靶点经RCSB PDB数据库筛选后,CDKN1A未匹配到相应的PDB ID号,将其删除,其余5个关键靶点的PDB ID号分别为PTGS2(PDB ID:5IKQ),DPP4(PDB ID:5T4B),PPARG(PDB ID:3V9V),RELA(PDB ID:6NV2),NQO1(PDB ID:1KBQ),随后将5个关键靶点与17个核心化合物进行分子对接。分子对接的Affinity值<-4.25 kcal·mol-1表示配体与受体之间有结合活性,Affinity值<-5.00 kcal·mol-1表示二者之间的结合活性较佳,Affinity值<-7.00 kcal·mol-1表示二者之间有很强的结合活性[13]。对接结果显示,最小值为-9.22 kcal·mol-1,最大值为-5.96 kcal·mol-1,所有对接的Affinity值均<-5.00 kcal·mol-1,说明关键靶点与核心化合物之间均有较好的结合活性,也从一定程度上证明筛选干预软骨细胞铁死亡的中药作用靶点与化合物的可靠性。其中靶点DPP4、PPARG与所有核心化合物的结合能均<-7 kcal·mol-1,表明这些化合物与关键靶点有更佳的结合能力,可能在中药干预软骨细胞铁死亡中有着关键作用,详见图6。根据Affinity值、潜在关键靶点与核心化合物,选取5对受体与配体分子对接后的结果进行可视化展示,分别为PTGS2-liteolin(木樨草素)、DPP4-isorham-netin(异鼠李素)、PPARG-kaempferol(山柰酚)、RELA-formononetin(芒柄花黄素)、NQO1-acacetin(刺槐素),详见图7。
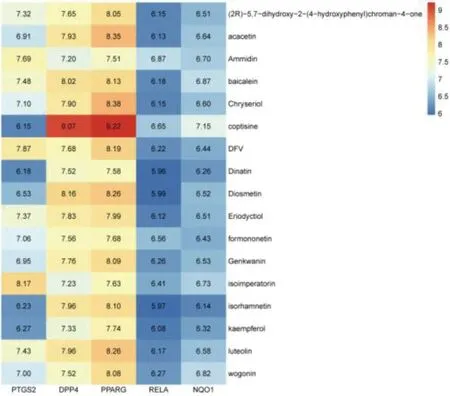
图6 关键靶点与核心化合物分子对接的结果热图

注:A:PTGS2-liteolin(木樨草素);B:DPP4-isorhamnetin(异鼠李素);C:PPARG-kaempferol(山柰酚);D:RELA-formononetin(芒柄花黄素);E:NQO1-acacetin(刺槐素)图7 关键靶点与核心化合物分子对接示意图
3 讨论
研究表明铁死亡属于免疫性细胞死亡,其许多产物被证明是炎症介质[14]。KOA的病理过程是一个慢性炎症反应的过程,铁死亡对于KOA的发病与治疗均有较大影响,可以作为治疗与预防KOA新的研究方向。中药在干预铁死亡方面拥有巨大的潜力,当前,关于中药干预软骨细胞铁死亡的研究较少。本研究以铁死亡相关靶点为切入点,构建靶点、化合物及中药网络,探索三者之间的关联,探寻调节软骨细胞铁死亡的中药及用药规律。
通过GO功能富集分析及KEGG信号通路分析发现,60个软骨细胞铁死亡差异靶点主要集中在铁死亡信号通路、HIF-1信号通路及白细胞介素-1β信号通路中,这与铁死亡干预KOA的发病过程是相吻合的,也证明了差异靶点的可靠性。HIF-1α是人体生长发育过程中关节软骨形成的核心,可以促进软骨祖母细胞的分化,并能抑制软骨细胞的异常肥大,铁离子可以降低HIF-1α活性,抑制HIF-1信号通路,从而加速软骨退变[6]。在 IL-1β诱导的炎症环境中,软骨细胞会发生铁死亡相关蛋白表达的变化,促进MMP13表达,抑制Ⅱ型胶原蛋白表达,从而加速KOA的进展[5]。
构建网络后关联化合物的潜在核心靶点为PTGS2、DPP4、PPARG、CDKN1A、RELA、NQO1。其中PTGS2又称为环氧化酶-2,可以编码其产物前列腺素E2,加速KOA进程[15],同时高表达的PTGS2也是细胞发生铁死亡过程中脂质过氧化的生物标记物[16]。研究表明,DPP4介导细胞的脂质过氧化,诱导肿瘤坏死因子的产生,导致铁死亡的发生,加速软骨细胞的衰老与死亡[17-18]。PPARG有较强的细胞抗氧化功能,提高PPARG表达水平,可以增强细胞的抗铁死亡能力,积极参与哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的调控,降低炎症介质水平[19-20]。CDKN1A诱导成纤维细胞生长因子2的表达,抑制软骨细胞的增殖与表达,p53介导 CDKN1A 的表达,可以抑制铁死亡的出现[18,21]。RELA是核转录因子-κB信号通路中的关键分子,广泛参与炎症与免疫反应,该通路激活后,导致炎症反应增加,产生大量炎症因子,诱导铁死亡的发生。细胞内活性氧的增加,会诱导脂质过氧化的出现,从而提高NQO1的水平,可以增强细胞抗氧化能力,激活抗氧化信号通路,抑制铁死亡[22-23]。
筛选得到的中药关联的核心化合物中,根据动物实验研究表明,山柰酚、木樨草素、异鼠李素、刺槐素、芒柄花黄素等化合物均可以降低相关炎症因子的表达,抑制软骨细胞的炎症损伤,延缓KOA的发展[24-28]。其中山柰酚可以激活核因子红细胞系2相关因子2/谷胱甘肽过氧化物酶4信号通路,增强了细胞的抗氧化能力,抑制细胞脂质过氧化的积累,延缓铁死亡的发生[29]。木樨草素因其较强的抗氧化及抗炎能力,可以抑制脂质过氧化与铁离子的累积,已成为靶向治疗铁死亡的新兴天然化合物[30]。根据网络拓扑学分析可知,关联靶点最多的中药为骨碎补、半枝莲、枳实、麻黄、女贞子等,提示这几味中药可能是干预软骨细胞铁死亡关键中药,可以为研究中药治疗KOA的作用机制及用药思路提供一定方向。其中骨碎补的质量标志物柚皮苷可以防止软骨基质的降解,抑制 NF-κB 信号通路的激活,降低炎症反应,保护软骨细胞[31],同时柚皮苷调节铁死亡参与的Nrf2/GPX4信号通路,下调活性氧水平,抑制铁死亡[32]。半枝莲的主要化合物灯盏花乙素通过调节核转录因子-κB及Nrf2信号通路,逆转KOA中聚集蛋白聚糖及Ⅱ型胶原蛋白的低表达,降低软骨细胞中的炎症表达[33]。分子对接结果表明,所筛选的关节靶点与核心化合物是合理与可靠的,推测在中药干预软骨细胞铁死亡中发挥了关键作用。
干预软骨细胞铁死亡的中药药性为寒温并重,临床中膝骨性关节炎的证候是复杂多变的,单纯寒证或单纯热证并不多见,多数为寒热错杂的病证,用药也需要寒性药与温性药并用。中药药味以苦、辛、甘为主,苦味能泄,能燥,即清热泻火燥湿;辛味能行,即行气行血,活血化瘀;甘味能补,能缓,即补虚扶正,缓急止痛。这与膝骨性关节炎中医证候类型的用药是相吻合的。筛选的中药主要归肝、肺及脾胃经,肝主筋,筋附于骨而聚于关节,且肝藏血,是铁离子主要储存场所,肝主疏泄,肺主治节,肝升肺降,一升一降,升降协调,共同调节人体气机及气血运行,对人体的生理功能有着重要的调节作用。脾胃为后天之本,脾主运化,胃主受纳,外源性铁元素的摄入主要通过食物,纳运协调,可以促进铁离子的正常吸收与代谢。根据用药规律分析,干预软骨细胞铁死亡的中药主要为清热类、补虚类及活血化瘀类,这与所筛选出的中药药性相匹配,治疗细胞铁死亡时需要清热消炎,行气活血,补虚扶正。
本研究基于网络信息学与数据挖掘,以软骨细胞与铁死亡为切入点,探究铁死亡在KOA中的作用机制,分析中药干预软骨细胞铁死亡关键靶点、核心化合物及用药规律,为研究中医药治疗KOA的作用机制提供新的思路与方法。本研究进行了中药的定性分析,可为后续进行药物定量验证研究提供依据。

