CRISPR/Cas9技术在遗传性心脏疾病中的研究进展
黎江溪,张世梅,王玉鑫,赵跃
( 大理大学基础医学院 生理学与病理生理学教研室,云南 大理 671000 )
自人类基因组成功测序以来,基因编辑技术的问世为解析生物体的基因信息和功能提供了巨大的便利。常见的基因编辑技术有三种:其中最早的是锌指核酸酶(zinc finger nucleases, ZFNs)技术,由ZFN二聚体通过DNA结合域(锌指结构域)识别双链DNA上的靶位点,及FokI(核酸内切酶结构域)行使切割功能[1]。另一种是转录激活因子样效应物核酸酶(transcription activator like effector nucleases, TALENs)技术,该技术的工作原理与ZFNs类似。而规律成簇的间隔短回文重复序列(clustered regularly inter spaced short palindromic repeats, CRISPR/Cas9)是最新发现的。CRISPR/Cas9系统与ZFNs、TALENs相比有着操作简单、识别位点多样化、成功率高、花费低、周期短、毒性低等优点。这三种基因组编辑工具都可以切割DNA双链,作为进一步探索疾病病理生理学的理想工具而广泛用于生命科学各个领域[2]。
在心脏病学领域,与已知基因相关的疾病已得到充分研究。心脏病变常表现出一系列的心电功能障碍,患者最终可能出现进行性心力衰竭或心脏性死亡。在所有年龄段,遗传性心脏病都是与人类疾病相关发病率和死亡率的主要原因,且病变除心脏移植手术外无其它彻底治疗方法,这给全球造成严重的经济负担。一直以来,人们缺乏相对可靠的心脏疾病模型[3],如今,在CRISPR/Cas9技术偶联下,针对相应的遗传性心脏病的体内外模型相继问世。此外,对于遗传性疾病,CRISPR/Cas9在基于分子的干预领域(如抑制DNA或DNA上的遗传缺陷表达)取得了巨大的成功,在RNA水平也衍生了成熟的疗法,如基因组编辑、外显子跳跃、等位基因特异性沉默、RNA转拼、基因替代疗法等。因而,CRISPR/Cas9技术将引领人们对遗传性心脏病的探索走向新未来。
1 CRISPR/Cas9基因技术
根据核酸内切酶的识别和切割机制分类,CRISPR/Cas9系统为IIA型系统[4],组成最为简单,且准确、快捷、高效、成本低,最受人们瞩目。
1.1 CRISPR/Cas9的发现
CRISPR/Cas系统是存在于多数古生菌和细菌中的获得性免疫系统。最早于1987年,日本科学家ISHINO等[5]在大肠杆菌中首次发现串联间隔重复序列。2002年,JANSEN等[6]正式将其命明为CRISPR,还以Cas来命名相关的核酸酶。2005年MOJICA和POURCEL等[7-8]发现CRISPR的间隔序列(spacer)和宿主菌的染色体之外的遗传物质高度同源,并猜测其对外源遗传物质有免疫作用。之后,MAKAROVA等[9]猜想CRISPR/Cas系统可能是细菌的适应性防御系统。2007年,研究人员证明了嗜热链球菌中的CRISPR/Cas系统是针对溶血性噬菌体的适应性免疫系统,推测Cas9可能是干扰所需的唯一蛋白质[10]。2008年,科研人员在表皮葡萄球菌和大肠杆菌中发现成熟的CRISPR RNAs(crRNAs)可以与Cas9蛋白形成复合体,该复合体能干扰噬菌体的增殖,为CRISPR/Cas9技术的发展奠定了基础[11]。2012年,有研究表明tracrRNA对于Cas9核酸酶复合物具有重要功能,且由crRNA和tracrRNA融合成的sgRNA依旧会介导Cas9复合体发挥功能[12]。2013年,张峰等[13]建立了由CRISPR、tracrRNA和Cas9组成的基因调控系统,首次建立了小鼠疾病模型。2016年,SUZUKI等[14]通过CRISPR技术将DNA片段插入非分裂细胞中,在细胞治疗等方面引起巨大反响。2020年10月,诺贝尔化学奖被授予共同开发CRISPR基因编辑工具的法国微生物学家Emmanuelle和美国生物化学家Jennifer。短短30余年,CRISPR系统在生命科学的各个领域都得到了迅猛发展,其中CRISPR/Cas9系统被人们认为是改造得最成功的基因编辑工具。
1.2 CRISPR/Cas9的组成及原理机制
CRISPR/Cas9系统主要由三部分组成,短RNA分子、指导RNA(gRNA)及有核酸酶活性的Cas9蛋白组成的核糖核蛋白复合物[15](见图1)。规范的CRISPR/Cas9系统充当位点特异性核酸酶,对由gRNA决定的底物DNA序列进行靶向。在CRISPR/Cas9中,指定DNA靶标的部分不是蛋白质本身,而是单向导RNA(sgRNA)分子,能够直接设计和合成大小[16]。Cas9蛋白的使用避免了其他DNA结合蛋白[例如锌指核酸酶(ZFNs)和转录激活因子样效应物(TALE)]每次都需要根据不同的靶DNA序列的需求重新设计的弊端。sgRNA Cas9的切割需要sgRNA(间隔序列)和protospacer(靶DNA序列)之间的序列互补,以及在其3'端存在合适的原间隔子序列(PAM),即CRISPR/Cas9的识别依赖于crRNA或sgRNA上的20个碱基的向导序列与目的DNA以及PAM切割位点的特异性[17](见图2)。CRISPR/Cas9系统源自原核生物中适应性免疫系统,PAM序列的存在使该系统能够区分自身和非自身的DNA靶标[18]。当外源性遗传物质入侵时,该系统的蛋白-RNA复合物首先与引导RNA的碱基配对定位在目标DNA序列上,然后在RNA指定的基因座上产生天然的dsDNA断裂(DSB)。为了响应DSB,细胞DNA修复则会通过非同源末端连接(NHEJ)致使DNA切割位点的随机插入或缺失。若存在同源DNA模板,切割位点周围的DNA就可以通过同源指导修复(HDR)来替换。在此过程中,HDR与NHEJ相互竞争,而插入缺失标记比基因置换更为丰富[19]。科研人员在使用CRISPR/Cas9时通常首先设计一小段特异性RNA序列(single guide RNA,sgRNA)与Cas9和转录调控因子形成的融合蛋白组成复合体,然后使复合体中的sgRNA的碱基互补配对序列与目的基因结合,之后Cas9 sgRNA复合物作为支架将效应分子募集到相应靶标从而激活基因转录或因空间位阻阻止RNA聚合酶与启动子结合及抑制转录延伸,最终Cas9利用内切酶活性对目标DNA序列进行切割[20]。
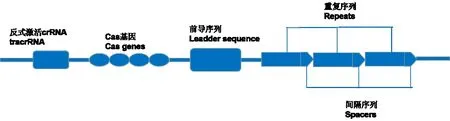
图1 CRISPR/Cas9系统的组成成分
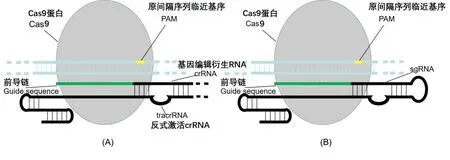
图2 CRISPR/Cas9系统的识别原理
1.3 CRISPR/Cas9的局限及改进方法
CRISPR/Cas9作为高效的基因编辑技术,存在着一些尚待解决的问题,如备受关注的脱靶效应、递送系统等,如何提高基因编辑的准确率及效率仍是科研人员关注的话题。
1.3.1 CRISPR/Cas9的局限 ①CRISPR/Cas9的脱靶效应CRISPR/Cas9进行基因组编辑会产生DSB,从而引起易错的非同源末端连接DNA修复途径,导致脱靶。脱靶效应可分为三种类型[21-22],第一种包括其他PAM(5'-NGG-3')上具有取代或错配的区域;第二种涉及其他PAM上包含插入和/或缺失的区域;第三种是切割具有不同PAM位点的序列。目前已有多种防止脱靶断裂的方法,包括双切口法,FokI-dCas9融合蛋白法和截短sgRNA法等[23]。②CRISPR/Ca9切割位点的偏移和低精确修复比例CRISPR/Ca9系统进行精确编辑时,会引入一段外源DNA进行同源修复,但由于Cas9蛋白切割位点可能会产生偏移,且修复系统外源与DNA同源修复缺乏响应,使得精确修复比例变低[24]。sgRNA的长度和靶标的位置也会对CRISPR/Ca9系统的精确性产生影响[25]。③PAM序列的严格依赖性Cas9蛋白与PAM结合对靶标序列进行识别时,一定程度上PAM可以限制CRISPR/Ca9系统对靶点的选择。PAM的有限性导致CRISPR/Ca9系统不能在全基因组的任意位点进行特异性切割[26]。④传递系统中的载体问题CRISPR/Ca9系统的运输主要是物理递送及病毒递送。物理递送包括显微注射、电穿孔等,常面临递送容量、药理问题等[26]。病毒载体则可能引发插入诱变、免疫原性及致癌作用等相关问题。其中,腺相关病毒(AAV)是CRISPR/Cas9组件递送的常用的选择,但AAV能容纳的货物体积较小[27]。⑤Cas9蛋白导致的宿主细胞的免疫排斥反应CRISPR/Ca9系统能引发靶细胞免疫排斥反应,当成分在体内传递,宿主的免疫系统便会发生排斥[28]。与其它病毒相比,AAV的免疫原性差,能触发免疫系统的各个组成部分。此外大多数人已经接触过腺病毒,会导致预先存在的适应性反应,这使得免疫排斥反应更为复杂[29]。
1.3.2 CRISPR/Cas9的改进方法 ①sgRNA的设计sgRNA与靶基因特异性结合,对于Cas9执行靶向切割功能的效率有较大影响。对于sgRNA,取决于物种基因组的大小,可能存在较多相似的序列,这些相似的序列断裂可能导致恶性肿瘤甚至死亡[30]。有关CRISPR/Cas9初步靶向的研究表明,并非gRNA中的每个核苷酸碱基都需要与靶DNA序列互补才能影响Cas9核酸酶活性。目前人们通常将crRNA和tracrRNA结合成一条单独sgRNA,在早期,执行引导功能的RNA是双引导RNA(dual guide RNA),其中crRNA和tracrRNA分别各自表达[31]。但 sgRNA与 Cas9形成的 Cas9-sgRNA复合物比双引导RNA与Cas9形成的Cas9-crRNA-tracrRNA复合物速度更快,使得用sgRNA进行基因编辑时效率会更高。②CRISPR/Ca9运载体的选取安全高效的运输载体也是CRISPR/Ca9有效应用的重要部分。将携带的DNA序列传递到靶细胞时可采用非病毒技术,例如电穿孔,脂转染和显微注射[32]。显微注射进行的基因转移被看作是金标准,传递效率约为100%[33]。该方法的优点是效率高及对传递大小的限制小,缺点是只能在体外或离体货物中使用。近年来,科研人员测试了基于纳米粒子的创新传输系统,该系统能提供CRISPR/Cas9构建体且最大限度地发挥相应功效[34-35]。③CRISPR/Cas9基因靶向效率在HDR修复过程中需质粒或单链寡核苷酸作为修复过程中的模板。目前HDR模板能够被病毒或非病毒载体安全地运送到细胞核[36]。有研究表明[37],HDR 模板末端添加的截短的Cas9目标序列(tCTS)与Cas9核糖核蛋白(RNP)相互作用,可使模板快速穿梭至细胞核,HDR效率提高约2~4倍。此外,用聚谷氨酸将Cas9 RNP稳定纳米颗粒,编辑效率提高约两倍且毒性小能冻干保存。结合这两种改进,即使减少HDR模板剂量,也能提高基因靶向效率。
2 CRISPR/Cas9在遗传性心脏病中的应用
大多数遗传性心脏疾病,如:冠心病(CHD)、肥厚型心肌病(HCM)、杜氏肌营养不良(DMD),由单个基因或多个突变基因引发,某些神经肌肉疾病也具有心脏疾病的特征[38-39]。尽管这些疾病具有很大的异质性,但许多研究小组已成功鉴定出与心脏病相关的基因,这些信息能被基因组编辑技术所利用。CRISPR/Cas9技术相比其它两种编辑技术有着突出的优点,广泛用于基因的敲除或敲入标记、大片段删除及转录调控,常作为探索与遗传性心脏疾病机制及治疗的重要工具。
2.1 体内外模型中的应用
2.1.1 体外模型 人类胚胎干细胞(hESC)的出现和适当的培养使它们成为研究特殊疾病和机制的有效工具,CRISPR/Cas9技术可以实现等基因集的生成,在比较疾病相关和健康的同基因hPSCCM的集合时,将突变对心脏疾病进展的影响分离[40]。在CRISPR/Cas9技术帮助下,针对遗传心脏疾病的优秀模型相继问世。JAFFRÉ等[41]对患者来源的心肌细胞运用CRISPR/Cas9产生的等基因对照iPSC来源的心肌细胞成功建立Noonan综合征的HCM模型。LI等[42]使用CRISPR/Cas9技术敲除H9(hESC)细胞系上的MLP(横纹肌相关蛋白)产生相应的缺陷型,该缺陷型后发展为HCM。Roche等[43]利用 CRISPR/Cas9 在人类诱导的hiPSC-CMs引入了Brugada综合征(BrS)突变,作为一种独立于患者的遗传背景,揭示了钠通道失活引发BrS的机制。
此外,CRISPR/Cas9技术常用于研究各种基因或蛋白质在遗传性心脏疾病机制中的作用。CHANG等[44]利用CRISPR/Cas9技术构建了两种FHL2基因敲除胚胎干细胞系,可用于DCM的机制研究及药物筛选。CEHOLSKI等[45]通过构建PLN突变hiPSC-CM细胞系,证实了该突变可导致心肌细胞对β受体激动剂反应迟缓。LI等[46]使用CRISPR/Cas9技术创建RAD(糖尿病相关蛋白)缺陷型人类胚胎干细胞系证明了细胞内钙水平升高和钙调节异常是RAD缺乏导致心脏肥大的核心机制。XIE等[47]利用CRISPR/Cas9基因编辑技术产生了有关TOF(法洛四联症)的hESC,揭示了TOF罕见突变通过HB-EGF信号转导人胚胎干细胞衍生的心肌肥大。ANG等[48]将 iPSC和CRISPR/Cas9技术相结合,在体外建立了与GATA4基因突变相关的先天性心脏病模型,来探讨该基因突变所导致的发病机制。MARCZENKE[49]利用 CRISPR/Cas9 与房颤相关的KCNA5基因,首次阐明了K+离子通道在心房hiPSC心肌细胞中的作用。
不仅如此,CRISPR/Cas9技术也增进人们对遗传性心脏病病理生理的理解。BHAGWAN等[50]利用CRISPR/Cas9切口酶靶向hiPSC中的基因座且引入遗传编码的钙指示剂,使得hPSC-CMs能够进行实时 Ca2+成像。CEHOLSKI等[51]用 CRISPR/Cas9将R9C PLN(引起DCM的心脏蛋白)突变的内源位点插入没有心血管疾病的人诱导hiPSC系,显示出钝化的β激动剂反应和有缺陷的钙处理,助于更好地了解人类心肌细胞中遗传性DCM的病理特征。SMITH等[52]利用CRISPR/Cas9技术在诱导的hPSC上引入某种突变产生了概括了许多疾病表型(异常收缩、Ca2+敏感、心律失常和肥大信号)的心肌病模型。WANG等[53]使用患者来源的hiPSC,运用CRISPR/Cas9和组织工程技术,在组织构建体中复制了巴氏综合征心肌病的病理生理学。GUO等[54]开发了基于CRISPR/Cas9-AAV9的体细胞诱变的CASAAV平台,通过该平台分析并解剖心肌细胞。
2.1.2 体内模型 由于衍生的心肌细胞应用上显示出有限的成熟度且物种来源不同,导致hPSCCM疾病模型无法概括多细胞完整心脏系统的生理复杂性,例如,代谢变化及细胞外基质改变[55]。近年来一些研究将CRISPR/Cas9技术应用到动物疾病模型的构建中,避免了传统的建模耗时长,效率低以及定位不精准等问题。其中,小鼠是最早且比较成熟的转基因动物模型。NAKAMURA等[56]使用CRISPR/Cas9相关DNA的血管内递送转染小鼠胎儿细胞证明了小鼠胎儿心脏中基因组序列的突变确实是通过静脉内导入并转染胚胎心脏细胞并随后表达Cas9和gRNA诱导的。JOHANSEN 等[57]使用 CRISPR/Cas9和 AAV9介导的短链RNA产生了心肌细胞特异性Cas9小鼠,并证明Cas9表达不影响心脏功能或基因表达。LIU等[58]利用CRISPR/Cas9基因组编辑技术在小鼠中验证了引发发育不良的左心综合征(HLHS)的双基因,表明HLHS可以通过组合方式遗传产生,从而为冠心病的复杂遗传学提供了新的范例。ALANKARAGE 等[59]通过创建 CRISPR/Cas9 基因编辑的小鼠模型对从患有先天性心脏病(CHD)的患者中鉴定出的新型错义变异体进行功能分析,揭示了多个先天性异常对CHD的影响。
随着基因编辑技术的不断进步,CRISPR/Cas9产生了许多除小鼠以外的转基因动物。CHEN等[60]使用CRISPR/Cas9系统生成的gtpbp3敲除斑马鱼,演示了gtpbp3敲除后异常的线粒体tRNA代谢,研究了Gtpbp3对线粒体生物发生和心脏功能的影响。LIANG等[61]通过CRISPR/Cas9技术在斑马鱼模型中进一步分析了异位症候群(HS)候选基因的功能,揭示了可能具有不同分子机制的三个潜在的HS致病基因。SASAGAWA等[62]使用CRISPR/Cas9敲除了斑马鱼中的GSTK1,发现在GSTK1基因敲除的斑马鱼中GSTK1的下调可能是各种病因的HCM的共同机制。SUI等[63]则通过CRISPR/Cas9技术成功产生了有关DMD的兔模型。YU等[64]也利用CRISPR/Cas9技术成功产生DMD的猪模型。DENIZ等[65]将CRISPR/Cas9系统和微型成像模态光学相干断层扫描相结合,对非洲爪蟾等发育系统强大的生物的心脏发育进行不同基因的分析。
2.2 基因治疗中的应用
遗传性心脏病采用基因治疗可以实现永久纠正,该思想最早由Clyde Keeler于1947年提出[66]。目前,全球已批准2300多项基因编辑临床试验,这些临床实验主要针对遗传性疾病。而下一代测序、生物信息学分析、临床发现和基础研究正在不断发现与心脏疾病有关的新基因,也为基因组编辑提供了新的治疗靶点。精确的基因组编辑技术使人类的种系突变得以纠正,尽管备受争议,一项研究在CRISPR/Cas9基础上将携带男性患者的杂合MYBPC3突变的精子,对健康女性的卵母细胞进行授精,发现携带HCM突变的人类胚胎中进行高保真基因修复是可行的,该技术还消除了镶嵌现象[67]。PRONDZYNSKI等[68]评价 MYBPC3反式剪接和基因置换作为人iPSC衍生心肌细胞的治疗选择,报告了来自健康供体和携带MYBPC3截短突变的HCM患者在hiPSC-CM中使用HCM的两种基因疗法的主要可行性。
由于疾病的遗传性和缺乏有效的疗法,DMD是种系基因组编辑的有吸引力的候选疾病。BENGTSSON等[69]利用CRISPR/Cas9技术开发了多种方法来改善患有DMD的小鼠模型的病理生理,表明AAV介导的肌肉特异性基因编辑在DMD的治疗中具有重要的潜力。MATA等[70]则通过CRISPR/Cas9技术矫正了DMD基因在狗疾病模型中的突变,并在该方法中提高了HDR介导的基因修复率。
不仅如此,一些不常见的遗传性心脏疾病在治疗中也成功应用了CRISPR/Cas9技术。KANEKO等[71]通过CRISPR/Cas9进行种系基因组编辑,以敲除严重心力衰竭小鼠模型中的PLN基因,结果表明被敲除的小鼠存活时间更长。XIE等[72]通过实验表明体内CRISPR/Cas9基因组编辑是通过选择性破坏致病突变来治疗PRKAG2心脏综合征和其他主要遗传性心脏病的有效工具,且结合多种测序分析,在样品的任何测试位点均未检测到脱靶和插入缺失。ZENG等[73]为马凡氏综合征基因治疗的技术可行性提供了原理证明,他们利用CRISPR/Cas9技术对人细胞和杂合子胚胎的碱基编辑实现了马凡氏综合征病原性FBN1突变的校正。
3 结语与展望
CRISPR/Cas9基因编辑技术可在细胞和生物个体水平中实现单个碱基的编辑,是最具有应用前景的基因编辑技术。尽管CRISPR/Cas9技术广泛用于基因的敲除或敲入标记、大片段删除及转录调控,成为了探索与遗传性疾病病理机制的重要工具。但由于CRISPR/Cas9基因编辑技术还存在一些问题需要我们去解决,如脱靶效应能导致未敲除目的基因,反而破坏了其他基因,最终造成癌症的发生及一些毒副作用。因此,CRISPR/Cas9技术在遗传疾病领域的临床应用还面临一定的挑战。但通过科学家的努力,CRISPR/Cas9技术正在不断的被改进和优化,未来对遗传性心脏疾病的机制研究及临床治疗中将得到广泛的应用,最终攻克遗传性心脏病的治疗难题,为更多的遗传性疾病患者带来福音。

