内生拮抗细菌对草莓2种病原真菌的抑制作用
张 莉,张博源,陈思乐,刘 猛,潘威霖,蒲一蕾,惠 明,谢 辉
(1.河南工业大学生物工程学院,河南郑州 450001; 2.河南省蚕业科学研究院,河南郑州 450001;3.工业微生物菌种保藏与选育河南省工程实验室,河南郑州 450001)
灰葡萄孢菌(Botrytiscinerea)是半知菌亚门病原菌,寄主范围相当广泛,其菌丝、孢子和菌核都可以侵染多种植物,对于宿主具有致死性,尤其容易感染瓜类、浆果类和茄果类等果蔬作物,是限制果蔬品质和产量提高的重要因素之一[1]。镰刀菌属(Fusariumspp.)是一类分布广泛的真菌,其致病性广,致病力强,使植物表现出萎蔫、腐烂、坏死等症状。张阳等研究发现,木贼镰刀菌、尖孢镰刀菌和茄腐镰孢菌均可造成草莓根腐病的发生[2]。在美洲、欧洲、澳洲和亚洲的部分区域都发现尖孢镰刀菌(F.oxysporum)和腐皮镰孢菌(F.solani)侵染草莓植株,而引起根腐病的报道,镰刀菌属病原菌已成为防治草莓根腐病中最棘手的病原种类[3]。
目前主要在植物叶面喷洒化学药剂防控植物真菌病害,化学方法抑制病害效果较好,但易使病原菌产生高抗药性,防治效果逐渐减弱[4]。生物防治主要利用细菌、真菌、放线菌等微生物,其新陈代谢产生的拮抗物质、促生物质和占据空间可以抑制病原菌的生长,因此不宜使病原菌产生耐药性,不会造成环境污染,有利于保持生态平衡。地衣芽孢杆菌(Bacilluslicheniformis)、格氏沙雷菌(Serratiagrimesii)、绿针假单胞菌(Pseudomonasaeruginosa)和丁香假单胞菌(P.syringae)都能显著抑制灰葡萄孢菌的菌丝生长和分生孢子萌发[5-8]。近年来,研究者分离出许多对病原真菌具有良好拮抗效果的植物内生菌[4],如从樱桃中分离得到的内生特基拉芽孢杆菌(B.tequilensis) TY-6[9],从番茄内生菌中筛选出的贝莱斯芽孢杆菌(B.velezensis)[10]。荧光假单胞菌(P.fruorescnes)、从枝菌根菌(arbuscular mycorrhiza)、枝芽孢菌属(Virgibacillus)、白黑链霉菌(S.alboniger) 和白刺链霉菌(Streptomycesalbospinus)等许多微生物被证实对草莓根腐病病原菌和灰霉菌有拮抗作用[11-13]。
植物内生菌是从健康植株中分离出来的菌株,在植物体内具有稳定的生存空间,不对宿主产生明显的病害,而且可以产生多种抗菌活性物质,可以与植物病原体进行相互竞争获得一种有利于自身发展和繁殖的因子,从而提高植物宿主对于这些病原体的抵御能力,是很有潜力的生物预防资源[14]。目前,对于植物内生菌拮抗灰霉病病菌和根腐病病菌的研究已有报道[6-7],但拮抗灰葡萄孢菌和腐皮镰刀菌的草莓内生菌鲜见报道。本研究从草莓植株中分离出内生菌,筛选出对灰葡萄孢菌具有良好抑制拮抗效果的菌株,并对抑菌效果进行初步研究。
1 材料与方法
1.1 供试材料
1.1.1 供试菌种 草莓内生菌从草莓健康植株上分离获得;草莓灰葡萄孢菌从草莓果实上分离获得,腐皮镰刀菌从发病草莓植株根部分离获得。
1.1.2 培养基 PDA培养基、PDB培养基、LB培养基和孟加拉红培养基,均在121 ℃条件下高压灭菌20 min后使用。
1.2 试验方法
1.2.1 内生菌的形态观察 将草莓内生菌采用平板划线法在LB固体培养基上得单菌落,观察记录在培养基平板上的生长状况、菌落颜色及特征。培养 3~5 d后,进行细菌革兰氏染色,在显微镜下观察菌落形态、大小和颜色,从而初步对拮抗菌进行分类。
1.2.2 灰葡萄孢菌孢子悬液的制备 将灰葡萄孢菌接入PDA培养基,28 ℃培养5~7 d,取菌丝和孢子放入无菌水中,过滤去除菌丝,制备孢子悬液,采用血球计数法调整悬液中孢子浓度为107CFU/mL,分装备用[15]。
1.2.3 拮抗细菌的筛选与拮抗能力的测定
1.2.3.1 拮抗细菌的筛选 以灰葡萄孢菌和腐皮镰刀菌为靶标真菌,采用传统的三点对峙培养法,挑取PDA平板上扩大培养的病原菌的菌丝接种于PDA培养基正中间,在距中心等距离处接种待筛选的菌株,以无菌水作为对照,28 ℃恒温培养4~5 d,观察内生菌对病原菌的抑制情况,每个菌种重复 2~3次。
1.2.3.2 拮抗菌株的拮抗性能测定 采用两点平板对峙法,对初筛有效果的细菌进行复筛。在直径为90 mm的装有PDA培养基培养皿背面任意画2条直径,在距离圆心2.5 cm的位置接种直径为 8 mm 的病原菌菌饼,在对称的另一侧相同距离处点接细菌。对照组在病原菌菌饼的对称侧点接无菌水。28 ℃培养 3~5 d,监测生长情况。对照组真菌菌落边缘至真菌中心位置的距离为R1;试验组真菌菌落边缘至真菌中心位置的距离为R2;真菌菌落边缘至相邻细菌菌落边缘距离为R3,即抑菌半径。抑菌率按照公式(1)计算:

(1)
1.2.3.3 拮抗菌无菌发酵滤液的抑菌活性测定[16]取拮抗菌接种于PDB培养基中,28 ℃、180 r/min培养 48 h,之后12 000 r/min离心20 min,收集上清液,分别用孔径为0.22、0.45 μm的滤膜过滤,得到无菌发酵液。用55 ℃左右的PDA培养基把上述发酵液稀释10、20倍,之后倒平板。用添加同体积无菌水的PDA培养基为对照。吸取10 mL无菌发酵液加入90 mL PDA培养基,每个平板倒入约25 mL,分4个平板。培养基凝固后,在中心接入直径为 8 mm 的灰葡萄孢菌块,28 ℃恒温培养。对照平板菌丝到菌落中心距离为RO,对不同处理中病原菌的菌落直径(R1)进行测量。采用公式(2)计算抑菌率。

(2)
1.2.3.4 拮抗菌无菌发酵液对孢子活性的影响 萌发率计算:孢子悬浮液每隔6 h观察1次,在12 h后观察并记录每个处理组的孢子悬浮液中孢子的萌发率,取血球计数板,每个玻片在物镜40×放大倍数下,随机选取5个不同的视野,记录孢子总数和孢子萌发数,孢子萌发出的菌丝长度超过孢子长度的1/2记为已萌发。每个处理组选取的5个视野的平均值与对照组106CFU/mL浓度的孢子悬液在所选视野中的孢子萌发数与孢子总数的比值即为该处理组的孢子萌发率,并根据公式(3)、公式(4)计算发酵液对病原菌孢子的萌发抑制率[17]。

(3)

(4)
1.2.4 16S rRNA的PCR扩增和序列分析 选取通用引物16S-27F(5′-A G A G T T T G A T C M T G G C T C A G-3′);16S-1492R (5′-G G Y T A C C T T G T T A C G A C T T-3′)进行PCR扩增。扩增产物回收、测序并进行同源性比较,利用MEGA X软件用邻接法neighbour-joining构建16S rRNA系统发育树分析。
2 结果与分析
2.1 内生细菌形态学特征的鉴定
对草莓9株内生细菌进行初步鉴定,从菌落形态可以看出,这9种菌落颜色为白色或乳白色,不透明,圆形,光滑或不规则,大部分属于革兰氏阳性杆菌(图1),只有菌株AJ-CM321-1属于革兰氏阴性杆菌,无芽孢,而属于革兰氏阳性杆菌的除菌株CO-CML21-3外其他菌株均有芽孢(表1)。


表1 9株内生拮抗菌形态及染色特征
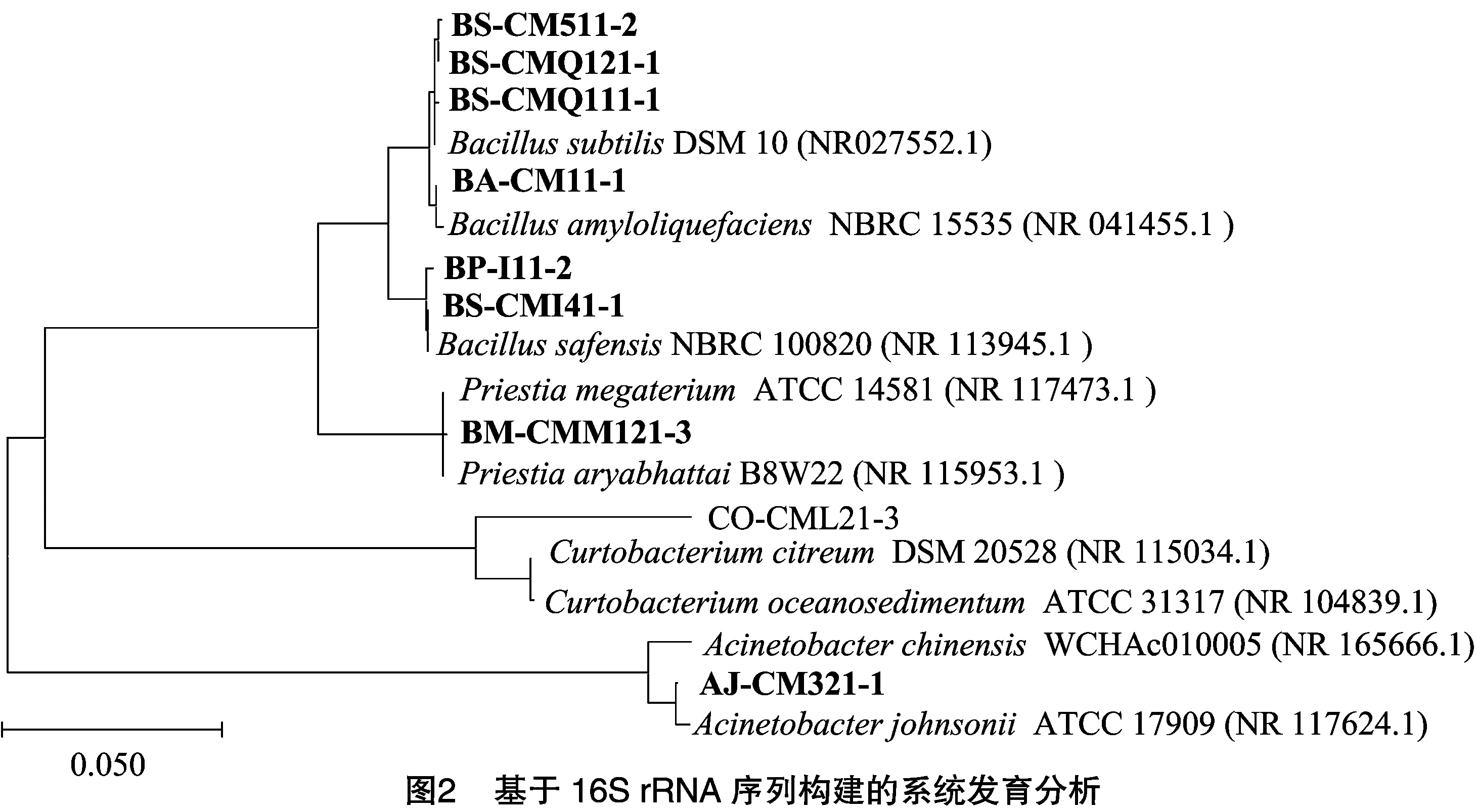
2.2 拮抗菌系统发育树分析
对16S rRNA的PCR扩增产物进行检测观察,扩增产物有单一的明亮条带产生,之后进行送样测序。根据测序结果,构建系统发育树进行分析,菌株BS-CM511-2、BS-CMQ121-1、BS-CMQ111-1与枯草芽孢杆菌(BacillussubtilisDSM 10)在同一分支,同源性达到99.3%,结合形态学和革兰氏染色鉴定结果可将其鉴定为枯草芽孢杆菌。
菌株BA-CM11-1与解淀粉芽孢杆菌(B.amyloliquefaciensNBRC 15535)的序列同源性高达99.8%,且这2个菌株在系统发育树的同一分支上,结合形态学和革兰氏染色鉴定结果,可认定内生菌BA-CM11-1为解淀粉芽孢杆菌。结合形态学和革兰氏染色鉴定结果可知,菌株BS-CMI41-1和 BP-I11-2与萨夫芽孢杆菌(B.safensis)的同源性分别为99.03%和99.52%;菌株AJ-CM321-1与约翰逊不动杆菌(Acinetobacterjohnsonii)的同源性为99.13%;菌株CO-CML21-3与海洋双歧杆菌(Curtobacteriumoceanosedimentum)的同源性为89.71%;菌株BM-CMM121-3与巨大芽孢杆菌(Priestiamegaterium)的同源性为99.45%(图2)。
2.3 拮抗内生细菌对灰葡萄孢菌及腐皮镰刀菌的拮抗能力测定
以病原菌为靶标真菌,初筛采用平板三点对峙法,从上述草莓内生菌中初步筛选具有明显拮抗效果的菌株。进一步缩小范围后,采用平板两点对峙培养法进行进一步的抑菌效果测定。结果表明,在枯草芽孢杆菌BS-CM511-2菌株与灰葡萄孢菌对峙时,灰葡萄孢菌的生长明显受到抑制,抑菌半径为27 mm,解淀粉芽孢杆菌BA-CM11-1菌株的抑菌半径为36 mm。解淀粉芽孢杆菌BA-CM11-1对灰葡萄孢菌的抑菌率为39.95%,枯草芽孢杆菌 BS-CM511-2对灰葡萄孢菌的抑菌率为57.23%,这2株菌对腐皮镰刀菌的抑菌率分别是46.10%和27.20%(表2)。
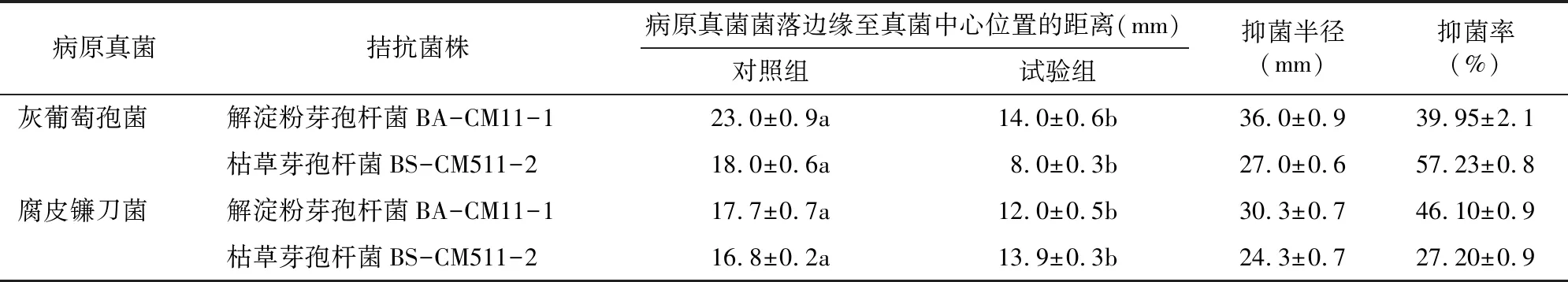
表2 拮抗菌对草莓病原真菌的抑菌率
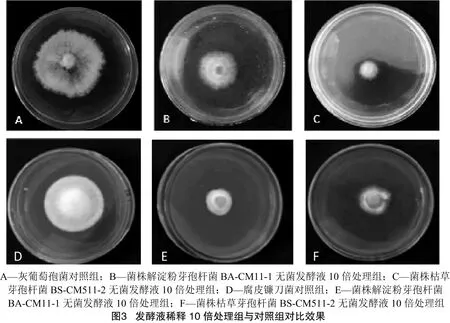
2.3.1 拮抗菌无菌发酵滤液对病原真菌的拮抗作用 拮抗菌发酵48 h的菌液经无菌过滤稀释后加入到PDA培养基中,可以显著抑制灰葡萄孢菌和腐皮镰刀菌生长,图3为稀释10倍的发酵液处理前后灰葡萄孢菌和腐皮镰刀菌生长5 d的情况。与对照组相比加入了拮抗菌发酵液处理组,菌丝生长缓慢,稀薄。在不加拮抗菌发酵液的对照组中,灰葡萄孢菌生长旺盛,菌丝向外扩展迅速,培养5 d对照组中的灰葡萄孢菌和腐皮镰刀菌菌落生长至半个培养皿。
图4、图5分别为枯草芽孢杆菌BS-CM511-2和解淀粉芽孢杆菌BA-CM11-1无菌发酵液稀释
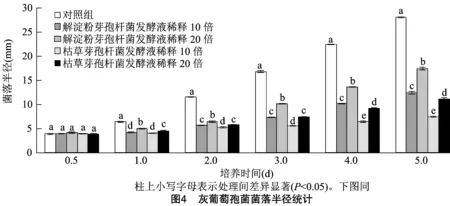
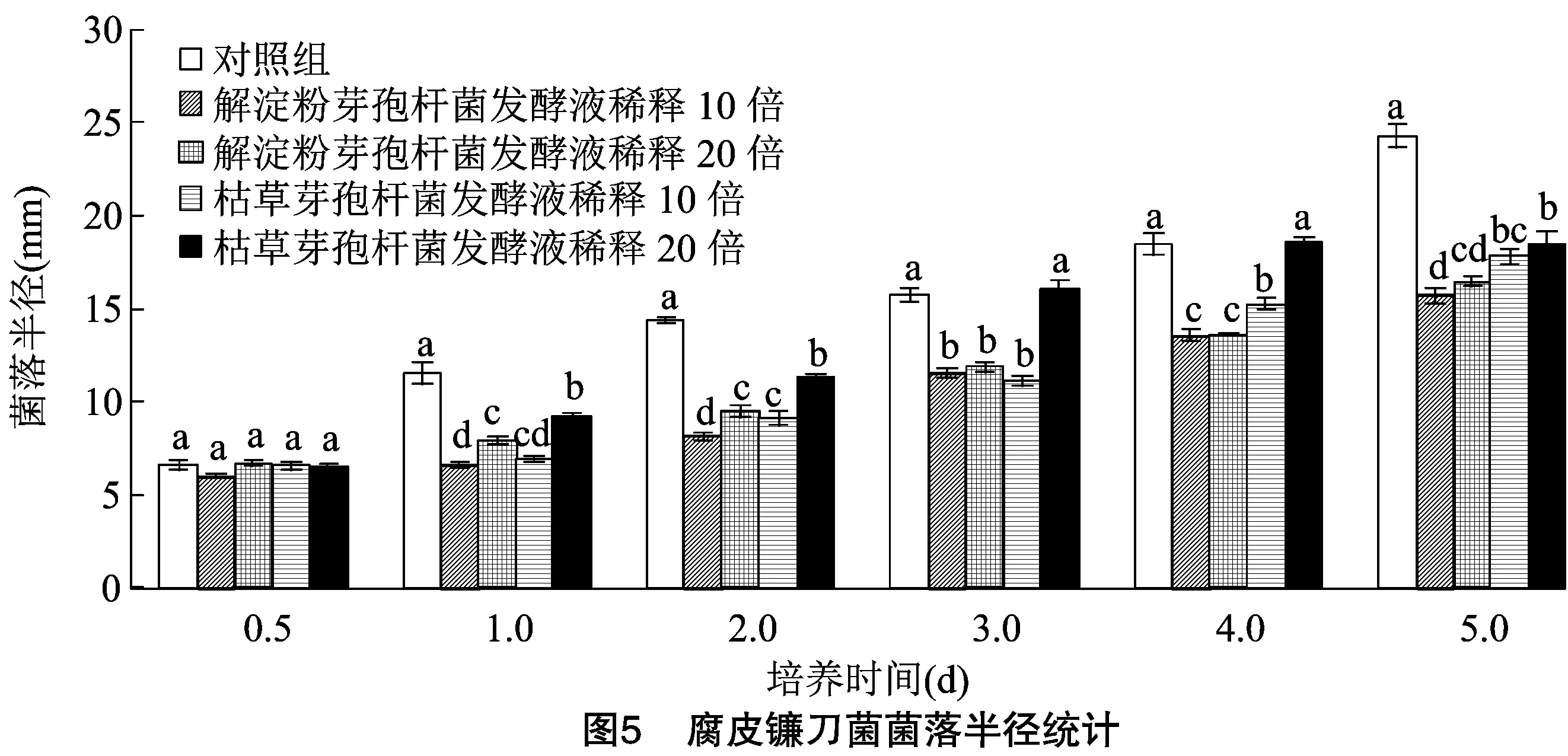
不同倍数对灰葡萄孢菌和腐皮镰刀菌菌落半径的影响。由图4、图5可见,随着培养时间的增加,各处理菌落半径均逐渐增加,且培养1.0 d后,稀释10倍和20倍的枯草芽孢杆菌BS-CM511-2和解淀粉芽孢杆菌BA-CM11-1无菌发酵液处理组的病原真菌菌落半径均显著小于对照组。其中稀释10倍的枯草芽孢杆菌BS-CM511-2发酵液对灰葡萄孢菌菌丝生长产生的抑制作用最大,培养5.0 d灰葡萄孢菌菌落半径比对照菌落半径小20.60 mm。加入稀释20倍的枯草芽孢杆菌BS-CM511-2发酵液,灰葡萄孢菌菌落半径较对照显著降低,培养5.0 d比对照的半径小17.57 mm。解淀粉芽孢杆菌BA-CM11-1无菌发酵液稀释10倍,对灰葡萄孢菌也具有显著抑制效果,培养5.0 d灰葡萄孢菌菌落半径比对照小15.64 mm,其抑菌效果与枯草芽孢杆菌BS-CM511-2无菌发酵液相比要弱。培养4.0、5.0 d时,各处理组灰葡萄孢菌菌落半径表现为枯草芽孢杆菌发酵液稀释10倍<枯草芽孢杆菌发酵液稀释20倍<解淀粉芽孢杆菌发酵液稀释10倍<解淀粉芽孢杆菌发酵液稀释20倍<对照,且差异均达到显著水平。添加不同浓度的无菌发酵液后,灰葡萄孢菌菌落大小不同,灰葡萄孢菌菌落大小随发酵液稀释倍数而变化。枯草芽孢杆菌发酵液稀释10倍对灰葡萄孢菌抑制效果最好。稀释10倍的解淀粉芽孢杆菌 BA-CM11-1无菌发酵液对腐皮镰刀菌菌丝生长产生的抑制作用最大,培养5.0 d腐皮镰刀菌菌落半径比对照菌落半径小 8.57 mm。稀释10倍的枯草芽孢杆菌BS-CM511-2发酵液对腐皮镰刀菌也具有显著的抑制效果,培养5.0 d腐皮镰刀菌菌落半径比对照小6.47 mm,其抑菌效果与解淀粉芽孢杆菌BA-CM11-1无菌发酵液相比要弱。在培养基中添加不同浓度的相同无菌发酵液后,随发酵液稀释倍数增大,腐皮镰刀菌菌落变小,解淀粉芽孢杆菌发酵液稀释10倍对腐皮镰刀菌菌丝生长的抑制效果最好。
2.3.2 无菌发酵滤液对病原真菌孢子的抑制作用 测定解淀粉芽孢杆菌BA-CM11-1和枯草芽孢杆菌BS-CM511-2的无菌发酵液对灰葡萄孢菌和腐皮镰刀菌孢子萌发的影响,以不加拮抗菌无菌发酵液作为对照。结果(表3)表明,培养12 h时无菌发酵液稀释10倍的条件下解淀粉芽孢杆菌BA-CM11-1对灰葡萄孢菌孢子的抑制率为81.57%,在相同稀释倍数下,枯草芽孢杆菌BS-CM511-2无菌发酵液对灰葡萄孢菌孢子萌发的抑制率显著高于解淀粉芽孢杆菌,为88.80%。相反,枯草芽孢杆菌BS-CM511-2发酵滤液处理的灰葡萄孢菌孢子萌发率比解淀粉芽孢杆菌BA-CM11-1低7.09%,且差异显著。解淀粉芽孢杆菌BA-CM11-1和枯草芽孢杆菌BS-CM511-2,在稀释20倍的情况下对灰葡萄孢菌孢子萌发均有较高抑制率,但低于稀释10倍的发酵液,分别为56.21%和62.83%。因此,枯草芽孢杆菌BS-CM511-2发酵液比解淀粉芽孢杆菌BA-CM11-1对灰葡萄孢菌孢子抑制作用强,稀释10倍的发酵液比稀释20倍的发酵液抑制作用强。解淀粉芽孢杆菌BA-CM11-1和枯草芽孢杆菌BS-CM511-2发酵液,稀释5倍较稀释10倍对腐皮镰刀菌孢子的抑制作用强,在相同稀释倍数下,枯草芽孢杆菌BS-CM511-2无菌发酵液对腐皮镰刀菌孢子的抑制率显著高于解淀粉芽孢杆菌。

表3 无菌发酵滤液不同倍数对病原真菌孢子萌发的抑制作用(12 h)
3 讨论与结论
植物内生细菌作为能稳定在健康植物组织内生长繁殖且与宿主建立互利互生关系的一类微生物,并在宿主抵御病原菌的侵染时进行协助。内生菌防治方法利用微生物及其代谢产物抑制植物病原菌的生长正越来越多地应用于实践[18-19]。目前,分析植物内生菌的生防效果是通过大量的分离纯化来鉴定进行测定内生菌的抑菌活性,刘超等从金银花等植物中分离的内生菌菌株JS-1对稻瘟病病菌具有很好的拮抗效果[20];宁爽分离得到的内生假单胞菌BTa14、Bar25可显著抑制葡萄霜霉病病菌增殖[21];何艺琴等从小麦中分离出对赤霉菌具有良好的抑菌效果的内生细菌XG-7[22];黄瓜的内生放线菌对多种靶标真菌都有较高的抑菌活性[23]。本研究从健康草莓植株中筛选得到9株内生菌,分别为巨大芽孢杆菌(P.megaterium)、海洋双歧杆菌(C.oceanosedimentum)、萨夫芽孢杆菌(B.safensis)、约翰逊不动杆菌(A.johnsonii)、枯草芽孢杆菌(B.subtilis) 和解淀粉芽孢杆菌(B.amyloliquefaciens)。其中稀释10倍的枯草芽孢杆菌BS-CM511-2发酵液对灰葡萄孢菌菌丝生长产生的抑制作用最大,培养5.0 d灰葡萄孢菌菌落半径比对照菌落半径小20.60 mm。枯草芽孢杆菌BS-CM511-2和解淀粉芽孢杆菌BA-CM11-1,2个菌株的无菌发酵液稀释10倍,对灰葡萄孢菌孢子萌发的抑制率分别为88.80%和81.57%,对灰葡萄孢菌有较好的拮抗效果。在培养基中添加不同浓度的相同无菌发酵液后,随发酵液稀释倍数的增大,腐皮镰刀菌菌落变小,解淀粉芽孢杆菌BA-CM11-1发酵液稀释10倍对腐皮镰刀菌菌丝生长的抑制效果最好。本研究筛选得到的这2株内生拮抗菌可作为生防资源应用于植物灰霉病和根腐病防治,两者在抑制率上存在差异,其发酵条件、抗菌物质和抑菌机制等仍需进一步研究。

