群结腐霉细胞壁降解酶的活性检测及基因表达分析
陈一帆,薛太强,陈思桥,张金凤,周冬梅,魏利辉
(1.江苏大学环境与安全工程学院,江苏镇江 212013; 2.江苏省农业科学院植物保护研究所,江苏南京 210014)
生姜(ZingiberofficinaleRosc.)是一种重要的经济作物,广泛种植于热带和亚热带地区[1]。中国是世界上生姜栽培面积最大且生产总量最多的国家之一,也是全球生姜出口大国。由群结腐霉(Pythiummyriotylum)侵染引起的生姜茎基腐病,是生姜主要病害之一[2],对生姜产业造成了巨大的经济损失[3-4]。该病害在生姜上的症状出现在地下根茎部位,表现为水渍状褐色病变,导致块茎腐烂、叶片变黄,最终使生姜萎蔫和坏死[5]。群结腐霉在世界各地都有分布,寄主范围广泛,除了生姜外还可以侵染花生等多种作物[6]。
植物病原菌按营养摄取方式可分为3种类型:活体营养型、死体营养型和半活体营养型[7]。活体营养型病原菌在其整个生命周期内从活的寄主细胞内摄取营养;死体营养型病原菌从死亡(或垂死)的寄主细胞中摄取营养;半活体营养型病原菌最初从活体寄主细胞摄取营养,然后转变为从死亡的寄主细胞中摄取营养。对3种类型病原菌分泌的植物细胞壁降解酶(plant cell wall-degrading enzymes,PCWDEs)数量进行比较发现,死体营养型病原菌中的PCWDEs数量最多;其次,半活体营养型病原菌,最少的是活体营养型病原菌[7]。PCWDEs主要包含3种碳水化合物活性酶(CAZymes),分别是糖苷水解酶(GH)、碳水化合物酯酶(CE)和多糖裂解酶(PL)[8]。植物细胞壁主要由纤维素、半纤维素、果胶和结构蛋白组成[9],是阻止病原菌入侵的主要物理屏障[10-12]。病原菌分泌的大量PCWDEs(如:纤维素酶,果胶酶,蛋白酶和木聚糖酶)可降解不同细胞壁组分,促进其侵染[13]。
纤维素和淀粉是生姜根茎中最主要的2种多糖[14],其中,纤维素是植物细胞壁的主要成分。病原菌产生的纤维素酶在其侵染植物和定殖的过程中起到重要作用[15]。纤维素酶如β-1,4-葡聚糖水解酶、内切葡聚糖酶和β-葡萄糖苷酶可降解纤维素生成葡萄糖,协同降解寄主细胞壁[16]。淀粉是植物中最重要的多糖之一,生姜根状茎中的淀粉含量约11.4%。不同种类的生姜淀粉中的直链淀粉所占的比例不同(约占18%~30%),与马铃薯淀粉相似[17]。淀粉酶一般作用于可溶性淀粉、直链淀粉、糖元等[18],分解直链淀粉后的最终产物以麦芽糖为主,同时还有麦芽三糖及少量葡萄糖。
群结腐霉属于死体营养型病原菌,基因组中含有大量PCWDEs编码基因[19-20],然而目前对这些PCWDEs的功能和特性知之甚少。本研究以群结腐霉在生姜粉末和葡萄糖培养基上生长的菌丝和环板中的培养液为材料,利用PCWDEs基因功能注释、转录组测序分析和酶活检测等方法,研究群结腐霉PCWDEs基因表达情况和酶活特征,从而深入探究群结腐霉侵染生姜的致病机制,为该病害的防控提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 本试验于2021年3月在江苏省农业科学院中进行,供试菌株群结腐霉SWQ7[21]从山东生姜病样中分离得到,保藏于江苏省农业科学院植物保护研究所蔬菜病害防控实验室。
1.1.2 培养基的配制 V8培养基[21]:V8蔬菜汁340 mL,CaCO33.4 g,5 000 r/min离心10 min后弃沉淀,按1 ∶9的体积比加入蒸馏水,琼脂1.5%,121 ℃ 灭菌20 min。
Plich液体培养基[22]:KH2PO40.5 g,MgSO4·7H2O 0.25 g,(NH4)2SO45 g,L-天冬酰胺 1 g,β-谷甾醇 0.01 g,使用NaOH调pH值至6.0,1 000 mL 超纯水,121 ℃灭菌15 min,加入硫胺素0.001 g。
1.1.3 主要试剂 葡萄糖,国药集团化学试剂有限公司;生姜粉末,山东省万兴食品有限公司;V8蔬菜汁,美国金宝汤公司;0.1 μm孔径的聚碳酸酯膜,美国GVS过滤技术公司;对硝基苯酚,上海西格玛奥德里奇贸易有限公司;对硝基苯基-α-D-吡喃葡萄糖苷,上海麦克林生化科技有限公司;对硝基苯基-β-D-吡喃葡萄糖苷,上海麦克林生化科技有限公司;对硝基苯基-β-D-吡喃木糖苷,上海麦克林生化科技有限公司;TruSeq Stranded mRNA试剂盒,因美纳科学器材有限公司。
1.1.4 主要仪器 单人双面垂直净化工作台,上海博迅医疗生物仪器股份有限公司;立式压力蒸汽灭菌锅,上海博迅医疗生物仪器股份有限公司;pH计,上海奥豪斯仪器有限公司;电子天平,上海奥豪斯仪器有限公司;恒温培养箱,上海善治仪器设备有限公司;生物分析仪,安捷伦科技有限公司;酶标仪,美国伯腾仪器有限公司。
1.2 试验方法
1.2.1 植物细胞壁降解酶类注释 使用生物学软件dbCAN2(http://bcb.unl.edu/dbCAN2/)分析蛋白质是否有CAZy结构域,预测碳水化合物活性酶的基因。利用CAZy网站(http://www.cazy.org/)[23],根据CAZy家族或亚家族分类推测含CAZy结构域蛋白的对应活性。PCWDEs指推测活性作用于植物细胞壁多糖组分或植物贮藏多糖的蛋白质,根据推测的活性列出底物。
1.2.2 环板试验 将群结腐霉SWQ7转接到含100 μg/mL氨苄青霉素的过滤V8培养基平板上,黑暗条件下于25 ℃培养箱中生长2 d。
本研究中使用一种称为环板的新型培养技术[24]。在环板的6个环形通道中加入含有 100 μg/mL 氨苄青霉素和适当碳源的Plich液体培养基,将聚碳酸酯膜覆盖在环板培养皿上,菌株转接在聚碳酸酯膜上生长,分别使用葡萄糖和生姜粉末作为碳源,制备浓度为1 mol/L葡萄糖原液并使用过滤灭菌,生姜粉末加入Plich培养基后高压灭菌。环板培养液中的葡萄糖最终浓度为25 mmol/L,生姜粉末的最终浓度为1%。将高温灭菌的聚碳酸酯膜覆盖在环板上,在环板中心接种直径为0.5 cm带有新鲜菌丝的V8琼脂块。25 ℃培养箱中黑暗生长72 h后,分别收集环板中聚碳酸酯膜上的菌丝(用于转录组分析)和下方环形通道中培养液(用于酶活检测),样品收集后立即放于液氮中速冻保藏。
1.2.3 RNA提取、RNA-seq文库制备、测序和数据分析 RNA的提取与纯化、RNA-seq文库制备及转录组测序由上海欧易生物医学科技有限公司完成。使用Trizol试剂提取样品中的RNA,在RNA样品中加入DNA酶去除残留的DNA。RNA的完整性采用生物分析仪来进行验证,使用分光光度计测量RNA纯度。通过TruSeq Stranded mRNA试剂盒制备2×150 bp的配对文库,并在Illumina HiSeq X平台上进行测序。
对原始数据利用Trimmomatic软件去除接头序列和低质量序列,获得高质量有效序列[25]。对处理后的序列采用UseGalaxy.eu中的软件工具进行下游分析[26],采用HISAT2 Galaxy将序列映射至SWQ7基因组进行组装[27](https://www.ncbi.nlm.nih.gov/genome/108473?genome_assembly_id=1746011)。使用HTSeq-count Galaxy统计所有比对质量 ≥ 10序列,采用联合模式处理重叠多个特征的序列,在它们映射至所有特征上计算非唯一映射序列[28]。利用DESeq2 Galaxy对计数数据进行基因差异表达分析,其中,默认Cook距离截止值用于异常值过滤[29]。差异表达基因的判定标准为在FPKM(Fragment per kilo bases per million reads)>10的情况下,DESeqPadj<0.05,DESeq log2FC>1或<-1。FPKM值通过表达每Kb基因长度的基因计数和每百万映射到所有基因的计数计算。
1.2.4 酶活测定 使用连接有对硝基苯酚(pNP)的底物进行酶活测定,在96孔板中加入总体积为100 μL标准测定缓冲液,其中含有Tris-HCl 20 mmol/L (pH值7.5),连有对硝基苯酚的底物2.5 mmol/L,环板培养液或超纯水20 μL。分别配制不同浓度的对硝基苯酚溶液(0、5、10、25、50、80、100、250 nmol/mL),测定对硝基苯酚溶液在405 nm波长处的数值,以标准品的浓度为横坐标、测定数值为纵坐标,绘制标准曲线。
在37 ℃反应3~8 h后,加入100 μL浓度为0.25 mol/L Na2CO3溶液终止反应,并使用酶标仪在405 nm波长处检测对硝基苯酚底物的水解量。酶活单位定义为1 μL培养基溶液1 h产生对硝基苯酚(pNP)的nmol量。本试验使用对硝基苯酚连接的底物检测酶活:使用对硝基苯基-α-D-吡喃葡萄糖苷检测α-葡萄糖苷酶活性;使用对硝基苯基-β-D-吡喃葡萄糖苷检测β-葡萄糖苷酶活性;使用对硝基苯基-β-D-吡喃木糖苷检测β-木糖苷酶活性。连接对硝基苯酚的底物在双蒸水中制备为50 mmol/L原液。试验中设置2个技术重复,4个生物学重复,结果使用Student’s T-test检验进行分析。
2 结果与分析
2.1 群结腐霉植物细胞壁降解酶的分析鉴定
通过生物学软件dbCAN2和CAZy网站预测分析,由图1和表1可知,得到群结腐霉中PCWDEs编码基因共273个,其中,纤维素降解酶有92个、木聚糖降解酶16个、果胶降解酶76个和淀粉降解酶7个。通过与其他已报道的腐霉菌株相比,群结腐霉中PCWDEs数量显著高于其他腐霉[30-35];除了贵阳腐霉和寡雄腐霉外,群结腐霉中纤维素降解酶、木聚糖降解酶、果胶降解酶和淀粉酶的数量是其他腐霉菌的2~3倍;值得注意,群结腐霉含有除瓜果腐霉和强雄腐霉以外,还含有其他腐霉菌不具有的木聚糖降解酶。
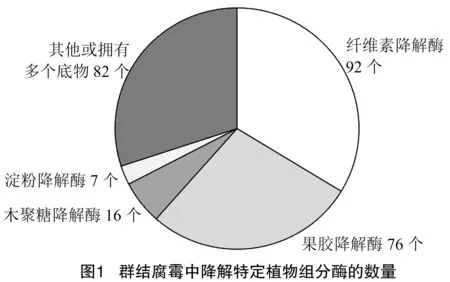

表1 群结腐霉和其他腐霉菌株中降解特定植物组分的PCWDEs数量
2.2 菌丝在环板上的生长情况
为了解群结腐霉PCWDEs在侵染生姜过程中的基因表达特征和酶活特性,本试验使用生姜粉末模拟生姜环境,试验对照选择最常作为简单碳源的葡萄糖为对照。由图2可知,生长72 h后观察群结腐霉菌丝生长情况,发现群结腐霉在生姜粉末和葡萄糖培养基上能够正常生长,但不能穿透聚碳酸酯膜生长至下方培养液中,但生姜粉末培养基中菌丝比葡萄糖培养基中生长得更加致密茂盛。
2.3 转录组结果分析
由转录组结果(表2)可知,以生姜粉末FPKM值>10,P<0.05,log2FC>1或<-1作为差异表达基因的判定标准发现,与葡萄糖培养基相比,群结腐霉在生姜粉末培养基上生长时有12个PCWDEs基因表达上调,这些基因编码的PCWDEs中的主要底物为淀粉和纤维素。其中,上调最高的2个基因为Pm_g10935.t1和Pm_g3514.t1,在CAZy家族中属于糖苷水解酶GH13_32,具有α-淀粉酶活性,其底物为淀粉。

2.4 酶活分析
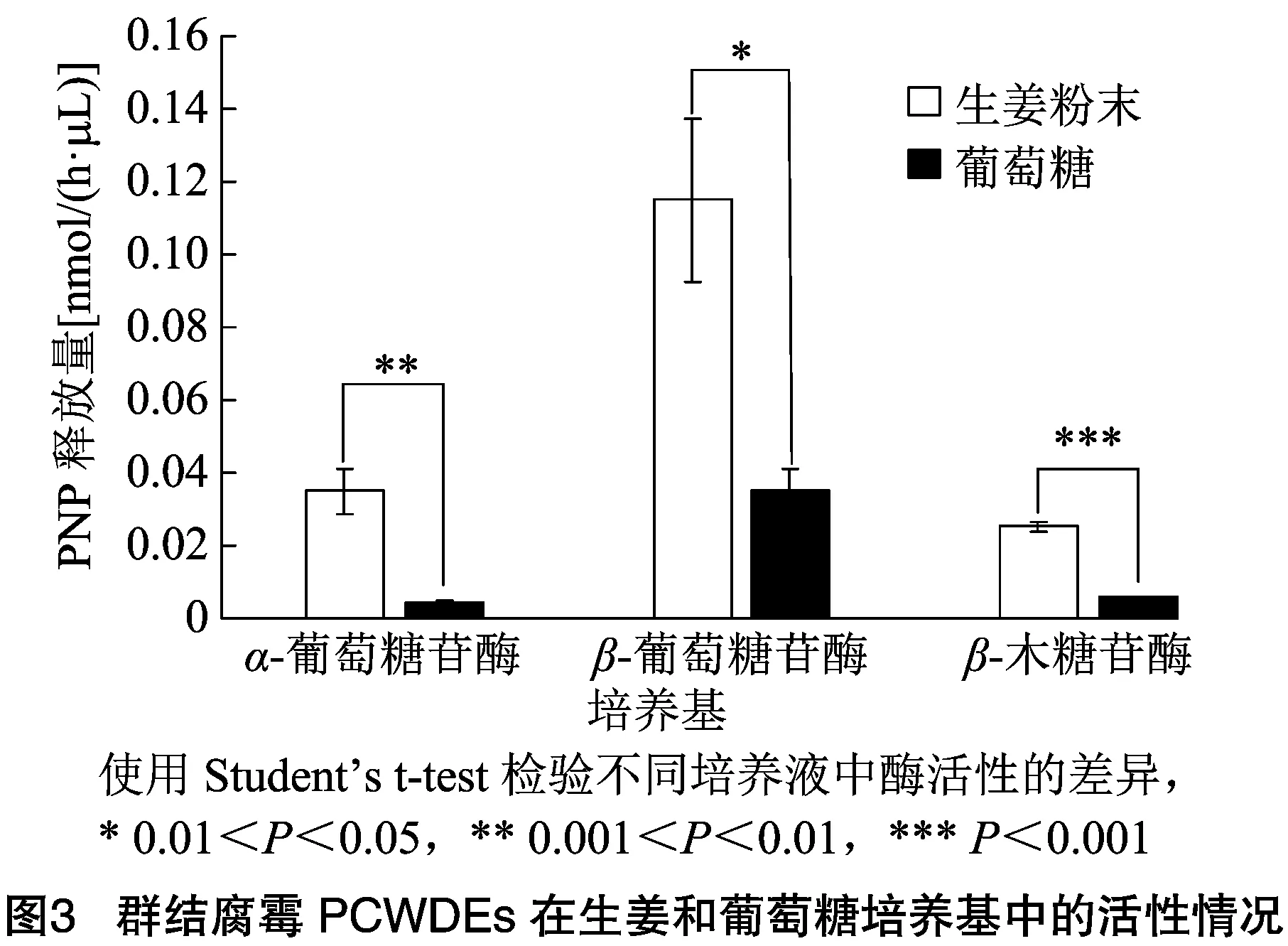
由于群结腐霉可产生降解淀粉和纤维素的α-葡萄糖苷酶和β-葡萄糖苷酶以及大量的木聚糖酶,因此,本研究检测了环板培养基中3种酶活性。由图3可知,群结腐霉在不同培养基上生长时3种酶活均存在显著差异,在生姜粉末培养液中α-葡萄糖苷酶、β-葡萄糖苷酶和β-木糖苷酶活性显著高于葡萄糖培养液对照。α-葡萄糖苷酶酶活为0.035 nmol/(h·μL),较对照高0.030 nmol/(h·μL);β-葡萄糖苷酶的酶活为0.115 nmol/(h·μL),较对照高0.080 nmol/(h·μL);β-木糖苷酶活性为0.025 nmol/(h·μL),较对照高0.019 nmol/(h·μL)。

表2 群结腐霉在生姜粉末培养基与葡萄糖培养基相比上调表达的PCWDEs基因
3 讨论
本研究通过生物学软件dbCAN2和CAZy网站对群结腐霉PCWDEs基因进行分析和功能注释,预测了PCWDEs基因编码的酶和对应的底物。将群结腐霉中的PCWDEs基因与其他腐霉菌株对比发现,群结腐霉中以各种植物组分为底物的降解酶数量均远大于其他腐霉菌株。不同植物的细胞壁组成存在一定差异,但主要由纤维素、半纤维素、果胶和结构蛋白等多种成分构成,群结腐霉PCWDEs对应多种底物,可协调降解细胞壁[36],这可能与群结腐霉能侵染多种寄主有关。
转录组结果显示,群结腐霉在生姜培养基中培养,上调的PCWDEs基因有12个,其中,淀粉降解酶的数量最多,其次是纤维素降解酶,这可能与生姜和腐霉细胞壁组成相关。袁甜甜等使用酸水解法测定在去除水分加工后的生姜中淀粉含量为87.8%[37],Chen等用蒽酮试剂测定出生姜组织样本粉末中纤维素占生姜根茎中纤维的70%,因此群结腐霉需要分泌大量的淀粉降解酶来破坏生姜组织[38]。此外,腐霉细胞壁的主要成分是2种类型的纤维素微纤维[39],推测纤维素降解酶数量比淀粉降解酶少的主要原因可能是过高水平的纤维素酶会降解腐霉的细胞壁导致细胞死亡。
利用连有对硝基苯酚底物的酶促反应检测群结腐霉中的酶活特征,发现生姜粉末培养基的α-葡萄糖苷酶、β-葡萄糖苷酶和β-木糖苷酶活性均比葡萄糖培养基中的酶活性高。这与转录组分析中发现的生姜粉末培养基中纤维素、淀粉和木聚糖为底物基因表达上调的结果一致。Geethu等检测果胶酶、木聚糖酶和纤维素酶的活性时,发现它们的活性都随着群结腐霉的生长而增加[15]。本研究中也检测了类似活性,但Geethu等在试验中使用百分数作为各项酶活之间的对比,2个试验间的数据难以进行比较。然而,群结腐霉在葡萄糖环板上生长时检测到了所有酶活,这与Geethu等之前检测时在蔗糖为底物时检测到纤维素酶、果胶酶、木聚糖酶和蛋白酶的结果[15]相似。
使用环板对群结腐霉的PCWDEs基因进行诱导表达具有一定的局限性,环板试验中使用的碳源经过高温灭菌,而在自然条件下植物宿主中的其他因素可诱导群结腐霉产生PCWDEs[40],在侵染过程中发挥不同的作用,因此后续仍需进一步优化试验条件。
本研究通过PCWDEs基因功能注释、转录组测序分析和酶活检测分析,表明淀粉和纤维素对群结腐霉中PCWDEs基因表达有重要作用,其功能分析需要进一步验证。本研究为后续解析群结腐霉致病机制奠定了基础,为群结腐霉引起的生姜茎基腐病的防治提供了理论依据。

