猪源唾液酸黏附素受体的表达及其纳米抗体筛选
洪伟鸣,郭子杰,李睿婷,李 玲,徐 海,张 亮,宋 亮
(江苏农牧科技职业学院,江苏泰州 225300)
病毒受体是指在宿主细胞内部或者细胞膜表面可特异性地与病毒结合,并促使病毒感染的糖类、脂类以及蛋白质类分子单体或复合物,其主要功能是识别细胞内外的病毒粒子并与之结合[1]。当前研究较为深入的病毒受体已达30多种,其中,唾液酸黏附素(Sialoadhesin,Sn),又被称为Siglec-1或者CD169,是一种巨噬细胞限制的Ⅰ型跨膜糖蛋白,属于唾液酸凝集素受体家族[2-3]。猪源Sn是猪繁殖与呼吸综合征病毒(PRRSV)入侵宿主的特异性细胞受体之一[4],PRRSV与Sn受体的结合增强了病毒向细胞表面的聚集,然后由网格蛋白介导内吞作用进入细胞[5]。由于Sn受体在PRRSV感染宿主过程中发挥着重要作用,使其成为了抗PRRSV药物研究的重要靶点。
早期研究表明,利用完整的靶细胞或者靶细胞膜免疫小鼠可筛选出能够阻断病毒结合的抗体。在研究PRRSV与巨噬细胞互作的过程中,发现2个肺泡巨噬细胞特异性单克隆抗体(mAb41D3、mAb41D5)能够阻断PRRSV的感染[6]。因此,分离纯化细胞表面的病毒受体分子,再制备针对受体的单克隆抗体,通过特异性单克隆抗体竞争性阻断病毒与受体的结合,是开发抗病毒药物的重要策略之一[7]。由于病毒受体分子在细胞表面丰度较低,其占比不足细胞膜总蛋白的万分之一,并且多为整合蛋白的形式包埋于脂质双层膜中,因此直接分离纯化受体分子的可操作性不强[8]。以猪源Sn受体为例,其完整的分子结构包含17个结构域,又可分为胞外区、跨膜区和胞内区3个部分,其中胞外区具有免疫球蛋白样结构的区域是病毒结合位点[9]。利用基因工程方法表达Sn受体胞外区蛋白分子,用于制备特异性抗体是值得尝试的途径。
纳米抗体是一种新型的基因工程抗体,因其天然缺失轻链,分子大小为纳米级,故被称为纳米抗体[10]。相比传统抗体而言,纳米抗体因其分子量小、稳定性强、亲和力高、组织穿透力强、易于生产和制备等诸多优势,在疾病诊断、治疗和预防领域得到广泛应用[11]。因此,本研究通过大肠杆菌表达系统制备Sn受体胞外区作为目标分子,利用T7噬菌体展示的纳米抗体文库中对其进行亲和筛选,以获得特异性结合Sn受体的纳米抗体分子,旨在为后续开展抗病毒活性研究打下基础。
1 材料与方法
1.1 试验材料
菌株与载体:DH5a、BL21-DE3大肠杆菌感受态细胞,购于诺唯赞公司;纳米抗体T7噬菌体展示文库、pET-30a(+)载体由笔者所在实验室保存。主要试剂:限制性内切酶、TaqDNA聚合酶、T4DNA连接酶均为宝生物公司产品;胶回收试剂盒为QIAGEN公司产品;SDS-PAGE凝胶制备试剂盒,购自天根公司;HisTrap HP层析柱,购自美国GE公司;其余试剂均为分析纯。主要仪器:台式离心机,购自美国Beck-man公司;BTX电转化仪、PCR仪,购自宝生物公司;Geldoc-It Imaging System,购自美国UVP公司。
1.2 重组表达载体pET-30a-Sn4D的构建
参考GenBank中上传的猪源Sn序列,并根据大肠杆菌表达系统进行密码子优化,由金斯瑞公司合成Sn受体4个免疫球蛋白样结构域(Sn4D)基因序列,并在该基因序列的上下游分别添加NdeⅠ、XhoⅠ限制性酶切位点。利用上述酶切位点将Sn4D基因插入原核表达载体pET-30a(+),双酶切鉴定和测序分析,将鉴定正确的重组载体命名为pET-30a-Sn4D并导入BL21-DE3感受态细胞,冻存备用。
1.3 Sn4D蛋白的表达与纯化
挑取携带重组表达载体pET-30a-Sn4D的大肠杆菌单菌落,37 ℃摇床过夜培养,次日按1 ∶100比例转接新鲜LB(Kan+)培养液,37 ℃摇床培养至菌液D600 nm=0.5,加入IPTG终浓度为0.5 mmol/L,继续诱导培养5 h,收获细菌,SDS-PAGE鉴定Sn4D蛋白表达情况。利用HRP Anti-6X His Tag抗体,Western-blot鉴定纯化蛋白的反应活性。根据HisTrap HP说明书,纯化目的蛋白,经NanoDrop测定蛋白浓度。
1.4 纳米抗体文库筛选Sn4D特异性结合抗体
取10 μL纯化的Sn4D蛋白(100 μg/mL)加入到900 μL NaHCO3(1 mol/L,pH值=8.6)包被缓冲液中,100 μL/孔包被酶标板,放置4 ℃过夜。次日,PBST缓冲液洗涤酶标板1次,加入5% BSA封闭液,37 ℃封闭2 h,PBST缓冲液洗板3 次。用包被缓冲液调整纳米抗体T7噬菌体展示文库至1×1011PFU/mL 浓度,每孔加入100 μL并于37 ℃孵育1 h,使纳米抗体与Sn4D蛋白充分作用。回收反应溶液,PBST洗涤酶标板10次,然后每孔加入 100 μL 1% SDS溶液洗脱与靶蛋白结合的噬菌体。取10 μL洗脱产物经双层琼脂夹心法测定噬菌体滴度,剩余洗脱产物加入至对数生长早期的BL21宿主细菌中进行扩增,直至宿主细菌完全裂解。PEG-NaCl 法回收扩增的噬菌体,调整回收的噬菌体浓度,重复上述筛选步骤2次,每轮筛选逐步降低Sn4D蛋白包被量,同时增加PBST中Tween-20浓度,以获得高亲和力的纳米抗体。利用公式:产出比=(洗脱噬菌体量/投入噬菌体量)×100%,计算每一轮筛选的得率。
1.5 阳性噬菌体的鉴定
测定第3轮洗脱产物的滴度并从平板上随机挑取72个单克隆噬斑,用T7噬菌体特异性引物T7 Select UP Primer 5′-G G A G C T G T C G T A T T C C A G T C-3′和T7 Select DOWN Primer 5′-A A C C C C T C A A G A C C C G T T T A-3′进行噬斑PCR鉴定。挑选PCR阳性扩增产物送金斯瑞公司测序分析,用DNAstar软件分析纳米抗体氨基酸序列。
1.6 纳米抗体与Sn4D结合的亲和力、特异性测定
根据序列分析结果,选取展示不同纳米抗体的噬菌体进行培养,回收噬菌体扩增产物,并统一调整浓度至1×1010PFU/mL。分别向包被Sn4D、BSA (50 ng/孔)酶标板中依次加入100 μL噬菌体。37 ℃ 孵育1 h后,弃去反应液,PBST洗涤酶标板10次,然后每孔加入100 μL 1% SDS溶液洗脱与蛋白结合的噬菌体。双层琼脂法测定洗脱产物中噬菌体滴度,将Sn4D孔洗脱噬菌体量设为P、BSA孔洗脱噬菌体量设为N,计算P/N值,比较不同纳米抗体与目标蛋白结合的特异性及亲和力强弱。
2 结果与分析
2.1 重组表达质粒的构建与蛋白表达
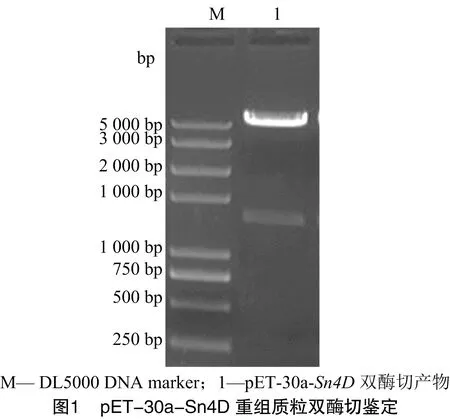
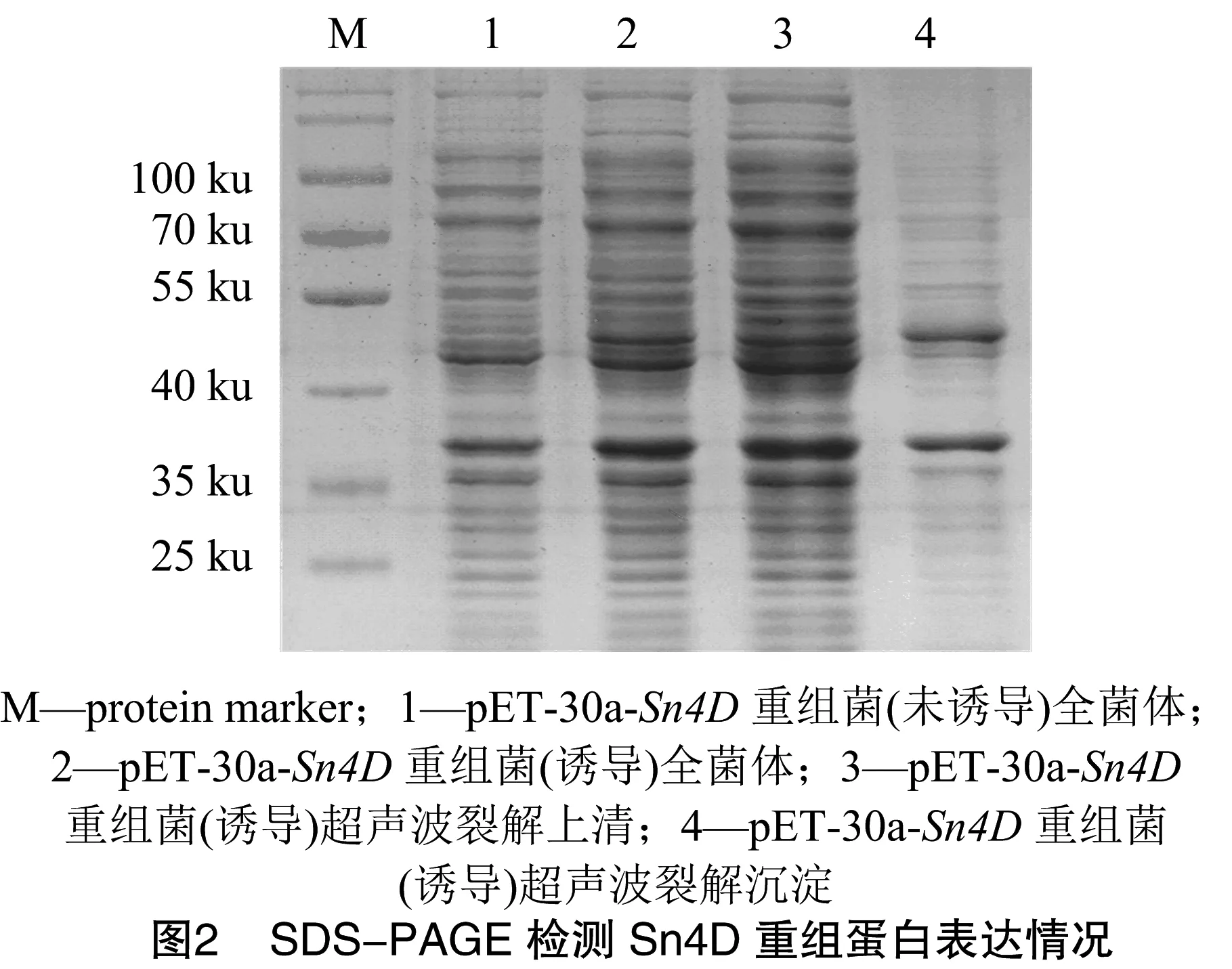
将人工合成的Sn4D基因插入原核表达载体pET-30a(+)构建重组表达载体pET-30a-Sn4D。由图1可知,通过NdeⅠ、XhoⅠ双酶切鉴定切出约1 300 bp目的条带,大小与预计相符合。序列测定结果显示,插入的Sn4D基因片段序列完全正确,阅读框无移码。IPTG诱导携带重组表达载体的大肠杆菌。由图2可知,SDS-PAGE检测可见大小约50 ku的疑似Sn4D蛋白表达,通过超声波破碎分析发现该蛋白主要以包涵体的形式存在。
2.2 Sn4D蛋白鉴定与纯化
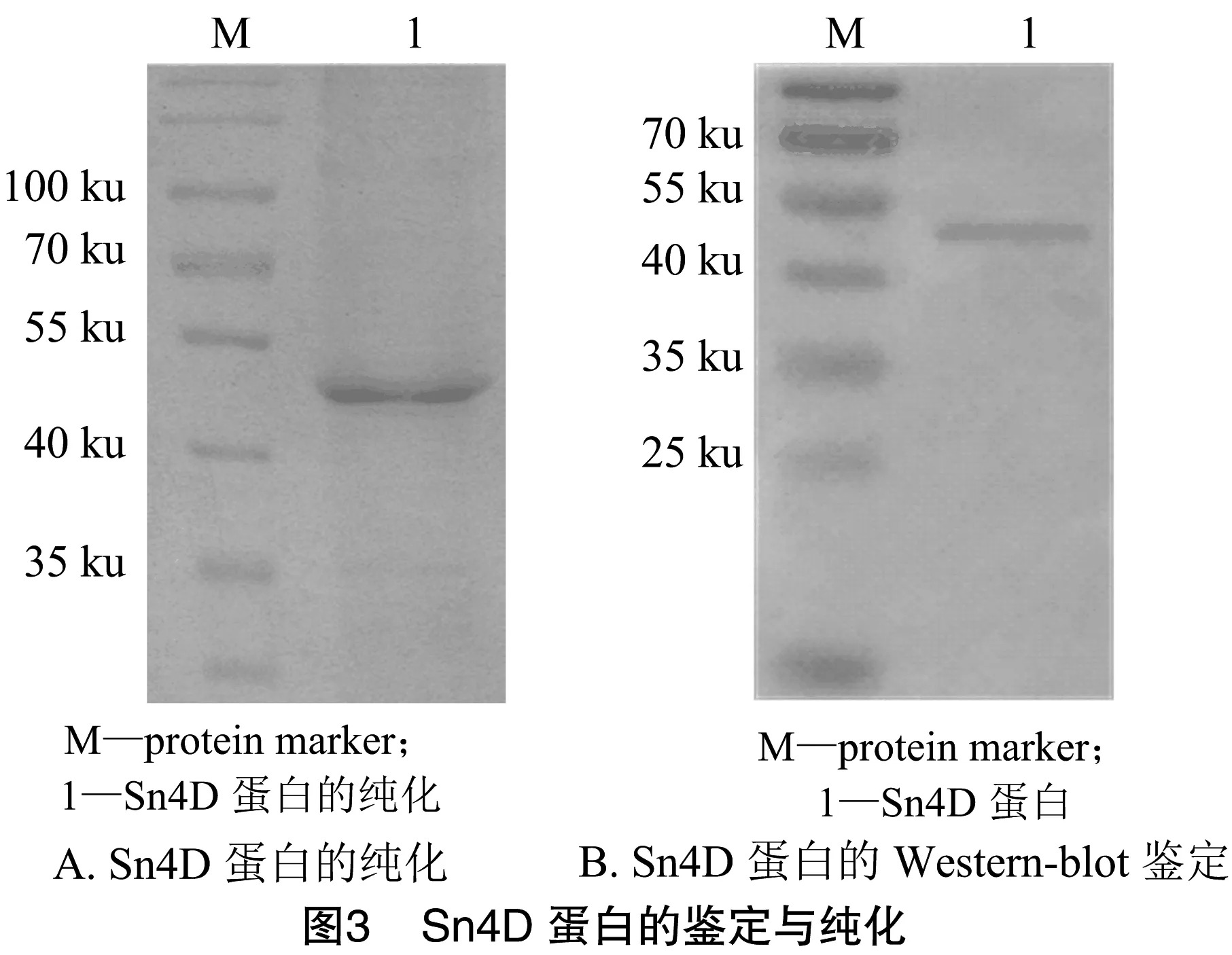
由图3可知,将回收Sn4D包涵体通过变复性处理,然后经HisTrap HP柱纯化得到条带相对单一的纯蛋白(图3-A);Western-blot检测显示,目标蛋白与HRP Anti-6X His Tag抗体呈现良好的反应性(图3-B)。将Ni柱纯化回收的蛋白经NanoDrop测定含量,并调整浓度至100 μg/mL,-80 ℃冻存备用。
2.3 Sn4D特异性重组噬菌体筛选
将纯化后的Sn4D蛋白作为靶分子并包被在固相载体上,使T7噬菌体展示的纳米抗体与之结合。由表1可知,筛选过程中包被的靶分子用量逐轮降低,而洗涤液PBST中Tween-20含量逐渐升高,通过加压筛选有利于获得高亲和的纳米抗体分子。第1轮筛选产出比仅为0.072%,而第2轮筛选则提高到1.27%,第3轮进一步降低了投入噬菌体的量,但仍有1.13%产出比,因此经过3轮筛选特异性结合Sn4D蛋白的噬菌体得到有效富集。
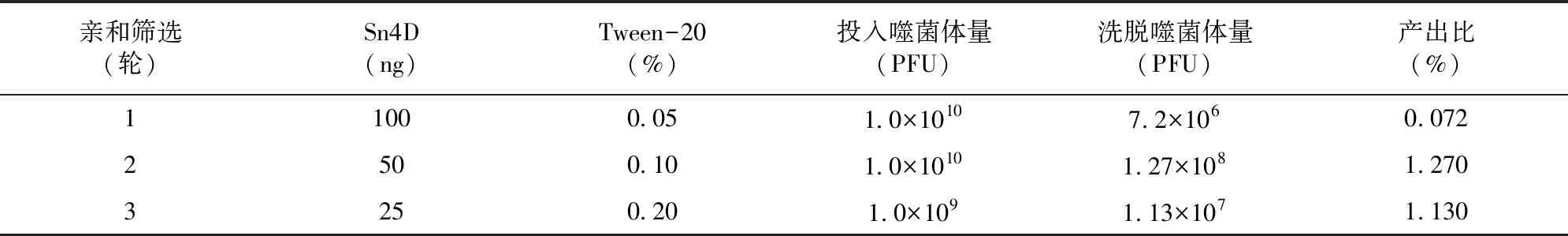
表1 亲和筛选过程中噬菌体的富集
2.4 单克隆噬菌体的鉴定
纳米抗体基因插入在T7噬菌体衣壳蛋白p10B基因下游,融合表达的衣壳蛋白在组装成T7噬菌体头部的同时将纳米抗体展示于表面。通过PCR方法检测插入位点的纳米抗体基因。由图4可知,携带纳米抗体基因的噬菌体PCR可扩增出约 750 bp 条带,而未携带纳米抗体基因的噬菌体仅扩增出250 bp条带。从第三轮洗脱产物中随机挑选72个单克隆噬菌斑进行PCR鉴定,共计鉴定得到63个携带纳米抗体基因的噬菌体。 将PCR产物进行序列测定,通过比对纳米抗体氨基酸序列,获得42个不同氨基酸组成的纳米抗体。
2.5 纳米抗体亲和力、特异性检测
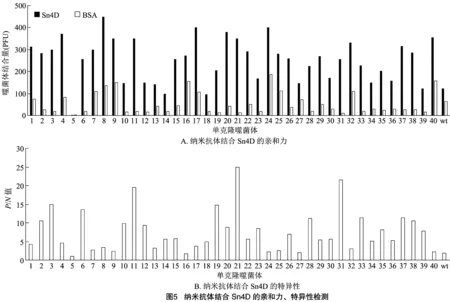
选取40株展示不同纳米抗体的T7噬菌体分别与Sn4D、BSA相作用。通过比较不同株噬菌体与Sn4D结合数量的多少,以此评价其展示的纳米抗体分子与Sn4D结合能力的强弱;比较同一株噬菌体分别与Sn4D、BSA结合数量的比值,以此来判定其展示的纳米抗体与Sn4D结合的特异性。由图5可知,第9、24株噬菌体虽然能够高亲和力地结合Sn4D,但也能高效结合BSA(图5-A),因此其展示的纳米抗体特异性较低(图5-B);第11、21、31株噬菌体仅与Sn4D有高亲和力结合,而不与BSA结合,表现出良好的亲和力与特异性。
3 讨论
Sn受体由部分分化的巨噬细胞亚群表达,而猪源Sn受体仅存在于肺泡巨噬细胞(PAM)上[12],从细胞中直接分离、纯化难度较大。因此,本研究中截取与病毒互作的Sn4D结构域,并在大肠杆菌表达系统中实现了高效表达。虽然原核表达系统缺乏加工、折叠以及修饰等功能,但可快速制备高纯度的靶标蛋白,这可为纳米抗体文库的淘选奠定良好的基础。
纳米抗体是一种发现于骆驼科、鲨鱼科的重链抗体,相比传统抗体而言有着许多无可比拟的优势,在抗病毒研究中的得到广泛应用。Liu等以PRRSV相对保守的Nsp-9蛋白为靶标,从噬菌体展示文库中筛选出8株抗PRRSV Nsp-9蛋白的纳米抗体,然后构建MARC-145细胞系来稳定表达活性最好的Nb6株纳米抗体,发现该细胞系可以抑制PRRSV基因组复制与转录,感染病毒后不出现病变[13]。本研究利用已构建的羊驼纳米抗体T7噬菌体展示文库[14],针对Sn4D蛋白开展3轮亲和筛选,通过降低靶标蛋白包被量、提高洗涤缓冲液中吐温含量等手段,加压筛选能够高亲和力结合Sn4D蛋白的纳米抗体分子。由表1可知,产出比在逐轮升高,目的噬菌体得到了有效富集。由于纳米抗体分子大约包含150个氨基酸,在T7噬菌体表面展示构成一定的空间位阻,随着次级文库的反复扩增,部分噬菌体克隆可能会出现纳米抗体基因丢失的现象,因此需要对筛选产物中噬菌体单克隆进行鉴定,以确定纳米抗体分子的完整性。由图4可知,约15%的噬菌体克隆丢失了纳米抗体基因。
采用固相载体包被靶标蛋白的方式进行亲和筛选,筛选体系中除了Sn4D靶标蛋白,还有BSA封闭蛋白,因此洗脱产物中的噬菌体可能针对Sn4D和BSA同时进行了有效富集,有必要分别测定单克隆噬菌体与Sn4D、BSA结合的特异性以及结合能力的强弱。由图5可知,第9、24株噬菌体能够同时高亲和力地结合Sn4D、BSA蛋白,故其结合的特异性不强;而第11、21、31株噬菌体仅与Sn4D高亲和力结合,显示出良好的特异性。考虑到原核表达的Sn4D蛋白与PAM细胞表面的天然Sn蛋白存在构象差异,因此仍需要制备PAM细胞,对筛选到的纳米抗体分子做进一步的亲和力、特异性鉴定。
本研究通过构建原核重组表达载体,制备高纯度Sn4D受体蛋白作为靶标,经过3轮亲和筛选成功获得6株能够高亲和力、特异性结合Sn4D蛋白的纳米抗体分子,为后续进一步开展抗病毒活性研究奠定了坚实基础。

