基于芬顿试剂-亚甲基蓝体系的褪色分光光度法测定人血清中过氧化氢酶活性
董 娜 ,李文莉 ,张爱菊 ,戴兴德* ,张小林
(1.甘肃医学院,平凉 744000;2.甘肃医学院附属医院,平凉 744000)
过氧化氢酶(CAT)广泛存在于人体肝脏、肾脏、红细胞、肌肉、小肠等组织中,细胞代谢产生的毒性物质H2O2能迅速被CAT 清除[1]。CAT 活性可作为某些慢性疾病预防诊断的指标[2-4],因此CAT活性测定在临床应用中越来越受到人们的重视[5]。文献报道了多种CAT 活性的测定方法,如滴定法[6]、荧光检测法[7-8]、紫外分光光度法[9-10]等。近年来,动力学分光光度法因高灵敏度、低检出限而备受关注。文献[11-13]等采用显色剂二苯胺磺酸钠、邻苯二胺、四甲基联苯胺进行CAT 活性分析,然而显色剂溶液保存难度较大,临床检验中难以随用随配。褪色分光光度法具有稳定性高的优势,目前本课题组已完成了罗丹明B[14]、中性红[15]体系测定CAT 活性的研究,检出限分别为0.011,0.006 8 U·m L-1。亚甲基蓝(MB)是一种生化染料,光灵敏度高,摩尔吸光系数大[16]。芬顿试剂(H2O2/Fe2+)有强氧化性,可氧化MB 使其褪色。鉴于此,本工作基于CAT 对H2O2氧化MB的抑制作用,提出了褪色分光光度法测定人血清中CAT活性的方法。
1 试验部分
1.1 仪器与试剂
UV1102型紫外-可见分光光度计。
H2O2底液:1 mmol·L-1,用水将0.50 mL 30%(质量分数,下同)H2O2溶液稀释至250 mL,以高锰酸钾法测定其浓度,根据测定结果再用水稀释至1 mmol·L-1。
CAT 标准溶液:1 U·m L-1,将CAT 和水按照1∶10 000质量比混匀,以高锰酸钾法测定其活性,根据测定结果再用水稀释至1 U·m L-1。
CAT、30% H2O2溶液、H2SO4、MB、FeSO4·7 H2O 均为分析纯;试验用水为蒸馏水。
1.2 试验方法
取人血清样品10μL于50 mL 容量瓶中,加入1 mmol·L-1H2O2底液3.00 mL,于30 ℃恒温反应15 min,加 入1.00 mol·L-1H2SO4溶 液1.00 mL,充分振荡混匀后依次加入0.10 mmol·L-1MB溶液5.00 mL 和0.01 mol·L-1FeSO4溶液1.00 mL,室温反应5 min后用水定容至50 mL。以水为参比,测定体系在665 nm 处的吸光度A(1 cm 比色皿),随同测定CAT 空白体系吸光度A0,以二者差值A-A0(ΔA)计算CAT 活性。
2 结果与讨论
2.1 试验原理
试验考察了不同体系在波长400~750 nm 内的吸光度A,结果见图1。

图1 紫外-可见吸收光谱图Fig.1 UV-Vis absorption spectra
结果表明:MB体系在665 nm 处可见光区有强吸收(曲线1),此时摩尔吸光系数为9.5×104L·mol-1·cm-1;在MB 中加入芬顿试剂时,10 min内体系变为淡蓝色,665 nm 处的吸光度A趋近于0(曲线2),说明MB 被氧化褪色;加入CAT 后,MB褪色受限,吸光度A恢复程度与CAT 活性有关(曲线3,4)。据此,可提出基于芬顿试剂-MB 体系的褪色分光光度法测定CAT 活性。
2.2 褪色反应条件的优化
2.2.1 催化剂
取1 mmol·L-1H2O2底液3.00 mL,考察了分别以Fe2+、Fe3+为催化剂时对MB-H2O2褪色反应催化效果的影响,结果见图2。
由图2可知:只加入H2O2,MB褪色不明显(曲线1,2);加入Fe2+、Fe3+对MB-H2O2褪色反应均有催化作用,但催化程度有差异;Fe3+对H2O2氧化MB褪色有微弱促进作用(曲线3),Fe2+对H2O2氧化MB褪色效果更显著(曲线4),其褪色率是Fe3+的7.5倍,这是由于Fe2+可催化H2O2产生氧化性更强的·OH[17]。因此,试验选择以Fe2+为MBH2O2褪色反应的催化剂。

图2 催化效果比较Fig.2 Comparison of catalytic effect
2.2.2 MB溶液用量
在不含底液和催化剂的情况下,考察了0.10 mmol·L-1MB 溶液用量对体系吸光度A的影响,结果见图3。

图3 MB溶液用量对体系吸光度的影响Fig.3 Effect of the amount of MB solution on absorbance of the system
由图3可知:当MB 溶液用量为0~7.00 mL时,吸光度A逐渐增大。但为减少测量误差,吸光度A控制在0.20~0.80内为宜。因此,试验选择的MB溶液用量为5.00 mL,此时体系中MB 浓度为1.00×10-5mol·L-1。
2.2.3 H2SO4溶液用 量
取1 mmol·L-1H2O2底 液3.00 mL,以1.00 mol·L-1H2SO4溶液为反应介质,考察了H2SO4溶液用量对MB 体系和MB+H2O2+Fe2+体系吸光度A的影响,结果见图4。

图4 H2 SO4 溶液用量对体系吸光度的影响Fig.4 Effect of the amount of H2 SO4 solution on absorbance of the system
结果表明:由于质子化效应,MB体系吸光度A随酸度增大而减小,但变化幅度不大(曲线1);H2SO4增强了Fe2+的水溶性和稳定性,更有利于MB与H2O2发生褪色反应(曲线2);当H2SO4溶液用量为1.00 mL 时,MB褪色明显,ΔA较大。因此,试验选择的H2SO4溶液用量为1.00 mL。
2.2.4 FeSO4溶液用量
取1 mmol·L-1H2O2底液3.00 mL,考察了0.01 mol·L-1FeSO4溶液用量分别 为0,0.20,0.40,0.60,0.80,1.00,2.00,3.00,4.00,5.00 mL时 对MB-H2O2褪色反应的影响。结果表明:当FeSO4溶液用量小于0.80 mL时,体系吸光度A随FeSO4溶液用量的增大而减小;当FeSO4溶液用量为0.80~3.00 mL 时,吸光度A保持稳定;当FeSO4溶液用量大于3.00 mL 时,吸光度A随FeSO4溶液用量的增大而增大,说明过量Fe2+导致H2O2分解,褪色反应不完全。为减少H2O2副反应,试验选择的FeSO4溶液用量为1.00 mL。
2.2.5 褪色反应时间
在上述优化条件下,对MB-H2O2褪色反应时间进行考察。结果表明,Fe2+催化MB-H2O2褪色反应速率极快,反应5 min时,体系吸光度A达到最小,并且60 min内保持稳定。因此,试验选择的褪色反应时间为5 min。
2.3 酶促反应条件的优化
2.3.1 H2O2底液用量
在上述优化的褪色反应条件下,考察了CAT空白体系中1 mmol·L-1H2O2底液用量对体系吸光度A的影响,结果见图5。

图5 H2 O2 底液用量对体系吸光度的影响Fig.5 Effect of the amount of H2 O2 base solution on absorbance of the system
结果显示:当H2O2底液用量在0~3.00 mL内时,体系吸光度A随H2O2底液用量的增大而减小;当H2O2底液用量大于3.00 mL 时,吸光度A保持平稳。因此,试验选择3.00 mL H2O2底液为CAT 酶促反应的底物。
2.3.2 酶促反应时间
取1 U·m L-1CAT 标准溶液3.00 mL作测试液,其他条件不变,测定不同酶促反应时间下体系ΔA,结果见图6。
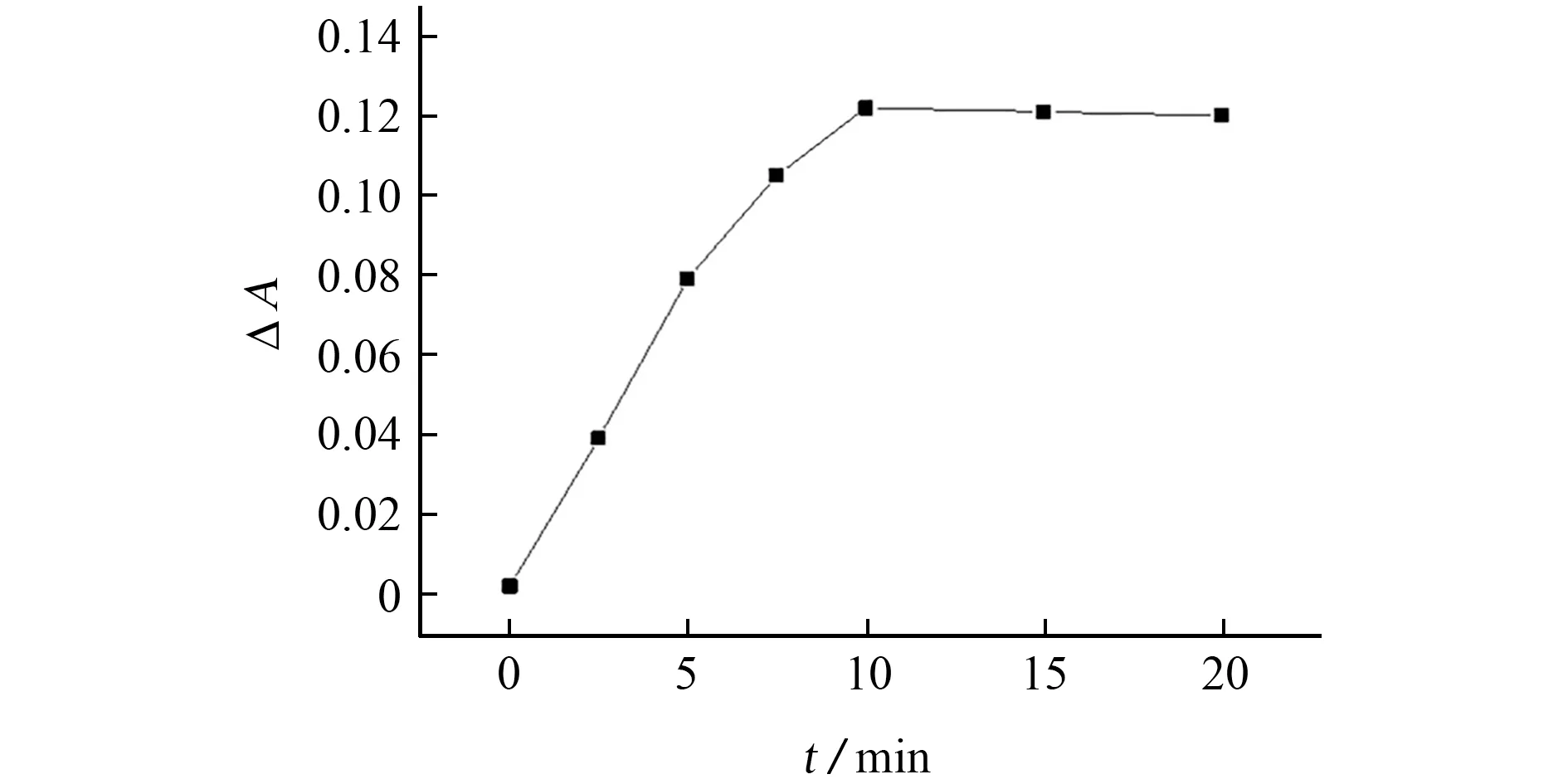
图6 酶促反应时间对体系ΔA 的影响Fig.6 Effect of enzymatic reaction time onΔA of the system
结果表明:5 min内的酶促反应表现出一级反应特征,ΔA随反应时间的延长而线性增大;10 min后,ΔA保持稳定。为使酶促反应进行完全,试验选择的酶促反应时间为15 min。
2.4 标准曲线和检出限
取1 U·m L-1CAT 标准溶 液0,0.50,1.00,0.80,1.50,2.00,2.50,3.00 mL 作测试液,按照试验方法测定体系ΔA,以体系中CAT 活性为横坐标,对应的体系ΔA为纵坐标绘制标准曲线。结果显示,CAT 活性在0.01~0.06 U·m L-1范围内与ΔA呈线性关系,线性回归方程为ΔA=12.23E-1.200×10-3,相关系数为0.997 6。
按照试验方法平行测定空白体系10次,以3倍标准偏差(s)与线性回归方程斜率(k)的比值计算检出限(3s/k),结果为0.002 4 U·m L-1。
2.5 样品分析和回收试验结果
按照试验方法对6 个健康人血清样品进行CAT 活性分析,并对其进行加标回收试验,计算测定值的相对标准偏差(RSD)和回收率,结果见表1。对于超出线性范围的溶液,将其稀释后再进行测定。
由表1可知:儿童和老人血清中CAT活性明显高于成年人,该结果与文献[18]报道一致;测定值的RSD 为1.7%~3.6%,加标回收率为92.0%~104%,说明该方法具有较高的准确度和精密度。

表1 样品分析及回收试验结果(n=6)Tab.1 Results of the sample analysis and test for recovery(n=6)
基于芬顿试剂与MB 快速发生褪色反应,利用CAT 对MB+H2O2+Fe2+褪色体系的抑制效应,从而完成人血清中CAT 活性的测定。该方法具有较高的准确度和精密度,为临床检验工作提供诊断依据,也为新型CAT 试剂盒开发研制提供理论保障。

