水产品中常见致病微生物快速检测体系的建立
熊志勇,王 磊,魏永春,马文英
(北京理工大学珠海学院材料与环境学院,广东珠海 519088)
0 引言
近年来,全球食品安全恶性事件频发,成为影响公共健康的重要因素,食品安全问题越来越成为社会关注的热点,其中,食源性致病菌是危害食品安全和人类健康的主要因素[1-3]。因食用水产品引起爆发性食物中毒也频繁发生,水产品中常见病原菌检测品种有副溶血弧菌、单增李斯特氏菌、霍乱弧菌、创伤弧菌、溶藻弧菌、沙门氏菌、大肠杆菌等。这些致病菌可引起剧烈呕吐、腹泻、头痛、发热,严重者常有脱水、全身痉挛、神志不清、血压下降等休克症状而危及生命。因此,建立针对水产品中致病微生物的有效检测体系,快速并且准确地完成对食品中致病菌的检测已成为保障食品安全和防止疾病传染的关键。
这些致病微生物常规检测方法需要分离培养、生化试验和血清学试验等多个步骤,检测周期长、操作繁琐、灵敏度低,而且每次只能检测出一种致病菌。其灵敏度也受杂菌干扰的一定影响,存在一定的假阴性,且无法对人工难以培养的病原微生物进行检测,已远远不能满足现代检测要求。
随着分子生物学发展,在分子生物学水平基础上建立的检测技术逐步成为食品中致病菌的检测方法。如DNA 指纹图谱、免疫捕获、分型技术、菌落杂交、PCR、实时定量PCR、基因芯片等,也已经显示出它在食源性致病菌检测方面的独特优势。其中PCR 方法该技术具有高效、高产、低成本、速度快等优点,有较好的可操作性,目前已在多种致病性微生物的检测中得到应用[4-8]。
针对水产品常见致病性微生物副溶血性弧菌耐热溶血毒素tlh 基因及其毒力基因trh 和tdh 基因、单增李斯特菌溶血素hly 基因、沙门氏菌invA 基因和大肠杆菌O157 rfbe、stx 1 和stx 2 基因为靶基因设计引物,建立能快速同时一体化检测该常见4 种致病性微生物的PCR 反应体系。从特异性和灵敏度方面对该方法进行评价,并将其直接应用于水产品样品中进行的实际检测。同时,也为PCR 技术应用到其他致病菌的高效检测奠定了一定的基础,为开展病原菌的早期预警、监测、分析和调查发挥积极作用。
1 材料与方法
1.1 材料
1.1.1 菌株
58 株标准菌株,武汉工程大学提供。包括金黄色葡萄球菌、蜡样芽胞杆菌、单增李斯特菌、沙门氏菌、大肠杆菌、小肠结膜炎耶尔森菌亚种和铜绿假单胞菌。
1.1.2 仪器与设备
YXQ-LS-75SⅡ型立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂产品;ZHWY-2102 型双层大容量全温度恒温摇床,上海智城分析仪器制造有限公司产品;HC-2518R 型高速冷冻离心机,安徽中科中佳科学仪器有限公司产品;DYY-6C 型电泳仪,北京六一仪器厂产品;Tocan240 型凝胶成像系统;TC-96HBPCR 型扩增仪,杭州博日科技有限公司产品;UV-7504 型单光束紫外- 可见分光光度计,上海欣茂仪器有限公司产品;DS-1 型高速组织捣碎机,上海精科实业有限公司产品。
1.1.3 试剂与培养基
细菌基因组DNA 快速提取试剂盒(硅胶膜离心柱法)、Bst DNA 聚合酶、10×ThermoPol Reaction buffer、10 mmol/L dNTPs,广州东盛生物科技有限公司提供;新鲜海带,购于当地超市。
副溶血性弧菌选择性培养基,青岛海博生物公司提供;大肠杆菌O157 选择性培养基,CHROmagar公司提供;沙门氏菌选择性培养基(SS),上海科兴商贸有限公司提供。
单增李斯特菌选择性培养基:蛋白胨15.0 g,酵母膏粉5.0 g,琼脂15.0 g,氯化钠5.0 g,色素2.3 g,抑制剂5.0 g,去离子水(平板) 1 L。
3%氯化钠碱性蛋白胨水:氯化钠5 g,硝酸钾0.1 g,蛋白胨20 g,蒸馏水1 L,加热溶解。
LB 肉汤液体培养基:LB 肉汤21 g,蒸馏水1 L,加热溶解。
LB 肉汤固体培养基:1 L LB 肉汤液体培养基加15 g 技术琼脂粉。
单增李斯特菌选择性培养基、LB 肉汤、技术琼脂粉,广东环凯微生物科技有限公司提供。
1.2 试验方法
1.2.1 菌株的培养
称取LB 肉汤21 g 溶于1 L 蒸馏水中,加热溶解,分装,于121 ℃下灭菌,得到基础培养基备用。在超净工作台内,按5%的接种量向已灭菌的培养基中加菌种母液,于37 ℃下以转速150 r/min摇床培养12 h。
1.2.2 试验菌株的筛选
将58 株标准菌株分别接种到副溶血性弧菌选择性培养基、沙门氏菌选择性培养基、单增李斯特菌选择性培养基和大肠杆菌O157 选择性培养基中,于37 ℃下静置培养48 h,筛选出试验所需4 种菌株。
1.2.3 DNA 模板的提取
(1) 试剂盒法。根据细菌基因组DNA 快速提取试剂盒说明书提取细菌基因组DNA。
(2) 水煮法。取过夜培养的菌悬液1 mL 加到1.5 mL 无菌离心管中,以转速12 000 r/min 离心2 min,尽量吸弃上清,加入50 μL 洗脱液TE,混匀后沸水浴5 min,以转速12 000 r/min 离心5 min,取上清-20 ℃下保存。
1.2.4 引物设计与合成
通过查阅相关文献,检索GenBank 数据库(http://www.ncbi.nlm.nih.gov/nuccore/472320310) 中已公布的副溶血性弧菌tlh 基因、单增李斯特菌溶血素hly 基因、沙门氏菌invA 基因和大肠杆菌O157 rfbe、stx 1 和stx 2 基因序列,利用PrimerExplorer V4 引物设计软件设计LAMP 引物,将2 条外引物F3、B3 用于试验PCR 体系,并将设计好的引物与Genbank 数据库中的核酸序列进行BLAST 比对,保证4 种食源性致病微生物引物的高度特异性。
3 种致病性微生物靶基因及其引物序列见表1。

表1 3 种致病性微生物靶基因及其引物序列
1.2.5 PCR 反应体系建立
PCR 扩增体系选取50 μL,2×TaqPCRMasterMix(含染料) 25 μL,引物F 2 μL,引物B 2 μL,模板DNA 2 μL,ddH2O 19 μL。
由于选择扩增目的片段小,扩增所需时间短,因此设定反应程序:94 ℃,5 min;94 ℃~30 s,55 ℃~30 s,72 ℃~30 s,30 个循环;72 ℃,10 min。反应结束后,用2%琼脂糖凝胶电泳进行结果分析。
1.2.6 PCR 反应特异性与灵敏度试验
将1.2.2 筛选出的全部试验菌株进行扩增反应,添加相应的引物。反应产物用2%琼脂糖凝胶电泳进行分析,对该方法的特异性进行评价。同时,以水为模板作阴性对照。其中,溶血弧菌引物的测试菌株包括副溶血弧菌、大肠杆菌、单增李斯特菌、金黄色葡萄球菌共20 株;单核细胞增生李斯特菌引物的测试包括单核细胞增生李斯特菌、大肠杆菌、副溶血性弧菌、铜绿假单胞菌共20 株;沙门菌引物的测试菌株包括沙门菌、蜡样芽胞杆菌、小肠结肠炎耶尔森菌亚种共20 株;大肠杆菌引物的测试菌株包括大肠杆菌、沙门氏菌、金黄色葡萄球菌、蜡样芽胞杆菌共20 株。
以副溶血性弧菌作为试验菌株测定反应体系的灵敏度,使用单束光紫外- 可见分光光度计测定其浓度,之后,以10 倍倍比稀释DNA 原液至1×10-1~1×10-9,取各稀释梯度DNA 溶液2 μL 作为扩增模板,进行LAMP 检测。同时,以水为模板,作为阴性对照。
1.2.7 多检测靶点同步PCR 试验
在优化PCR 反应体系后,进一步开发针对8 个靶点同步检测的一体化系统。通过将58 株标准菌株分别针对其8 个靶点在同一PCR 程序中进行扩增,PCR 仪为96 孔,一次可同时检测12 株菌,以考查菌株一体化检测特异性。
1.2.8 人工污染海产品样品灵敏度试验
以4 种菌株作为试验菌株测定模拟样品的灵敏度。海带25 g 加入到3%氯化钠碱性蛋白胨225 mL中,于DS-1 型高速组织捣碎机中匀浆约60 s,制成海带匀浆。将待接种的菌液等梯度稀释,无菌操作取1×10-1~1×10-9每个梯度稀释纯菌培养液1 mL 分别加入到9 mL 的海带匀浆中混匀。人工污染的各稀释梯度匀浆分别取1.0~1.5 mL 无菌离心管中,以转速3 000 r/m 离心5 min,吸取上清液到另一支1.5 mL无菌离心管中,以转速12 000 r/min 离心5 min,尽量吸弃上清液,沉淀用0.9%无菌生理盐水1 mL 重新悬浮,按1.2.2(2) 水煮法提取DNA,进行LAMP扩增。同时,以未染菌的海带匀浆为模板进行扩增,作为阴性对照,并做平行试验。
2 结果与分析
2.1 试验菌株筛选
经过4 种选择培养基的筛选,从58 株标准菌株中筛选出的目的菌株,副溶血经弧菌8 株、李斯特菌10 株、沙门氏菌9 株及大肠杆菌6 株。挑选出供后续试验。
2.2 特异性与灵敏度检测
结果显示,以tlh、tdh、trh 基因设计的副溶血性弧菌引物,对8 株副溶血性弧菌结果呈阳性,而对其他12 株对比菌株扩增结果呈阴性(见图1);以hly 基因设计的单增李斯特菌引物,对10 株单增李斯特菌扩增结果呈阳性,对其他大肠杆菌、沙门氏菌等对照菌株结果呈阴性(见图2);以invA 基因设计的沙门氏菌引物,对9 株沙门氏菌扩增结果呈阳性,对其他11 株对比菌株扩增结果呈阴性(见图3);对6 株大肠杆菌O157 扩增结果呈阳性,对其他14 株对比菌株扩增结果呈阴性(见图4,图中显示为rfbe 基因扩增结果,stx 1、stx 2 扩增结果图略)。针对4 种菌株的6 对引物对目的菌株检出率为100%,对非目标菌株扩增结果均为阴性,研究结果表明,检测方法特异性为100%。
副溶血弧菌特异性检测结果见图1,单增李斯特菌特异性检测结果见图2,沙门氏菌特异性检测结果见图3,大肠杆菌O157 特异性检测结果见图4。
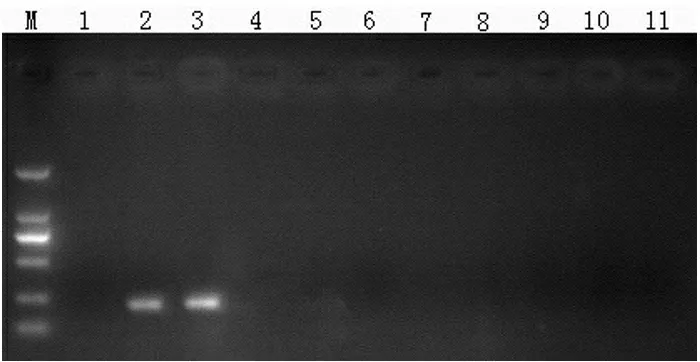
图1 副溶血弧菌特异性检测结果
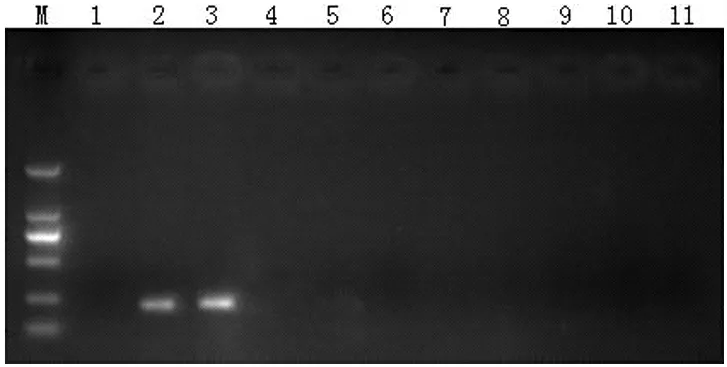
图2 单增李斯特菌特异性检测结果

图3 沙门氏菌特异性检测结果

图4 大肠杆菌O157 特异性检测结果
于37 ℃下过夜培养的副溶血性弧菌悬浮菌液,经平板细胞计数得出,细胞起始菌落总数为2.07×108CFU/mL,以10 倍梯度进行菌液稀释,用试剂盒DNA 提取法,对菌液进行DNA 提取,进行PCR 灵敏度检测试验。
PCR 灵敏度检测结果见图5。
由图5 可知,当菌液菌落总数为2.07×102~2.07×108CFU/mL 时,都进行了PCR 扩增,菌落总数少于2.07×102CFU/mL 没有PCR 扩增条带产生,由于DNA 提取的体系是50 μL,其中只用2 μL作为PCR 反应的模板,所以试验方法建立的PCR 反应体系的检测灵敏度为8.28×101CFU/mL。

图5 PCR 灵敏度检测结果
2.3 多靶点同步PCR 检测
利用PCR 仪,针对8 个靶点可一次同时检测12 株菌。结果显示该试验选用的58 株标准菌株利用本试验建立的PCR 程序同步检出率为100%,表明建立的简易PCR 体系,可用于多位点多菌株的同步检测。在将来新一代324 孔PCR 仪中,将可能对40 个水产品的8 个靶点进行同步检测,极大地提高检测效率。
2.4 人工污染海产品样品的灵敏度检测
待接种的副溶血弧菌标准菌株ATCC 17802,经平板计数,其菌落总数为4×107CFU/mL。取10 倍倍比稀释1×10-1~1×10-91 mL 菌液接入9 mL 海带匀浆中,混匀作为人工污染海产品样品原样,使得人工污染海产品样品原样中副溶血弧菌菌落总数为4×107CFU/mL(9 mL 海带匀浆相当于1 g 海带)。人工污染后,各取1 mL 海带匀浆提取DNA,进行PCR 扩增。
人工污染副溶血弧菌水产品样品PCR 灵敏度检测见图6。

图6 人工污染副溶血弧菌水产品样品PCR 灵敏度检测
由图6 可知,人工污染海产品样品中菌含量为4×106~4×103CFU/mL 时,均发生扩增反应,产生扩增片段,当菌落总数为4×102CFU/mL 时,不产生片段,扩增反应不发生。因此,判定该法直接检测 食品样品中的副溶血性弧菌的检测限为4×103CFU/mL。
待接种的单增李斯特菌标准菌株ATCC 19118,经平板计数,其菌落总数为2.14×109CFU/mL。取10 倍倍比稀释1×10-1~1×10-91 mL 菌液接入9 mL海带匀浆中,混匀作为人工污染海产品样品原样,使得人工污染海产品样品原样中单增李斯特菌为2.14×109CFU/mL(9 mL 海带匀浆相当于1 g 海带)。人工污染后,各取1 mL 海带匀浆提取DNA,进行PCR 扩增。
人工污染单增李斯特菌水产品样品PCR 灵敏度检测见图7。
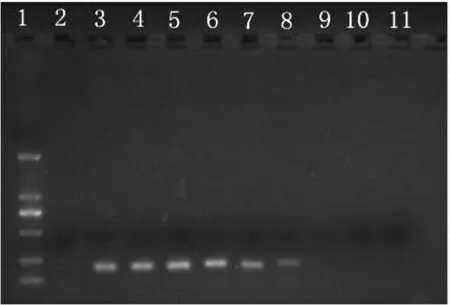
图7 人工污染单增李斯特菌水产品样品PCR 灵敏度检测
由图7 可知,人工污染海产品样品中菌落总数为2.14×109~2.14×103CFU/mL 时,均发生扩增反应,产生扩增片段,当菌落总数为2.14×102CFU/mL时,不产生片段,扩增反应不发生。因此,判定该法直接检测食品样品中的副溶血性弧菌的检测限为2.14×103CFU/mL。
待接种的沙门氏菌标准菌株ATCC 29269,经平板计数,其菌落总数为8×107CFU/mL。取10 倍倍比稀释1×10-1~1×10-91 mL 菌液接入9 mL 海带匀浆中,混匀作为人工污染海产品样品原样,使得人工污染海产品样品原样中单增李斯特菌为8×107CFU/mL(9 mL 海带匀浆相当于1 g 海带)。人工污染后,各取1 mL 海带匀浆提取DNA,进行PCR 扩增。
人工污染沙门氏菌水产品样品PCR 灵敏度检测见图8。
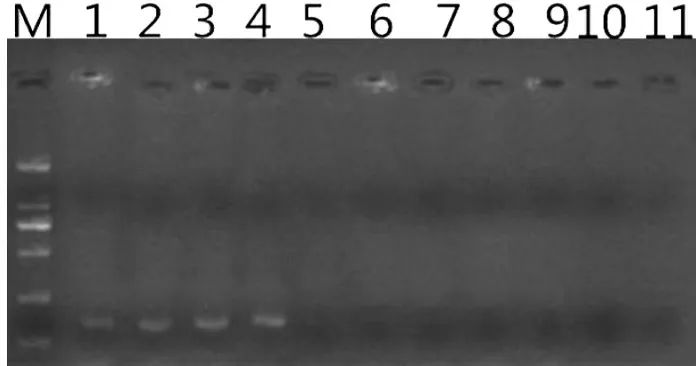
图8 人工污染沙门氏菌水产品样品PCR 灵敏度检测
由图8 可知,人工污染海产品样品中菌落总数为8×107~8×104CFU/mL 时,均发生扩增反应,产生扩增片段,当菌落总数为8×103CFU/mL 时,不产生片段,扩增反应不发生。因此,判定该法直接检测食品样品中的副溶血性弧菌的检测限为8×104CFU/mL。
待接种的大肠杆菌标准菌株ATCC 43895,经平板计数,其菌落总数为1.07×109CFU/mL。取10 倍倍比稀释1×10-1~1×10-91 mL 菌液接入9 mL 海带匀浆中,混匀作为人工污染海产品样品原样,使得人工污染海产品样品原样中单增李斯特菌为1.07×109CFU/mL(9 mL 海带匀浆相当于1 g 海带)。人工污染后,各取1 mL 海带匀浆提取DNA,进行PCR 扩增。
人工污染大肠杆菌水产品样品PCR 灵敏度检测见图9。
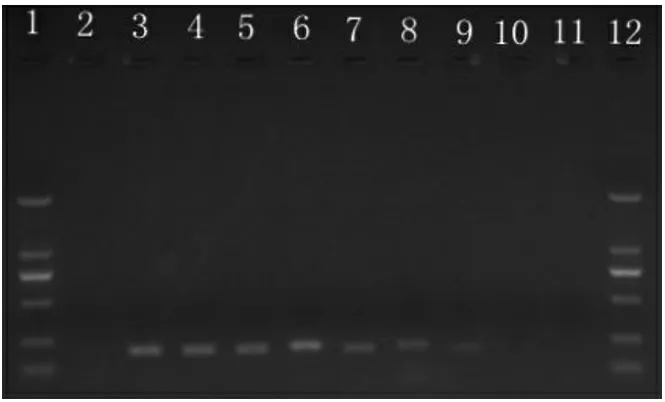
图9 人工污染大肠杆菌水产品样品PCR 灵敏度检测
由图9 可知,人工污染海产品样品中菌落总数为1.07×109~1.07×103CFU/mL 时,均发生扩增反应,产生扩增片段,当菌落总数为1.07×102CFU/mL时,不产生片段,扩增反应不发生。因此,判定该法直接检测食品样品中的副溶血性弧菌的检测限为1.07×103CFU/mL。
3 结论
常规的分离培养和生化鉴定耗时长,且灵敏度偏低,容易发生错检和漏检,不利于食源性突发疫情的快速诊断处置。PCR 技术相比于传统培养法和免疫学方法,如酶联免疫吸附法、免疫荧光法等,其特异性更强、灵敏度更高、操作更为简便快捷,已在食源性疾病病原检测中得到广泛应用[9-10]。
针对水产品中常见的4 种致病性微生物副溶血性弧菌、单增李斯特菌和沙门氏菌和大肠杆菌O157进行研究,对其特异性高度保守基因设计引物,并进行多靶点同步PCR 检测,结果表明,目标菌株扩增结果均为阳性,特异性为100%,且具有较高的灵敏度,基因组DNA 的检测限约为8.28×101CFU/mL,直接对水产品样品的灵敏度检测分别为4×103CFU/mL、2.14×103CFU/mL、8×104CFU/mL 和1.07×103CFU/mL,同前人所用PCR 方法只对一种菌株进行检测的灵敏度相近[11-12],表明该方法具有较强的实用价值。
系统全面地分析了水产品中常见的4 种致病性微生物的PCR 检测分析方法,对其特异性和灵敏度进行评价,并针对每种菌分别模拟真实食品体系,对该方法的实用性进行检测;研究选取的扩增片段小,每个循环所需时间较短,每个PCR 扩增程序仅为30 s,且设计的8 对引物长度相近,因此可设定相同的PCR 退火温度,所有目的菌株同时在相同PCR 程序下进行扩增,实现多种菌株一体化同步检测;试验结果表明,建立的该检测方法具有很强的特异性和较高的灵敏度,且在食品体系检测中也具有较高灵敏度,表明该方法具有一定实用价值;设计的8 对引物具有高度特异性和靶向性,可用于其他检测方法对上述几种菌检测的参考引物;研究采用的靶点具有高度特异性,该靶点可推广至其他检测方法中应用,如实时荧光定量PCR 检测法、多重PCR 及环介导等温扩增技术(LAMP) 等方法[13-15]。
建立的快速检测方法更加有利于实现一体化同步检测,为快速检测多种食源性致病性微生物提供了平台,具有较强的实用意义和推广价值,对于提高食品卫生水平、保证食品安全和推动食品国际贸易发展具有重要的意义。

