敲低NLRP12对高眼压大鼠RGCs的保护作用及其抑制细胞焦亡的机制
宋伟琼 何芳 杜玲芳 谭华霞 刘丹
1湖南省郴州市第一人民医院眼科,郴州423000;2中南大学湘雅医院眼科,长沙410078
视网膜神经节细胞(retinal ganglion cells,RGCs)死亡是青光眼致盲或视野缺损的潜在病理机制[1]。年龄是青光眼的主要危险因素,而目前认为眼压升高是关键的可变危险因素[2-3]。而且,通过手术或药物降低眼压可将视网膜损伤和渐进性视野丧失的发生率降低近一半[3],从而确立了降低眼压是治疗青光眼的有效方法。高眼压会导致细胞毒性因子和退化因子的产生。其中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是一种促炎细胞因子,在青光眼患者和青光眼模型大鼠的视盘中检测到TNF-α及其受体表达升高,而且TNF-α介导了高眼压对RGCs的细胞毒性作用[4]。研究发现,NOD样受体家族热蛋白结构域12(NOD-like receptors family pyrin domain containing 12,NLRP12)在调节自身炎症性疾病中发挥重要作用[5-6]。Caspase-1介导的细胞焦亡在促进促炎细胞因子表达方面具有关键作用[7]。NLRP12可以通过激活caspase-1诱发神经节细胞焦亡和白细胞介素1β(interleukin-1β,IL-1β)成熟,促进青光眼的RGCs死亡和神经炎症[7]。然而,在高眼压中NLRP12能否通过激活caspase-1调控RGCs炎症及阻断NLRP12/caspase-1信号对高眼压环境下视网膜损伤是否具有改善作用尚不清楚。本研究拟探讨高眼压造成大鼠RGCs损伤的炎性机制,研究敲低NLRP12对RGCs的影响及其作用机制,为青光眼视神经损伤的治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞来源 8~10周龄成年雄性SPF级SD大鼠70只,体质量200~300 g,购自西安交通大学动物实验中心。大鼠在12 h光/暗循环中饲养,可自由获取水和食物。所有动物实验均遵循视觉与眼科研究协会关于在眼科和视力研究中使用动物的声明,并获得湖南省郴州市第一人民医院动物伦理委员会批准(批文号:2020086)。大鼠RGCs(CP-R122)购于武汉普诺赛公司。
1.1.2主要试剂及仪器 兔抗大鼠NLRP12抗体(#A6671)、兔抗大鼠caspase-1抗体(#A0964)(美国ABclonal Biotech公司);兔抗大鼠cleaved-caspase-1抗体(YC0002)、兔抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(YM3029)(美国Immunoway公司);山羊抗兔二抗(美国Bioworld Technology公司);兔抗大鼠β-微管蛋白Ⅲ(β-tubulin Ⅲ)抗体(ab18207),Alexa Fluor 488偶联的山羊抗兔IgG(ab150077),IL-1β、TNF-α酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国Abcam公司);靶向大鼠NLRP12的小干扰RNA(small interfering RNA,siRNA)(上海吉玛公司);Lipofectamine 3000(美国Invitrogen公司);活性重组大鼠caspase-1(rat recombinant caspase-1,rrcaspase-1)(7524-100)(美国Biovision公司);氯胺酮、甲苯噻嗪(美国Phoenix Scientific公司);苏木精-伊红染色试剂盒、RIPA裂解液(上海碧云天公司);增强型化学发光(enhanced chemiluminescence,ECL)试剂盒(美国eBioscience公司)。眼科烧灼器(美国Rumex国际公司);眼压计(TV02,芬兰TonoLab公司);RM2235型石蜡切片机、Leica DM2000生物显微镜(德国Leica公司)。
1.2 方法
1.2.1常规培养大鼠RGCs及分组处理 采用含体积分数10%胎牛血清的DMEM培养基培养RGCs,将细胞置于体积分数5% CO2、37 ℃湿润培养箱中培养24 h,更换新鲜DMEM培养基,培养5~7 d。RGCs到达对数生长期后,将其分为对照组、rrcaspase-1组、siRNA阴性对照(siRNA negative control,siNC)+rrcaspase-1组、siNLRP12+rrcaspase-1组,其中rrcaspase-1组、siNC+rrcaspase-1组、siNLRP12+rrcaspase-1组分别采用加入rrcaspase-1(2 μg/ml)、siNC+rrcaspase-1(2 μg/ml)和siNLRP12(20 μmol/L)+rrcaspase-1(2 μg/ml)试剂的含Lipofectamine 3000的DMEM培养基处理细胞24 h,对照组不予处理。去除各组细胞培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,免疫固定液室温固定15 min,PBS洗涤5次,每次10 min;室温下用免疫染色封闭缓冲液将RGCs封闭1 h,并在4 ℃下用以1∶ 500稀释的抗β-tubulin Ⅲ一抗孵育过夜。用PBS洗涤3次,每次5 min,将细胞用荧光二抗(1∶ 1 000)在室温下孵育2 h。荧光显微镜下观察细胞并拍照。
1.2.2大鼠高眼压模型建立及分组处理 采用氯胺酮(100 mg/kg)和甲苯噻嗪(10 mg/kg)肌内注射全身麻醉大鼠。采用随机数字表法将70只大鼠分为对照组、高眼压组、高眼压+siNC组、高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组,每组14只。于右眼建模,参照文献[8-9]的方法通过巩膜外静脉烧灼术诱发高眼压模型。通过角膜缘周边的结膜和Tenon囊做1个切口。右眼巩膜外静脉通过其相对于眼外肌的位置来识别,其中2条背静脉和1条颞腹静脉在手术显微镜下用手持眼科烧灼器进行烧灼。对照组大鼠仅接受右眼结膜切口处理,不进行烧灼。成功的高眼压模型被定义为眼压升高大于基线眼压的30%,并且巩膜外静脉烧灼术后没有与烧灼相关的并发症。高眼压+siNC组、高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组建立高眼压模型后立即分别给予尾静脉注射0.2 ml siNC、siNLRP12(20 μmol/L)和siNLRP12(20 μmol/L)+rrcaspase-1(2 μg/ml)试剂。
1.2.3siRNA细胞转染 通过NCBI数据库获得NLRP12的基因序列CCAAATGGAGACCCTCTTT。RGCs接种至6孔板,待RGCs长至70%融合后,将siRNA加入含Lipofectamine 3000的DMEM培养基并替换原来的培养基,培养细胞24 h。随后收集细胞抽提细胞总蛋白,采用Western blot法检测NLRP12的表达量评估转染效果。
1.2.4大鼠眼压测量 巩膜外静脉烧灼术后1 d、1周、2周、3周,采用质量分数0.5%盐酸丙胺卡因滴眼液局部麻醉大鼠,测量大鼠右眼眼压,若峰值眼压高于基线或<6 mmHg(1 mmHg=0.133 kPa)或发生角膜溃疡、前房积血及其他眼部病变,则将大鼠排除,同时补充大鼠至基线数量。
1.2.5苏木精-伊红染色法观察大鼠视网膜结构 造模后3周,采用随机数字表法每组选择3只大鼠,腹腔内注射3倍麻醉剂量的巴比妥钠进行安乐死。左手抓住小鼠颈部皮肤,轻压在实验台上,取侧卧位,左手食指尽量将小鼠眼周皮肤往颈后压,使眼球突出。用眼科弯镊迅速夹出完整眼球,用质量分数4%多聚甲醛固定10 min,沿角巩膜剪开眼球,去除角膜和晶状体,用2把显微镊夹住巩膜缘,并用镊子蜕去巩膜,用滤纸吸干房水和残余玻璃体,轻轻保留视网膜。视网膜组织用石蜡包埋保存。沿矢状面切片,每个组织制备3个视网膜组织切片,厚度为5 μm,用苏木精-伊红染色试剂盒进行染色。使用Leica DM2000生物显微镜观察切片,观察区域为内界膜至外界膜且距离视神经1 mm内,并获取该区域图片。由2名独立的观察者利用ImageJ 1.8.0软件中的计数模块获得各组图片中细胞核(紫蓝色)的数量即为视网膜细胞数量。
1.2.6Western blot法检测RGCs和视网膜组织中NLRP12、caspase-1、cleaved-caspase-1蛋白表达水平 大鼠造模后3周,采用随机数字表法各组选取3只大鼠,参照1.2.5部分提取大鼠视网膜组织。提取1.2.1部分RGCs和视网膜组织总蛋白,其中RGCs在冰浴中超声破碎10 s,共3次,4 ℃下离心半径6.5 cm,12 000 r/min离心15 min,收集上清,BCA蛋白定量法测定蛋白浓度。采用RIPA裂解液(强)裂解视网膜组织,离心收集上清液及蛋白定量方法同RGCs。将等量的蛋白质(RGCs为50 μg,视网膜组织为100 μg)加样到SDS-PAGE凝胶上并转移至PVDF膜,用TBST稀释的质量分数5%脱脂奶粉封闭1 h,4 ℃下兔抗大鼠NLRP12抗体(1∶ 200)、caspase-1抗体(1∶ 200)、cleaved-caspase-1抗体(1∶ 500)、GAPDH抗体(1∶ 1 000)孵育过夜;次日,洗膜后用相应二抗(1∶ 5 000)在室温下孵育1 h,用ECL试剂盒观察条带并用Image Lab成像系统记录,使用ImageJ软件进行灰度分析。目的蛋白相对表达水平=(处理组目标灰度值/内参灰度值)/(对照组目标灰度值/内参灰度值)。
1.2.7ELISA法检测大鼠血清和RGCs培养物上清中TNF-α及IL-1β质量浓度 收取各组培养RGCs的上清液和造模3周后14只大鼠静脉血清,用预冷PBS洗涤,离心半径15 cm,1 500 r/min离心20 min。将上清液转移至新管中,分别使用TNF-α和IL-1β ELISA试剂盒检测TNF-α和IL-1β表达水平。使用96孔板分光光度计测量450 nm处的吸光度(A)值。通过与同时生成的标准曲线进行比较,将A值转换为TNF-α和IL-1β质量浓度,并对数据进行标准化处理(对照组数值化为1)得到TNF-α和IL-1β质量浓度变化的相对值。
1.3 统计学方法
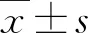
2 结果
2.1 各组RGCs培养
对照组、rrcaspase-1组、siNC+rrcaspase-1组、siNLRP12+rrcaspase-1组RGCs均被带有绿色荧光的β-tubulin Ⅲ抗体所标记(图1)。
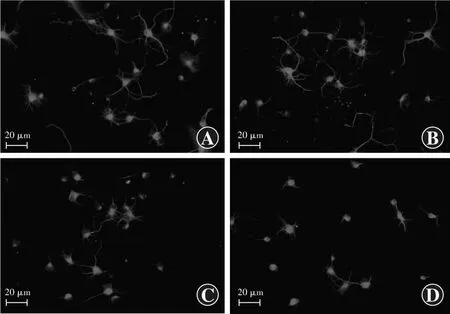
图1 各组β-tubulin Ⅲ标记的RGCs(Alexa Fluor 488 ×200,标尺=20 μm) 绿色荧光为β-tubulin Ⅲ标记RGCs A:对照组 B:rrcaspase-1组 C:siNC+rrcaspase-1组 D:siNLRP12+rrcaspase-1组
2.2 对照组和高压眼组大鼠术后不同时间点眼压比较
对照组和高眼压组术后不同时间点眼压总体比较差异均有统计学意义(F分组=128.255,P<0.001;F时间=92.562,P<0.001),其中与对照组比较,术后1、2、3周高眼压组眼压高于对照组,差异均有统计学意义(均P<0.05)(表1)。
2.3 各组大鼠视网膜结构和RGCs数量比较
对照组视网膜各层组织清晰,RGCs呈单层排列,高眼压组和高眼压+siNC组RGCs层松散,视网膜内丛状层变薄。高眼压+siNLRP12组视网膜内丛状层较高眼压组增厚,高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组RGCs层松散(图2)。
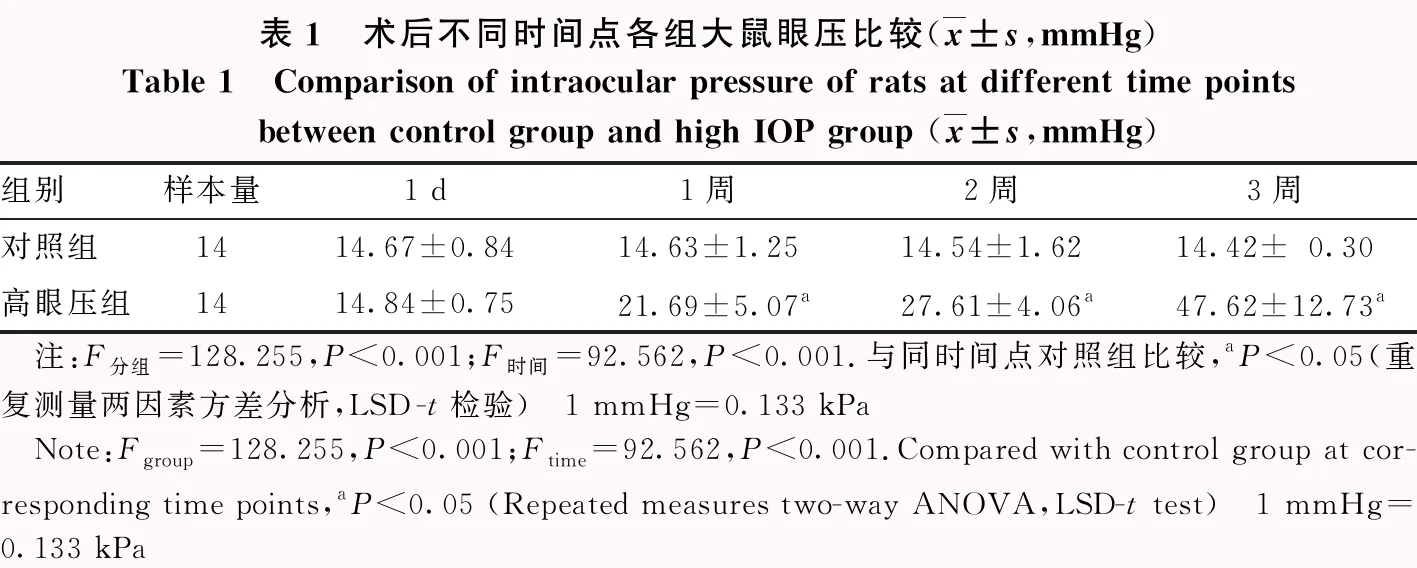
表1 术后不同时间点各组大鼠眼压比较(x±s,mmHg)Table 1 Comparison of intraocular pressure of rats at different time points between control group and high IOP group (x±s,mmHg)组别样本量1 d1周2周3周对照组1414.67±0.8414.63±1.2514.54±1.6214.42±0.30高眼压组1414.84±0.7521.69±5.07a27.61±4.06a47.62±12.73a 注:F分组=128.255,P<0.001;F时间=92.562,P<0.001.与同时间点对照组比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) 1 mmHg=0.133 kPa Note:Fgroup=128.255,P<0.001;Ftime=92.562,P<0.001.Compared with control group at cor-responding time points,aP<0.05 (Repeated measures two-way ANOVA,LSD-t test) 1 mmHg=0.133 kPa

图2 NLRP12敲低后各组大鼠视网膜结构(HE ×200,标尺=50 μm) A:对照组视网膜各层组织清晰,RGCs呈单层排列 B:高眼压组RGCs层松散,视网膜内丛状层变薄 C:高眼压+siNC组RGCs层松散,视网膜内丛状层变薄 D:高眼压+siNLRP12组RGCs层松散,内丛状层较高眼压组变厚 E:高眼压+siNLRP12+rrcaspase-1组RGCs层松散
对照组、高眼压组、高眼压+siNC组、高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组RGCs数量分别为(119.31±23.25)、(89.19±16.98)、(88.87±13.92)、(109.33±10.25)、(92.89±12.58)个,总体比较差异有统计学意义(F=201.932,P<0.001),其中高眼压组、高眼压+siNC组、高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组RGCs数量少于对照组,高眼压+siNLRP12组RGCs数量多于高眼压+siNC组,高眼压+siNLRP12+rrcaspase-1组RGCs数量少于高眼压+siNLRP12组,差异均有统计学意义(均P<0.05)。
2.4 各组大鼠视网膜组织中NLRP12表达、caspase-1活化及炎症因子表达水平比较
蛋白电泳结果显示,与对照组比较,高眼压组、高眼压+siNC组高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组caspase-1和cleaved-caspase-1蛋白条带表达强度增加高眼压组、高眼压+siNC组、高眼压+siNLRP12+rrcaspase-1组NLRP12蛋白条带表达强度增加,高眼压+siNLRP12组NLRP12蛋白条带表达强度减弱;与高眼压组比较,高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组NLRP12、caspase-1和cleaved-caspase-1蛋白条带表达强度减弱(图3)。各组大鼠视网膜组织中NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β质量浓度总体比较,差异均有统计学意义(F=139.022、36.981、69.587、96.065、103.223,均P<0.05),其中高眼压组、高眼压+siNC组、高眼压+siNLRP12组和高眼压+siNLRP12+rrcaspase-1组caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β质量浓度较对照组升高,高眼压+siNLRP12组较高眼压+siNC组降低,高眼压+siNLRP12+rrcaspase-1组较高眼压+siNLRP12组升高,差异均有统计学意义(均P<0.05)(表2)。

图3 Western blot法检测术后3周大鼠视网膜组织中NLRP12、cleaved-caspase-1和caspase-1表达 1:对照组;2:高眼压组;3:高眼压+siNC组;4:高眼压+siNLRP12组;5:高眼压+siNLRP12+rrcaspase-1组 NLRP:NOD样受体家族热蛋白结构域;GAPDH:甘油醛-3-磷酸脱氢酶
2.5 各组RGCs中NLRP12表达、caspase-1活化及炎症因子表达水平比较
蛋白电泳结果显示,与对照组比较,rrcaspase-1组cleaved-caspase-1条带表达强度明显增加,NLRP12条带表达强度变化不明显。与siNC+rrcaspase-1组比较,siNLRP12+rrcaspase-1组cleaved-caspase-1及NLRP12蛋白条带表达强度降低(图4)。各组RGCs中NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β相对质量浓度总体比较差异均有统计学意义(F=56.302、106.286、108.629、95.305、68.207,均P<0.05),其中rrcaspase-1组、siNC+rrcaspase-1组caspase-1和cleaved-caspase-1蛋白相对表达量较对照组升高,siNLRP12+rrcaspase-1组NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量较对照组降低,rrcaspase-1组、siNC+rrcaspase-1组、siNLRP12+rrcaspase-1组TNF-α和IL-1β相对质量浓度较对照组升高,siNLRP12+rrcaspase-1组NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β相对质量浓度较siNC+rrcaspase-1组降低,差异均有统计学意义(均P<0.05)(表3)。

图4 Western blot法检测RGCs中NLRP12、caspase-1和cleaved-caspase-1表达 1:对照组;2:rrcaspase-1组;3:siNC+rrcaspase-1组;4:siNLRP12+rrcaspase-1组 NLRP:NOD样受体家族热蛋白结构域;GAPDH:甘油醛-3-磷酸脱氢酶
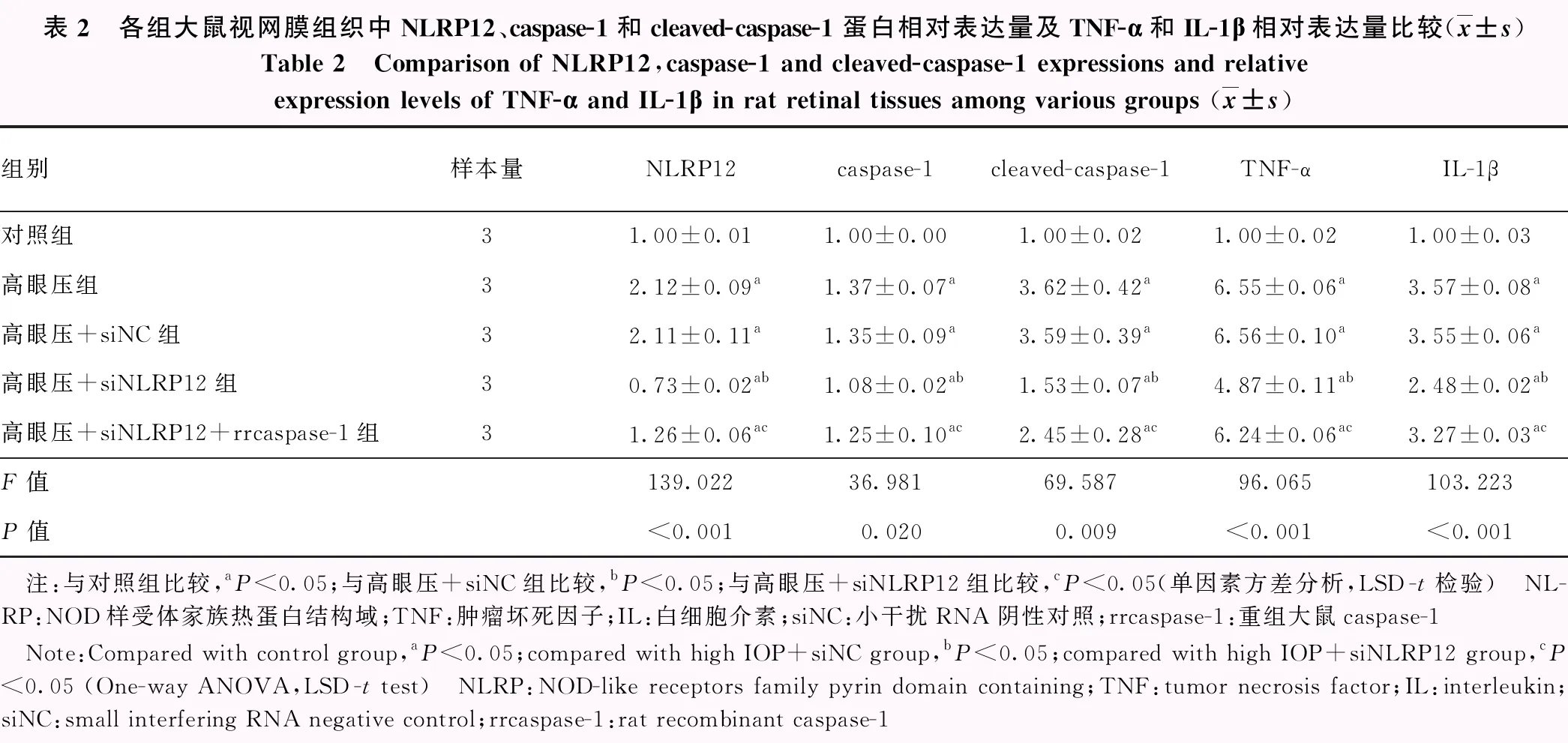
表2 各组大鼠视网膜组织中NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β相对表达量比较(x±s)Table 2 Comparison of NLRP12,caspase-1 and cleaved-caspase-1 expressions and relative expression levels of TNF-α and IL-1β in rat retinal tissues among various groups (x±s)组别样本量NLRP12caspase-1cleaved-caspase-1TNF-αIL-1β对照组31.00±0.011.00±0.001.00±0.021.00±0.021.00±0.03高眼压组32.12±0.09a1.37±0.07a3.62±0.42a6.55±0.06a3.57±0.08a高眼压+siNC组32.11±0.11a1.35±0.09a3.59±0.39a6.56±0.10a3.55±0.06a高眼压+siNLRP12组30.73±0.02ab1.08±0.02ab1.53±0.07ab4.87±0.11ab2.48±0.02ab高眼压+siNLRP12+rrcaspase-1组31.26±0.06ac1.25±0.10ac2.45±0.28ac6.24±0.06ac3.27±0.03acF值139.02236.98169.58796.065103.223P值<0.0010.0200.009<0.001<0.001 注:与对照组比较,aP<0.05;与高眼压+siNC组比较,bP<0.05;与高眼压+siNLRP12组比较,cP<0.05(单因素方差分析,LSD-t检验) NL-RP:NOD样受体家族热蛋白结构域;TNF:肿瘤坏死因子;IL:白细胞介素;siNC:小干扰RNA阴性对照;rrcaspase-1:重组大鼠caspase-1 Note:Compared with control group,aP<0.05;compared with high IOP+siNC group, bP<0.05;compared with high IOP+siNLRP12 group,cP<0.05 (One-way ANOVA,LSD-t test) NLRP:NOD-like receptors family pyrin domain containing;TNF:tumor necrosis factor;IL:interleukin;siNC:small interfering RNA negative control;rrcaspase-1:rat recombinant caspase-1
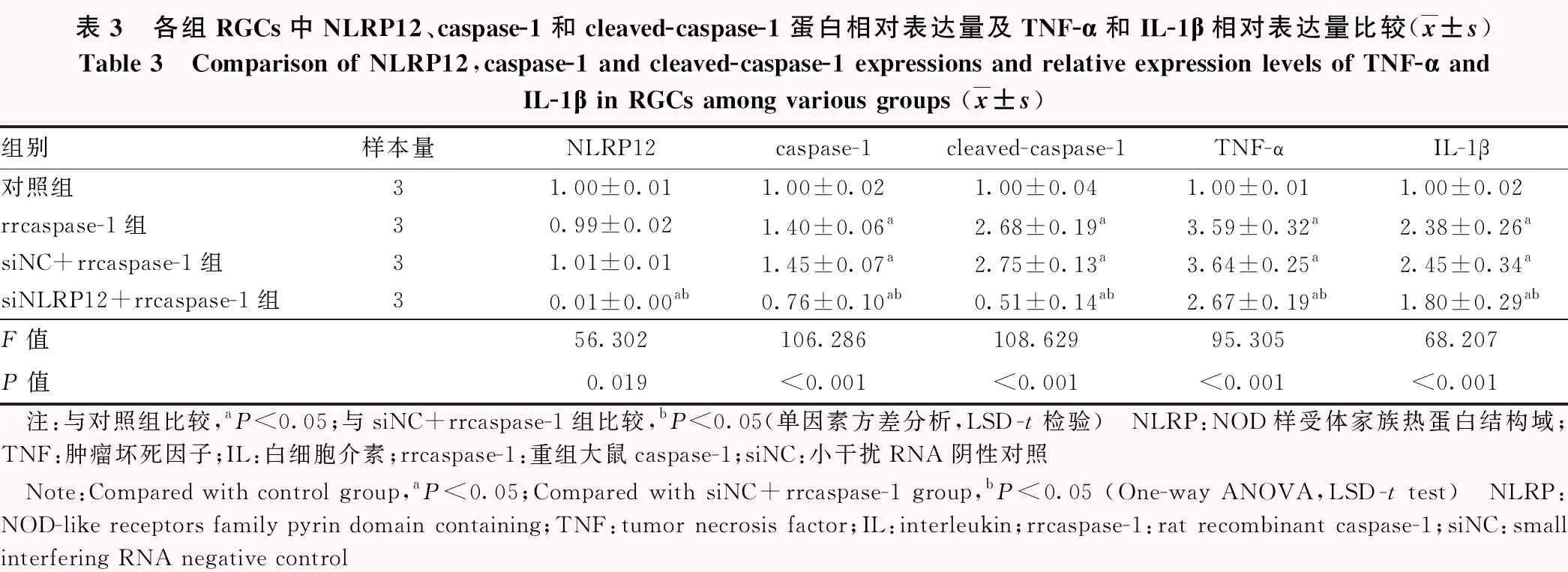
表3 各组RGCs中NLRP12、caspase-1和cleaved-caspase-1蛋白相对表达量及TNF-α和IL-1β相对表达量比较(x±s)Table 3 Comparison of NLRP12,caspase-1 and cleaved-caspase-1 expressions and relative expression levels of TNF-α and IL-1β in RGCs among various groups (x±s)组别样本量NLRP12caspase-1cleaved-caspase-1TNF-αIL-1β对照组31.00±0.011.00±0.021.00±0.041.00±0.011.00±0.02rrcaspase-1组30.99±0.021.40±0.06a2.68±0.19a3.59±0.32a2.38±0.26asiNC+rrcaspase-1组31.01±0.011.45±0.07a2.75±0.13a3.64±0.25a2.45±0.34asiNLRP12+rrcaspase-1组30.01±0.00ab0.76±0.10ab0.51±0.14ab2.67±0.19ab1.80±0.29abF值56.302106.286108.62995.30568.207P值0.019<0.001<0.001<0.001<0.001 注:与对照组比较,aP<0.05;与siNC+rrcaspase-1组比较,bP<0.05(单因素方差分析,LSD-t检验) NLRP:NOD样受体家族热蛋白结构域;TNF:肿瘤坏死因子;IL:白细胞介素;rrcaspase-1:重组大鼠caspase-1;siNC:小干扰RNA阴性对照 Note:Compared with control group,aP<0.05;Compared with siNC+rrcaspase-1 group, bP<0.05 (One-way ANOVA,LSD-t test) NLRP:NOD-like receptors family pyrin domain containing;TNF:tumor necrosis factor;IL:interleukin;rrcaspase-1:rat recombinant caspase-1;siNC:small interfering RNA negative control
3 讨论
本研究证实,在RGCs中激活caspase-1对NLRP12表达的影响不明显,但明显增强RGCs的炎症水平;敲低NLRP12可以通过下调NLRP12表达抑制caspase-1活化,并减轻高眼压对视网膜的损伤和RGCs的炎症反应。本研究结果巩固了青光眼中RGCs损伤和炎症与NLRP12/caspase-1信号的联系。另外,国内外通过高眼压大鼠接受siRNA转染改变目标基因用于探讨RGCs损伤和炎症机制的研究尚不多见。本研究表明敲低NLRP12可抑制高眼压大鼠血清TNF-α和IL-1β的表达,减轻炎症反应和RGCs损失。本研究结果为青光眼疾病的治疗提供了关键靶点。
青光眼是亚洲人群中常见的眼病,其特点是眼压突然大幅升高、严重眼痛和不可逆性视力丧失,可发展为永久性盲[10-11]。眼压的快速升高可导致视网膜缺血-再灌注损伤和RGCs死亡[12]。当血管破裂引起的缺血/缺氧导致氧气和葡萄糖缺乏时,视网膜变得脆弱,随后引发一系列炎症过程[13]。研究证实,高眼压诱导的缺血会引发小胶质细胞神经炎症,从而介导视网膜损伤和RGCs死亡[14-17]。视网膜缺血不仅直接诱导RGCs死亡,还会通过触发损伤相关分子模式诱导的Toll样受体4炎症小体依赖性神经炎症以激活小胶质细胞,从而进一步诱导RGCs死亡[18-20]。尽管如此,目前仍缺乏对青光眼的有效治疗方案。而且关于高眼压中RGCs神经炎症发生机制的研究仍较少,因此需要更深入地了解潜在的神经炎症机制,以确定青光眼治疗的关键目标。
本研究通过巩膜外静脉烧灼术升高眼压,导致视神经轴突退化并最终丧失RGCs。研究表明,巩膜外静脉烧灼术诱导的眼压升高导致TNF-α水平在3 d内升高,7 d时水平比正常高17倍,并至少保持升高4周[21]。另外,多项研究证实青光眼患者视网膜和视盘中TNF-α水平升高[22-23]。本研究与这些研究的结果一致,通过ELISA法观察到大鼠血清中TNF-α浓度明显升高。另外,IL-1β是中枢神经系统的重要炎症介质[24],而且成熟IL-1β和NLRP12之间发生相互作用,从而放大炎症级联反应[7]。另外,脂多糖诱导的实验性炎性高眼压青光眼模型中,TNF-α和IL-1β水平同样升高[25],因此,结合本研究通过苏木精-伊红染色观察到的RGCs损伤可知本研究成功建立了高眼压模型,其特征是导致明显的视网膜炎症和RGCs损失。
Caspase-1介导一种新的程序性裂解细胞死亡形式,即细胞焦亡,其特征是细胞肿胀、单层脂质体中的孔形成、膜破裂和炎性细胞因子的释放[26-29]。研究发现NLRP12是调控肠道微生物群紊乱导致炎症疾病的关键[5-6]。NLRP12通过体内和体外的caspase-1依赖性启动细胞焦亡,导致炎症水平升高[7]。而且,Truax等[30]观察到NLRP12可以激活核因子κB炎症信号通路依赖的促炎症因子加工。本研究观察到rrcaspase-1处理的RGCs中炎症因子水平上调,而敲低NLRP12后观察到无论血清水平还是RGCs水平,TNF-α和IL-1β浓度均明显降低,证实NLRP12在高眼压大鼠中是促炎的关键原因之一。另外,NLRP12基因缺失显著减轻了RGCs丢失和视网膜损伤的严重程度,证实NLRP12激活是青光眼视网膜缺血性损伤的触发因素[7]。本研究使用siRNA敲低NLRP12,不仅观察到其抑制了高眼压大鼠的视网膜细胞损失,还观察到caspase-1的活性模式cleaved-caspase-1的表达水平被明显抑制,而当重新补充rrcaspase-1后高眼压大鼠的视网膜细胞损失和炎症因子TNF-α和IL-1β质量浓度均明显升高。这表明减少NLRP12表达可能是治疗高眼压大鼠视网膜损伤的有效手段,其机制是通过抑制caspase-1的激活。
本研究巩膜外静脉烧灼术操作简单,眼压升高重复性好,尽管本实验中成功造模,造模后未见异常,但不排除眼内局部存在淤血及缺血的风险。另外,尽管敲低NLRP12对高眼压大鼠RGCs数量的保护作用以及对高眼压中炎症因子TNF-α和IL-1β表达有抑制作用,但是敲低NLRP12对RGCs数量的保护作用和对TNF-α和IL-1β表达的抑制作用似乎仅有部分作用效果,因此可能仍存在其他调控机制,需要进一步验证。
综上所述,本研究得出与高眼压中视网膜损伤和RGCs炎症相关的新机制。我们认为,敲低NLRP12可抑制RGCs的缺失和炎症反应,减轻视网膜组织损伤的严重程度,而且敲低NLRP12对caspase-1激活的抑制作用是其核心机制。表明抑制NLRP12/caspase-1诱导的神经炎症可能是治疗青光眼的潜在策略,为青光眼治疗提供新的治疗靶点。本研究也为将来NLRP12/caspase-1抑制剂在治疗青光眼方面的临床应用提供了实验基础。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明宋伟琼:参与论文选题、研究设计、实验实施、数据采集和分析、论文撰写;何芳:参与论文选题、研究设计、实验实施、数据采集和统计分析、文章内容的审核和定稿;杜玲芳:参与论文选题、研究设计、实验实施、对文章智力性内容修改和定稿;谭华霞:参与数据采集;刘丹:参与数据收集和统计分析

