Plackett-Burman 联用响应面法优化酶法-超声波提取葛根中葛根素工艺
黄佳伟,梁 雁,韦慧鲜,阮碧芳
(广西农业职业技术大学,广西 南宁 530000)
葛根系豆科植物野葛(Pueraria lobata(Willd.)Ohwi)的干燥根[1]。研究发现,葛根中含有葛根素、芒果苷、大豆苷、三萜类、香豆素、皂苷等化合物[2],其中葛根素具有抗氧化、保护肝脏、抗肿瘤等多种药理作用[3-5],可用于冠心病、心肌梗死等心脑血管病和糖尿病的治疗,具体表现为扩张冠状动脉,改善心肌缺血,降低血糖以及清除氧自由基等[6-7]。
由葛根制成的相关药品、保健食品、化妆品已在市场上销售多年,具有良好的市场基础。如何从葛根中环保、高效、低成本地提取葛根素是近年的研究热点[8]。目前,葛根素的提取方法主要有微波法、浸提法、溶剂分离法、乙醇提取法、超声波提取法等[9-13],这些提取方法只能在一定程度上利用机械碎裂、热效应、空化效应的手段破坏葛根细胞壁,存在得率低、浪费提取溶剂的缺点。酶法提取技术高效快速、条件温和,且能通过破坏植物细胞壁加速细胞内物质溶出,不但能较大程度地提高提取物得率,同时还能保持其原有的功效。
本研究将纤维素酶提取和超声波提取联合应用于葛根中葛根素的提取,强化两种提取方法的优势,以葛根素得率为评价指标,进一步优化液料比、乙醇体积分数、超声时间、酶解时间等提取工艺参数,找到更为环保、提取效率更高的葛根素提取方法,为葛根的开发与应用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
葛根素标准品(纯度≥98%):上海源叶生物科技公司;乙醇(分析纯):天津市富宇精细化工有限公司;葛根,市售;纤维素酶(50 U/mg):上海源叶生物科技公司。
1.1.2 仪器与设备
UV-5500 紫外可见分光光度计:上海元析仪器有限公司;HH-6 数显恒温水浴锅:常州国华电器有限公司;SB-5200D 超声波清洗仪:宁波新艺超声设备有限公司;SHB-Ⅲ循环水式真空泵:郑州长城科工贸有限公司;FW135 粉碎机:泰斯特仪器有限公司;RE5220 旋转蒸发仪:常州杰博森仪器有限公司。
1.2 方法
1.2.1 葛根素样品溶液的制备
精密称取经粉碎并过3 号筛(50 目)的葛根粉末2.5 g,按一定液料比(乙醇∶葛根粉末)加入一定体积分数的乙醇,然后再加入一定质量分数的纤维素酶,50 ℃水浴酶解一定时间,酶解结束后,95 ℃水浴灭活5 min,于30~80 ℃下超声处理20~70 min,然后进行真空抽滤,并利用旋转蒸发仪对滤液进行浓缩,用无水乙醇将浓缩液定容至100 mL,即得粗提葛根素样品溶液。
1.2.2 葛根素含量的测定
1.2.2.1 葛根素标准曲线的绘制
精密称取葛根素标准品质量20 mg,用乙醇溶解并定容至25 mL 容量瓶中,得到质量浓度为800 μg/mL的葛根素标准品母液,将标准品母液稀释至1.6、3.2、4.8、6.4、8.0、9.6 μg/mL,分别于250 nm 波长下测定吸光度值。得到葛根素质量浓度(c)与吸光度值(A)的标准曲线方程:A=0.077 3c+0.012(R2=0.999 55)。
1.2.2.2 葛根素得率的计算
精密移取提取样液,稀释至适宜浓度,使之在250 nm 吸光度值的线性范围内,根据标准曲线方程计算葛根素质量浓度,葛根素得率按照以下公式计算。
式中:c为葛根素质量浓度,μg/mL;V为样品体积,mL;N为稀释倍数;m为葛根粉的质量,g。
1.2.3 单因素试验设计
固定液料比30∶1(mL/g)、纤维素酶添加量0.5%、乙醇体积分数50%、酶解时间50 min、超声时间30 min、超声温度60 ℃,分别考察液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1(mL/g))、纤维素酶添加量(0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)、乙醇体积分数(30%、40%、50%、60%、70%、80%)、酶解时间(30、40、50、60、70、80 min)、超声时间(20、30、40、50、60、70 min)、超声温度(30、40、50、60、70、80 ℃)对葛根素得率的影响。
1.2.4 Plackett-Burman 试验设计
结合单因素试验结果,采用Plackett-Burman 试验设计,对液料比(A)、纤维素酶添加量(B)、乙醇体积分数(C)、酶解时间(D)、超声时间(E)、超声温度(F)进行关键因素的筛选,以葛根素得率作为响应值。每个因素有高低两个水平。Plackett-Burman 试验设计因素及水平见表1。
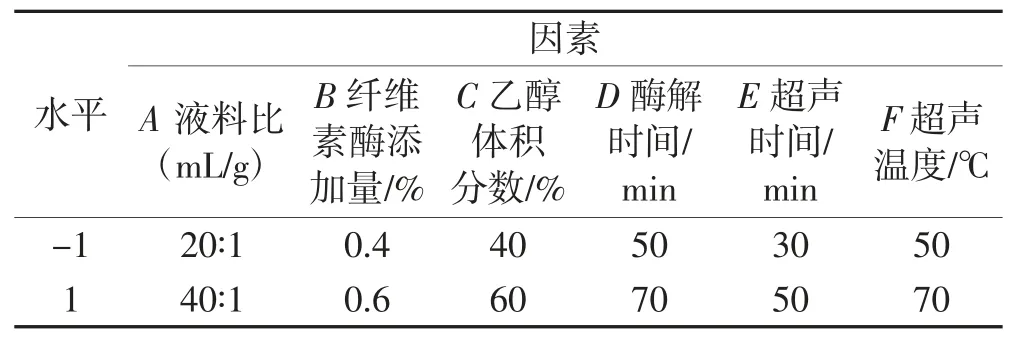
表1 Plackett-Burman 试验设计因素及水平表Table 1 Factors and levels of Plackett-Burman experiment design for puerarin extraction
1.2.5 最陡爬坡试验
根据Plackett-Burman 试验结果,筛选出对葛根素得率具有显著影响的因素,其他非显著因素条件保持不变,以各因素的效应大小确定爬坡的方向和步长试验设计[14],根据葛根素得率的高低确定具有显著影响因素的最佳提取范围。
1.2.6 响应面优化试验设计
根据最陡爬坡试验结果,固定纤维素酶添加量0.4%,酶解时间70 min,将液料比(A)、乙醇体积分数(B)、超声时间(C)、超声温度(D)设为自变量,葛根素得率设为响应值,利用Box-Behnken 试验原理,设计四因素三水平的优化试验。因素及水平编码如表2所示。
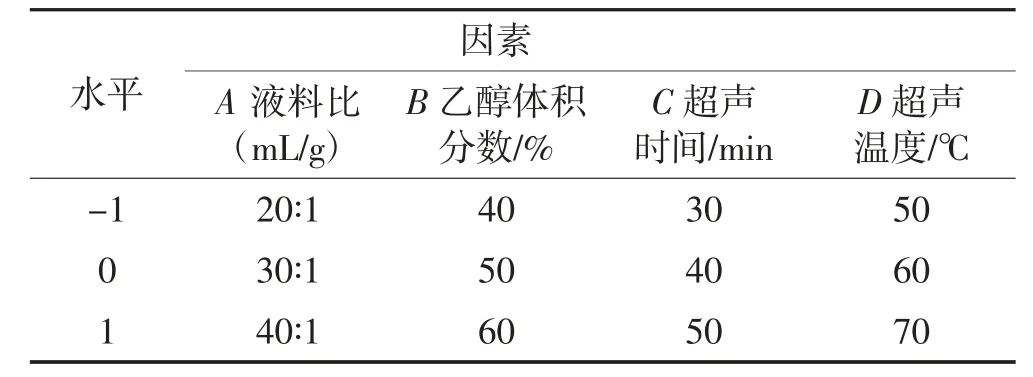
表2 Box-Behnken 响应面试验因素与水平表Table 2 Factors and levels of Box-Behnken response surface experiments for puerarin extraction
1.2.7 数据处理
采用Excel 2007、Origin 8、Design Expert 11 软件进行数据分析和绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对葛根素得率的影响
如图1 所示,随着乙醇所占比例的不断增大,葛根素得率呈现先增加后减少的趋势,液料比为30∶1(mL/g)时,葛根素得率达到最大值,液料比在30∶1~60∶1(mL/g)时,葛根素得率随着乙醇所占比例的增大而降低,这可能是乙醇占比的增加,使细胞内外葛根素浓度差变大,葛根素不断溶出;液料比增大到一定范围后,其他物质如糖类、蛋白质也相继扩散出来[15],形成粘附性胶团附于葛根粉末表面,导致其得率下降。因此,选取液料比20∶1、30∶1、40∶1(mL/g)进行后续筛选试验。
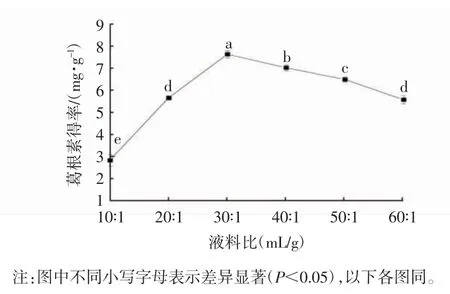
图1 液料比对葛根素得率的影响Fig. 1 Effect of liquid-solid ratio on the yield of puerarin
2.1.2 纤维素酶添加量对葛根素得率的影响
酶反应提取作为新型的提取技术,具有高效节能、操作简单方便、反应温和的优势,常用于中成药有效成分的提取应用[16-17]。如图2 所示,反应前期,随着纤维素酶添加量的不断增加,葛根素得率显著提高,纤维素酶添加量为0.5%时,葛根素得率达到最大值,而后继续增加纤维素酶添加量,葛根素得率却开始降低,原因可能是过多纤维素酶的加入,大量大分子物质如蛋白质等溶出[18],阻塞了溶出孔,酶解效率降低,导致葛根素得率下降。因此,选择纤维素酶添加量0.4%、0.5%、0.6%进行后续筛选试验。
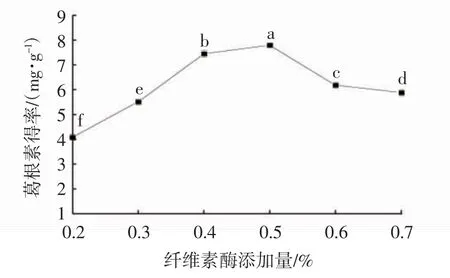
图2 纤维素酶添加量对葛根素得率的影响Fig. 2 Effect of cellulase adding amount on the yield of puerarin
2.1.3 乙醇体积分数对葛根素得率的影响
如图3 所示,反应前期,随着乙醇体积分数的升高,葛根素得率不断提高,乙醇体积分数为50%时,葛根素得率达到最大值,之后葛根素得率呈下降趋势,原因是随着乙醇体积分数的增加,葛根粉中其他可溶于乙醇的成分如极性小分子也在不断溶出,与葛根素竞争溶剂,使其溶出受限。因此,选择乙醇体积分数40%、50%、60%进行后续筛选试验。
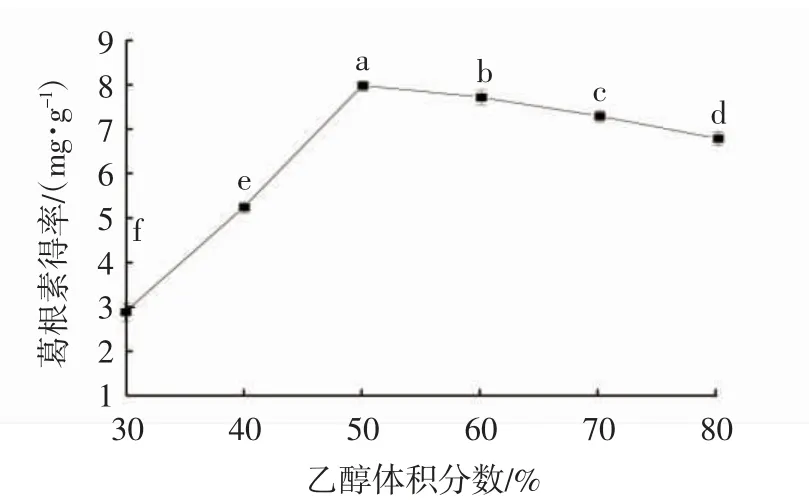
图3 乙醇体积分数对葛根素得率的影响Fig. 3 Effect of ethanol content on the yield of puerarin
2.1.4 酶解时间对葛根素得率的影响
如图4 所示,葛根素得率随着酶解时间的延长呈现先升高后降低的变化趋势。在酶解时间为60 min时,葛根素得率达到最大值,之后随着酶解时间的延长,葛根素得率反而降低,原因可能是当酶解时间过长时,酶解底物过多,酶反应趋于稳定[19];随着葛根细胞壁破裂,黏性物质释放,致使葛根素溶出受阻。因此,选择酶解时间50、60、70 min 进行后续筛选试验。
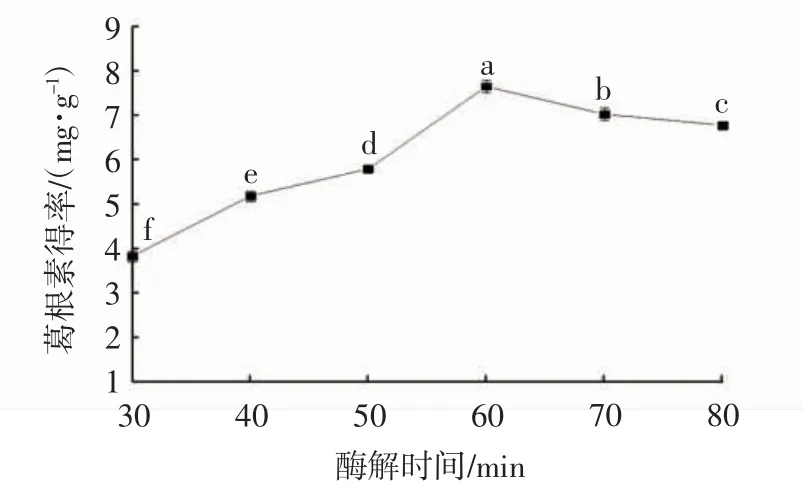
图4 酶解时间对葛根素得率的影响Fig. 4 Effect of enzymatic hydrolysis time on the yield of puerarin
2.1.5 超声时间对葛根素得率的影响
如图5 所示,反应前期,随着超声时间的延长,葛根素得率不断提高,在40 min 时达到最大值,随后葛根素得率下降,原因可能是超声时间过长,引起细胞空间构型改变[20],葛根素溶出受限,导致其得率下降。因此,选择超声时间30、40、50 min 进行后续筛选试验。
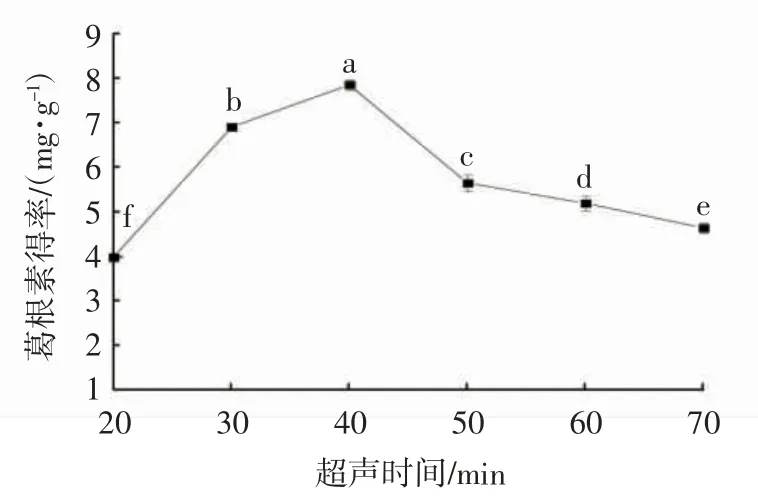
图5 超声时间对葛根素得率的影响Fig. 5 Effect of ultrasonic time on the yield of puerarin
2.1.6 超声温度对葛根素得率的影响
如图6 所示,反应前期,随着超声温度的升高,葛根素得率不断提高,超声温度为60 ℃时,葛根素得率达到最大值,之后葛根素得率反而不断下降。原因可能是超声温度过高时,葛根素部分结构受到破坏,导致葛根素得率下降。因此,选择超声温度50、60、70 ℃进行后续筛选试验。
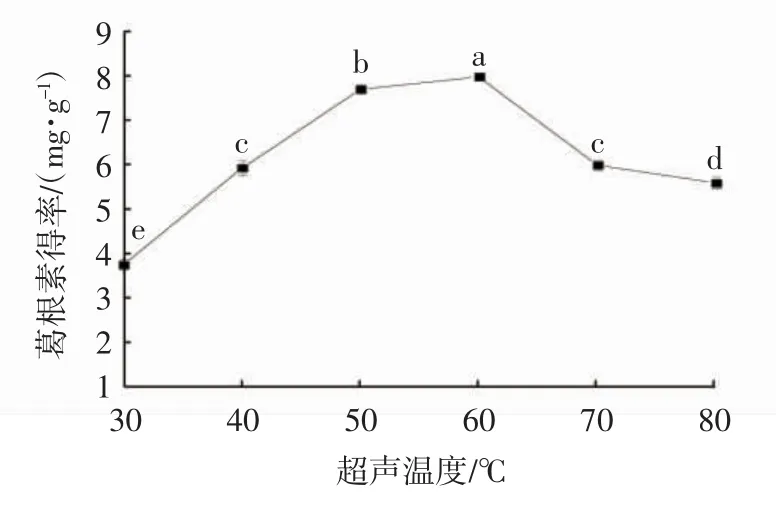
图6 超声温度对葛根素得率的影响Fig. 6 Effect of ultrasonic temperature on the yield of puerarin
2.2 Plackett-Burman 试验结果
根据单因素试验结果,以葛根素得率为响应值,采用Plackett-Burman 法进行显著因素筛选试验。试验设计及结果见表3,对试验结果进行方差分析及显著性检验,结果见表4。由表4 可知,模型的F 值=24.97>1,P 值<0.01,R2=0.96 7=0.929,表明模型设计合理;6 个因素对葛根素得率的影响程度大小为:A>E>C>F>D>B;液料比(A)、乙醇体积分数(C)、超声时间(E)、超声温度(F)对葛根素得率影响显著(P<0.05),纤维素酶添加量(B)和酶解时间(D)对葛根素得率影响不显著。
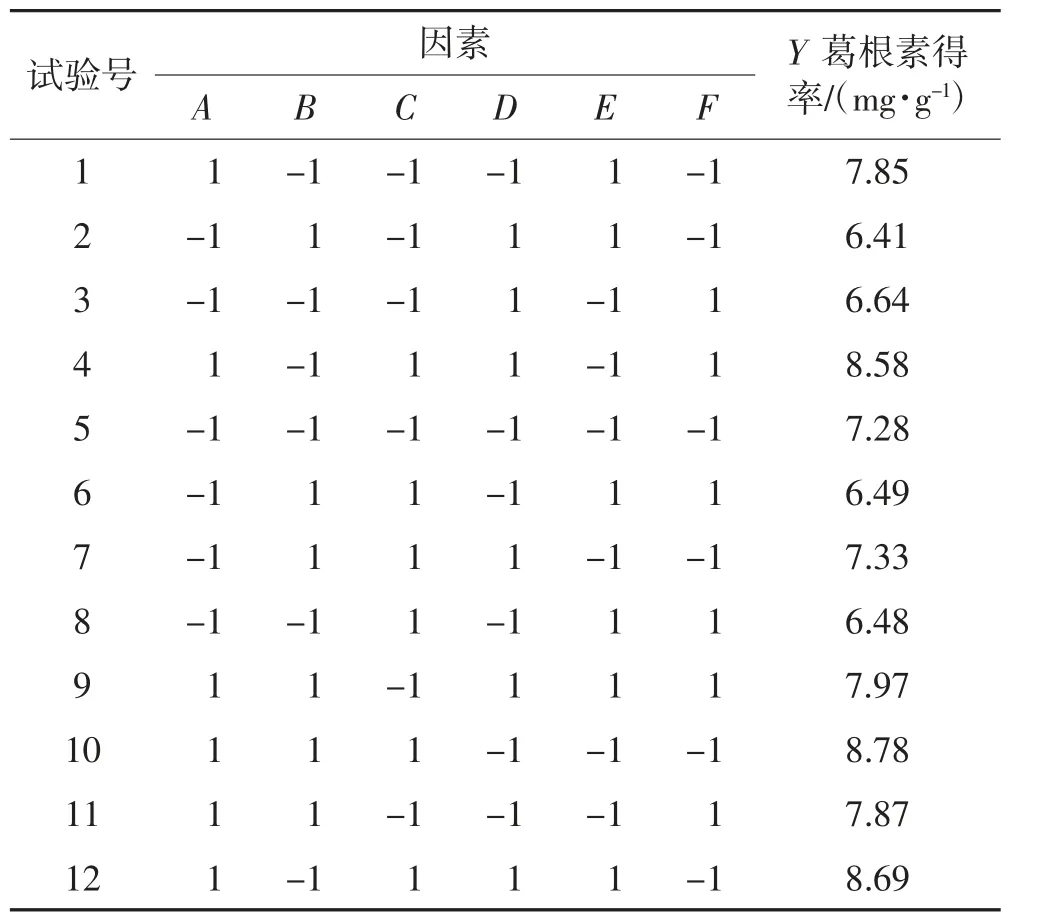
表3 Plackett-Burman 试验设计及结果Table 3 Plackett-Burman experiment design and results
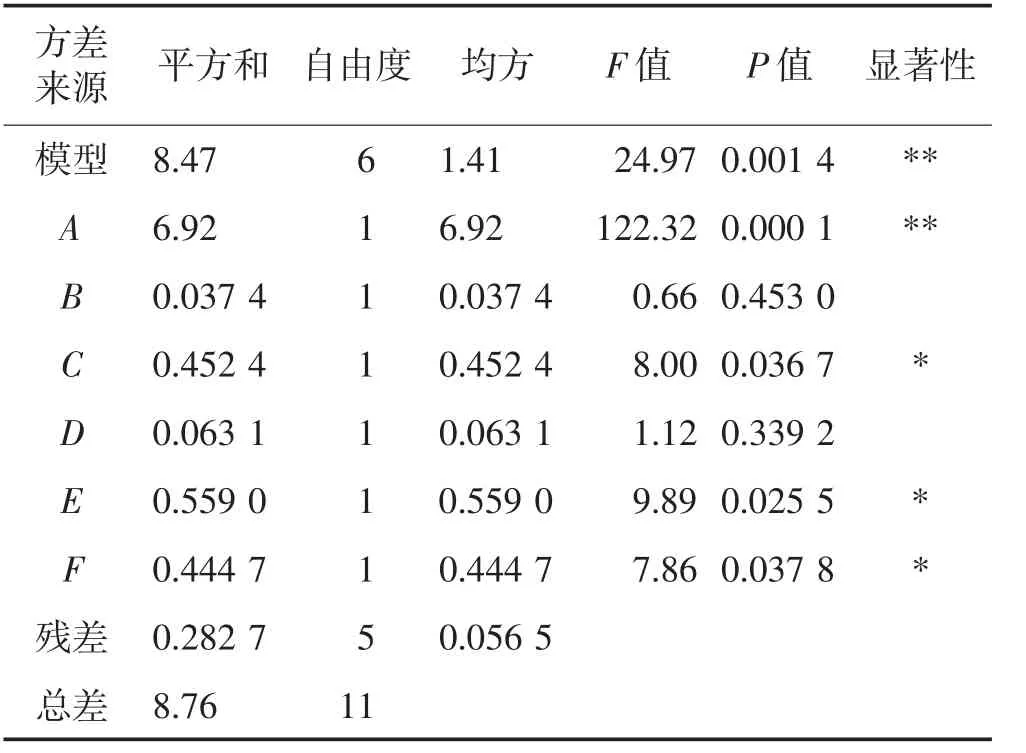
表4 Plackett-Burman 试验统计分析Table 4 Statistical analysis of Plackett-Burman test
对表3 数据进行回归分析,得到6 个因素和响应值葛根素得率的多元一次回归方程:Y=7.53+0.76A-0.056B+0.19C+0.072D-0.22E-0.19F。从方程可知:在显著性因素中,液料比和乙醇体积分数为正效应,即随着取值的增大,葛根素得率呈升高趋势;超声时间和超声温度为负效应,即随着取值的增大,葛根素得率为降低趋势。在非显著性因素中,纤维素酶添加量为负效应,应取其低水平,酶解时间为正效应,应取其高水平。
因此,在后续试验中,固定纤维素酶添加量0.4%,酶解时间70 min。选择液料比、乙醇体积分数、超声时间、超声温度4 个因素进一步考察,分析这4 个因素及其相互作用对葛根素得率的影响。
2.3 最陡爬坡试验结果
由表5 可知,随着液料比(A)和乙醇体积分数(C)逐渐增大,超声时间(E)和超声温度(F)逐渐减小,葛根素得率呈先升高后降低的趋势。试验组3 的葛根素得率最大,因此,选取试验组3 作为响应面试验的中心点。
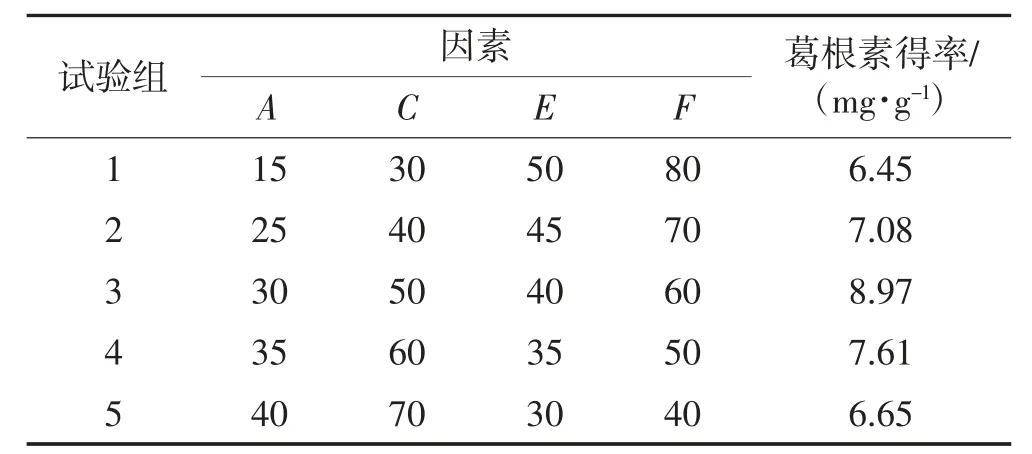
表5 最陡爬坡试验设计及结果Table 5 Design and results of the steepest climbing test
2.4 响应面试验结果
2.4.1 响应面试验设计与结果及方差分析
根据最陡爬坡试验结果,采用Box-Behnken 设计原理,将4 个自变量设计成四因素三水平共29 组试验,响应面试验结果见表6。
使用Design Expert 11 软件对表6 的试验结果进行数据处理,将葛根素得率作为响应值,与各个因素进行回归拟合,得到二次多项回归方程为:Y=8.73 +0.14A +0.3B -0.27C +0.14D -0.21AB +0.1AC -0.42AD-0.078CD-0.88A2-0.66B2-0.19C2-0.32D2。方差分析结果见表7。
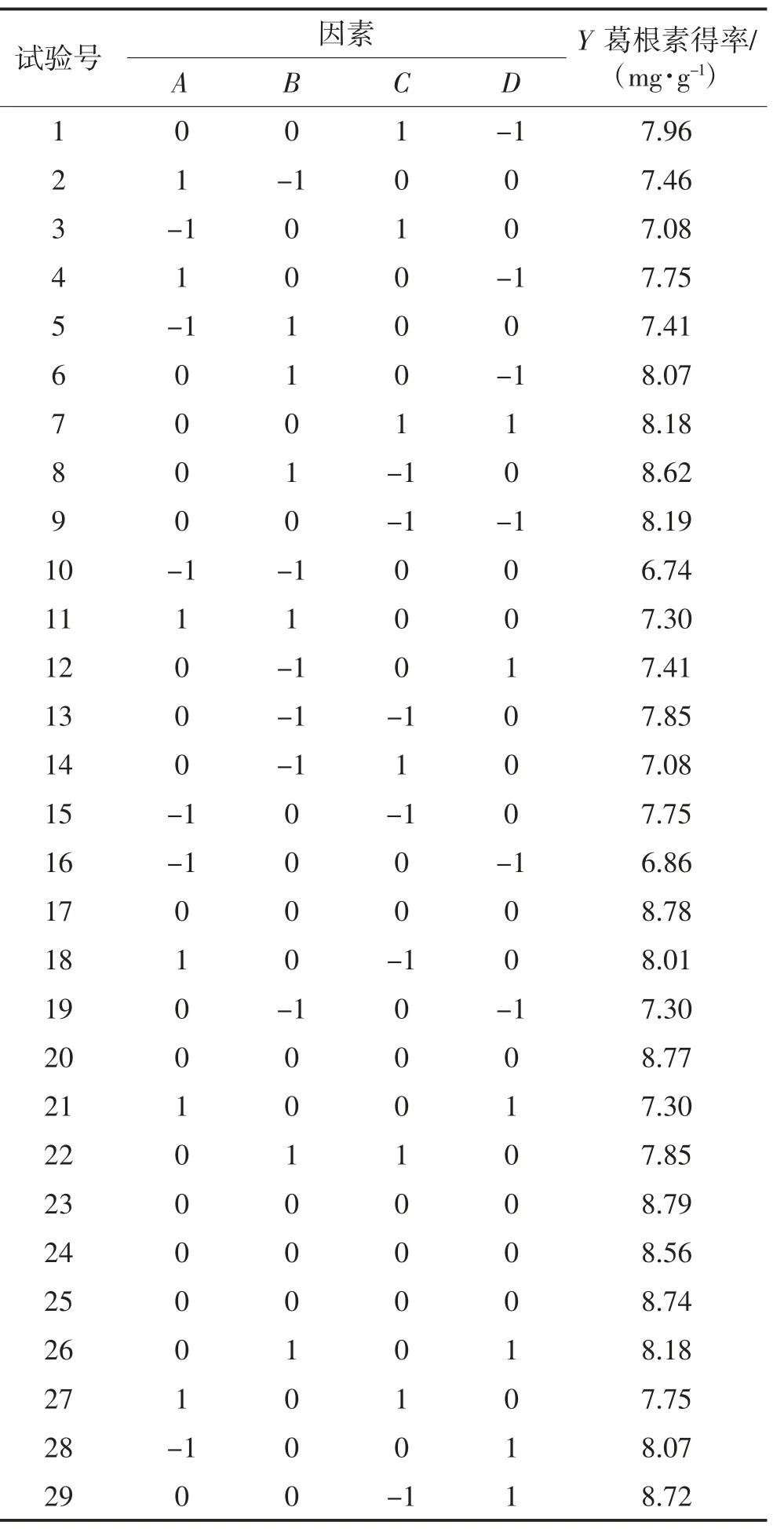
表6 Box-Behnken 试验设计方案及结果Table 6 Box-Behnken experiment design and results
由表7 可知,模型P<0.000 1,模型可信度高,同时失拟项不显著(P=0.123 2)>0.05,说明该方程拟合合理,模型可用于实际值的预测。B、C、AD、A2、B2、D2对响应值的影响极显著(P<0.01),A、D、AB、C2对响应值的的影响显著(P<0.05)。以上结果说明:乙醇体积分数和超声时间是影响葛根素提取的2 个主要因素,液料比和超声温度次之;液料比与乙醇体积分数、液料比与超声温度的交互作用对葛根素的得率有显著影响(P<0.05),其他因素交互作用的P 值均大于0.05,对葛根素的得率无显著影响。回归方程的R2=0.957 4,=0.914 7,说明该模型可以用于解释91.47%响应值的变化,即模型与实际试验拟合程度较好,可在该模型基础上进行试验因素条件优化,用于预测葛根素的最优提取工艺。
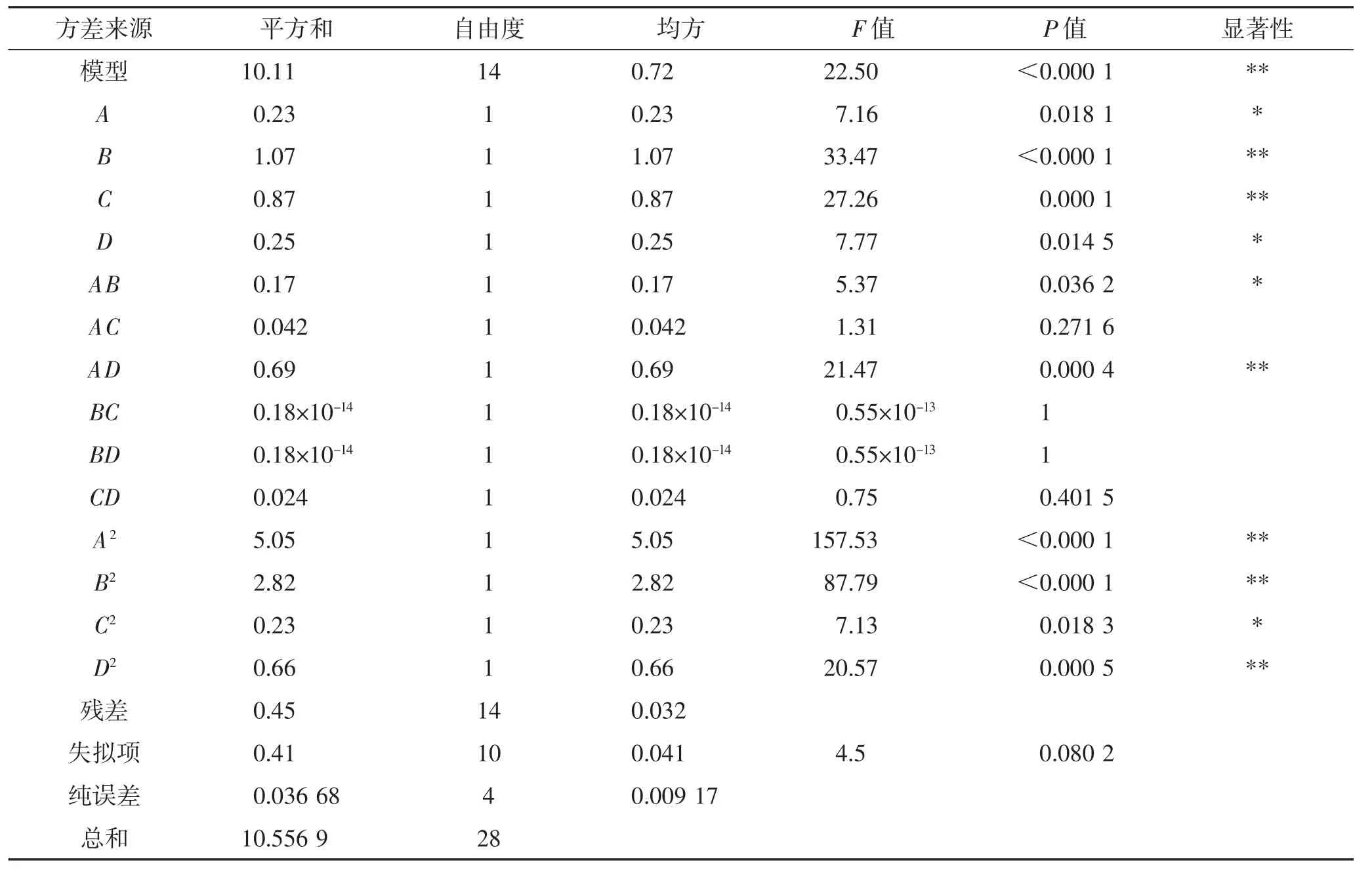
表7 Box-Behnken 试验回归方程方差分析表Table 7 Analysis of variance of regression equation for Box-Behnken test
2.4.2 响应面图形分析
响应面图的坡度显示了因素对响应值的影响,坡度越陡峭,即倾斜度越大,表明两个因素之间的交互作用对响应值的影响越显著。对比响应面图的坡度陡缓趋势可知(图7),乙醇体积分数(B)对葛根素得率影响较大,其次是超声时间(C)和超声温度(D),液料比(A)的响应面曲面相对平缓,说明液料比对葛根素得率影响相对较小。乙醇体积分数(B)与液料比(A)之间的交互作用对葛根素得率影响显著(P<0.05),当乙醇体积分数较小时,液料比对葛根素得率影响较大,随着液料比的增大,葛根素得率快速升高,而乙醇体积分数增大后,葛根素得率又降低;液料比(A)与超声时间(C)的交互作用对葛根素得率影响不显著,随着液料比增大和超声时间的延长,葛根素得率出现先升高后降低的趋势;液料比(A)与超声温度(D)的交互作用对葛根素得率影响极显著(P<0.01),葛根素得率呈现先升高后降低的趋势;乙醇体积分数(B)与超声时间(C)的交互作用对葛根素得率的影响不显著,随着乙醇体积分数升高和超声时间延长,葛根素得率呈现先升高后降低的趋势;乙醇体积分数(B)与超声温度(D)的交互作用对葛根素得率的影响不显著,葛根素的得率随着乙醇体积分数和超声温度的升高呈现先提高后降低的趋势;超声温度(D)与超声时间(C)的交互作用对葛根素得率影响不显著,葛根素得率呈现先提高后降低的趋势。
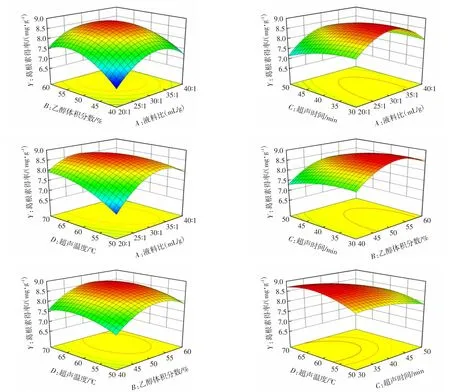
图7 各因素间的交互作用对葛根素得率影响的响应面图Fig. 7 Response surface diagram of the effects of factors interaction on the yield of puerarin
2.5 葛根素提取最佳工艺条件的预测及验证试验
经过Plackett-Burman 试验、最陡爬坡试验,最后由Box-Behnken 试验预测得到,在固定纤维素酶添加量0.4%,酶解时间70 min 的情况下,葛根素提取的最佳工艺条件为:液料比29.13∶1(mL/g),乙醇体积分数52.41%,超声时间31.78 min,超声温度63.82 ℃。在上述条件下模型预测的葛根素得率为8.89 mg/g。为了便于实际操作,将提取条件修正为:液料比30∶1(mL/g),乙醇体积分数52%,超声时间31 min,超声温度64 ℃。按照修订后条件进行3 次验证试验,葛根素平均得率为8.78 mg/g,与理论预测值仅有1.23%的误差,数据重复性较好,证实Design Expert 11 软件构建的以葛根素得率为响应值的模型是有效可靠的。
3 结论
中成药中有效成分的药效保留主要取决于对中成药原药的提取、分离、纯化技术,而传统的提取方法已无法满足中成药提取后药物质量控制的要求,这也是阻碍中成药实现药物现代化的原因之一。本研究通过纤维素酶对植物细胞壁酶解的特点,在超声波辅助的温和条件下,通过Plackett-Burman 试验筛选出影响显著的因素,从最陡爬坡试验得出最大响应值区域,并将其作为Box-Behnken 响应面法的分析中心点,进行四因素三水平的响应面试验,通过优化及验证试验,确定提取葛根中葛根素的最佳工艺参数为:液料比30∶1(mL/g),乙醇体积分数52%,超声时间31 min,超声温度64 ℃。在该工艺条件下,葛根素平均得率为8.78 mg/g,与理论值基本相符,表明采用Box-Behnken 响应面法优化从葛根中提取葛根素的工艺是可行的。

