葫芦科作物叶片硅含量测定方法的优化
孙 楠,闫国超,何 勇,朱祝军
(浙江农林大学 园艺科学学院,浙江 杭州311300)
硅是地壳中含量仅次于氧的第二大元素,能够有效地提高植物对于真菌、细菌、害虫等引起的生物胁迫和高温、盐害、干旱等非生物胁迫的抗性[1-4]。硅对植物的有益作用也是目前研究的热点,硅含量测定技术是植物硅素营养研究中最关键的技术之一。按照测定流程,植物样品硅含量测定可以分为样品硅提取和硅含量测定两步。目前,较为常见的硅提取方法主要有微波消解法、马弗炉灰化法、热消解法等,硅含量的测定方法主要有重量法、比色法、电感耦合等离子体发射光谱法(ICP-AES)等。但是,微波消解法、马弗炉灰化法和热消解法的处理过程涉及高温高压条件,需要浓硝酸等强腐蚀性化学品;重量法测定需样品分解、二次脱水、过滤、高温灰化等繁琐步骤;电感耦合等离子体发射光谱法(ICP-AES)使用的仪器昂贵,测定过程耗时长[5]。比色法因操作危险性低、流程简便等优点得到广泛应用。由于已有的比色法多应用于硅高度积累的禾本科作物,且各方法的测定条件具有较大差异,如显色液测定波长有810 nm、650 nm和700 nm[5-8],硅钼黄显色反应时间有沸水浴1 min[5]和室温反应5 min[5]等,硅钼蓝还原反应时间有室温静置20 min和30 min[7,9]。胡军等[6]和梁永超等[10]提出的方法均为采用植物鲜样研磨提取后,使用硅钼蓝比色法对植物组织硅含量进行测定,与传统的干样灰化提取法相比,测定流程较为简便、快速。但是,上述方法主要针对的是水稻组织,而且对于测定流程中的硅钼蓝还原反应时间、显色液测定波长等测定条件仍不明确。
作为硅中度积累的葫芦科植物,硅在其生长和抗逆等方面的积极作用也被广泛报道[1-4],但有关葫芦科植物硅含量测定的研究仍比较少见。联合国粮农组织(FAO)统计数据显示,2019年黄瓜、南瓜和西瓜3种葫芦科作物在中国栽培面积达318万hm2,产量达1.396亿t,是我国最主要的葫芦科作物。因此,本文以黄瓜、南瓜和西瓜3种葫芦科作物为材料,在已有研究基础上,对葫芦科硅含量测定过程中的研磨温度、浸提时间、硅钼黄显色反应、硅钼蓝还原反应和最佳吸收波长等进行探索和优化。
1 材料与方法
1.1 试验材料
所采用的黄瓜品种为‘津优1号’(S1),南瓜品种为‘蜜本’(S2),西瓜品种为‘早佳8424’(S3)。种子进行55 ℃温汤浸种,在26 ℃恒温培养箱里催芽后育苗。幼苗长至2叶1心时,定植于塑料大棚内,每个品种定植20棵,株距50 cm,行距2 m,单蔓整枝,定植一个月后取植株第8片叶作为样品。
1.2 测量波长选择和标准曲线制作
1.2.1 硅标准溶液浓度设置
硅标准溶液购自上海麦克林生化科技有限公司,浓度为1.000 mg·mL-1。在6个2.5 mL圆底离心管内分别加200 μL的0、5、10、15、20、30 μg·mL-1硅标准溶液。
1.2.2 吸光度测定
硅标准液添加完成后进行硅钼蓝反应,具体如下:向离心管中加0.24 mL 5%钼酸铵溶液混匀,50 ℃水浴5 min,进行硅钼黄显色反应;向离心管中继续加入0.8 mL 50 g·L-1草酸溶液用于掩蔽磷的干扰;最后加0.32 mL 15 g·L-1抗坏血酸溶液混匀后静置5 min,还原生成硅钼蓝。用岛津VU-2600分光光度计在400~1 000 nm波段进行扫描,确定最佳吸收波长。最佳吸收波长测定后进行标准曲线制作。
1.3 样品研磨温度对测定结果的影响
1.3.1 研磨温度处理
在全自动样品快速研磨仪(JXFSTPRP-24L,上海净信实业发展有限公司)进行样品研磨。每个品种称取6份0.1 g样品置于2.5 mL圆底离心管,并放置氧化锆研磨珠。其中3份加0.4 mL 0.5 mol·L-1H2SO4,50 Hz室温(T1)研磨30 s成匀浆,加0.4 mL 0.5 mol·L-1H2SO4上下颠倒混匀后浸提10 min。另外3份样品和磨样模块置于液氮中进行低温处理,50 Hz低温(T2)研磨30 s,完成后加0.8 mL 0.5 mol·L-1H2SO4上下颠倒混匀浸提10 min。
1.3.2 吸光度测定
将浸提完成的样品12 000×g离心5 min。吸取0.2 mL上清液用于硅钼蓝反应,采用1.2.2节方法中测定的最佳波长测定吸光度。
1.4 硅钼蓝反应条件探究
参照胡军等[6]和梁永超等[10]的测定方法,样品50 Hz低温(液氮,-196 ℃)研磨30 s后加0.8 mL 0.5 mol·L-1H2SO4浸提10 min,离心后取0.2 mL上清液置于新离心管。
其中,硅钼黄水浴时间试验是向离心管加0.24 mL 5%钼酸铵溶液后混匀,50 ℃条件下水浴1 min(W1)、2 min(W2)、3 min(W3)、4 min(W4)和5 min(W5)(表1)。水浴完成后加0.8 mL 50 g·L-1草酸溶液,加0.32 mL 15 g·L-1抗坏血酸溶液混匀后静置5 min,810 nm处测定吸光度。
硅钼蓝还原反应时间是向离心管加0.24 mL 5%钼酸铵溶液,50 ℃水浴5 min,加0.8 mL 50 g·L-1草酸溶液,加0.32 mL 15 g·L-1抗坏血酸溶液混匀后分别静置0 min(R1)、2 min(R2)、4 min(R3)、6 min(R4)和8 min(R5)(表1)。每种样品的每个处理设置3个生物学重复。
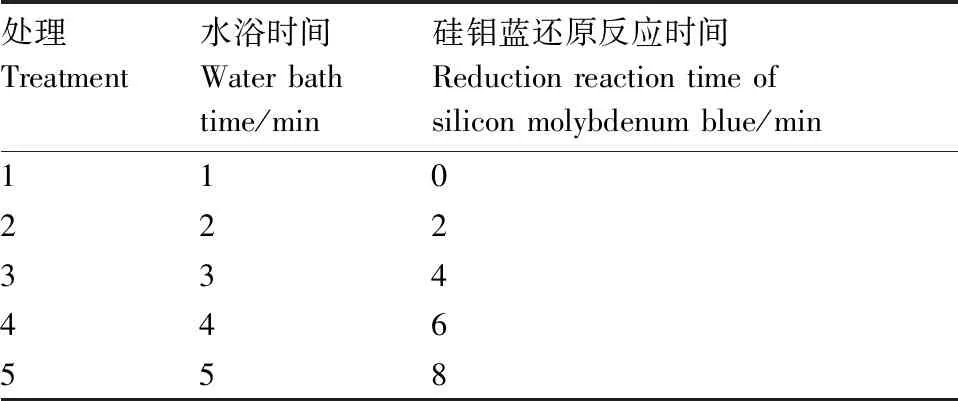
表1 硅钼蓝反应条件
1.5 正交试验
采用3因素3水平的正交试验研究样品种类、浸提时间和研磨时间对葫芦科叶片硅含量测定值的影响。因素水平表见表2,共设9个复合处理,每个处理3次重复。
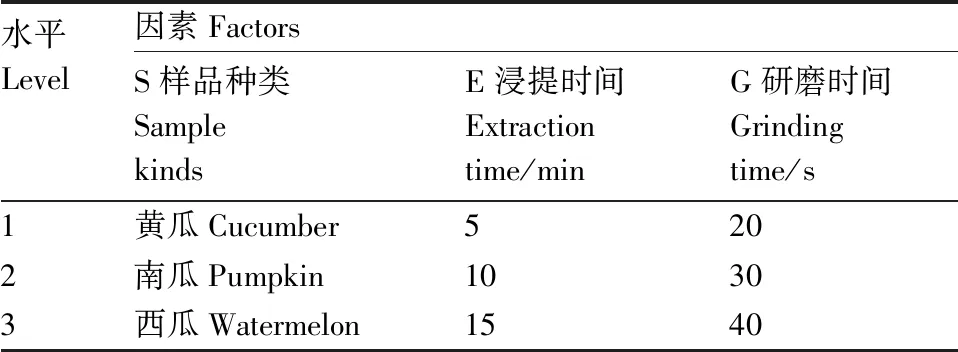
表2 正交试验因素水平表
1.6 浸提时间和研磨时间的全因子试验
为进一步优化硅提取方法,对每种样品在硅提取过程中涉及的浸提时间和研磨时间进行全因子试验。S1、S2、S3分别对应黄瓜、南瓜和西瓜;E1、E2、E3分别对应浸提5 min、10 min和15 min;G1、G2、G3分别对应研磨20 s、30 s和40 s。每个处理3个生物学重复。
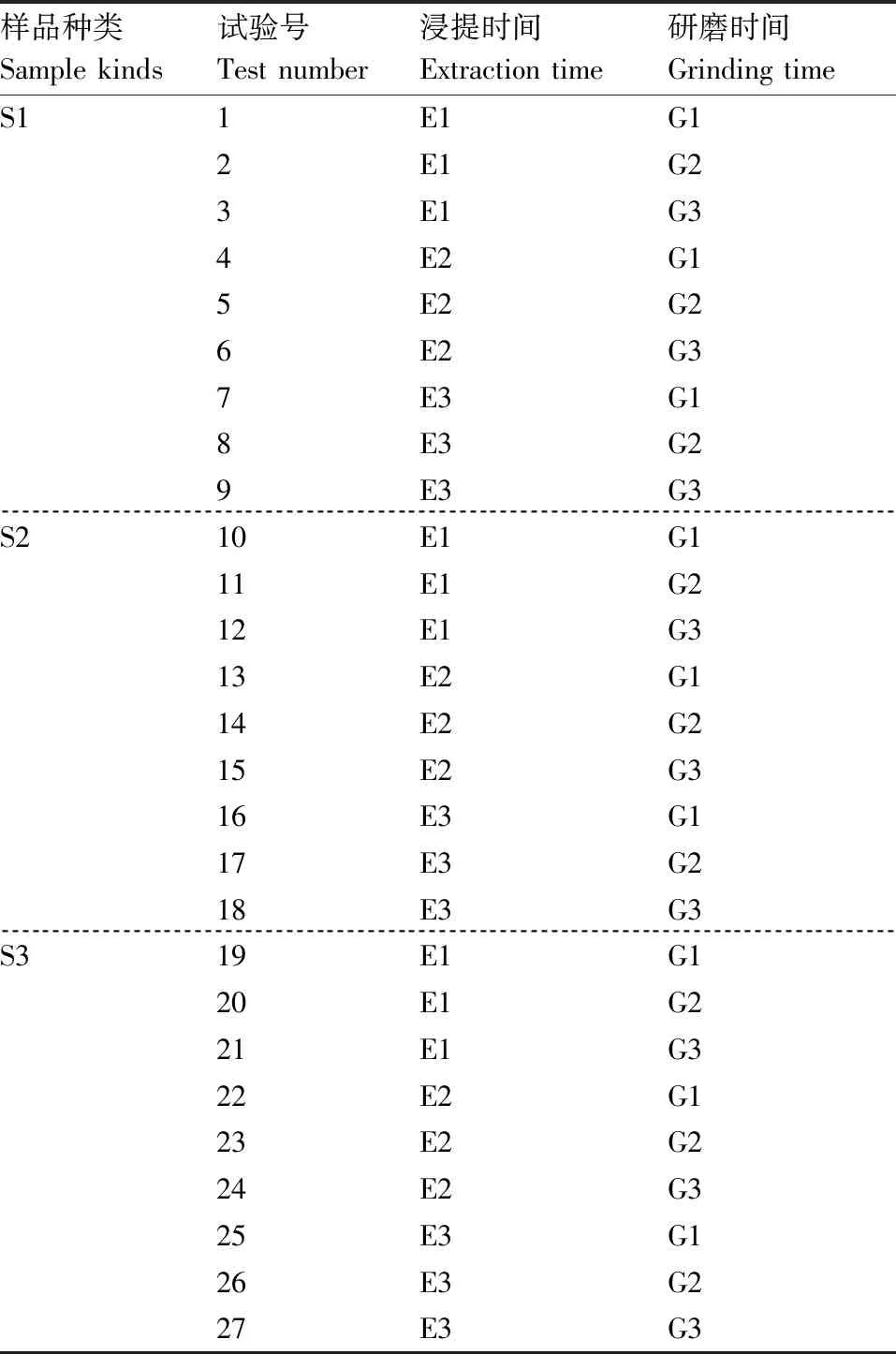
表3 全因子试验
1.7 回收率测定
参照陈秋娟等[11]和杨帆等[12]研究,称取1 g黄瓜、南瓜和西瓜叶片鲜样,分别加入50、100、150 μg·g-1鲜样硅标准液,每个处理8个生物学重复。在研磨仪上进行50 Hz低温(液氮,-196 ℃)研磨30 s,常温浸提10 min。将浸提完成的样品12 000×g离心5 min,吸取0.2 mL上清液于新离心管,加0.24 mL 5%钼酸铵溶液混匀,50 ℃水浴3 min,进行硅钼黄显色反应;向离心管中继续加入0.8 mL 50 g·L-1草酸溶液用于掩蔽磷的干扰;最后加0.32 mL 15 g·L-1抗坏血酸溶液混匀后静置2 min,还原生成硅钼蓝,在810 nm处测定吸光度。
1.8 数据分析
用SPSS19.0(IBM)软件进行数据统计分析,采用Duncan法在0.05水平进行显著性测验,使用Origin7.5(OriginLab)软件绘图。
2 结果与分析
2.1 最大吸光波长选择与标准曲线制作
由图1-A可知,最大吸收峰出现在810 nm附近。图1-B可知,标准曲线方程为y=6.991 9x-0.507 1,拟合度(R2)为0.999。

A,波段扫描;B,标准曲线。A, Band scanning; B, Standard curve.图1 波段扫描和标准曲线Fig.1 Band scanning and standard curve
2.2 样品研磨温度对测定结果的影响
对同一种作物而言,与室温研磨相比,用液氮低温研磨测得的硅含量显著(P<0.05)提高,黄瓜、南瓜和西瓜硅含量测定值分别提高33.5%、12.3%和27.6%(图2)。因此,液氮低温研磨优于室温研磨。

无相同小写字母表示同一组内差异显著(P<0.05)。S1,黄瓜;S2,南瓜;S3,西瓜。下同。Bars marked without the same lowercase letter indicated significant differences at P<0.05. S1, Cucumber; S2, Pumpkin; S3, Watermelon. The same as below.图2 研磨温度对测定结果的影响Fig.2 Effects of grinding temperature on determined results
2.3 硅钼黄水浴时间和硅钼蓝还原反应时间对测定结果的影响
从图3-A可知,50 ℃水浴1~3 min,随着时间延长硅含量测定值逐渐增大,水浴时间超过3 min测定结果趋于稳定,认为50 ℃水浴3 min时硅钼黄显色反应已经完成,可用于下一步反应。由图3-B可知,还原反应时间0~2 min,硅含量测定值随着时间延长而增大,超过2 min后,测定结果不再有显著差异(P>0.05),说明室温静置2 min时,硅钼蓝还原反应已经完成,可用于吸光度测定。
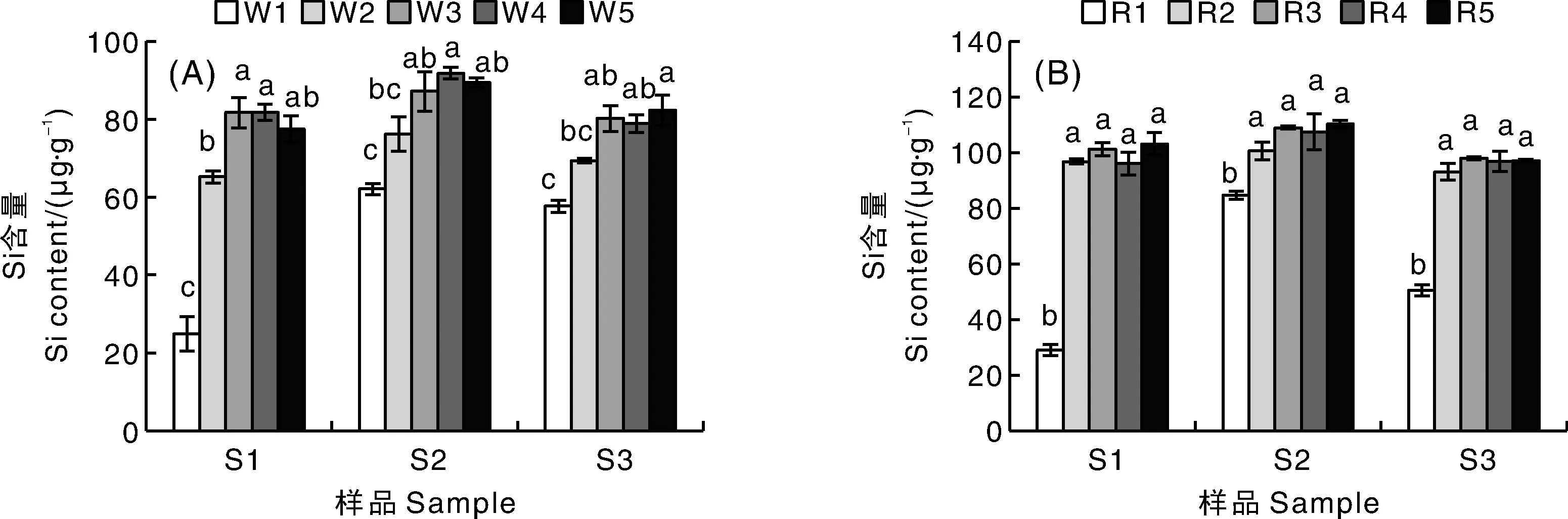
A,水浴时间;B,硅钼蓝还原反应时间。W1,水浴1 min;W2,水浴2 min;W3,水浴3 min;W4,水浴4 min;W5,水浴5 min。R1,还原反应0 min;R2,还原反应2 min;R3,还原反应4 min;R4,还原反应6 min;R5,还原反应8 min。A, Water bathing time; B, Silicon molybdenum blue reduction reaction time. W1, Water bathing for 1 min; W2, Water bathing for 2 min; W3, Water bathing for 3 min; W4, Water bathing for 4 min; W5, Water bathing for 5 min. R1, Reduction reaction for 0 min; R2, Reduction reaction for 2 min; R3, Reduction reaction for 4 min; R4, Reduction reaction for 6 min; R5, Reduction reaction for 8 min.图3 水浴时间和硅钼蓝还原反应时间对测定结果的影响Fig.3 Effects of water bathing time and silicon molybdenum blue reduction reaction time on determined results
2.4 正交试验结果
从表4、表5和表6可知,样品种类(S)对测定结果有极显著影响(P<0.01),研磨时间(G)对测定结果有显著影响(P<0.05)。各因素方差分析结果表明,影响因素大小顺序为S>G>E,极差分析结果表明最佳组合是S1E2G3。说明相同提取条件下,黄瓜叶片中硅含量显著高于南瓜和西瓜叶片,样品种类对测定值的影响是植物对硅吸收利用能力不同造成的。不考虑样品种类,综合考虑测定准确性和时效性,优化的提取条件为E2G2,即浸提10 min,液氮研磨30 s。
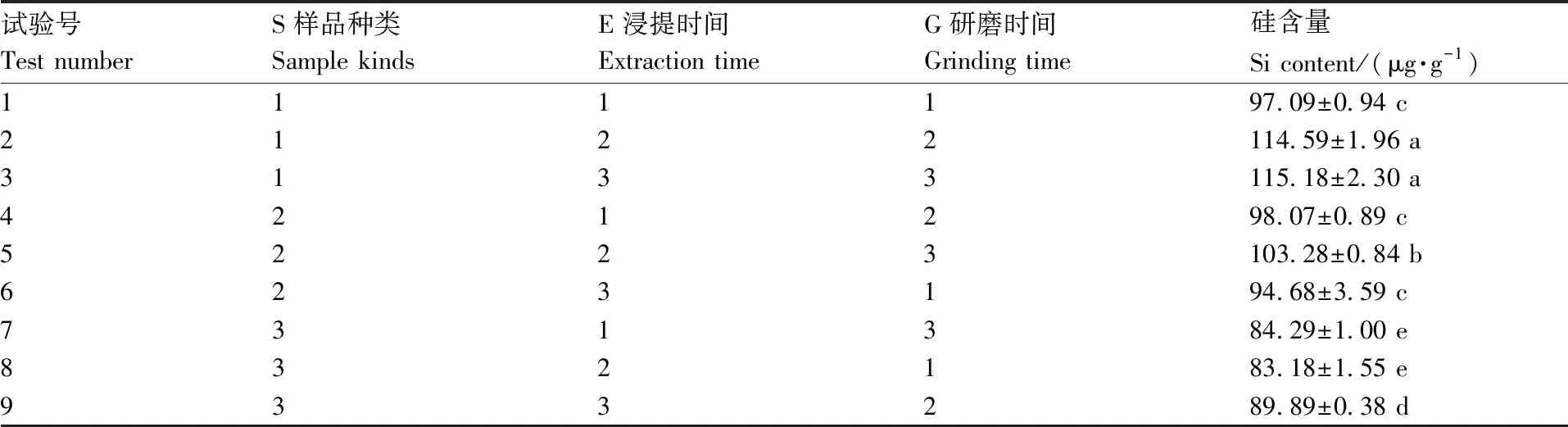
表4 正交试验设计与结果
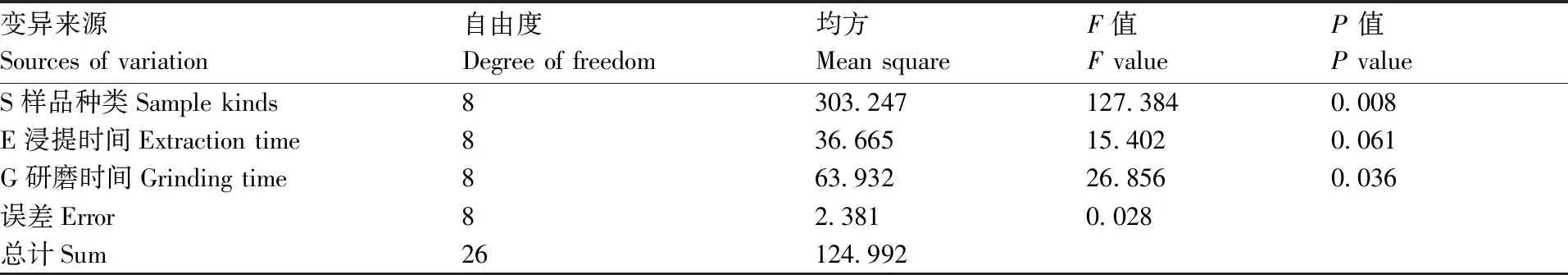
表5 各因素方差分析结果
2.5 浸提时间和研磨时间的全因子试验结果
图4的全因子试验结果表明,研磨时间为20 s(G1)时,浸提时间对3个种类样品的葫芦科叶片硅含量测定值影响不大;研磨时间为30 s(G2)和40 s(G3)时,浸提10 min和浸提15 min的硅含量测定值显著(P<0.05)高于浸提5 min处理。结合时效性认为,50 Hz低温研磨30 s(G2),浸提10 min(E2)组合对3个品种的测定效果最佳,与正交试验结果一致。
2.6 回收率测定
采用优化后的提取方法,用硅钼蓝比色法测定样品硅含量,结果表明,黄瓜叶片中硅含量回收率是93%~103%,南瓜叶片中硅含量回收率是93%~106%,西瓜叶片中硅含量回收率是95%~108%(表7)。

表6 正交试验极差分析结果
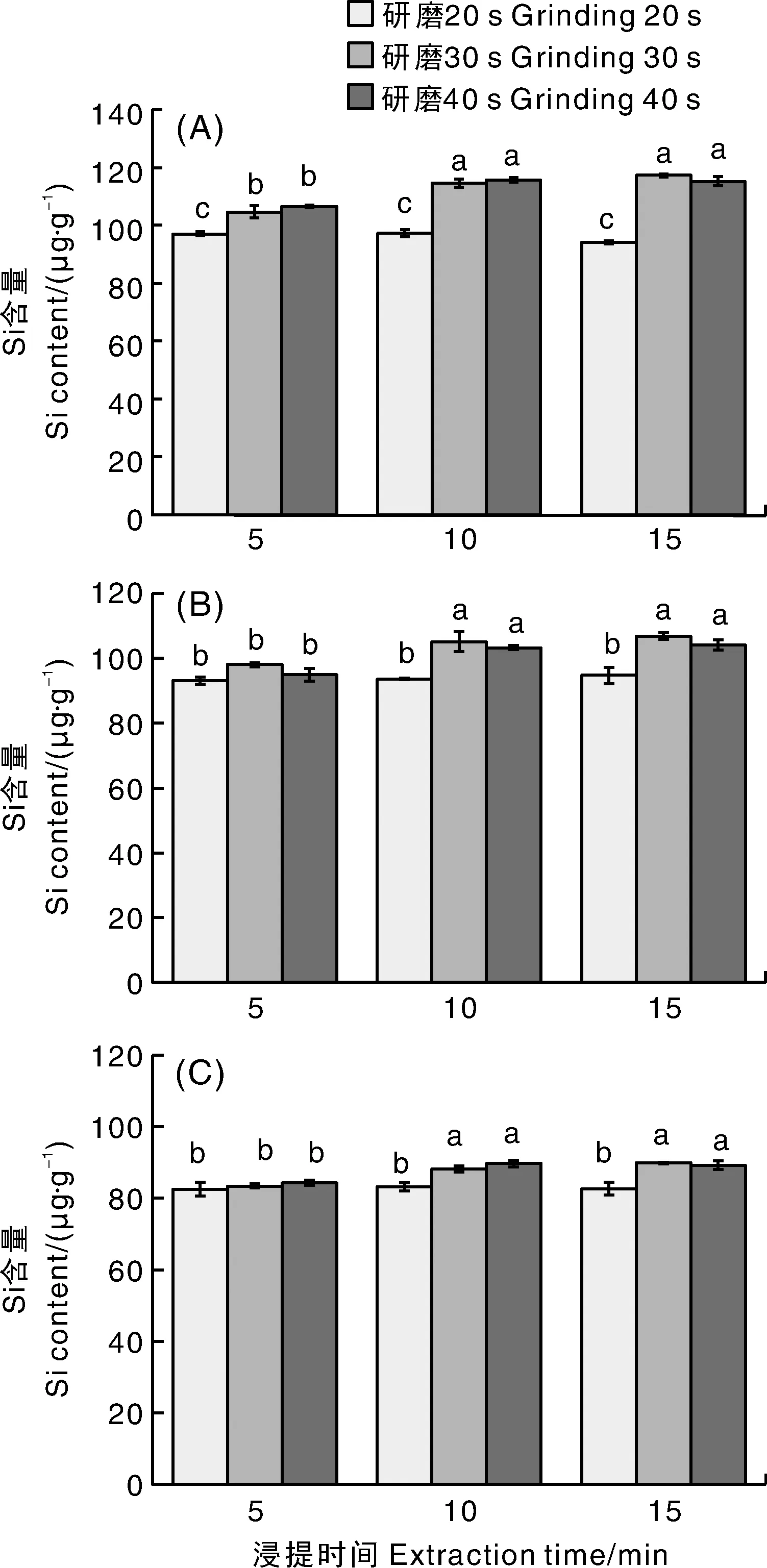
A,黄瓜;B,南瓜;C,西瓜。A, Cucumber; B, Pumpkin; C, Watermelon.图4 浸提时间和研磨时间对测定结果的影响Fig.4 Effects of extraction time and grinding time on determined results
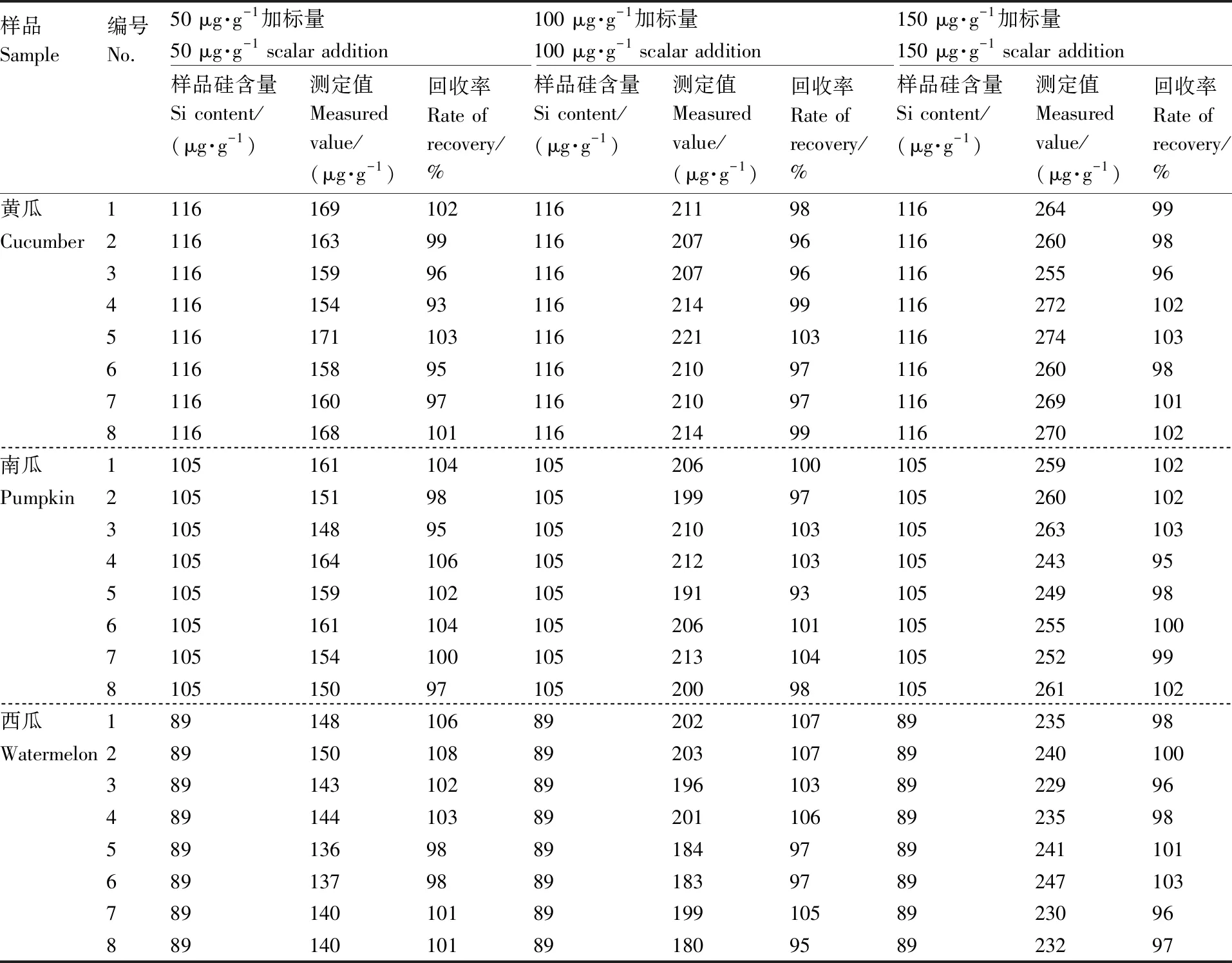
表7 回收率实验结果
3 讨论与结论
硅钼蓝比色法是植物硅含量测定中较为常用的方法,主要测定流程包括:样品硅浸提、硅钼黄显色反应、硅钼蓝还原反应和吸光度测定4个关键过程。但此前报道的方法更多的是针对水稻、小麦等硅积累量较高的禾本科作物,对同为硅积累作物的葫芦科作物研究较少,本研究主要围绕上述4个关键过程,研究明确适于葫芦科作物的硅钼蓝比色法。
在样品硅浸提方面,此前的方法主要采用室温研磨后浸提[6,8,10]。本研究发现,研磨仪低温(液氮,-196 ℃)研磨的硅含量测定值高于室温研磨,这可能是由于液氮冷冻后植物组织破碎程度更高,从而释放出更多硅。此外,研磨仪低温研磨可以实现多样品同时研磨,极大地提高了研磨效率。在研磨时间和浸提时间方面,研究结果表明研磨30 s、浸提10 min能够在较短时间内实现最优测定效果。
在硅钼黄与硅钼蓝反应时间优化中,本文对反应完全的最短时间进行了优化探究。结果表明,硅钼黄显色反应50 ℃水浴时间超过3 min后,测定值不再有显著增加。在前人方法中,胡军等[6]采用沸水浴1 min,根据《GB6682—2008 分析实验室用水规格和试验方法》中兼顾反应速率和操作安全性,采用室温反应5 min。结合本研究结果,在葫芦科植物硅含量测定中50 ℃水浴3 min已完成硅钼黄显色反应,可进行下一流程。在硅钼蓝还原反应方面,王华等[7]和华海霞等[8]的研究中,硅钼蓝还原反应条件是室温静置20 min,李换丽[9]的研究中还原反应条件采用室温放置30 min,胡军等[6]则在添加硫酸亚铁铵混匀后立即测定吸光值。本研究针对葫芦科植物的测定结果表明,室温静置2 min后硅含量测定值趋于稳定,显色液即可用于后续吸光度测定。
此外,在吸光度测定方面,本研究发现,硅钼蓝显色液最大吸收峰出现在波长810 nm附近。胡军等[6]的研究采用810 nm作为测定波长,本研究结果与此一致,而王华等[7]采用650 nm作为测定波长,华海霞等[8]采用700 nm作为测定光波,与本研究测定的810 nm有较大出入,在这两项研究中未见光谱扫描数据。因此,建议在硅含量测定时进行光谱扫描以确定最大吸收峰波长。
本研究围绕植物组织硅含量测定中的硅钼蓝比色法,针对葫芦科作物叶片硅含量测定流程进行了优化,优化后的方法为:研磨仪50 Hz低温(液氮,-196 ℃)研磨30 s,室温浸提10 min,硅钼黄显色反应条件为50 ℃水浴3 min,硅钼蓝还原反应2 min,810 nm处测定吸光值,该方法回收率是93%~108%。针对葫芦科植物优化后的硅钼蓝比色法采用研磨仪低温研磨,缩短了研磨时间并可多样品同时研磨,同时缩短硅钼黄显色和硅钼蓝还原反应时间,并确定了吸光度测定最适波长。王华等[7]、华海霞等[8]和李换丽[9]的研究中采用的测定方法均耗时超过1 h,本方法耗时约30 min,大大提高了检测效率。优化后的测定流程不仅提高了葫芦科植物组织硅含量检测的准确性,同时缩短了检测时间,可为园艺植物硅营养研究提供技术支持。

