OSA改性多孔淀粉负载并改善柚皮苷生物利用度
王 璐,丁 喆,2,陆胜民,*,姜 昊,3,郑美瑜,杨 颖
(1.浙江省农业科学院 食品科学研究所,浙江 杭州 310021; 2.浙江工业大学 食品科学与工程学院, 浙江 杭州 310014; 3.奥克兰大学 化学科学学院, 奥克兰1010)
辛烯基琥珀酸酐淀粉酯(OSA改性淀粉)俗称纯胶,是淀粉和辛烯基琥珀酸酐(OSA)在一定条件下酯化得到的具有高生物可降解性和高食用安全性的乳化、增稠剂,也是目前唯一一种被允许应用于食品中的烯基淀粉酯[1-2]。OSA改性淀粉结构中淀粉的多糖长链、亲水的羧酸基团和疏水的烯基长链赋予了OSA改性淀粉优异的壁材特性和两亲性,加之其兼具成本低廉、绿色可再生、无污染等优势,使其逐渐成为科技工作者研究和关注的热点[3-6]。多孔淀粉是一种无毒、经济的吸附剂,它已经作为药物载体、污染物吸附剂、包封囊材在食品、制药和环境工业等领域中有所研究[7-8],应用多孔淀粉来包封和缓慢释放食品成分,不仅可以提升被吸附分子的稳定性,还可以有效地减缓其由于高温、光照、氧气等诱发的氧化进程[9-10]。将多孔淀粉进行OSA酯化,可同时赋予淀粉颗粒吸附性和两亲性,这将会进一步扩展淀粉颗粒的应用范围[11]。
柑橘黄酮是一类具有多生物活性的植物膳食黄酮[12],其中代表性的柚皮苷(NA)以其出色的抗氧化、抗病毒、抗炎和抗肿瘤等功效,已在食品与医药领域多有研究。然而,柚皮苷的水溶性较差,口服生物利用度较低,极大地限制了其性能发挥和应用[13]。因此,本研究拟借助OSA改性多孔淀粉的吸附性和两亲性,将其与NA的纳米效应相结合制备OSAPS-NA复合物,并对其制备工艺进行优化,获得负载率较高的复合物。通过代谢动力学模型对复合物的口服生物利用率进行研究,为OSA改性淀粉在载体领域的拓展提供了一定的数据基础。
1 材料与方法
1.1 实验仪器
分析天平,梅特勒-托利多仪器有限公司;超声波清洗机,上海美奈特实业有限公司;离心机,上海安亭科学仪器厂;高效液相色谱仪(LC-2030C 3D Plus型),Shimadzu 公司(日本);C18反相色谱柱(SunFire,5 μm, 250 mm×4.6 mm),Waters 公司(美国)。
1.2 实验材料
柚皮苷(纯度≥95%),西安小草生物科技有限公司;蜡质玉米淀粉(50 U·g-1),甘肃昆仑生物有限公司;辛烯基琥珀酸酐(纯度≥99.5%),α-淀粉酶,NA标准品(纯度≥98%)和新橙皮苷标准品(纯度≥98%)均购于上海源叶生物科技有限公司;甲酸(色谱纯)、乙腈(色谱纯)购于上海阿拉丁试剂有限公司;去蒸馏水为实验室自制。其余所用试剂均为分析级,购于阿拉丁生物科技有限公司。
1.3 OSA改性多孔淀粉的制备
OSA改性多孔淀粉(OSAPS)的制备过程参考李海燕等[14]的制备方法。将蜡质玉米淀粉以30 g·mL-1的质量浓度悬浮于pH值4.5的磷酸盐和醋酸盐混合缓冲液中,于55 ℃水浴锅中搅拌(100 r·min-1)20 min,然后向悬浮液中加入的复合酶(α-淀粉酶与糖苷酶的质量比为6:1),复合酶质量浓度为20 mg·g-1(相当于2.0%蜡质玉米淀粉质量);将样品在55 ℃水浴中搅拌24 h,然后用1 mol·L-1NaOH将混合液pH值调节为10.0,以终止酶解。将悬浮液在4 ℃ 7 000×g离心15 min,用蒸馏水重复洗涤3次。最后,将收集的沉淀物置于50 ℃恒温箱中干燥8 h,研磨沉淀物后过90目筛,即得多孔淀粉。
将6.0 g多孔淀粉均匀地分散在30 mL去离子水中,用3% NaOH将pH值调至8.5,在1 h内将600 μL 30 mg·mL-1的辛烯基琥珀酸酐-无水乙醇溶液缓慢滴加至淀粉浆中,在35 ℃反应1 h后,再用3% HCl将pH值调至6.5,离心混合物并用去离子水洗沉淀3次,然后用90%乙醇洗涤3次,置于45 ℃恒温箱中干燥24 h,将干燥的沉淀物研磨后过90目筛,即得到OSAPS粉末(酯化度约为0.012 6)。
1.4 OSAPS-NA复合物制备与工艺优化
将40 mg NA溶于10.0 mL无水乙醇或丙酮溶液中,记为溶液A;将一定质量的OSAPS分散至正己烷中,记为混悬液B。将混悬液B滴入溶液A中,并在超声机中负载一段时间,然后将混合液离心,将沉淀在烘箱中干燥24 h,将干燥的沉淀物研磨后过50目筛(孔径为0.282 mm),即获得OSAPS-NA复合物粉末。
本研究采用反溶剂沉淀法将NA负载于OSA改性多孔淀粉,在制备OSAPS-NA复合物时,需要以负载率为评价标准,对所用溶剂、制备方法、正己烷与丙酮的体积比(V正己烷/V丙酮)、NA与OSA改性多孔淀粉的质量比(mOSAPS/mNA)、超声强度、超声时间进行单因素优化,优化指标如表1所示。
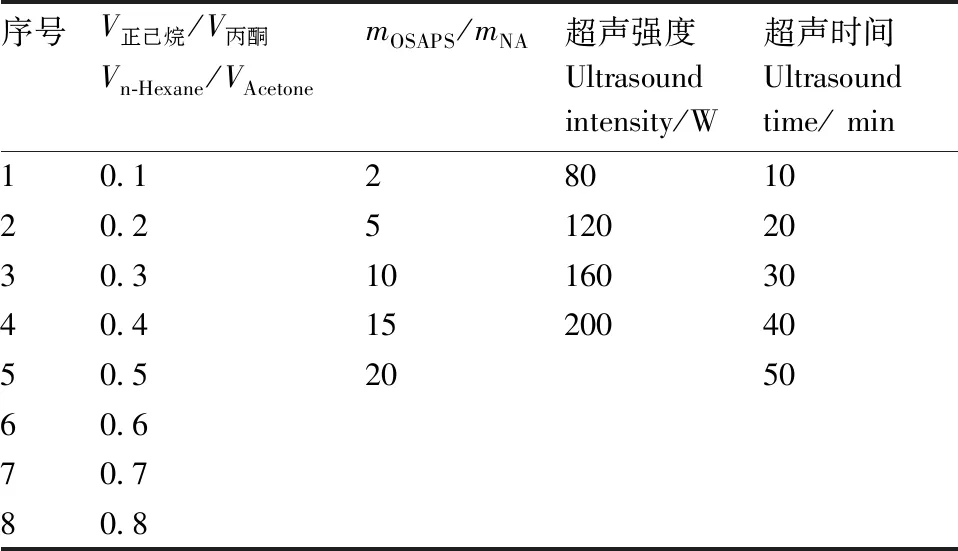
表1 OSAPS-NA复合物优化指标
1.5 负载率检测
1.5.1 检测条件
采用高效液相色谱对NA的浓度进行检测,检测条件为:C18反相色谱柱;检测温度 (柱温箱温度)为30 ℃;流动相为乙腈-去离子水体积比20∶ 80,流速为1.0 mL·min-1;检测波长为283 nm;进样体积为10 μL。
1.5.2 标准曲线测定
精确称取NA标准品10 mg,用无水乙醇定容至10 mL,充分溶解,然后用无水乙醇将上述溶液稀释至0.5、0.25、0.125、0.062 5、0.031 25 mg·mL-1,即得NA标准品溶液。采用1.5.1节所述方法对NA标准溶液进行检测,以NA的峰面积为纵坐标,以质量浓度为横坐标绘制标准曲线。
1.5.3 负载率计算
采用高效液相色谱对OSAPS-NA复合物制备过程中离心步骤的上清液中NA的质量浓度进行加测。复合物中NA的负载率计算公式[15]如下:
(1)
式(1)中:R为负载率,ce为每个实验上清液中NA的质量浓度,Ve为相应的上清液体积,m0为NA的初始质量。
1.6 表面张力与胶束浓度检测
分别制备30.77、15.39、7.70、3.85、1.92、0.96、0.48 mg·mL-1的OSA改性多孔淀粉悬浮液,将其分别置于80 ℃水浴锅中搅拌,并使其糊化。常温冷却后,将内径为0.5 mm的毛细管分别插入OSA改性多孔淀粉糊化溶液中,使毛细管下缘刚好与液面连接。用Image J软件记录并计算每个质量浓度的OSA改性多孔淀粉糊化溶液在毛细管中上升的高度h与接触角θ,并用公式(2)计算各浓度的OSA改性多孔淀粉糊化溶液的表面张力[16]。
γ=ρghr/2cosθ。
(2)
式(2)中,γ代表表面张力,r取值为0.25 mm,g取值为常温下各浓度的OSA改性多孔淀粉糊化溶液的密度(g·cm-1),ρ代表不同OSA改性多孔淀粉悬浮液的密度。
以OSA改性多孔淀粉糊化溶液的质量浓度为横坐标,以其相应的表面张力为纵坐标,绘制曲线,沿曲线转折点的两边分别作切线,两条切线的交叉点所对应的浓度即为OSA改性多孔淀粉的临界胶束浓度。
此外,用该方法对最佳条件下制备的OSAPS-NA复合物在负载前后的表面张力进行了检测。将负载NA前后的OSAPS颗粒与OSAPS-NA复合物(具有相同的OSAPS浓度)分别溶解于去离子水中,并分别在80 ℃水浴锅中搅拌,然后分别检测冷却后的糊化溶液的表面张力。
1.7 OSAPS-NA复合物释放动力学研究
1.7.1 溶液配制
模拟胃液的配制:向1 000 mL去离子水中加入浓盐酸,使盐酸水溶液的pH值为1.5±0.2,向该盐酸水溶液中加入10.0 g胃蛋白酶,混合均匀后即获得模拟胃液。
模拟肠液的配制:用1 000 mL去离子水溶解6.8 g磷酸二氢钾,然后用0.1 mol·L-1NaOH将溶液的pH值调至6.8。向上述溶液中加入10.0 g胰蛋白酶和10.0 g胆汁酸钠水合物,混合均匀后即获得模拟肠液。
1.7.2 释放动力学研究
将NA原材料和OSAPS-NA复合物(含有相同质量的NA)分别加入200 mL模拟胃液和200 mL模拟肠液中,在5、10、15、30、60、90、120、240和480 min分别取样200 μL,并同时向体系中加入等体积的模拟消化液。用4倍体积的无水乙醇稀释样品,充分混合后,用高效液相色谱检测每个时间点的样品中NA的浓度。用上述检测结果计算每个时间点NA的累积释放量。以不同时间点的累积释放率为数据基础,进行Korsmeyer-Peppas模型[公式(4)]的拟合,计算该淀粉基载体的释放速率。累积释放量的计算公式和Korsmeyer-Peppas模型如下:
(3)
Cr=k×tn。
(4)
式(3)和(4)中,Cr为t时间内NA在释放体系中的累积释放率(%);Ve为每次的取样量;V0为释放溶液的体积;ci和cn分别为i和n个样品中的NA的浓度;mt为复合物中NA的总质量;k为基于构成大分子网络或颗粒系统的特性所获得的释放常数;n为扩散指数,表示运输机制。
1.8 OSAPS-NA复合物口服生物利用度研究
1.8.1 动物饲养
选取12只体重为(250±20)g的Sprague-Dawley大鼠(SD大鼠)用于生物利用度研究。将用于研究的SD大鼠随机分为两组(NA原材料组和OSAPS-NA复合物组),在相同的外部环境(包括温度、湿度、光线、食物和水)下饲养3 d,并在给予口服样品前禁食24 h。3组大鼠(n=6)分别口服去离子水、NA原材料-去离子水混悬液、OSAPS-NA混悬液(口服剂量根据NA计算,用相当于大鼠体重50 mg·kg-1的柚皮苷质量对大鼠进行灌胃)。口服后,在0、5、15、30、60、90、120、240、360、720、1 440和2 880 min,通过眼眶静脉窦穿刺获得血样,将血样立即3 000 ×g离心10 min,保存在-40 ℃冰箱中。杭州赫贝科技有限公司实验动物福利和伦理委员会审查并批准了本研究的动物实验操作(许可证号:HB2021130009031WL-A)。
1.8.2 血液样品检测与药代动力学研究
在分析之前,首先在37 ℃水浴中解冻冷冻样品。血浆样品的预处理方法为:精确吸取血清样品20 μL并用100 μL无水乙醇萃取,将萃取体系放在涡旋搅拌器上摇动1 min,然后离心 (10 000×g,10 min)。最后,将上清液中的10 μL注入HPLC系统。检测条件同1.5节。以血清中NA的质量浓度为纵坐标,时间为横坐标绘制药-时曲线。应用房室模型和统计矩模型拟合并计算NA原材料和OSAPS-NA复合物中NA在大鼠体内的药代动力学参数。相对生物利用度(Frb)按以下公式计算[17]。
Frb(%)=(SAUCp/SAUCr)×100。
(5)
式(5)中,SAUCp为OSAPS-NA复合物给药组的药-时曲线下面积;SAUCr为NA原材料给药组的药-时曲线下面积。实验结果的差异显著性用One-way ANOVA进行评价,P<0.05表示差异显著,P<0.01表示差异极显著。所有的数据均以平均值±标准差表示。
2 结果与分析
2.1 OSAPS-NA复合物的优化
采用反溶剂沉淀法制备了OSAPS-NA复合物,并对其制备过程中影响负载率的重要指标进行单因素优化,其优化结果如图1~图3所示。首先以负载率为评价指标,对复合物制备所用溶剂和负载方式进行筛选,其筛选结果如下。
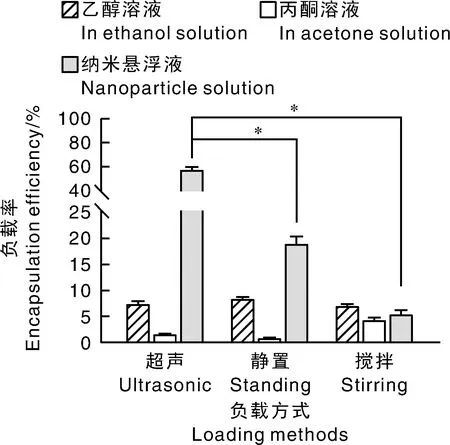
*表示差异显著(P<0.05)。*meant significant difference at the levels of P<0.05.图1 溶剂种类与负载方式的筛选结果Fig.1 Results of filtering for solvent and loading methods
由图1可知,以反溶剂沉淀法制备的NA纳米悬浮液结合超声辅助吸附法制备的OSAPS-NA复合物获得了最高的负载率(57.93%±2.1%)。在同样的负载条件下,用反溶剂沉淀法获得的纳米颗粒获得了更好的吸附率,说明反溶剂沉淀法是影响OSAPS负载NA的关键因素之一。固定反溶剂沉淀法的制备条件,超声法使负载率达到最高,并且与其他负载方法具有显著性差异,说明超声法更适宜NA纳米颗粒的负载。由于淀粉酶在淀粉颗粒表面水解出的孔隙是向心的[16],而搅拌负载时的纳米颗粒随悬浮液转动的角度与淀粉表面的开孔平行,与负载所需的方向(向孔隙内负载)垂直,这可能是负载率低于静置法的原因。与此同时,纳米悬浮液结合超声辅助吸附法制备的OSAPS-NA复合物的负载率高于静置法,可能是由于超声法提供的高动能增加了纳米颗粒与改性淀粉表面和空隙的接触概率,进而增加了负载率。综上所述,超声法和反溶剂沉淀法是制备高负载率的OSAPS-NA复合物的关键因素。因此,将就这两种方法的操作要点进行后续的单因素优化研究。
超声强度和超声时间是超声法负载过程的重要控制因素。从图2中可以看出,不同超声时间和超声强度下对NA负载率的变化幅度较大,超声强度为80 W、超声时间为10 min时NA负载率最低,仅为27.56%±3.32%;超声强度为200 W,超声时间为20 min时,负载率最高,为62.89%±2.71%。代表超声强度为200 W的红色线一直在所有相应数据点的最上方,呈现先增加后降低的趋势。由于超声时间继续延长,负载率出现下降,可能是由于淀粉颗粒在超声时本身的膨胀[18]所致。
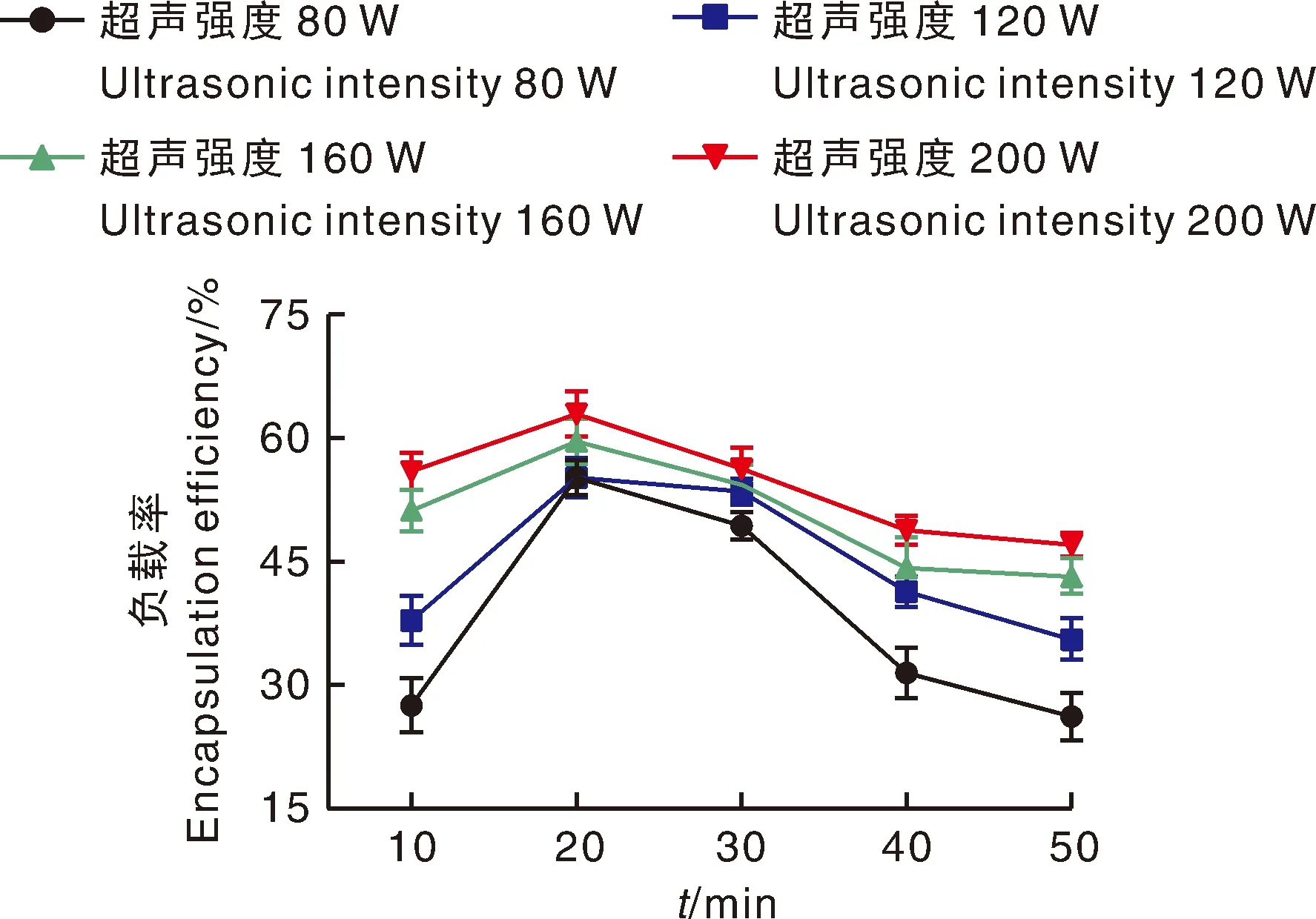
图2 超声强度和超声时间对负载率的影响Fig.2 Effect of ultrasonic intensity and ultrasonic time on loading rate
从反溶剂沉淀的角度,对V正己烷/V丙酮和MOSAPS/MNA进行了优化,优化结果如图3所示。图3-A是制备NA纳米粒子所需的反溶剂(正己烷)和溶剂(丙酮)应用比例的优化结果。随着正己烷体积占比的增加,OSAPS对NA的负载率也随之增加。结合实物图(图3-B),在不超声的情况下,当正己烷与丙酮溶液的体积比为0.8时,混合体系中的NA出现析出,超声后,这一比例前移至0.6,说明超声过程能够促进NA颗粒的析出。从图3-A可知,当正己烷与丙酮溶液的体积比为0.6时,OSA改性淀粉对NA的负载率最高,达到了78.51%±3.84%,该结果与实物图的结果(图2-B)相一致。从图3-C可知,在固定OSAPS质量的情况下,随着NA在丙酮中质量浓度的提升,OSAPS对NA的负载率先增加后减小,当mOSAPS/mNA=5时,负载率最高,达到了71.49%±2.26%。因此,mOSAPS/mNA=5是优化的最佳选择。
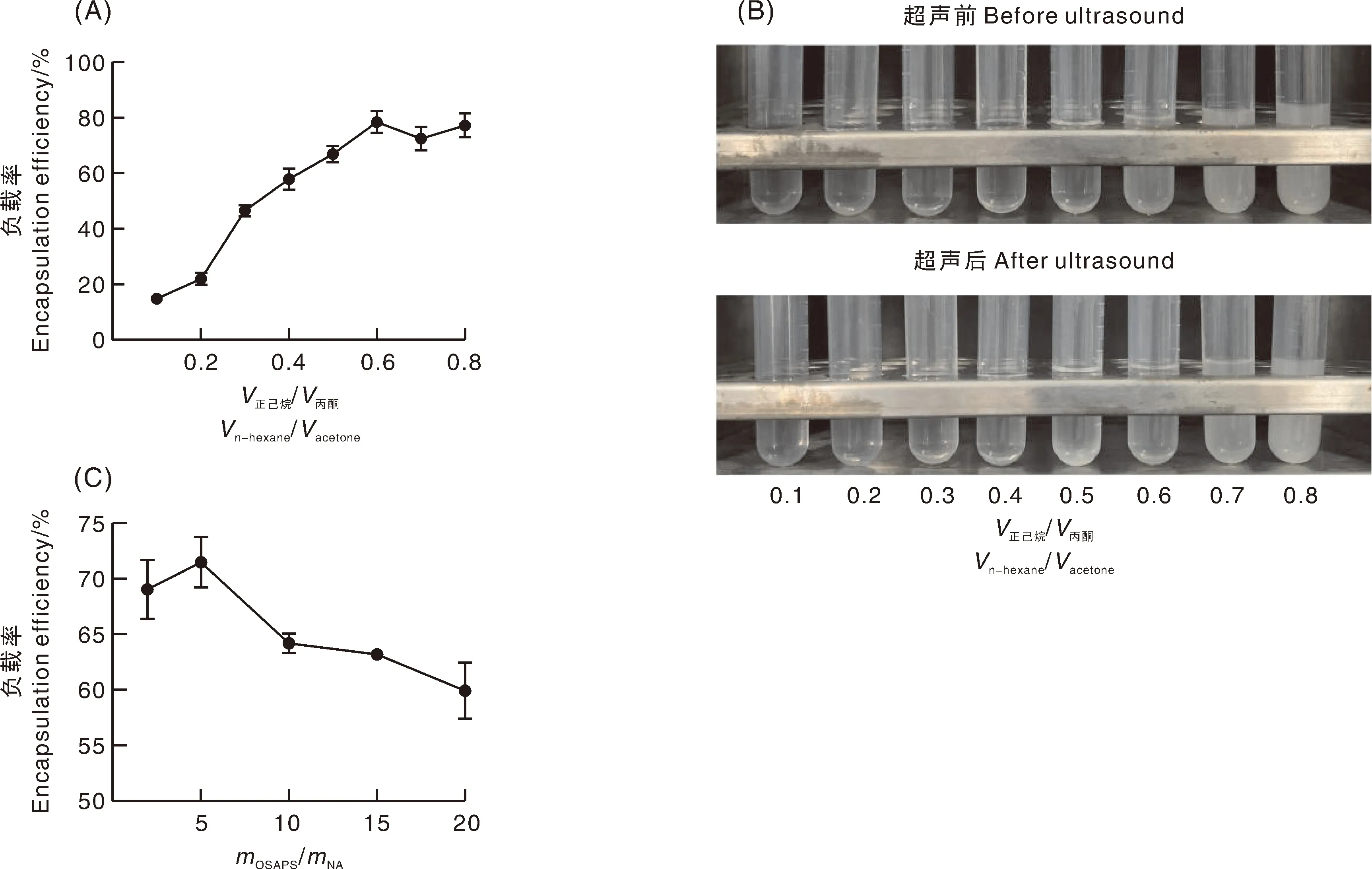
A和B为V正己烷/V丙酮优化结果;C为mOSAPS/mNA优化结果。A and B, Optimization results of Vn-hexaneether/Vacetone; C, Optimization results of mOSAPS/mNA.图3 V正己烷/V丙酮和mOSAPS/mNA对负载率的影响Fig.3 Effect of Vpetroleumether/Vacetone and mOSAPS/mNA on loading rate
综上所述,优化后的OSAPS-NA复合物制备方法为:将40 mg NA溶于10.0 mL丙酮溶液中记为溶液A,将200 mg OSAPS分散至6.0 mL正己烷中,记为混悬液B。将混悬液B滴入溶液A中,并在强度为200 W超声机中放置20 min,然后将混合液离心,将沉淀在烘箱中干燥24 h,将干燥的沉淀物研磨后过50目筛,即获得OSAPS-NA复合物粉末。
2.2 临界胶束浓度检测结果
由图4计算可得,OSAPS的临界胶束浓度为(5.622±0.451) mg·mL-1,其对应的表面张力约为63.12 μm·m-1。经计算。在最优的制备条件下,OSAPS的质量浓度为12.5 mg·mL-1,该数值高于OSAPS的临界胶束浓度,说明复合物形成过程中NA的负载不仅与OSA改性多孔淀粉的吸附作用有关,还可能被部分溶解的OSA改性多孔淀粉所形成的胶束所包裹。此外,经检测,在最佳的OSAPS-NA复合物制备条件下,OSAPS在水中的表面张力为(63.66±5.20)μm·m-1,OSAPS-NA复合物在水中的表面张力为(65.49±4.10)μm·m-1,其数值略高于OSAPS糊化液,可能是由于易在热水中溶解的NA降低了OSAPS-NA复合物糊化液的密度,进而增加了其表面张力。此外,冷却后水溶液的NA会被糊化的OSAPS胶束包埋,减缓其结晶的增长[19]。
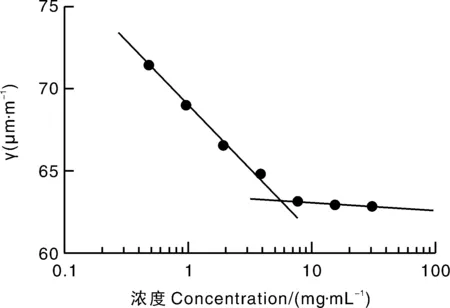
图4 临界胶束浓度检测结果Fig.4 Detection results for critical micelle concentration
2.3 释放动力学研究结果
图5和表2分别是NA原材料和OSAPS-NA复合物的释放曲线和释放动力学参数拟合结果。从图5-可知,OSAPS-NA复合物中的NA在模拟胃液和模拟肠液中的累积释放率均高于NA原材料,说明负载后的NA具有更高的溶解性。从实际检测的结果来看,6 h时NA和OSAPS-NA复合物在模拟胃液中的累积释放率分别是7.412%±0.141%和68.800%±3.234%,同时,它们在模拟肠液中的累积释放率分别为20.225%±1.978%和69.800%±3.106%。经计算可知,OSAPS-NA复合物中的NA在模拟胃液和模拟肠液中的溶解度分别提升了9.28和3.45倍。尽管,在37 ℃时,NA和OSAPS会在人工胃液(强酸性条件)中部分分解[20],但OSAPS-NA复合物中的NA在模拟胃液和模拟肠液中较高的累积释放率说明复合物的形成对NA起到了较好的增溶和保护作用。这可能是OSAPS的两亲性及其胶束共同作用的结果。
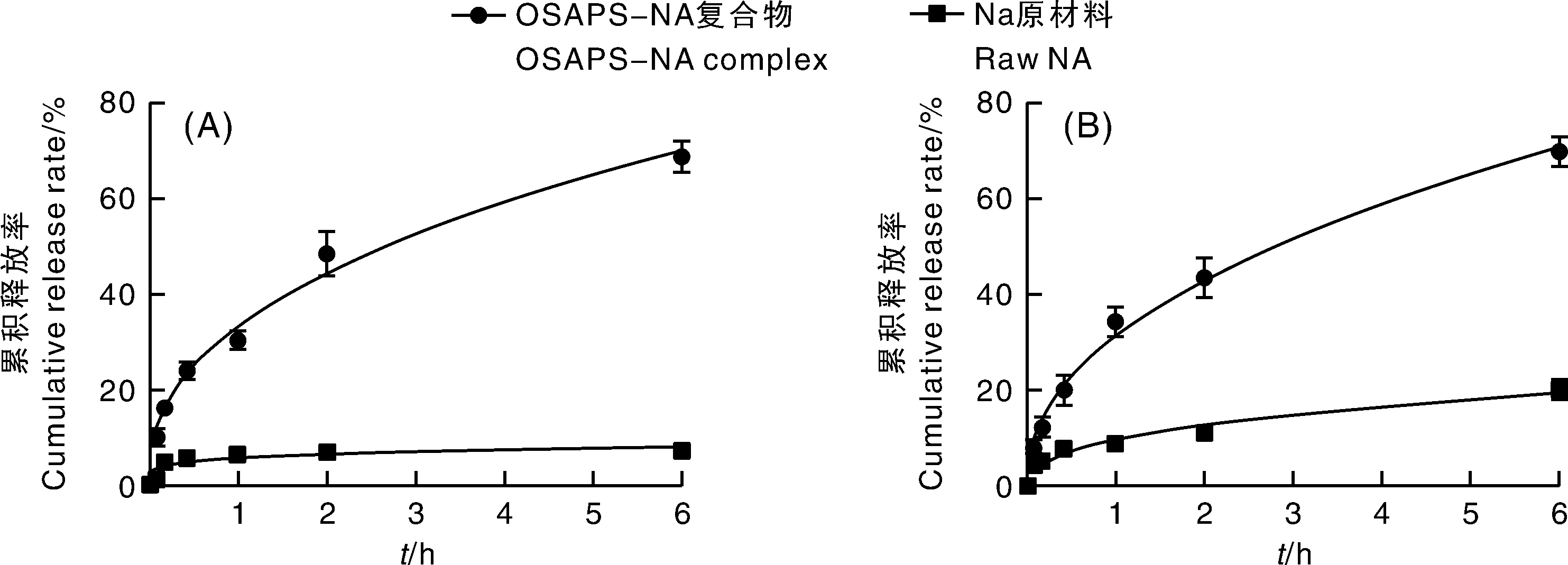
图5 NA原材料和OSAPS-NA复合物在模拟胃液(A)和模拟肠液(B)中的释放曲线Fig.5 Release profiles of NA raw material and OSAPS-NA complexes in simulated gastric fluid (A) and simulated intestinal fluid (B)

表2 NA原材料和OSAPS-NA复合物的释放动力学参数拟合结果
从模型的角度分析OSAPS-NA复合物中NA的释放机制,结果如表2所示。NA原材料在模拟胃液和模拟肠液中的n值均小于0.43,说明NA在原材料中的释放符合Fickian 扩散。OSAPS-NA复合物中NA在模拟胃液和模拟肠液中的n值均处于0.43至0.85之间,说明OSAPS对NA的释放机制属于异常扩散(非Fickian 扩散),即仅由NA的颗粒属性控制释放。此外,OSAPS-NA复合物在两种媒介中的n值都大于NA原材料,说明OSAPS-NA复合物中NA释放速度的主要控制因素已偏向于载体控制[21]。
2.4 口服生物利用度
NA原材料和OSAPS-NA复合物的药-时曲线如图6所示。根据拟合结果可知,口服NA原材料和OSAPS-NA复合物在大鼠体内的药-时曲线符合二室模型,并且药-时曲线的双峰预示着NA在大鼠体内的消除过程中存在着肝-肠胆道循环现象,这个结果与之前的研究结果是一致的[22]。综合以上结果,本研究将通过二室模型和统计矩对NA原材料和OSAPS-NA复合物的药代动力学参数分别进行分析,结果如表3所示。由表3可知,OSAPS-NA复合物的最高血药浓度(Cmax)和0~2 880 min内的药-时曲线下面积[AUC(0~2880)]值约为NA原材料的4.57和9.80倍,OSAPS-NA复合物的相对生物利用度(Frb)值为979.61%±56.79%。上述关键参数说明,本研究中获得OSAPS-NA复合物能够显著提高NA在大鼠体内的生物利用度。OSAPS-NA复合物胶束浓度可能是出现这个结果的主要原因。在合适的流动性、较低的表面张力和胶束形成的共同作用下,NA体内生物利用度的提升可能取决于NA在复合物中的小尺寸、两亲性OSAPS的增溶作用及其胶束的保护作用。同时,与NA原材料相比,OSAPS-NA复合物明显缩短NA的达峰时间(Tmax),由60 min缩短至15 min,这表明OSAPS-NA复合物中的NA通过大鼠血管壁进入血液的时间更短。但较长的分布半衰期(t1/2α)表明该复合物中的NA分布到组织和器官中的速度较慢,这也解释了OSAPS-NA复合物较高的平均滞留时间[MRT(0-∞)]和较大的0~∞ min内的药-时曲线下面积[AUC(0-∞)]。
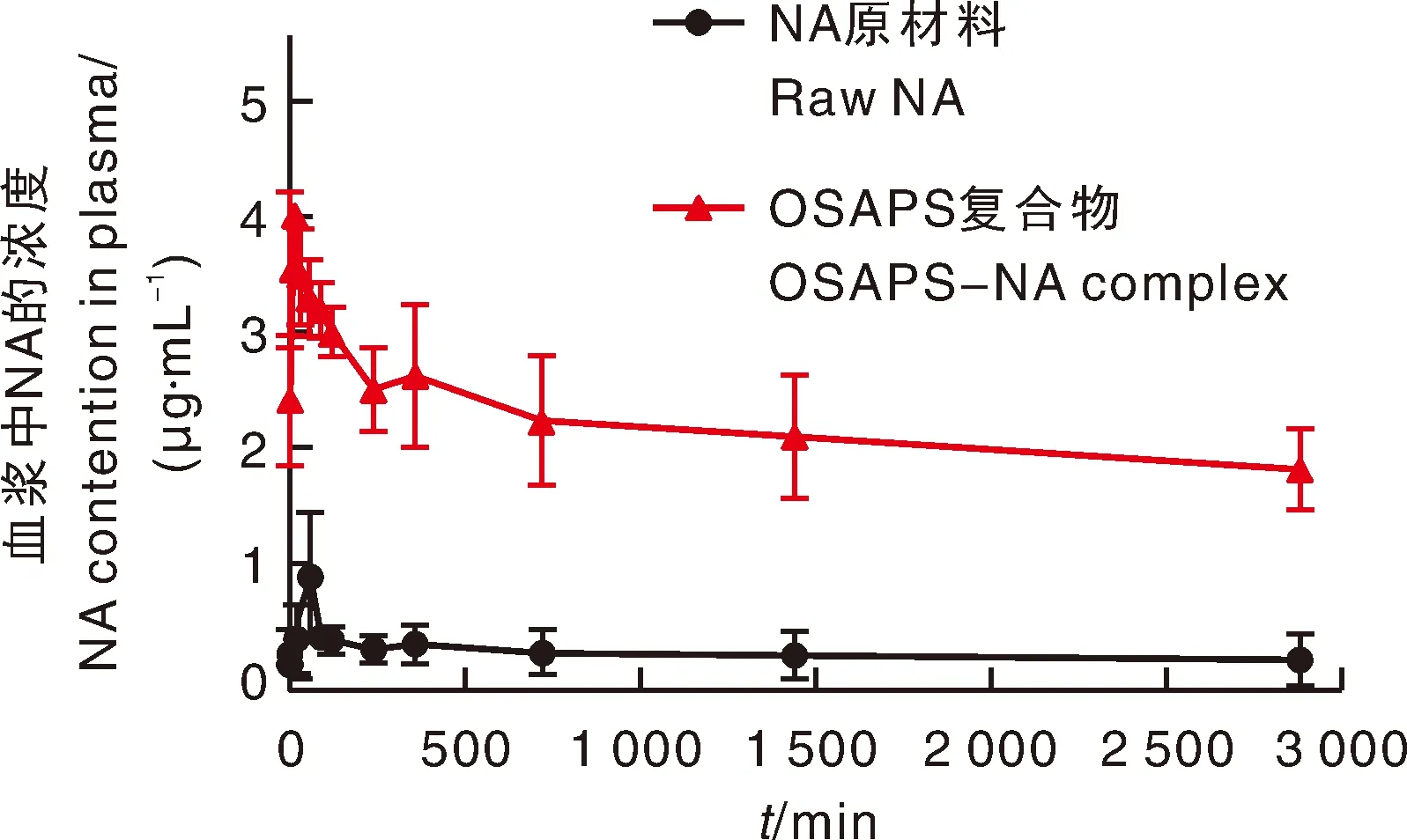
图6 口服NA原材料和OSAPS-NA复合物后NA在血浆中的浓度Fig.6 Plasma concentration of NA following oral administration of OSAPS-NA complex and the raw NA
3 结论
超声辅助的反溶剂沉淀法可以高效率地将NA负载于OSAPS中,负载过程的最佳优化条件为:在NA质量浓度为4 mg·mL-1的前提下,以丙酮和正己烷(体积比1∶0.6)为作用溶剂,超声强度为200 W,超声时间为20 min。在最佳条件下,NA在OSAPS中的负载率为71.49%±2.26%。药代动力学结果显示,NA在小鼠体内的药-时曲线出现双峰现象,并且符合二室模型。动力学参数结果显示,OSAPS-NA复合物的最高血药浓度和0~2 880 min内的药-时曲线下面积值是NA原材料的4.57和9.80倍,并且达峰时间缩短至15 min。这些现象可能是NA在复合物中的小尺寸、两亲性的OSAPS的增溶作用及其胶束的保护作用共同作用形成的。该研究为OSA改性淀粉在载体领域的拓展提供了一定的数据基础。

