托西酸舒他西林中对甲基苯磺酸烷基酯检查方法研究
姚兰?傅蓉?邹宇?孙苓苓
摘要:目的 对工艺中可能产生的对甲基苯磺酸烷基酯建立气相色谱-三重四极杆质谱联用的测定方法。方法 以(5%-苯基)-甲基聚硅氧烷为固定液的弹性石英毛细管柱为色谱柱;进样口温度为200 ℃,程序升温,起始温度50 ℃,维持1 min,以每分钟10 ℃升温至300 ℃;进样体积1 μL。以三重四极杆串联质谱仪检测;离子源为电子轰击源(EI),质谱监测模式为多反应监测(MRM)。结果 经方法學验证,混合对照品溶液各峰分离良好,对甲基苯磺酸甲酯、乙酯、异丙酯分别在0.002485~0.1863 μg/mL、0.002019~0.1514 μg/mL 、0.001879~0.1409 μg/mL浓度范围内线性关系良好,在0.05~0.15 μg/mL浓度范围内回收率为94.5%~113.7%,方法检出灵敏度低于1%TTC。结论 该方法准确可靠,适用于托西酸舒他西林中对甲基苯磺酸烷基酯的测定。按该方法形成质量标准草案,并采用拟修订方法对生产企业提供的6批样品进行测定,6批样品均符合规定。
关键词:托西酸舒他西林;对甲基苯磺酸甲酯;对甲基苯磺酸乙酯;对甲基苯磺酸异丙酯;气相色谱-三重四极杆质谱联用
中图分类号:R917文献标志码:A
Study on the determination of p-toluenesulfonic acid alkyl ester
in sultamicillin tosilate
Yao Lan, Fu Rong, Zou Yu, and Sun Lingling
(Liaoning Institute for Drug Control, Shenyang 110032)
Abstract Objective A gas chromatography-triple quadrupole mass spectrometry (GC-MSMS) method was developed for the determination of alkyl p-toluenesulfonate. Method An elastic quartz capillary column with (5%-phenyl)-methylpolysiloxane as stationary liquid was used as the chromatographic column. The inlet temperature is 200 ℃. The column temperature was programmed. The starting temperature was set at 50 ℃ for 1 minute, and then the temperature was increased to 300 ℃ at a rate of 10 ℃ per minute; the injection volume was 1 μL. The Electron Ionization source (EI) was used as the ion source, and the monitoring mode was multiple reaction monitoring (MRM). Result The results showed that the peak area of methyl p-toluenesulfonate, ethyl p-toluenesulfonate, and isopropyl p-toluenesulfonate had a good linear relationship in the concentration range of 0.002485~0.1863 μg/mL, 0.002019~0.1514 μg/mL and 0.001879~0.1409 μg/mL, respectively. The recovery rates were 94.5%~113.7% in the range of 0.05~0.15 μg/mL, respectively. The detection sensitivity concentration was less than 1% TTC. Conclusion The method was accurate and reliable. According to this method, a draft of quality standard was formed, and 6 batches of samples were determined by the proposed method. All 6 batches of samples met the requirements.
Key words Sultamicillin tosilate; Methyl p-toluenesulfonate; Ethyl p-toluenesulfonate; Isopropyl p-toluenesulfonate; Gas chromatography-triple quadrupole mass spectrometry
托西酸舒他西林收载于《中国药典》2020年版[1],为舒他西林对甲基苯磺酸盐。《中国药典》2020年版[1]该品种[生产要求]项下要求:应对生产工艺进行评估以确定形成遗传毒性杂质甲苯磺酸烷基酯的可能性。必要时,应采用适宜的分析方法对产品进行分析,以确认甲苯磺酸酯的含量符合国家药品监督监管部门相关指导原则或ICH M7指导原则的要求。
根据生产单位提供的工艺,托西酸舒他西林生产主要使用的溶剂包含甲醇、异丙醇、乙酸乙酯等,成盐试剂对甲苯磺酸与溶剂有形成对甲基苯磺酸甲酯、对甲基苯磺酸乙酯、对甲基苯磺酸异丙酯的可能性,磺酸烷基酯为带有基因毒性警示结构化合物[2],对甲基苯磺酸烷基酯属带有基因毒性警示结构无致突变性数据化合物,应采用适宜的方法控制该类杂质不高于可接受限度。
根据ICH M7中毒理学关注阈值(TTC)的建议[3],具有诱变性的杂质每天每人摄入1.5 μg时其风险是可以忽略的(终生暴露情况下理论的患癌风险小于十万分之一),可以通用于大部分药物作为可接受限度控制标准。托西酸舒他西林成人推荐使用量为最大每次0.75 g,每日两次(共1.5 g)。照上述控制标准,1.5 μg /1.5 g应作为该品种该类杂质可接受的限度控制标准,即1 ppm。
1 仪器与试药
1.1 仪器
三重四极杆气质联用仪:Agilent7890B-7000C三重四极杆气质联用仪
天平: XP205 (Mettler Toledo)
1.2 试剂与对照品
试验使用的试剂与对照品详见表1。
1.3 供试品
生产企业提供的托西酸舒他西林原料药6批,批号C04200501、C04200502、C04200503、C04210101、C04210102、C04210103。
1.4 色谱柱
HP-5(19091J-413)30 m×0.320 mm,0.25 μm;DB-5(122-5032) 30 m×0.25 mm,0.25 μm。
2 方法与结果
2.1 研究方法
对甲基苯磺酸甲酯、对甲基苯磺酸乙酯、对甲基苯磺酸异丙酯照气相色谱法(《中国药典》2020年版通则0521)和质谱法(通则0431)测定。
2.1.1 供试品溶液
取供试品约1.0 g,精密称定,置具塞(胶塞)试样瓶中,将试样瓶置冰水浴中冷却,加甲基叔丁基醚10 mL,立即旋紧胶塞,室温下振摇20 min,静置5 min,取上清液用微孔滤膜(0.22 μm)滤过,取续滤液,即得。
2.1.2 混合对照品贮备溶液
取对甲基苯磺酸甲酯、对甲基苯磺酸乙酯与对甲基苯磺酸异丙酯对照品适量,精密称定,加甲基叔丁基醚溶解并稀释制成分别约含10 μg/mL的混合对照品溶液。
2.1.3 系列混合对照品溶液
精密量取混合对照品贮备溶液适量,用甲基叔丁基醚稀释制成每1 mL分别约含2、10、50、100和150 ng系列混合对照品溶液。
2.1.4 灵敏度溶液
取每1 mL分別约含2 ng的混合对照品溶液,作为灵敏度溶液。
2.1.5 色谱条件
以(5%-苯基)-甲基聚硅氧烷为固定液的弹性石英毛细管柱为色谱柱;进样口温度200 ℃;分流比1︰1;载气为高纯氦气(He),流速2.0 mL/min;程序升温,起始温度50 ℃,维持1 min,以每分钟10 ℃升温至300 ℃;进样体积1 μL。
2.1.6 质谱条件
以三重四极杆串联质谱仪检测;离子源为电子轰击源(EI),离子源温度200 ℃;碰撞气为氮气,流速1.5 mL/min;辅助加热器(MSD传输线)温度为300 ℃;质谱监测模式为多反应监测(MRM);监测离子对、碰撞电压(CE)参考值见表2;为提高检测灵敏度,可根据保留时间分段监测各化合物。
2.1.7 系统适用性要求
精密量取混合对照品溶液(150 ng/mL)连续进样,对甲基苯磺酸异丙酯峰面积的相对标准偏差不得过5.0%,各色谱峰之间的分离度应符合要求。以上符合要求情况下,进行线性关系的考查。系列混合对照品溶液色谱图中,计算各成分浓度与相应峰面积的线性回归方程,相关系数(r)应不小于0.99。灵敏度溶液色谱图中,对甲基苯磺酸甲酯峰、对甲基苯磺酸乙酯峰及对甲基苯磺酸异丙酯峰的信噪比,均应不小于10。
2.1.8 测定法
精密量取系列混合对照品溶液、供试品溶液与灵敏度溶液,分别注入气相色谱-串联质谱仪,记录色谱图和质谱图。
2.1.9 限度
供试品溶液色谱图中如检出与对照品保留时间相同的色谱峰,并且在扣除背景后的质谱图中,所选择的2个监测离子对均出现,供试品溶液的监测离子对峰面积比(比值=定性离子峰面积/定量离子峰面积×100%)与浓度相当的对照品溶液的监测离子对峰面积比进行比较时,相对偏差不超过下列规定的范围,则可判定样品中存在该杂质:相对比例>50%,允许±20%偏差;相对比例20%~50%,允许±25%偏差;相对比例10%~20%,允许±30%偏差;相对比例≤10%,允许±50%偏差。按标准曲线法以峰面积计算,含对甲基苯磺酸甲酯、对甲基苯磺酸乙酯与对甲基苯磺酸异丙酯分别不得过1 ppm。小于灵敏度溶液主峰面积的峰忽略不计。
2.2 方法学研究结果
2.2.1 专属性
对甲基苯磺酸甲酯、对甲基苯磺酸乙酯、对甲基苯磺酸异丙酯EI源(70 ev)质谱图见图1,根据离子响应选择定量与定性参考离子见“2.1.6”质谱条件。
精密吸取对照品溶液、供试品溶液与空白溶液,照上述“2.1”方法,各进样1 μL,结果混合对照品溶液各峰分离良好,溶剂与样品基质不干扰测定,方法专属性良好。典型色谱图见图2~6。
2.2.2 准确度与重复性
取供试品(批号C04200502)1.0 g,共9份,每组3份,精密称定,置具塞试样瓶中,将试样瓶置冰水浴中冷却,每组样品分别精密加入低、中、高混合对照溶液(浓度分别为0.05、0.10、0.15 μg/mL)
10 mL,密闭,室温振摇20 min,静置5 min,用
0.22 μm微孔滤膜滤过,取续滤液,即得。照“2.1”方法,每样品进样两次,结果表明:各样品回收率良好,以回收率的样品间RSD考察重复性,样品间重复性符合要求,方法准确可靠,结果见表3。
2.2.3 检测限与定量限
精密称取对甲苯磺酸甲酯、对甲苯磺酸乙酯、对甲苯磺酸异丙酯对照品各适量,用甲基叔丁基醚溶解并逐级稀释,以信噪比10为定量限,信噪比3为检测限,各杂质定量限与检测限结果见表4,典型图谱见图7~10。1 ppm应作为该品种该类杂质可接受的限度控制标准,检测限浓度均能够满足ICH M7推荐的杂质可忽略限度(0.01 ppm)。
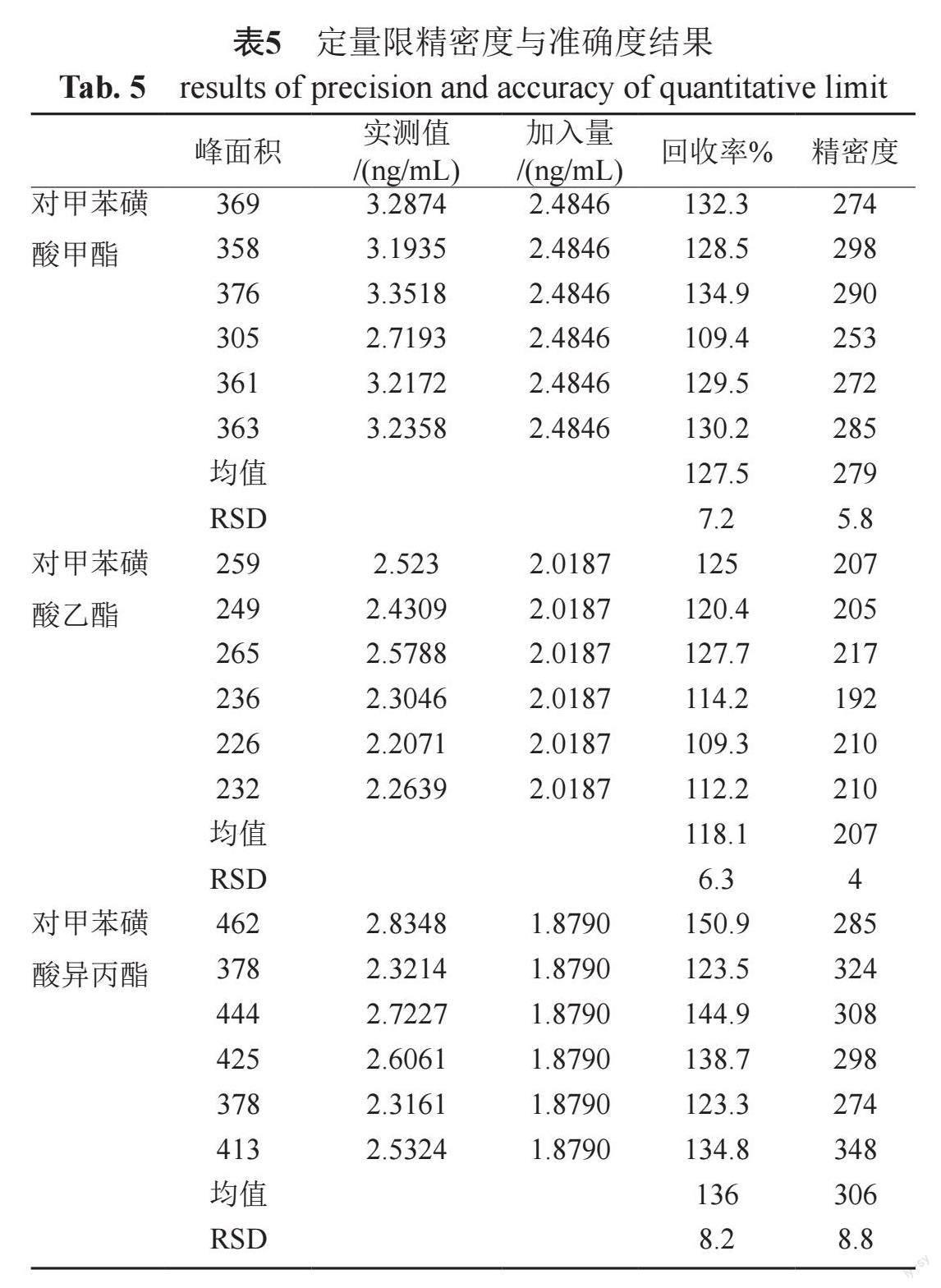
2.2.4 定量限精密度与准确度
取定量限溶液,连续进样6次,并计算峰面积相对标准偏差考察精密度。取供试品6份,每份1.0 g,精密称定,置50 mL具塞试样瓶中,各加定量限溶液10 mL,密闭,振摇20 min,用0.22 μm微孔滤膜滤过,取续滤液,即得,照"2.1"方法,进样1 μL计算回收率。精密度与准确度结果见表5。结果表明,精密度与回收率结果良好。
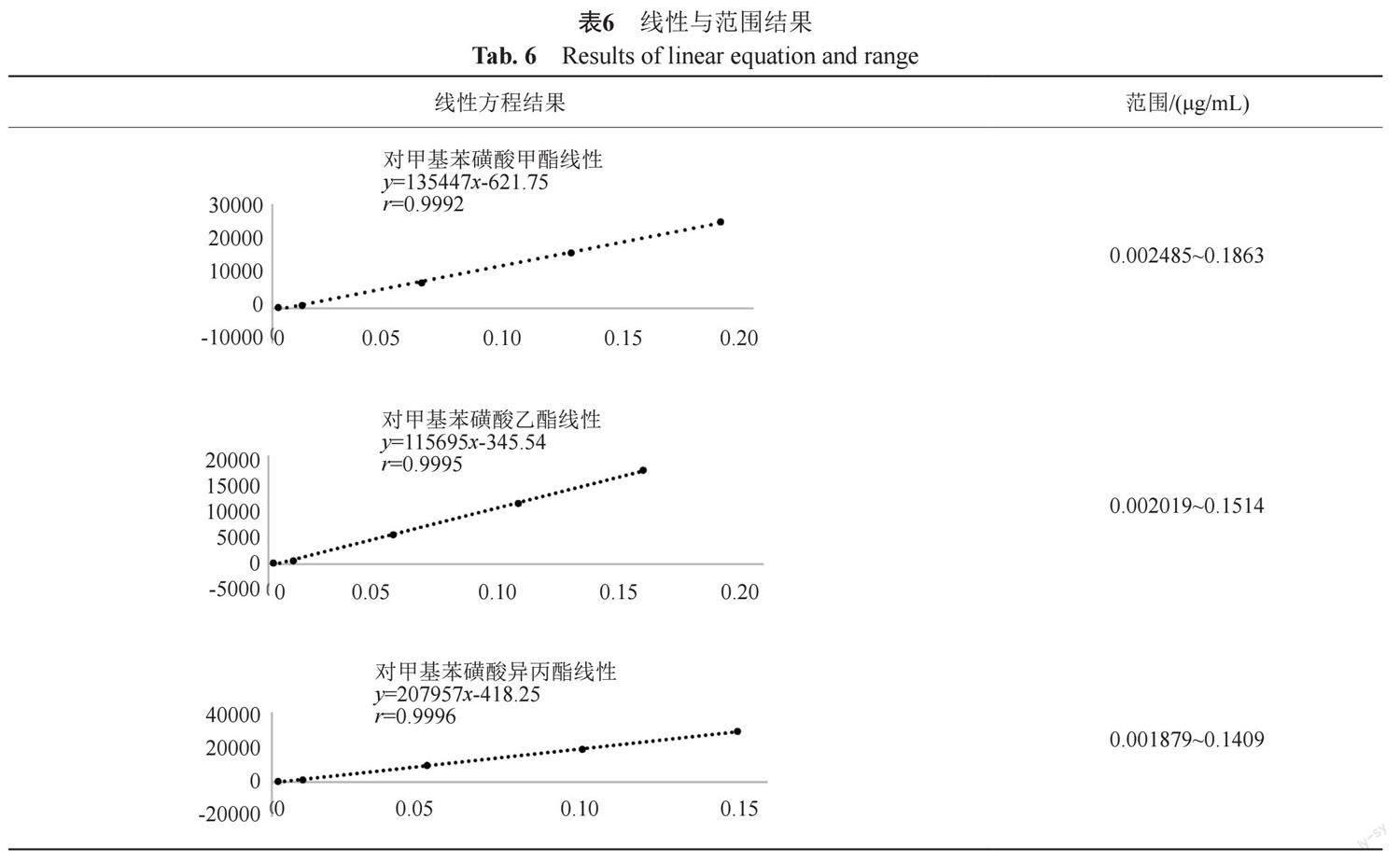
2.2.5 线性与范围
精密称取对甲苯磺酸甲酯、对甲苯磺酸乙酯、对甲苯磺酸异丙酯对照品各适量,用甲基叔丁基醚溶解并逐级稀释,制成线性系列溶液,照“2.1”方法,进样1 μL,各杂质线性范围内峰面积与浓度线性关系良好,r值不小于0.9992。线性与范围结果见表6。
2.6 耐用性
采用DB-5 (122-5032) Length30 m×Diam.0.25 mm Film 0.25 μm色谱柱,照“2.1”方法,进样混合对照溶液(约0.05 μg/mL),结果各峰分离良好。色谱图见图11,表明方法耐用性良好。
2.3 樣品测定结果
取供试品1.0 g,精密称定,精密加入甲基叔丁基醚10 mL,振摇20 min,用0.22 μm微孔滤膜滤过,取续滤液,进样1 μL。按外标标准曲线法计算,结果见表7。有1批检出对甲基苯磺酸异丙酯,其余样品均未检出,6批样品均符合规定。
3 讨论
综上研究,该方法简便、结果准确可靠,适用于托西酸舒他西林中对甲基苯磺酸甲酯、乙酯、异丙酯的检测。根据检验结果,该企业样品中该类杂质控制良好,杂质未检出或痕量检出。根据ICH M7中毒理学关注阈值(TTC)的建议,低于1%TTC杂质可以忽略不计,该方法检测灵敏度能够满足1%TTC,可以满足该杂质的质量控制。《欧洲药典》收载GC-MS法测定甲磺酸甲酯、乙酯、异丙酯,采用衍生化法使待测物沸点降低,使满足顶空法要求,本文中待测物无法通过衍生化法满足顶空法要求。有文献报道采用液质联用方法测定该类杂质,因该类杂质易水解,液质法不满足测定需求。本文采用GC-MSMS直接进样法,由于样品浓度较大(0.1g/mL),对系统污染严重。因此选择甲基叔丁基醚作为溶剂,托西酸舒他西林与对甲基苯磺酸烷基酯的在该溶剂中溶解性差异较大,溶剂能够提取样品中的待测物,并使原料药对测定无干扰。测定中发现,对甲基苯磺酸异丙酯存在进样口吸附的现象,因此,方法先以杂质对照品浓溶液对进样口进行充分的预饱和,结果较理想。
参 考 文 献
国家药典委员会 中华人民共和国药典[S].(2020年版二部). 北京: 中国医药科技出版社 2020: 434-435
Snodin D J. Genotoxic impurities: from structural alerts to qualification [J]. Org Process Res Dev, 2010, 14(4): 960-976.
ICH.ICH Harmonized Guideline, Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals To Limit Potential Carcinogenic Risk M7(R1)[S/OL].(2017-3-31)[2022-9-21]. https://database.ich.org/sites/default/files/M7_R1_Guideline.pdf.

