磺胺嘧啶锌软膏质量评价
卢玉凤?李洁?李少杰?李茜?梅芊?林红军?刘英
摘要:目的 對磺胺嘧啶锌软膏的质量现状进行综合评价。方法 基于质量源于设计(quality by design, QbD)理念,建立HPLC法测定磺胺嘧啶锌软膏的含量、有关物质与抑菌剂含量,并开展水活度、抑菌效力、酸碱度、体外释放等相关探索性研究项目。采用法定标准检验与探索性研究相结合,对国家药品抽检的29批次样品与调研企业收集的样品进行检验,并对测定结果统计分析与汇总,进而科学公正地评价其质量。结果 法定标准检验结果显示,29批次磺胺嘧啶锌软膏的合格率为100%。探索性研究提示磺胺嘧啶锌软膏的处方仍有进一步优化的空间,可通过优化处方设计提高释放率和降低黏稠度,并选择合适的抑菌剂种类,增强对真菌的抑菌效力等改善产品疗效。同时,提示原料质量与软膏生产过程控制对软膏质量起着不容忽视的作用。现行标准中鉴别项有待优化,含量测定方法为永停滴定法,受基质干扰,新建专属性更强的HPLC法。结论 目前磺胺嘧啶锌软膏整体质量一般,软膏和原料质量标准有待提高,建议企业优化处方设计,同时关注原料质量与软膏生产过程控制,从而全面提高产品质量。
关键词:磺胺嘧啶锌软膏;质量分析;质量源于设计;抑菌剂;包材
中图分类号:R917,R978.1文献标志码:A
Quality evaluation of sulfadiazine zinc ointment
Lu Yufeng, Li Jie, Li Shaojie, Li Qian, Mei Qian, Lin Hongjun, and Liu Ying
(Henan Institute For Drug and Medical Device Inspection, Henan Chemical Quality Evaluation and Control Engineering Technology Research Center, Zhengzhou 450018)
Abstract Objective This study aimed to comprehensive evaluate the quality status of sulfadiazine zinc ointment. Methods Based on the concept of quality by design (QbD), HPLC method for determining the content, related substances and bacteriostatic agents of sulfadiazine zinc ointment was established, and exploratory research projects related to water activity, bacteriostatic efficacy, pH value, in vitro release, etc. were carried out. According to the combination of general requirements of the national assessment program and exploratory research, the 29 batches of sulfadiazine zinc ointment from the national drug sampling and samples collected by research enterprises were tested, and the measurement results were analyzed and summarized in order to evaluate their quality scientifically and fairly. Results The legal test results showed that the qualified rate of these 29 batches of sulfadiazine zinc ointment was 100%. But exploratory research showed that the prescription of sulfadiazine zinc ointment could be further optimizated. The therapeutic effect can be improved by optimizing the prescription design to reduce the viscosity and improve the release rate and selecting the appropriate type of bacteriostatic agent to enhance the antibacterial effect of fungi. At the same time, raw material quality and production process control play an important role in the quality of ointment. The identification items in the current standard need to be optimized. The content determination method is the permanent titration method. Due to matrix interference, a new HPLC method with stronger specificity has been established. Conclusion The overall quality of sulfadiazine zinc ointment at present is only common. The current quality standards of the ointment and raw materials need to be improved. It is suggested that enterprises optimize prescription design, pay attention to the quality of raw materials and control the ointment production process, so as to comprehensively improve product quality.
Key words Sulfadiazine zinc ointment; Quality analysis; Quality by design; Bacteriostatic agent; Packaging material
磺胺嘧啶锌软膏为局部外用磺胺类抗生素,具有磺胺嘧啶和锌两者的作用,对多数革兰阳性菌、革兰阴性菌和酵母菌等有良好的抗菌作用,并且不为氨基苯甲酸所拮抗,其中锌因能破坏细菌的DNA结构,亦具有抑菌作用。同时,本品可补充烧伤患者体内锌损失,增强机体抵抗干扰和创面愈合能力。临床适用于预防及治疗Ⅱ、Ⅲ度烧伤继发创面感染[1-2]。
1975年,美国Fox公司合成磺胺嘧啶锌[3]。1981年,河南师范大学化学系研发磺胺嘧啶锌原料及软膏(内部资料)。1989年,磺胺嘧啶锌软膏投产并用于临床[4]。目前,国外无该品种原料与软膏上市,国内共有磺胺嘧啶锌软膏生产企业3家,批准文号3个,但在产企业仅1家。2022年国家药品抽检从14个省(直辖市、自治区)抽取到29批次磺胺嘧啶锌软膏,涉及1家生产企业,1个批准文号,全面覆盖在产企业。本文按《中国药典》2015年版(以下简称ChP2015)年版[5]
或2020年版(以下简称ChP2020)[6]二部磺胺嘧啶锌软膏质量标准进行检验,并结合探索性研究结果对其质量现状进行客观评价,为助力企业全面提高产品质量与完善质量标准提供数据支持。因本品国外无原研药,选择同类型、同疗效的美国辉瑞磺胺嘧啶银乳膏为对照样品。
1 仪器与试药
1.1 仪器与试剂
Waters e2695高效液相色谱仪(美国Waters公司);Dionex Ultimate 3000双三元液相色谱仪(美国Dionex公司);Thermo QE plus离子轨道阱高分辨质谱仪(美国Thermo Fisher公司);ZYT-1型自动永停滴定仪(上海安亭科学仪器厂);ZHR-2型锥入度测定仪(天津天大天发科技有限公司);Aqualab-4TE 型水分活度仪(美国decagon公司);Olympus BX51光学显微镜(日本Olympus公司);Malvern Mastersizer 2000激光粒度测定仪和Hydro 2000MU(A)湿法进样器(英国Malvern公司);TK-12D型透皮仪(上海锴凯科技贸易有限公司);W3/230型水蒸气透过率测试系统(济南兰光机电技术有限公司);OX2/230型氧气透过率测试系统 (济南兰光机电技术有限公司);BRUKER MPA型傅立叶变换近红外光谱仪(德国Bruker公司);XRD-7000型X-射线衍射仪(日本Shimadzu公司);IRPrestige-21型傅立叶变换红外分光光度计(日本Shimadzu公司)等仪器。
乙腈为色谱纯,购自美国Sigma公司,超纯水由Millipore纯水仪制备,其余试剂均为分析纯。
1.2 试药
标准物质:磺胺嘧啶(批号100026-201404,99.7%)、羟苯甲酯(批号100278-201906,99.9%)、羟苯乙酯(批号100847-202105,100.0%)、羟苯丙酯(批号100444-202005,99.9%)磺胺(批号100024-201103,99.8%)、磺胺脒(批号100412-201302,92.0%)均购自中国食品药品检定研究院;对羟基苯甲酸(批号LRAC5151,100.0%)购自Sigma-Aldrich公司;N-乙酰磺胺嘧啶(批号2-JGC-61-2,97%)购自Toronto Research Chemicals公司;水活度标准溶液:0.500aw(批號21161034)、0.760aw(批号21720818)、0.920aw(批号21645394)、0.984aw(批号21643391)、1.000aw(批号20964482),均购自美国Meter Group公司。
试验菌种:金黄色葡萄球菌[CMCC(B) 26003]、铜绿假单胞菌[CMCC(B) 10104]、白色念珠菌[CMCC(F) 98001]、黑曲霉[CMCC(F) 98003],均购自中国食品药品检定研究院。
样品:2022年磺胺嘧啶锌软膏国家药品抽检样品(以下简称国抽样品)29批次,涉及A企业。调研收集A企业的辅料(空白基质和羟苯乙酯)、1批次聚乙烯/铝/聚乙烯复合药用软膏管、3批次磺胺嘧啶锌原料与3批次磺胺嘧啶锌软膏。1批次国外对照样品:磺胺嘧啶银乳膏(批号EL2544,规格1%),购自美国辉瑞公司。1批次近红外建模验证样品:克霉唑乳膏(批号170901,规格1%),购自B企业。
2 试验方法
2.1 法定标准检验
按ChP2015或ChP2020二部磺胺嘧啶锌软膏质量标准进行检验,主要项目包括性状、鉴别、粒度、无菌、装量和含量测定。
2.2 探索性研究
根据质量源于设计(quality by design, QbD)的理念[7],针对本品为多剂量外用无菌软膏的特点,基于药品全生命周期质量控制,围绕产品安全性、有效性、稳定性与质量可控性开展以下探索性研究。
2.2.1 安全性
磺胺嘧啶锌软膏为多剂量无菌外用软膏,开启后易受微生物污染,而微生物生长与水活度密切相关,考察水活度;处方中添加抑菌剂为羟苯乙酯,考察抑菌剂含量的同时,以抑菌效力为指标考察抑菌剂的种类是否合适;外用软膏对皮肤的刺激性与酸碱度相关;本品基质复杂,原料及软膏现行质量标准缺失有关物质,考察有关物质,同时进行杂质谱分析,查清杂质来源及产生原因,分析杂质结构有无遗传毒性警示结构,从源头控制杂质。结合水活度、抑菌剂含量、抑菌效力、酸碱度、有关物质及杂质谱分析测定结果与分析,对处方设计的合理性进行评价。
(1)水活度 采用Aqualab-4TE型水分活度仪,测定条件:25 ℃。样品前测定,首先取水活度的标准溶液0.500、0.760、0.920、0.984和1.000 aw对仪器的准确性进行验证,每个标准溶液的水活度读数均需要在标准值的±0.003 aw范围。然后测定29批次国抽样品水活度,每批平行测定3次,取平均值。
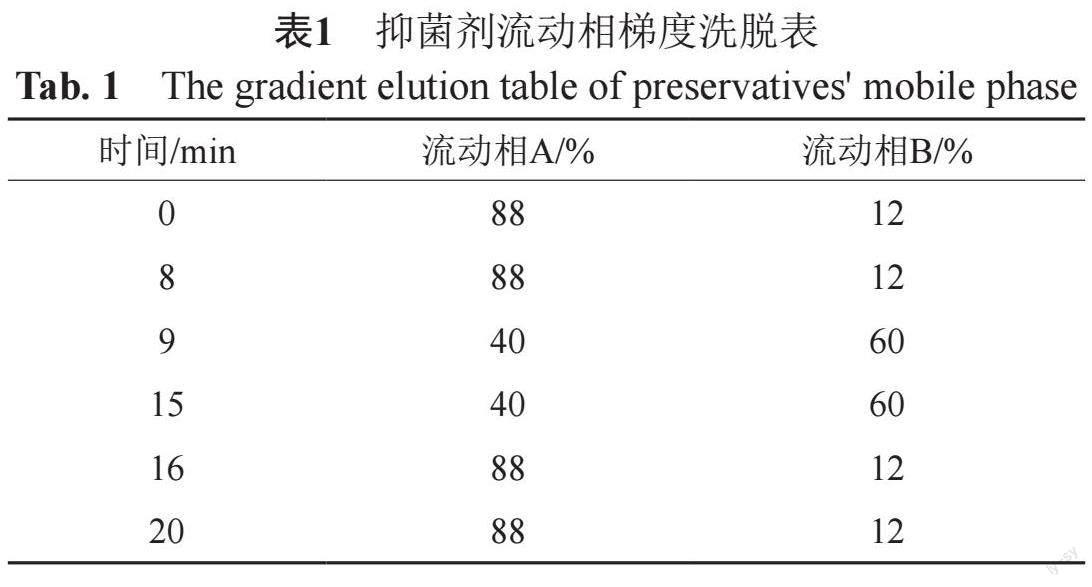
(2)抑菌剂含量 建立HPLC法同时测定羟苯甲酯、羟苯乙酯和羟苯丙酯3种常用尼泊金酯类抑菌剂含量。采用Kromasil 100-5 C18色谱柱(5 μm,4.6 mm×250 mm);流动相A为冰乙酸-水(1:87),流动相B为乙腈,梯度洗脱,见表1;流速1.0 mL/min;柱温30 ℃;进样量20 μL;检测波长260 nm。
(3)抑菌效力 参考ChP2020四部通则1121抑菌效力检查法[8],以2种细菌:金黄色葡萄球菌、铜绿假单胞菌,2种真菌:白念珠菌、黑曲霉作为试验菌种,分别设置2、7、14和28 d这4个时间点进行试验。选取有代表性的5批次国抽样品和对照样品进行抑菌效力研究,并对处方量的抑菌剂羟苯乙酯和羟苯甲酯的抑菌效力进行比较。
(4)酸碱度 取样品,采用pH计直接测定其pH值。
(5)有关物质 参考USP现行版磺胺嘧啶含量测定色谱条件[9]及相关文献[10],建立HPLC法同时测定磺胺嘧啶锌软膏及原料有关物质。采用Kromasil 100-5 C18色谱柱(5 μm,4.6 mm×250 mm);流动相A为冰乙酸-水(1:87, V/V),流动相B为乙腈,梯度洗脱,见表2;流速1.0 mL/min;柱温35 ℃;进样量20 μL;检测波长260 nm。
(6)杂质谱分析 结合磺胺嘧啶锌原料的合成路线、降解途径、磺胺嘧啶锌软膏的生产工艺对杂质谱进行分析;对比磺胺嘧啶锌软膏、原料、原料的起始物料磺胺嘧啶、辅料羟苯乙酯及空白基质色谱图,分析杂质来源;采用双三元二维液相色谱—Q Exactive Plus高分辨质谱对软膏和原料中检出的杂质进行确证与结构推断。
2.2.2 有效性
磺胺嘧啶锌软膏标准检验发现29批次国抽样品中,5批次有团聚物,为考察团聚物是否影响药效,分析团聚物成分;本品为混悬型软膏,原料的晶型和粒度会影响其在基质内的分布状态和药效发挥,考察原料晶型与粒度分布;根据原料晶型与粒度分布测定结果,结合软膏生产工艺分析团聚物形成原因;同时为考察药物释放程度,进行体外释放试验;软膏的黏稠度影响涂布延展性,间接影响疗效,考察锥入度。
(1)团聚物成分分析 分别取有团聚物的样品与无团聚物样品进行比较,目视团聚物为白色点状物,见图1。采用显微镜法、HPLC法对团聚物成分进行分析。
(2)原料粒度分布 采用显微镜法测定原料粒度,光散射法(激光粒度仪)测定原料粒度分布。
(3)原料晶型 分别采用红外分光光度法(IR)与粉末X-射线衍射法(PXRD)测定原料红外光谱图与X-射线衍射图,分析其晶型。
(4)团聚物形成原因 根据原料晶型与粒度分布测定结果,同时模拟软膏生产工艺,考察原料在软膏水相(甘油和水混合)中分散情况,并结合企业调研情况分析团聚物形成原因。
(5)体外释放试验 从29批次国抽样品中选取不同剩余有效期,且有代表性的14批次样品与1批次对照样品,采用Franz扩散池法,体外释放试验条件:扩散池为带有标准开帽式毛玻璃样表面的扩散池系统,注入孔直径为15 mm;人工膜为MCE膜(直径25 mm,0.45 ?m),膜面积1.77 cm2;接受液介质为0.1 mol/L盐酸溶液;接收液介质温度为32 ℃;接收液介质体积为7 mL;搅拌速率为250 r/min。分别在0.5、1、2、4、5和6 h取出全部接收液,采用新建磺胺嘧啶锌软膏含量测定HPLC方法测定接收液中磺胺嘧啶含量,并分别换算为磺胺嘧啶锌或磺胺嘧啶银含量,每批样品测定3次,取平均值計算不同取样时间药物累积释放量,考察磺胺嘧啶锌软膏批间释放差异,重点关注团聚物是否影响磺胺嘧啶锌释放,比较磺胺嘧啶锌软膏与对照样品释放差异,并分析导致释放差异的因素。
(6)锥入度 采用ChP2020年版四部通则0983锥入度测定法[11],取样品适量小心装满样品杯,采用震动法除去可能混入的气泡,在(25±0.5) ℃环境下放置24 h后,用Ⅲ号椎体进行测定,每批次样品平行测定3份,取平均值,并根据计算公式换算为Ⅰ号椎体锥入度推测值。
2.2.3 稳定性
磺胺嘧啶锌软膏为油/水两相的热力学不稳定体系,基于药品全生命周期质量控制,根据ChP2020四部9001原料药物与软膏稳定性试验指导原则[12],进行影响因素试验和3个月加速试验,考察其稳定性。同时本品有效期3年,包材为聚乙烯/铝/聚乙烯复合药用软膏管,处方中水分占比52%,贮藏期间,水分挥发影响产品稳定性和质量,考察包材阻隔性。
(1)影响因素试验 取国抽样品与调研收集样品各1批次,除去外包装,分别在高温(40 ℃)、高湿(饱和硝酸钾溶液,相对湿度92.5%,25 ℃)与光照(4500±500) Lx下放置相应天数,考察高温、高湿与强光照射条件对样品的性状、粒度、酸碱度、水活度、有关物质、羟苯乙酯和磺胺嘧啶锌含量等指标的影响。
(2)加速试验 取调研收集样品1批次,除去外包装,在温度30 ℃、相对湿度65%条件下放置3个月,分别在0、1、2、3月4个时间点取样,以样品的性状、粒度、酸碱度、水活度有关物质、锥入度、羟苯乙酯和磺胺嘧啶锌含量与含量均匀性为指标,考察样品稳定性,为其处方设计、工艺改进、质量研究、包装改进、运输和贮存提供必要资料。
(3)包材阻隔性 参考国家药包材标准(2015)YBB00252005-2015聚乙烯/铝/聚乙烯复合药用软膏管[13],采用GB/T31355-2014 包装件和容器水蒸气透过性测试方法红外传感器法[14]测定软膏管水蒸气透过率;采用GB/T31354-2014 包装件和容器氧气透过性测试方法库仑计检测法[15]测定软膏管氧气透过率;采用《中国药典》2020年版四部通则4010水蒸气透过量测定法第一法重量法2减重法[16]测定软膏管水蒸气透过量;对调研收集1批次包材的阻隔性能进行考察。
2.2.4 质量可控性
从软膏和原料质量标准,以及近红外建模3方面进行研究。目前,国外药典均未收载该品种原料和制剂。
(1)软膏质量标准
①鉴别 现行标准鉴别试验样品前处理产生的沉淀量少,无法按标准规定的沉淀取样量进行化学鉴别试验,通过优化样品前处理方式进行修订。
②含量测定 现行标准为永停滴定法,因基质易黏附于铂片电极,使电极灵敏度降低,试验中需经常清洗电极。同时空白基质消耗滴定液,干扰测定。参考USP现行版磺胺嘧啶含量测定方法[9]和相关文献[17],建立专属性强的HPLC法,并进行方法学验证,色谱条件见“2.2.1(2)”项下。
(2)原料质量标准
①有关物质 现行标准缺失与安全性相关的有关物质,建立专属性强、灵敏度高的HPLC法,色谱条件见“2.2.1(5)”项下。测定调研收集3批次原料有关物质,有效控制杂质量。
②锌含量 现行标准缺失与有效性相关的锌含量测定,磺胺嘧啶锌中锌作为主药的组成部分,对药物的疗效起着至关重要的作用,烧伤患者体内会大量丧失锌,磺胺嘧啶锌可补偿锌损失[18],从而增强机体抵抗感染能力,使其具有控制感染与促进愈合的双重功能。参照《中国药典》2000年版(ChP2000)二部磺胺嘧啶锌含量测定“锌”项下方法[19],建立络合滴定法测定原料中锌含量,该法与上述ChP2000中测定方法一致,但滴定度不同,该法滴定度为每1 mL乙二胺四醋酸二钠定液(0.05 mol/L)相当于3.27 mg的锌,计算锌含量。
(3)近红外建模 采用MPA型傅立叶变换近红外光谱仪,积分球模式,将样品置入近红外专用22 mm玻璃管采集NIR光谱。
①近红外一致性检验模型 采集29批次国抽样品和3批次调研收集样品共192张原始光谱,采用一阶导数+矢量归一化进行预处理,平滑点:13个,谱段为9087.6~7760.7 cm-1、6356.7~4165.8 cm-1。参考光谱数量不少于20张,CI(一致性指数)限度设置为5,建立一致性检验模型。同时采集1批次调研收集样品、1批次对照样品和1批次克霉唑乳膏对所建一致性检验模型进行验证。
②近红外定量模型 取全部29批次国抽样品建立定量模型,使用OPUS软件进行自动优化并结合手动修改得到谱段范围及预处理方法。再用所建模型对29批次国抽样品进行测定,对预测结果与所建HPLC法样品含量测定结果进行比较,并采用交叉验证方法来判断模型的准确度和稳健性,计算得到R2、RMSECV、最小偏差和最大偏差。
3 结果与讨论
3.1 法定标准检验
按法定标准检验,29批次国家药品抽检样品均符合规定,合格率100%。对与产品质量密切相关的主要检验项目如粒度、装量和含量测定结果进行统计分析。
3.1.1 粒度
29批次国抽样品粒度测定结果为均小于180 ?m。
3.1.2 装量
29批次国抽样品装量批内5支RSD为0.25%~4.64%,其中标示装量为15与20 g的样品各有2批次装量批内5支RSD大于3.0%,表明A企业需关注样品灌装工艺稳定性,见图2。
3.1.3 含量测定
29批次国抽样品含量结果为4.98%~5.39%,均值为5.26%,(标准规定:含量应为4.50%~5.50%),均无低限投料情况,含量测定箱式图表明从2020年至2022年,样品含量有逐年提高的趋势,见图3。
3.2 探索性研究
3.2.1 安全性
(1)水活度 采用“2.2.1(1)”方法测定29批次国抽样品水活度,测定结果为0.9581~0.9632 ,平均值为0.961,RSD为0.2%,表明磺胺嘧啶锌软膏水活度适宜大部分微生物生长,需加合适的抑菌剂阻止自身及环境微生物的生长繁殖。
(2)抑菌剂含量 采用“2.2.1(2)”方法测定29批次国抽样品和3批次调研收集样品中抑菌剂含量。新建HPLC方法经方法学验证可准确测定软膏中抑菌剂含量,测定结果为:32批次均未检出羟苯甲酯和羟苯丙酯,表明A企业未添加处方外的抑菌剂羟苯甲酯和羟苯丙酯;32批次羟苯乙酯含量为95.4%~131.8%,平均值为102.9%,RSD为11.3%,频数分布图显示其含量呈左偏分布,表明其含量多数小于100%,见图4 ;29批次国抽样品羟苯乙酯含量箱式图显示有5批羟苯乙酯含量在124%~131%之间,超过拟定限度80%~120%上限,合格率为82.8%,提示A企业应关注羟苯乙酯投料量准确性,见图5;由SPSS 25.0软件进行相关性分析,Sig.双尾为0.266>0.05,表明羟苯乙酯含量与样品剩余有效期不相关,表明贮存期间羟苯乙酯较稳定,不易降解;参考欧盟委员会第1004/2014号委员会条例[20]化妆品中羟苯酯类抑菌剂单酯限量为0.4%,建议A企业关注羟苯乙酯添加量的合理性。
(3)抑菌效力 采用“2.2.1(3)”方法测定有代表性的5批次国抽样品和1批次对照样品抑菌效力。结果参照ChP2020四部通则1121抑菌效力检查法[8],5批次国抽样品抑菌效力对细菌达到A级标准,对真菌未达到B级标准,所用抑菌剂0.5%羟苯乙酯的抑菌效力对细菌仅达到B级标准,对真菌未达到B级标准,表明羟苯乙酯未与磺胺嘧啶锌起到协同抑制作用。然而对照样品对细菌和真菌抑菌效力均达到A级标准,其所用抑菌剂为0.3%羟苯甲酯,按磺胺嘧啶锌软膏处方和生产工艺,取磺胺嘧啶锌原料、空白基质与0.3%羟苯甲酯制成混合物,其抑菌效力对细菌达到A级标准,对真菌达到B级标准。提示A企业应关注抑菌剂种类,并根据ChP2020四部通则1121,软膏中抑菌剂的量应为最低有效量的原则,对抑菌效力做進一步研究,选择对真菌抑菌效力强的抑菌剂。
(4)酸碱度 采用“2.2.1(4)”方法测定29批次国抽样品和3批次调研收集样品pH值,结果为32批次样品pH值为6.5~6.9,均值6.7,RSD为1.5%,酸碱度接近中性,对皮肤刺激性较小,表明磺胺嘧啶锌软膏酸碱度适宜;同时此中性条件下,处方中的抑菌剂羟苯乙酯不易降解,有利于样品贮藏期间羟苯乙酯稳定;参考USP现行版磺胺嘧啶银乳膏[21],拟定磺胺嘧啶锌软膏pH值限度为4.0~7.0,29批次国抽样品pH值均在拟定限度范围内,合格率100.0%。
(5)有关物质 采用“2.2.1(5)”方法测定29批次国抽样品、3批次调研收集样品及3批次原料有关物质。结果磺胺嘧啶锌软膏共检出10个杂质,单杂含量小于0.08%,总杂含量小于0.3%;原料检出7个杂质,单杂含量小于0.04%,总杂含量小于0.2%;磺胺嘧啶锌软膏和原料中杂质含量均较低。
(6)杂质谱分析
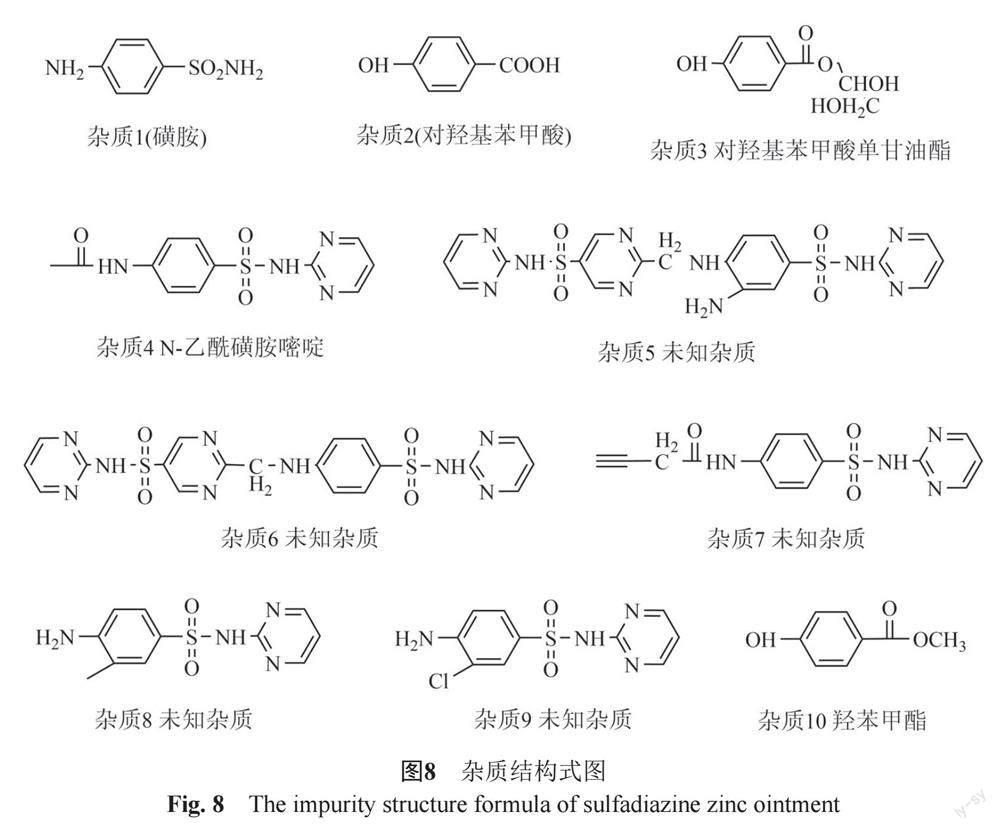
①杂质来源分析 通过对比磺胺嘧啶锌软膏、原料、原料起始物料磺胺嘧啶、辅料羟苯乙酯、空白基质色谱图,见图6,分析磺胺嘧啶锌软膏中检出的10个杂质来源,其中7个杂质,即杂质1、杂质4~9与磺胺嘧啶锌原料及原料起始物料磺胺嘧啶杂质种类相同;2个杂质,即杂质2和杂质10与辅料羟苯乙酯杂质种类相同。
取处方量的羟苯乙酯与甘油充分混匀后按软膏生产工艺加热,比较辅料羟苯乙酯、甘油、羟苯乙酯和甘油混合溶液加热前与加热后色谱图,见图7 ,结果羟苯乙酯与甘油混合后经加热产生杂质3,同时杂质2和杂质10加热后峰面积较加热前略有增大。
通过对比色谱图,分析杂质来源,并对杂质进行归属,见表3,软膏中7个杂质来源于原料,有必要严格控制原料中杂质;总杂含量软膏比原料高0.1%,分析为软膏比原料多检出杂质2、杂质3和杂质10,表明在软膏生产过程中产生此3个杂质,有必要加强软膏生产过程控制,减少杂质产生。
②杂质确证与结构推断 查阅文献资料[22-24],并结合磺胺嘧啶锌原料的合成路线、降解途径、磺胺嘧啶锌软膏的软膏生产工艺及杂质来源分析;采用双三元二维液相色谱—Q Exactive Plus高分辨质谱对检出的10个杂质进行确证与结构推断,确证杂质1为磺胺,杂质2为对羟基苯甲酸,杂质4为N-乙酰磺胺嘧啶;推断杂质3为羟苯乙酯和甘油混合加热后反应产生的对羟基苯甲酸单甘油酯,同时推断杂质5~10结构,结构式见图8,经查阅相关文献[25-27],与常见的遗传毒性警示结构进行比较,本品中检出10种杂质均不含遗传毒性警示结构。
3.2.2 有效性
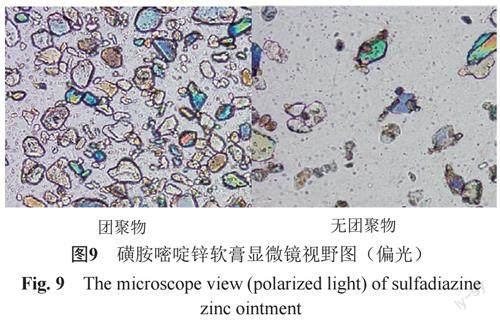
(1)团聚物成分分析 分别挑取同1批次国抽样品中团聚物和无团聚物部分涂布于载玻片上,覆以盖玻片,立即在400倍显微镜下检视,见图9。结果团聚物中布满磺胺嘧啶锌晶体,结合企业调研情况,初步认为团聚物为磺胺嘧啶锌。另采用新建的软膏含量测定HPLC方法,分别取相同称样量的团聚物和无团聚物制备成溶液,比较两种溶液色谱图中磺胺嘧啶峰面积,结果团聚物中磺胺嘧啶峰面积大于无团聚物部分,进一步证明团聚物为磺胺嘧啶锌。
(2)原料粒度分布 采用光散射法测定原料粒度分布,激光粒度仪测定3批次调研收集原料,d(0.9)为28~37 ?m,利于药物吸收;D[3,2]1批为11 ?m,2批为7 ?m,表明原料批次间粒径有差异。采用显微镜法观察该3批次原料粒度,结果3批次中,1批次粒径大的原料粒子分布均匀,2批次粒径小的原料粒子有团聚现象,见图10,提示企业关注原料粒径。
(3)原料晶型 采用红外光谱法测定3批次调研收集原料红外光谱图均与磺胺嘧啶锌对照图谱(光谱集573图)[28]一致,表明为同一晶型。采用粉末X-射线衍射(PXRD)法测定该3批次原料,结果原料衍射峰均为锐峰,表明为结晶型粉末;衍射峰数量和位置均一致,表明为同一晶型。但3批次原料衍射峰强度有差异,其中1批次粒径大的原料衍射峰强度高,2批次粒径小的原料衍射峰强度低,表明原料批次间有差异。
(4)团聚物形成原因 根据原料粒度分布与晶型测定结果,结合企业调研和软膏生产工艺,分析软膏中团聚物形成原因为粒径小的原料投入水相溶解罐后不易分散,打入乳化罐又未充分搅匀,被基质包裹形成团聚物。提示企业关注原料粒径和软膏生产过程控制。目前,企业已通过改善软膏生产过程控制,避免软膏中团聚现象发生。
(5)体外释放试验 采用“2.2.2(5)”中方法对有代表性的14批次国抽样品和1批次对照样品进行体外释放试验,并以取样时间为横坐标,单位面积药物累积释放百分率为纵坐标绘制释放曲线,见图11,结果为6 h累积释放百分率:有团聚物5批次为2.26%/cm2~3.34%/cm2,无团聚物9批次为3.62%/cm2 ~5.62%/cm2,表明团聚物对药物释放有影响,提示企业关注软膏生产过程控制。对照样品6 h累积释放百分率为14.17%/cm2,高于磺胺嘧啶锌软膏,提示企業优化处方设计,提高释放率,改善有效性。
(6)锥入度 采用“2.2.2(6)”中方法测定29批次国抽样品、3批次调研收集样品及1批次对照样品锥入度,结果32批次样品锥入度值为178~212,对照样品为351,表明磺胺嘧啶锌软膏黏稠度高于对照样品,涂布延展性较差,提示企业优化处方设计,降低产品黏稠度。
3.2.3 稳定性
(1)影响因素试验 在高温、高湿及强光照射条件下,软膏的性状无变化,未发现油水分离现象,其粒度、酸碱度、水活度、有关物质、羟苯乙酯和磺胺嘧啶锌含量均无显著变化。
(2)加速试验 在温度30 ℃、相对湿度65%条件下放置3个月,软膏的性状无变化,未发现油水分离现象,其粒度、酸碱度、水活度、有关物质、均匀性、羟苯乙酯和磺胺嘧啶锌含量、锥入度等均无显著变化。
上述影响因素和3个月加速试验结果均表明磺胺嘧啶锌软膏稳定,在阴凉(20 ℃以下)贮藏条件下可以保证药品有效期内质量稳定。
(3)包材阻隔性 国标方法测定软膏管水蒸气透过率为0.00011 g/d,氧气透过率为0.013 cm3/d,推算磺胺嘧啶锌软膏3年有效期内水蒸气透过量为0.12 g;药典方法测定软膏管水蒸气透过量为0.006%;表明A企业所使用的包材(聚乙烯/铝/聚乙烯复合药用软膏管)阻隔性能良好,可防止有效期内样品水分挥发,以保证药品质量稳定。
3.2.4 质量可控性
(1)磺胺嘧啶锌软膏质量标准
①鉴别 现行软膏质量标准鉴别试验,样品前处理方法为加入稀盐酸200 mL使磺胺嘧啶锌溶解,磺胺嘧啶锌浓度约为2.5 mg/mL,再取15 mL(相当于磺胺嘧啶锌37.5 mg)进行后续处理生成磺胺嘧啶沉淀,理论上沉淀物量为33 mg,无法按标准规定的沉淀取样量0.05和0.1 g进行化学鉴别反应,探索性研究发现将稀盐酸加入量减至20 mL,沉淀量显著增加,可满足化学鉴别反应沉淀取样量,现行质量标准鉴别项需修订。
②含量测定 采用“2.2.4(1)”软膏含量测定中新建HPLC法,经方法学验证,方法学各项指标均符合要求,可准确测定磺胺嘧啶锌软膏及原料中磺胺嘧啶锌含量。HPLC法测定29批次国抽样品、3批次调研收集样品含量为4.88%~5.24%(按标示量计算为97.6%~104.8%),现行软膏质量标准为永停滴定法,32批次样品含量为4.98%~5.39%(按标示量计算为99.6%~107.8%)。对2种方法含量测定结果进行比较,永停滴定法由于基质消耗滴定液,比HPLC法平均偏高3%(按标示量计算)。采用SPSS 25.0软件对2种方法含量测定结果进行配对样本t检验,P=0,<0.05,表明HPLC法与永停滴定法含量测定结果有显著性差异。经企业调研,A企业按100%投料,新建HPLC法,低中高3个浓度水平的平均回收率为99.94%,其含量测定结果更接近实际投料量,更能准确反映磺胺嘧啶锌软膏真实含量,现行质量标准方法需修订。
(2)磺胺嘧啶锌质量标准
①有关物质 采用“2.2.4(2)”原料有关物质中新建HPLC法测定3批次调研收集原料有关物质,结果原料检出杂质7个,单杂%小于0.04%,总杂%小于0.2%,杂质含量较低。
②锌含量 采用“2.2.4(2) ”锌含量中方法,经方法学验证,该方法准确度高,专属性强,可有效控制锌含量,结果测定3批次调研收集原料中锌含量为11.3%~11.8%。根据测定结果及磺胺嘧啶锌分子式(C20H18N8O4S2Zn·2H2O),分子量为599.94,Zn分子量为65.38,按磺胺嘧啶锌无水物计算,Zn占比为11.59%,拟定限度为11.0%~12.2%(相当于理论量的95%~105%)。3批次原料锌含量均在拟定限度范围内,表明原料合成时锌完全与磺胺嘧啶结合。
③含量测定 采用原料现行质量标准永停滴定法与新建软膏含量HPLC法同时测定3批次调研收集原料含量,结果2种方法测定3批次原料含量结果基本一致。采用SPSS25.0软件对2种方法含量测定结果进行配对样本t检验,Sig.双尾为0.35>0.05,表明2种方法含量测定结果无显著性差异。分析现行质量标准永停滴定法因不受基质影响,方法专属性好,滴定终点明显,准确度高,无须修订。
(3)近红外建模
①近红外一致性检验模型 采用“2.2.4(3)”中近红外一致性检验模型方法,结果验证用1批次调研收集磺胺嘧啶锌软膏的6张光谱的CI值在5以内,表明为同一品种;1批次对照样品的3张光谱的CI值在45~50之间,表明为不同品种;1批次克霉唑乳膏的3张光谱的CI值在55~60之间,远大于5,亦表明为不同品种。以上验证结果均表明所建近红外一致性检验模型可有效区分磺胺嘧啶锌软膏和非磺胺嘧啶锌软膏。
②近红外定量模型 采用“2.2.4(3)”中近红外定量模型方法,经交叉验证计算得到R2为81.09,RMSECV为0.05,所建立近红外定量模型预测结果与HPLC含量测定结果接近,最小偏差为0.0007,最大偏差为0.12,可用于本品生产过程质量控制。
(4)剂型名称
根据磺胺嘧啶锌软膏处方,基质为O/W乳剂型基质,乳化剂为聚山梨酯80;其生产工艺为水相、油相分别经加热灭菌后再混合乳化、灌封制得,按照中国药典2020年版四部通则0109软膏剂与乳膏剂表述,建议剂型名称修订为乳膏剂。
(5)说明书问题
磺胺嘧啶锌软膏说明书“包装”表述为“铝塑复合管”,实际为“聚乙烯/铝/聚乙烯复合药用软膏管”,包装材质不符合国家食品药品监督管理局第24号令《药品说明书和标签管理规定》[29],建议对说明书中包装材质进行规范化表述。
4 总结
采取法定标准检验结合探索性研究对磺胺嘧啶锌软膏的质量现状进行综合评价。按法定标准检验,29批次国抽样品法定檢验合格率100%,探索性研究合格率82.8%,因此产品总体质量为一般。探索性研究提示磺胺嘧啶锌软膏和原料质量标准有待提高;建议企业优化处方设计,关注原料质量与软膏生产过程控制,从而全面提高产品质量;同时建议将剂型名称修订为乳膏剂,并对说明书中包装材质进行规范化表述。
参 考 文 献
马忠敏, 常东明, 岳苏华, 等. 磺胺嘧啶锌对实验性烧伤的作用[J]. 新乡医学院学报, 1989, (2): 79-82.
杨美华. 磺胺嘧啶锌软膏治疗518例烧伤创面的应用体会[J]. 现代医药卫生, 2006, (14): 2183-2184.
常东明, 马忠敏, 王素琴, 等. 愈合灵(磺胺嘧啶锌)的毒理研究[J]. 新乡医学院学报, 1986, (3): 13-16.
中华人民共和国卫生部药典委员会. 卫生部标准[S]. (1993年版). 北京: 中华人民共和国卫生部药典委员会, 1993: X2-51.
国家药典委员会. 中华人民共和国药典[S]. (2015年版二部). 北京: 中国医药科技出版社, 2015: 1559.
国家药典委员会. 中华人民共和国药典[S]. (2020年版二部). 北京: 中国医药科技出版社, 2020: 1843.
International conference on harmonization of technical requirements for registration of pharmaceuticals for human use (ICH) . pharmaceutical development.Q8[S]. 2005: 1-19.
国家药典委员会. 中华人民共和国药典[S]. (2020年版四部). 北京: 中国医药科技出版社, 2020: 176-177.
USP-NF Online[EB/OL]. [2022-11-29]. https: //doi. usp. org/USPNF/USPNF_M78900_05_01. html.
李少杰, 楊淑先, 王立萍. HPLC测定磺胺嘧啶锌软膏中的有关物质[J]. 华西药学杂志, 2015, 30(5): 615-616.
国家药典委员会. 中华人民共和国药典[S]. (2020年版四部). 北京: 中国医药科技出版社, 2020: 147-148.
国家药典委员会. 中华人民共和国药典[S]. (2020年版四部). 北京: 中国医药科技出版社, 2020: 457-460.
中国食品药品检定研究院. 国家药包材标准[S]. 北京: 中国医药科技出版社, 2015: 263-265.
国家标准化管理委会. 国家标准[S/OL]. GB/T 31355-
2014. https: //std. samr. gov. cn/search/std?q=GB%2FT
31355-2014.
国家标准化管理委会. 国家标准[S/OL]. GB/T 31354-
2014. https: //std. samr. gov. cn/search/std?q=GB%2FT
31354-2014.
国家药典委员会. 中华人民共和国药典[S]. (2020年版四部). 北京: 中国医药科技出版社, 2020: 381-383.
徐桂清, 于刚, 李伟, 等. 磺胺嘧啶锌的HPLC测定[J]. 中国医药工业杂志, 2003, (12): 41-42.
郭振荣, 李利根, 李烽. 重视烧伤后补锌, 促进创面愈合[J]. 中华烧伤杂志, 2001, (4): 202-203.
国家药典委员会. 中华人民共和国药典[S]. (2000年版二部). 北京: 中国医药科技出版社, 2000: 1051.
Official Journal of the European Union. Commission Regulation(EU) No 1004/2014 of 18 September 2014 amending Annex V to Regulation (EC) No 1223/2009 of the European Parliament and of the Council on cosmetic products[EB/OL]. [2014-09-26]. https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32014R1004&qid=1700313709254.
USP-NF Online[EB/OL]. [2022-11-29]. https: //doi. org/10. 31003/USPNF_M78970_01_01.
陈国亮, 李剑, 杨丽娜. 卤代水解法合成对羟基苯甲酸单甘油酯[J]. 应用化工, 2016, 45(6): 1092-1095.
李璐, 廖乃英. UPLC-QTOF-MS鉴定磺胺嘧啶原料药的有关物质[J]. 药物分析杂志, 2019, 39(12): 2148-2156.
汪茂田, 李伟, 戴新志. 磺胺嘧啶锌的结构[J]. 中国药学杂志, 1988, (9): 551.
万君玥, 陈华, 尹婕. 化学药品中杂质的基因毒性评估策略以及相关分析方法研究进展[J]. 药物分析杂志, 2022, 42(4): 557-571.
马磊, 马玉楠, 陈震, 等. 遗传毒性杂质的警示结构[J]. 中国新药杂志, 2014, 23(18): 2106-2111.
ICH办公室. ICH指导原则:M7 Genotoxic Impurities 遗传毒性杂质[EB/OL]. [2014-06-23]. https: //www. cde. org. cn/ichWeb/guideIch/toGuideIch/4/1.
国家药典委员会. 药品红外光谱集[S](第一卷1995). 北京: 化学工业出版社, 1995: 光谱号573.
国家药品监督管理局. 法规文件: 药品说明书和标签管理规定(局令第24号)[EB/OL]. [2006-03-15]. https: //www. nmpa. gov. cn/yaopin/ypfgwj/ypfgbmgzh/20060315010101975. html.

