猪博卡病毒研究进展
余 蕊,张 会,高 艺,孙永科,杨玉艾,张 恒
(1.云南农业大学,云南昆明 650210;2.山东信得科技股份有限公司,山东青岛 266104;3.青岛韦立国际集团,山东青岛 266000)
博卡病毒(bocavirus)是一类重要的人兽共患病病原体,最初发现于20世纪60年代。博卡病毒自发现以来,相继在多种动物中被检出,例如犬[1]、牛等,人类中也有检出[2]。2009年,瑞典研究人员采集患断奶仔猪多系统衰弱综合征(PMWS)病死猪的淋巴结,通过研磨及一系列处理后提取DNA,采用随机多重置换扩增、高通量测序及生物信息学分析方法,最终得到1条1 879 bp的新型细小病毒片段。因其序列与人博卡病毒序列相似,被命名为猪博卡病毒(porcine bocavirus,PBoV),这是PBoV首次进入人们的视线[3]。
近年来,PBoV逐渐在世界各地蔓延开来,常常与猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪圆环病毒2型(porcine circovirus 2,PCV2)等病毒共感染导致猪发病,且感染率逐年升高,给养猪业带来新的挑战[4-6]。此外,在儿童[7]与水貂[8]中也检测到PBoV,其跨物种传播能力引发了新的担忧,可能成为威胁人类健康的新型病原体。目前我国对于PBoV的研究及流行病学监测数据较少,并且相关人员对PBoV的认视也不足,因此养殖人员、兽医、流行病学调查及科研人员全面了解该病原,对于防控该病传播至关重要。本文从病原学、流行病学、致病机制、检测方法及防控手段等5个方面进行综述介绍,以期为我国PBoV研究及其感染防控提供参考。
1 病原学
PBoV属于细小病毒科细小病毒亚科,是博卡病毒属的新成员。博卡病毒为无囊膜病毒,呈二十面体对称,直径为25~30 nm。博卡病毒基因组为不分段的线性单链DNA,长度为4~6 kb,其中PBoV长度约为5 kb,末端有发卡结构[9]。
PBoV基因组含有3个开放阅读框——ORF1、ORF2和ORF3,分别编码4种蛋白,即NS1、VP1/VP2和NP1(图1)。ORF1位于5'端,序列长约1.9 kb,主要参与病毒复制。ORF1包含与滚环复制、解旋酶和ATP酶活性相关的保守基序,编码非结构蛋白NS1。ORF2位于3'端,编码衣壳结构蛋白VP1/VP2,其中VP1长度约为2.1 kb,VP2约为1.6 kb,VP1与VP2的基因组序列重叠在一起。VP1/VP2衣壳结构蛋白是PBoV的主要抗原蛋白,二者的抗原性在很大程度上决定了病毒的抗原性。VP1蛋白独特区(VP1u)中存在钙依赖性磷脂酶A2(PLA2)酶活性基序,增强了衣壳蛋白释放到细胞质中的能力,“HDXXY”基序是催化中心,而保守的“YLGPF”基序是PLA2的Ca2+结合环。VP2蛋白包括8个β折叠、1个αA螺旋、1个DE环和1个HI环,其与病毒衣壳蛋白的组装、稳定性及表面结构有关[10]。VP1和VP2对SeV诱导的IFN-β启动子激活具有显著增强作用,这与人博卡病毒(human bocavirus,HBoV)VP1/VP2的干扰素协同激活作用一致[11-13]。
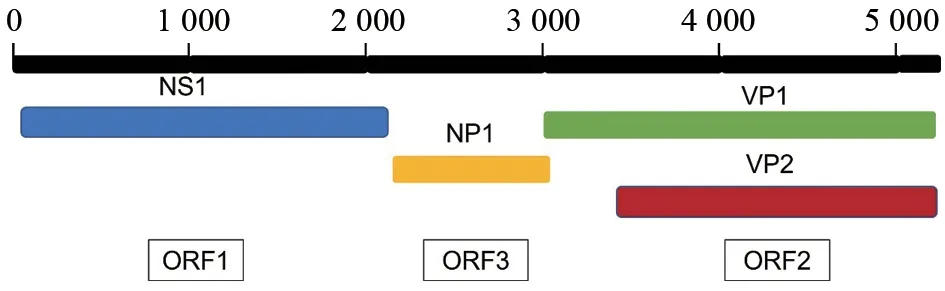
图1 PBoV基因组结构示意图
ORF3位于ORF1与ORF2之间,是博卡病毒属成员的特征序列,编码非结构蛋白NP1[10]。NP1蛋白是一种新的干扰素拮抗蛋白,通过干扰I型干扰素的产生与信号传导来拮抗病毒的先天免疫。I型干扰素系统包括干扰素表达及其信号通路,它提供了强大的抗病毒先天免疫反应[14],其中干扰素的产生由IRF3和NF-κB共同调节,信号传导由ISGF3复合物调节。NP1蛋白抑制先天免疫反应的过程:阻断SeV诱导的IFN-β启动子激活且呈剂量依赖性,并显著抑制SeV诱导的IFN-α、IFN-β、ISG15和ISG56 mRNA的表达;在不影响IRF3表达、磷酸化与核转移的情况下,竞争性结合IRF3的DNA结合域(DBD),阻止IRF3 DBD与IFN-β启动子结合,从而负调控IFN-β的产生。除此之外,NP1蛋白通过与IRF9的DNA结合域(DBD)结合来阻断ISGF3 DNA结合活性,以此拮抗IFN信号传导,表现出广谱抑制先天免疫反应的能力[13,15]。进一步的研究[16]发现:NP1蛋白在其N端和C端区域包含两个功能独立的域,其N端区域通过靶向IRF3和IRF9的下游来负调节IFN-β和ISRE的启动子活性;其C端区域通过增强p65的磷酸化和IκBα的降解来诱导NF-κB活化,从而促进促炎细胞因子表达。NP1的核定位使其能够更有效地诱导NF-κB活化。
目前PBoV的分型依据尚未确定。一些学者认为VP1可以在很大程度上影响病毒的组织嗜性和致病性,因此应以编码VP1的基因序列相似性高低作为分类依据[17]。常用的分型方法有两种:依据病毒VP1和NS1编码基因序列进行基因型划分,均可分为3个基因群(G1、G2、G3)[18-19],但这两种分型方法在G3型分群上还存在一些差异[20]。选取NCBI上发布的比较完整的PBoV基因序列,截取VP1蛋白基因,使用软件MEGA-X10.1中的邻接法构建系统进化树(图2)。相对于G1群,G2群和G3群处于同一个进化支上,说明G2群和G3群可能由同一基因群进化而来,经过重组进化后差异较大,最终分为两个不同的基因群。G2、G3群与G1群在进化上相距较远,可能来自两个不同的祖先。
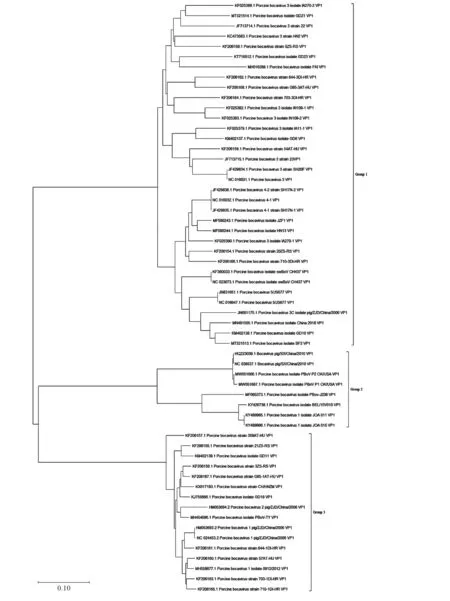
图2 PBoV VP1蛋白编码基因进化树构建
2 流行病学
自2009年PBoV首次在瑞典被发现以来,世界各国不仅在现有猪群中检测PBoV,甚至回顾了之前采集的样本。在回溯样本时,中国[9]与克罗地亚[21]都在2006年采集的样本中检测出PBoV。此外,在罗马尼亚2006—2007年和2010—2011年从野猪种群中收集的样本中也检测到PBoV,并且样本中的感染率从9.14%(43/470)增加到17.74%(66/372)[22]。这提示2009年PBoV在瑞典被首次报道前,它就已经存在于猪群中。
目前多种PBoV毒株在仔猪多系统衰竭综合征、呼吸道综合征及腹泻病例中均被发现[23-24];PBoV在临床样品中与RNA病毒,例如猪繁殖与呼吸综合征病毒(PRRSV)、PCV2、猪瘟病毒(CSFV)等具有较普遍的共感染现象[4],可通过呼吸道、消化道和血液水平传播,也可通过胎盘垂直传播[25];目前PBoV已在世界范围内迅速蔓延,包括中国、北爱尔兰[9]、美国[26]、斯洛文尼亚、克罗地亚[27]、泰国[28]、捷克、斯洛伐克[29]、德国[30]、乌干达、肯尼亚[31],比利时[5]、马来西亚[32]等国家。PBoV在我国出现后,其流行率有升高趋势。2010年,PBoV在我国仔猪粪便样本中的检出率为12.59%[9]。2018年,对来自广东省和吉林省的猪群样本进行检测发现,PBoV检出率为18.1%(84/463)[33]。2021年,我国中部地区腹泻仔猪中检测到PBoV感染为74.73%(210/281)[6]。从GenBank中发布的国内外PBoV毒株序列信息可见(表1),自2010年我国发现PBoV以来,PBoV在我国的流行毒株种类不断增加,但主要流行G1群。

表1 国内外PBoV分离情况
PBoV的流行可能与猪龄相关。Zhang等[4]在腹泻猪肠道病毒感染的发生与调查研究中发现,育肥猪中PBoV的感染率高于其他年龄猪。Mohan等[32]在研究中发现,PBoV流行率在断奶仔猪和育肥猪中比新生仔猪高。同样,在来自罗马尼亚的样本中,6~12月龄的猪PBoV感染率(77.06%,84/109)比12~36月龄(22.94%,25/109)高[22]。据报道[21,29],在捷克和斯洛伐克,断奶仔猪比其他年龄组的猪更容易感染PBoV。因此,有研究人员提出一个假设,母源抗体可能在仔猪预防PBoV感染中起重要作用[29]。
3 致病机制
目前PBoV的确切致病机制尚不清楚。它难以分离培养,且常与其他猪肠道病毒共存,临床上最常见共感染病毒为PCV-2,在PCV-2感染猪群中PBoV检出率为83.8%,同时在健康猪中也可检测到PBoV,因此有研究人员推测PBoV可能不直接导致猪发病,而是作为一种辅助病毒存在[19,34,41]。PBoV在多种组织中都被检测到,例如淋巴结[3]、胃肠道[9]、扁桃体[28]、脑组织[30]、肺脏、肾脏、肝脏、脾脏[31]等,说明PBoV具有广泛的组织噬性。PBoV具有免疫抑制作用,广谱干扰I型干扰素的产生以及干扰素的信号转导。此外,PBoV通过激活NF-κB途径来促进炎症反应[13,15-16]。
临床上PBoV常与多种其他猪肠道病原混合感染,呈现腹泻和呼吸系统疾病症状[23,40]。仔猪感染PBoV后主要表现为精神沉郁、食欲下降,经剖检可见,胃肠黏膜充血,肠管肿胀,肠壁变薄,胃肠内容物有未消化乳凝块。组织病理学变化主要出现在空肠、回肠和十二指肠,主要表现为绒毛萎缩,有时出现绒毛肠上皮细胞轻度扁平和坏死,退化的肠细胞脱落进入管腔,淋巴细胞和中性粒细胞浸润到固有层,伴有凋亡碎片和血管充血[4,40]。PBoV在病猪的淋巴结、脾脏和扁桃体中的检出率最高,表明这些器官可能是病毒的主要侵害部位[32]。2016年,Pfankuche等[30]研究发现,在患脑脊髓炎的猪中仅检测到了PBoV。该结果与2013年Mori等[42]在脑炎病人的脑脊液中检出HBoV的报道十分相似。由此推测,当PBoV单独感染时可能会导致猪的脑脊髓炎。
4 诊断与检测
4.1 病原分离与鉴定
细胞培养分离是常用的病毒分离方法。自2009年PBoV首次被检出以来,科研人员尝试在各种体外细胞系中分离纯化该病毒。Zeng等[36]2011年尝试在常用体外细胞系——猪肾细胞(PK-15)、猪睾丸细胞(ST)、猪肺泡巨噬细胞(PAM)、猴肾细胞(MARC-145)和人胚胎肾上皮细胞(HEK293T)中分离纯化PBoV,均未检测到病毒生长。目前仅McKillen等[41]使用猪原代肾细胞培养4代后发现,细胞出现圆形病变,经RT-PCR与IFA均证实PBoV被成功繁殖,成功构建了PBoV原代细胞培养系统。
4.2 分子生物学方法
分子生物学诊断的主要技术有核酸分子杂交、聚合酶链式反应和生物芯片技术。PCR是PBoV的主要检测方法,相较于其他检测方法,其灵敏度更高,检测速度更快。朱小甫等[43]针对VP1、VP2基因建立了检测PBoV-1的nPCR方法,该方法检测下限降低至4.742×10-2ng/μL,较其他研究[44]的灵敏度有所提高。TaqMan探针法qPCR已通过靶向VP1基因用于PBoV-2的检测和定量,无需PCR后的检测程序即可实时检测病毒载量[33]。师乾凯等[45]参照GenBank登录的PBoVNP1基因和PEDVM基因保守序列,建立了能够同时快速定量检测PBoV G1基因群和PEDV的双重TaqMan荧光定量PCR方法,对临床上两者共感染病例的流行病学调查具有重要意义。
4.3 免疫学方法
免疫学诊断的主要技术有凝集试验、沉淀反应、补体结合试验、中和反应及免疫标记技术。常规的凝集试验、中和反应等方法因PBoV不能在体外细胞系中分离纯化,尚无应用案例。目前间接ELISA是PBoV的常用检测手段之一,即通过抗原抗体的特异性结合,使用荧光抗体检测相应抗原。该方法对实验人员的技术要求更高,灵敏度高于细胞培养分离法,但低于分子生物学方法,特异性相较其他两种方法更强,目前尚无商品化的诊断试剂盒面世。张晶[46]用重组VP1蛋白作为包被抗原,初步建立PBoV间接ELISA抗体检测方法,其与Western blot结果符合率为81.25%,批内和批间重复试验变异系数均小于10%。Shi等[47]构建了基于PBoV重组NP1蛋白的间接ELISA方法。该方法针对PBoV G1群检测的准确率高,重复性好,且与PEDV、猪传染性胃肠炎病毒(transmissible gastroenteritis of swine,TGEV)、PCV2、PPV、PRRSV的抗血清均无交叉反应。
5 防控手段
目前还没有关于PBoV疫苗研发的相关报道。张韬等[48]利用原核表达系统大量表达了 VP1 蛋白,成功制备了针对PBoV VP1蛋白的兔多克隆抗体,这给亚单位疫苗的研发工作带来了突破性进展。由于PBoV在临床上的共感染现象十分严重,目前还没有针对该病的特效药。因此,在生猪养殖中需要加强饲养管理,注意生物安全,采取科学的免疫预防措施,重视保健防疫措施。常用防控手段包括:从健康猪群中引种,坚持全进全出的管理模式;按规定程序接种CSFV、伪狂犬病病毒、细小病毒等常用疫苗;在饲料或饮水中添加一些保健预防药物,例如柴胡、金银花等中兽药制剂。
6 结语
PBoV的相关基础研究较少。该病毒在国内外的检出率逐年升高,临床上共感染现象十分严重,难以在体外细胞系中分离鉴定及纯化,目前致病机制尚未明确,疫苗研发也尚未成功。最近PBoV突破物种屏障感染人类与水貂,给公共卫生带来新的挑战。深入了解PBoV病原学特点,特别是对其致病机制进行深入研究,对生猪养殖及公共卫生安全具有重要意义。

