右美托咪定联合罗哌卡因行连续性前锯肌平面阻滞在乳腺癌改良根治术术后镇痛的效果
陈宏博,金资源,郑艳雅,吴艳琴
温州市人民医院麻醉科,浙江温州 325027
2018 年全球癌症统计数据显示,全球新发1810万癌症病例中,女性乳腺癌高达210 万,是癌症死亡的主要原因,严重威胁女性生命健康[1]。乳腺癌改良根治术是乳腺癌外科治疗的标准术式,该手术方式切除范围广、创面大,术后患者疼痛明显。前锯肌平面(serratus anterior plane,SAP)阻滞是一种较新的区域阻滞技术,因SAP 位置表浅,操作相对简单,并发症较少,能为前外侧胸壁提供良好的镇痛效果,可用于乳腺癌手术后镇痛[2]。但SAP 单次阻滞时间仅为5~7h,不能满足术后长时间镇痛需求[3]。因此,有学者提出连续性SAP 阻滞以延长阻滞时间[4]。右美托咪定是一种新型的α2受体激动剂,研究发现右美托咪定联合局部麻醉药用于神经阻滞时,可增强后者的作用效果,延长其神经阻滞的时间[5-6]。本研究拟探讨右美托咪定联合罗哌卡因行连续性SAP 阻滞在乳腺癌改良根治术术后镇痛的效果,现报道如下。
1 资料和方法
1.1 研究对象
选取2020 年7 月至2022 年6 月于温州市人民医院行全身麻醉下单侧乳腺癌改良根治术的40 例患者为研究对象,年龄28~69 岁,身高145~170cm,体质量 45~80kg,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅱ级。排除既往有乳腺癌手术史、术前接受化疗、有右美托咪定禁忌证、严重心肺疾病、神经阻滞穿刺相关禁忌证及无法配合的患者。根据随机数字表法将患者分为Con 组(罗哌卡因+生理盐水)和Dex 组(罗哌卡因+右美托咪定),每组各20 例。本研究经温州市人民医院伦理委员会批准(伦理审批号:2020-231),所有患者均签署知情同意书。
1.2 麻醉方法
所有患者术前禁食6h、禁饮2h,入室后监测生命体征。麻醉诱导前行患侧SAP 置管。患者取侧卧位,患侧朝上,常规消毒铺巾,使用线阵超声探头(10~12MHz)定位于腋中线第5 肋骨水平,超声图像由外向内依次识别背阔肌、前锯肌及肋骨,采用平面内进针技术,使用20G 留置套管针由肋弓朝头端方向进针,当针尖到达前锯肌浅层时,注入生理盐水3~5ml,超声图像见液性分离暗区后,留置套管并予以固定。SAP 置管均由同一位资深麻醉医生进行。所有患者行统一麻醉诱导方案:丙泊酚1.5~2.5mg/kg、芬太尼4μg/kg、罗库溴铵0.8mg/kg,待药物完全起效后行气管插管。全身麻醉维持采用:丙泊酚4~8mg/(kg·h)、瑞芬太尼4~8μg/(kg·h)并复合0.6~1MAC 七氟烷维持麻醉,间断给予罗库溴铵0.15mg/kg 维持肌松。切皮前给予酮咯酸氨丁三醇30mg,术毕给予托烷司琼2~3mg 预防恶心呕吐。
1.3 连续性SAP 阻滞给药方案
手术结束麻醉拔管前使用超声再次确认留置套管位置,Con 组患者给予0.25%罗哌卡因(注册证号:H20140764,生产单位:AstraZeneca AB,规格10ml:75mg)30ml 负荷剂量后,连接患者自控镇痛(patient controlled analgesia,PCA)泵,配方为0.125%罗哌卡因250ml,输注背景量为5ml/h,PCA量为5ml,锁定时间45min;Dex 组患者给予0.25%罗哌卡因30ml 并复合1μg/kg 右美托咪定(批准文号:国药准字H20090248,生产单位:江苏恒瑞医药股份有限公司,规格2ml:200μg)负荷剂量,镇痛泵配方为0.125%罗哌卡因复合10μg/kg 右美托咪定共250ml,输注背景量为5ml/h,PCA 量为5ml,锁定时间45min。镇痛泵共使用48h。患者完全清醒后,采用针刺法测定神经阻滞效果,将成功阻滞的患者纳入研究。回病房后,患者数字分级评估量表(numerical rating scale,NRS)评分≥4 分时自行按压PCA,按压15min 后疼痛仍不能缓解时,静脉给予羟考酮2mg,每隔5min 可重复给药,直至NRS≤3 分。
1.4 观察指标
记录术后8h、12h、24h 及48h 患者的静态及动态NRS 评分;记录术后8h、12h、24h 及48h 患者的Ramsay 镇静评分(1 分:焦虑、烦躁不安;2 分:清醒配合,安静合作;3 分:嗜睡,对指令有反应;4 分:浅睡眠,对强刺激反应敏捷;5 分:睡眠,对强刺激反应敏捷;6 分:深睡眠,呼唤不醒);记录术后48h 羟考酮消耗量;记录各种不良反应,包括恶心呕吐、头晕、口干、心动过缓(心率<50 次/min)等;记录SAP 阻滞相关并发症,如出血、局部麻醉药中毒等。
1.5 统计学方法
采用SPSS 24.0 统计软件对数据进行分析处理。正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的一般资料比较
两组患者的一般资料比较,差异均无统计学意义(P>0.05),见表1。

表1 两组患者的一般资料比较
2.2 两组患者术后不同时点的NRS 评分比较
Dex 组患者不同时点的静态及动态NRS 评分均显著低于Con 组(P<0.05),见表2。

表2 两组患者术后不同时点的NRS 评分比较[M(Q1,Q3),分]
2.3 两组患者术后不同时点的Ramsay 镇静评分及羟考酮用量比较
Dex 组患者术后8h、12h 及24h 的Ramsay 镇静评分显著高于Con 组(P<0.05)。Dex 组患者术后羟考酮用量显著低于Con 组(P<0.05),见表3。
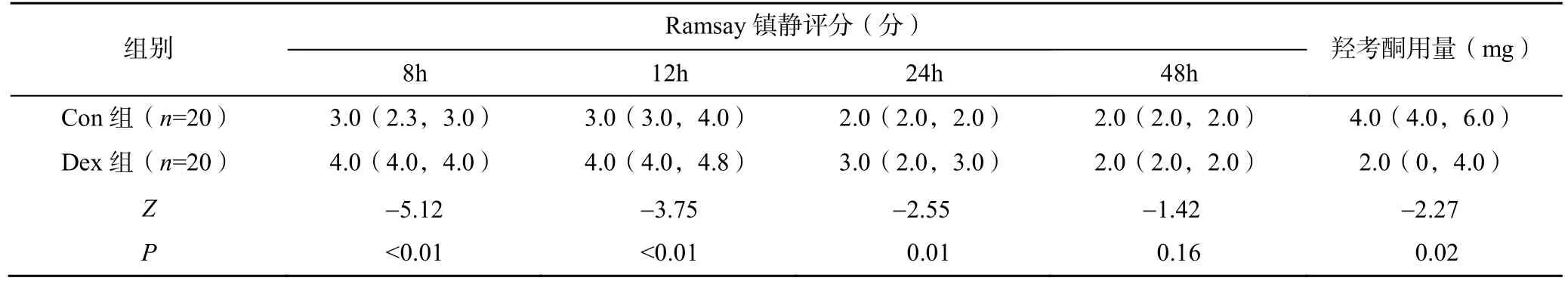
表3 两组患者术后不同时点的Ramsay 镇静评分及羟考酮用量比较[M(Q1,Q3)]
2.4 两组患者的术后不良反应及并发症比较
两组患者术后均未发生出血、局部麻醉药中毒等与SAP 阻滞相关的并发症。Dex 组患者的口干发生率显著高于Con 组(P<0.05),见表4。
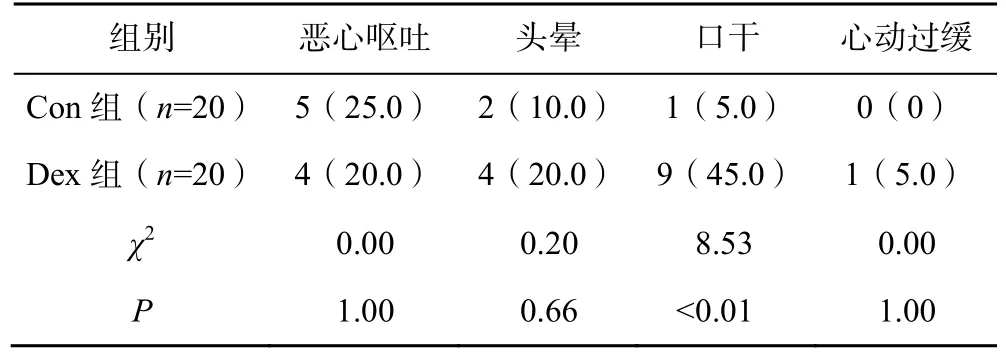
表4 两组患者的术后不良反应比较[n(%)]
3 讨论
乳腺癌是女性最常见的恶性肿瘤,手术治疗是新发乳腺癌最基本的手段[7]。研究显示40%的乳腺癌患者术后会经历严重的急性疼痛[8],且高达60%的患者出现术后慢性疼痛[9],因此乳腺癌术后疼痛管理显得尤为重要。临床上常用静脉注射阿片类药物、胸段硬膜外镇痛及胸椎旁神经阻滞来缓解术后疼痛[8]。但静脉使用阿片类药物会带来许多的不良反应,如呼吸抑制、恶心呕吐等。胸段硬膜外镇痛操作难度大,相对禁忌证及并发症较多,操作期间容易损伤神经,阻滞期间更容易出现低血压等不良反应[10]。胸椎旁神经阻滞技术难度大,有较高的失败率,且同样并发症较多,常见的如神经损伤、低血压等[11]。
SAP 阻滞是Blanco 等[2]提出的一种新型前胸壁区域阻滞技术。该技术是在超声引导下,将局部麻醉药注入到前锯肌表面或深面间隙,以阻滞胸部肋间神经皮支、胸背神经、胸长神经等,从而达到镇痛效果。Blanco 等[2]在4 位女性志愿者腋中线水平进行SAP 阻滞,并通过脂肪抑制磁共振成像和三维重建技术来观察局部麻醉药在SAP 的分布情况,发现T2~T9水平皮肤出现麻木感,且能缓解疼痛。由于单次阻滞时间较短,Xiao 等[12]研究连续性SAP 阻滞在乳腺癌患者术后早期疼痛与恢复的有效性。结果发现,与单次SAP 阻滞+PCA 组相比,术后连续性SAP 阻滞组患者术后疼痛评分降低且患者恢复质量较高。但该研究结果也显示,连续性SAP 阻滞组患者术后8~24h 的疼痛评分仍>3 分。因此,本研究在此基础上,同时使用佐剂联合局部麻醉药,以期达到更佳的术后镇痛效果。
右美托咪定是一种G 蛋白耦联的高选择性α2受体激动剂,其可增强局部麻醉药在神经阻滞中的作用。最新研究表明,区域阻滞中添加右美托咪定作为佐剂可有效应用于乳腺癌手术患者的术后镇痛。Bakr 等[13]研究右美托咪定联合改良胸神经阻滞对乳腺癌改良根治术患者术后疼痛与应激反应的影响,结果发现与单纯注射布比卡因的对照组相比,联合注射右美托咪定组患者的镇痛效果更好,应激反应更轻微。Hefni 等[14]同样发现右美托咪定作为佐剂行胸神经阻滞比使用氯胺酮作为佐剂更有效地控制乳腺癌术后疼痛。本研究Dex 组患者所使用的右美托咪定剂量为1μg/kg,这也是其他相关研究[14-16]所采用的剂量。
本研究结果显示,Dex 组患者在术后各时点的静态及动态NRS 评分均降低,且术后48h 阿片类药物消耗量降低,这与上述研究结果相似。究其原因,可能与右美托咪定通过收缩注射部位血管延缓局部麻醉药吸收、减少去甲肾上腺素分泌从而抗交感反应、抗炎症反应、诱导抑制性反馈回路等相关[17]。另有研究显示,术后持续静脉输注右美托咪定可产生足够的镇静水平,这种作用可为患者带来舒适的术后体验[18]。本研究发现,术后24h 内Dex 组患者的镇静评分增加,这可能与右美托咪定在局部吸收入血、产生中枢镇静效果有关。
恶心呕吐是乳腺癌手术常见并发症,最新研究显示右美托咪定通过减少对阿片类药物的需求减少术后恶心呕吐的发生[19]。尽管本研究结果显示,Dex组患者术后48h 阿片药物消耗量较低,但两组患者的术后恶心呕吐发生率并无明显差异,这可能与两组患者的术后阿片药物需求都较少有关。本研究采取超声引导下SAP 置管,安全性高,两组患者均未出现与阻滞相关的并发症。另外,本研究发现Dex组患者口干发生率较高,这也是右美托咪定联合局部麻醉药使用时较常发生的不良反应[20],具体机制不详,可能与右美托咪定吸收入血、激动α2受体、引起水盐排泄增多致使唾液分泌减少有关。
综上所述,右美托咪定联合罗哌卡因可增强连续性SAP 阻滞在乳腺癌改良根治术患者的术后镇痛效果,减少术后阿片类药物用量,且无明显不良反应。

