α-烯醇化酶1 对非小细胞肺癌侵袭转移的影响
赵心宇,王恩琴,卢韬,张丽红
1.绍兴文理学院医学院,浙江绍兴 312000;2.绍兴市人民医院医学检验科,浙江绍兴 312000
最新癌症统计报告显示,肺癌是全球癌症死亡的最主要原因,每天有超过350 人死于肺癌,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占85%[1]。NSCLC 恶性程度高、进展快,早期缺乏典型的临床症状,一经发现大多为中晚期,治疗手段和疗效均有限。我国NSCLC 患者的5 年生存率仅为19.7%[2],因此,研究NSCLC 侵袭转移的相关分子机制,对发现新的治疗靶点,改善患者预后具有重要意义。α-烯醇化酶1(alpha-enolase 1,ENO1)是烯醇化酶的3 种亚型之一,属于糖酵解过程中重要的限速酶,能够催化2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸。近年来多个研究发现ENO1 在多种类型肿瘤的发生、发展中均具有重要作用。既往研究显示在肺癌患者的癌组织和外周血中,ENO1 表达升高,且对肺癌患者早期诊断具有一定价值[3],但ENO1 对NSCLC 的生物学功能有何影响尚不明确。本研究旨在探讨ENO1 对NSCLC 侵袭转移和增殖的作用,现报道如下。
1 材料与方法
1.1 材料
人NSCLC细胞株A549、H460(中国科学院细胞库,上海);ENO1、GAPDH单克隆抗体及抗兔抗体(Abcam公司,美国);RIPA蛋白裂解液、BCA试剂盒(博士德生物工程有限公司,武汉);ENO1-小干扰RNA(small interfering RNA,siRNA)(锐博生物科技有限公司,广州);Lipo6000TM转染试剂、CCK-8试剂盒(碧云天生物技术有限公司,上海);ENO1、内参GAPDH引物(生工生物股份有限公司,上海);One Step SYBR RT-qPCR Kit(Takara公司,日本);SDS-PAGE凝胶制备试剂盒、PMSF(北京索莱宝生物科技有限公司);Biolonase核酸酶(拜朗生物科技有限公司,上海);蛋白Marker(Invitrogen公司,美国);Transwell小室(Corning公司,美国)。
1.2 生物信息学分析
利用TCGA 数据库(https://gdc-portal.nci.nih.gov/)分析ENO1在肺腺癌和肺鳞癌中的表达差异及与患者肿瘤分期之间的关系;Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)用于分析肺腺癌和肺鳞癌中ENO1表达水平对患者生存率的影响;利用GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中的GSE30219数据集分析272 例NSCLC患者的ENO1相对表达量,探讨ENO1与NSCLC临床病理指标的相关性。
1.3 细胞培养和转染
将H460、A549细胞培养于含10%胎牛血清的DMEM培养基,培养条件为37℃、5%CO2的湿润培养箱;当细胞处于对数生长期时接种于6孔板中,24h后细胞融合度达70%~90%,利用Lipo6000TM转染试剂瞬时转染。实验分为实验组(siRNA干扰)及对照组。
1.4 实时定量聚合酶链反应
利用RNA提取试剂盒提取上述转染24h后细胞的全部RNA,实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)一步法验证转染效率。
1.5 蛋白质印迹实验
提取转染48h后的A549及H460细胞总蛋白,BCA试剂盒检测蛋白浓度,煮沸变性后进行聚丙烯酰胺凝胶电泳,将蛋白湿转至聚偏二氟乙烯膜上,5%脱脂牛奶室温封闭2h,加入一抗(ENO1、GAPDH)后4℃孵育过夜,加入二抗室温孵育2h,ECL显色后曝光测试。
1.6 CCK-8 实验
收集各组细胞并按2×104个/孔(100μl)的密度接种至96孔板中,分别在铺板后24h、48h、72h,向各孔加入10μl CCK-8检测液,继续培养2h,酶标仪检测各孔450nm吸光度(A450)。
1.7 划痕实验
取对数期细胞均匀铺在6孔板中,进行转染,转染结束待细胞生长密度至90%左右,用10μl无菌移液枪枪头在6孔板中划十字划痕,磷酸盐缓冲液清洗3次,换用无血清培养基培养。分别在0h、24h、48h镜下观察划痕的改变情况并拍照记录。
1.8 Transwell 侵袭实验
用不含胎牛血清的DMEM培养基以1 ∶8稀释Matrigel胶基质,将Transwell小室置于24孔板中,取50μl稀释胶加至小室上室面,37℃孵育3h。取各组对数生长期细胞,调整细胞密度为1.5×105/L,每孔加入100μl细胞悬液至Transwell上室,下室加入含10%胎牛血清的DMEM培养基。常规培养48h后,用4%多聚甲醛固定、结晶紫染液染色,200倍显微镜视野下随机选取5个视野拍照,Image J软件进行细胞计数并分析。
1.9 统计学方法
应用SPSS 19.0软件进行统计学分析。计数资料用例数(百分率)[n(%)]进行描述,组间比较采用χ2检验,计量资料以中位数(四分位数间距)M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学数据库分析
2.1.1 ENO1在NSCLC的表达及其与TNM分期的关系从TCGA数据库得到肺鳞癌(502例癌组织及49例正常组织)和肺腺癌(535例癌组织和59例正常组织)中ENO1的表达量,发现与正常组织相比,ENO1在肺鳞癌及肺腺癌中的表达均显著升高(P<0.001),见图1A、F。肺鳞癌中ENO1表达水平与分期无关。Ⅱ~Ⅳ期肺腺癌中ENO1 的表达水平显著高于Ⅰ期(P<0.001),见图1B,N1~N3期肺腺癌中ENO1的表达水平显著高于N0期(P<0.001),见图1D。

图1 TCGA数据库中ENO1在NSCLC中的表达
2.1.2 数据库分析ENO1与NSCLC患者预后的关系利用Kaplan-Meier Plotter数据库探索ENO1表达水平与患者总生存之间的关系,结果显示无论是肺腺癌还是肺鳞癌,ENO1的表达水平越高,患者预后越差(P<0.05),见图2。
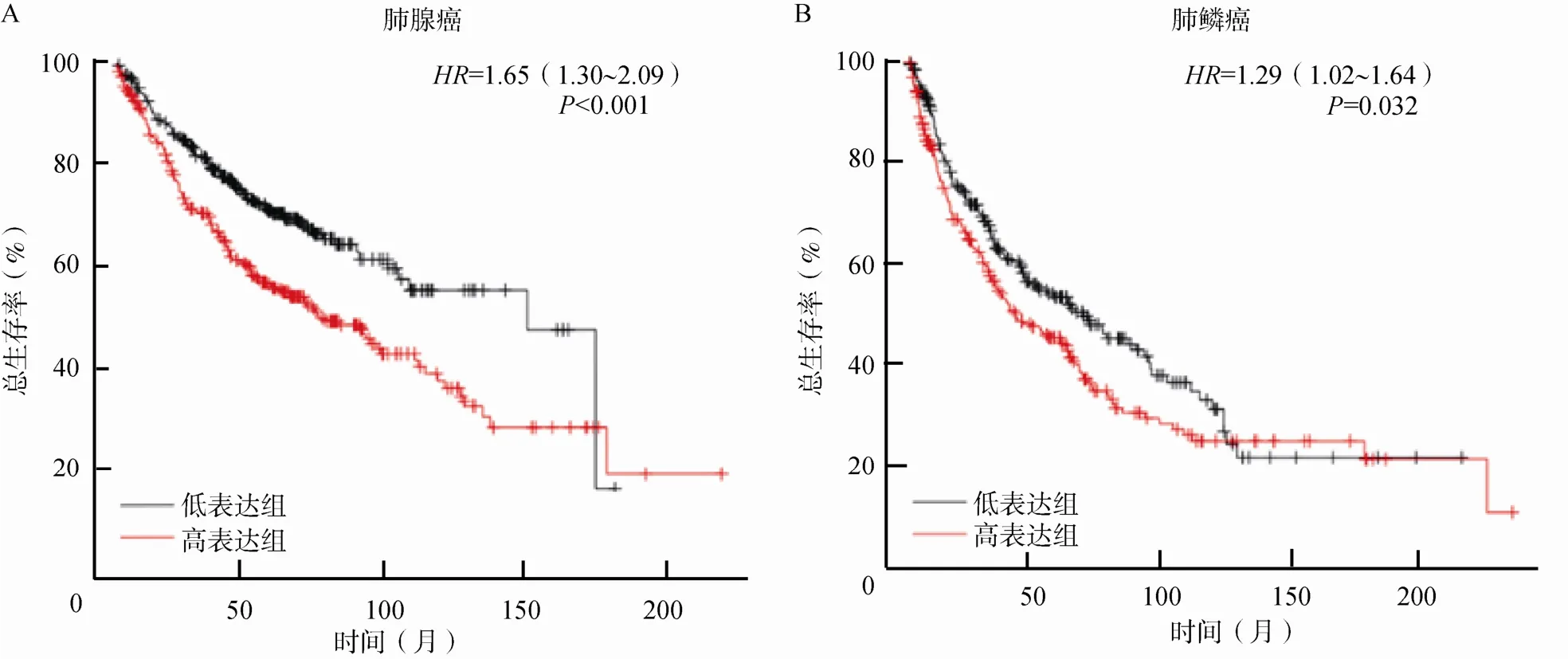
图2 ENO1表达水平与肺腺癌、肺鳞癌患者的预后关系
2.1.3 数据库分析ENO1与NSCLC患者临床特征的关系 分析GEO数据库中272例NSCLC患者的临床资料,结果显示,ENO1表达水平与患者组织学分型及是否复发显著相关(P<0.001),与患者的TNM分期、年龄、性别及是否复发无相关性(P>0.05),见表1。

表1 ENO1 与NSCLC 患者临床特征的相关性(例)
2.2 干扰ENO1 表达效果验证
应用RT-qPCR和蛋白质印迹法验证ENO1干扰效果,结果显示A549、H460细胞转染si-ENO1后,mRNA和蛋白相对表达量均低于对照组(P<0.001),见图3。

图3 siRNA 干扰ENO1 效果验证
2.3 干扰ENO1 表达对NSCLC 细胞增殖能力的影响
CCK-8 实验结果显示,A549、H460 细胞经转染后,48h 及72h 的OD 值均显著低于对照组(P<0.05),见图4。
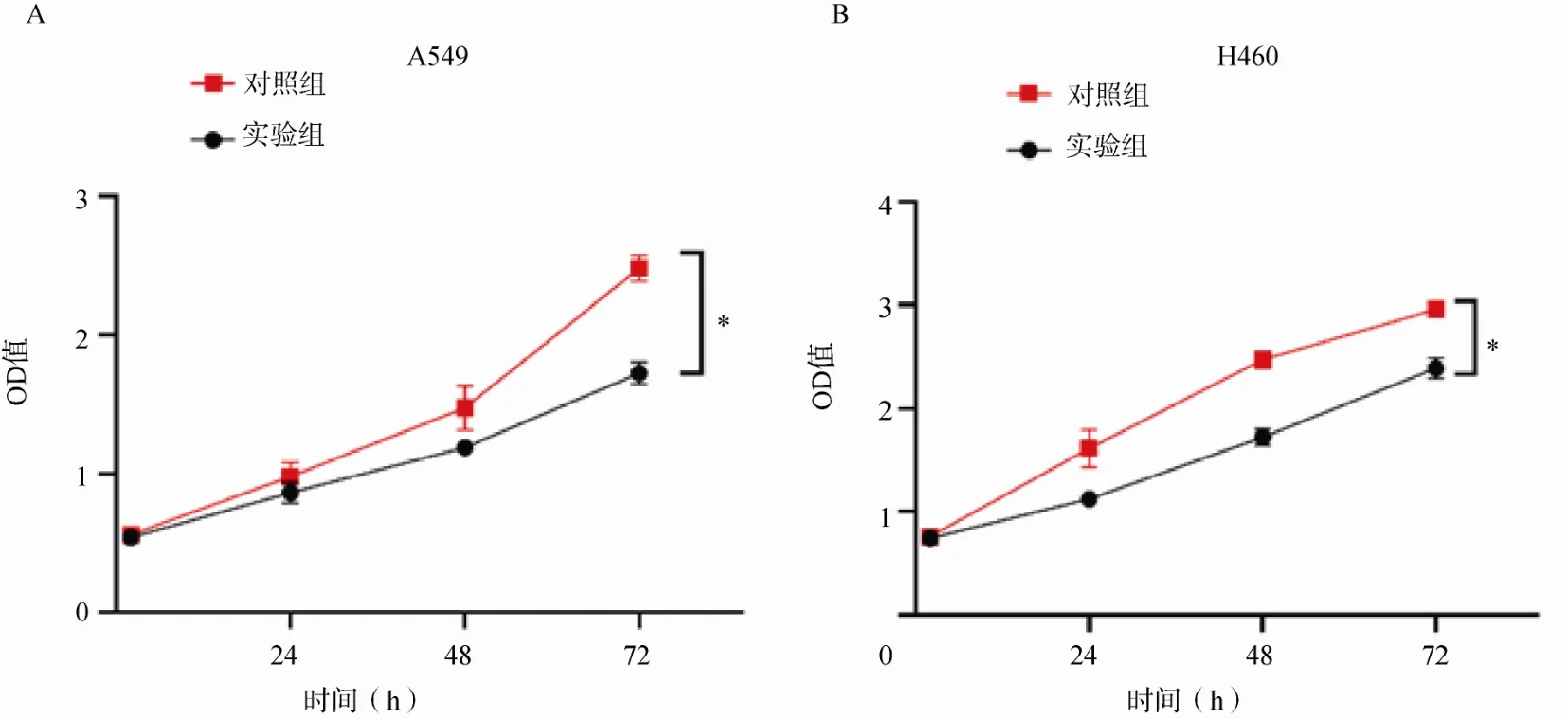
图4 CCK-8 实验检测细胞增殖能力
2.4 干扰ENO1 表达对NSCLC 细胞迁移能力的影响
划痕实验发现,与对照组相比,干扰ENO1 表达后A549 及H460 细胞迁移能力均减弱(P<0.05),见图5。

图5 划痕实验检测细胞迁移能力(×100)
2.5 干扰ENO1 表达对NSCLC 细胞侵袭能力的影响
Transwell 实验结果显示,与对照组相比,干扰ENO1 表达后A549 及H460 细胞体外侵袭能力均减弱(P<0.05),见图6。

图6 Transwell 实验检测细胞侵袭能力
3 讨论
ENO1 又称为2-磷酸-D-甘油水解酶,主要存在于细胞膜和细胞质中,具有催化糖酵解过程、维持线粒体膜稳定性、调节信号通路、促进纤溶酶形成等多种生物学功能[4-7]。ENO1 能够促使恶性肿瘤细胞发生Warburg 效应,使其通过有氧糖酵解途径利用葡萄糖,同时降低线粒体内的有氧磷酸化,让肿瘤细胞实现无限增殖[8-10]。此外,定位于细胞膜表面的ENO1 能够结合并活化纤溶酶原,使肿瘤细胞发生侵袭转移;还可增强单核巨噬细胞的浸润能力,其机制可能是通过Notch 信号通路进而控制c-myc 癌蛋白的表达,参与肿瘤形成[11]。研究表明,ENO1 的表达水平与多种恶性肿瘤的预后显著相关[12-13]。Jiang 等[14]发现外泌体来源的ENO1 可通过上调整合素α6β4 的表达,实现FAK/Src-p38MAPK 途径的激活从而促进肝细胞癌的生长和转移。而在胃癌细胞中,ENO1 主要通过调节Akt 信号通路促进肿瘤的增殖和转移[15]。此外,在乳腺癌、膀胱癌、大肠癌中均发现ENO1 能够促进肿瘤细胞的增殖、侵袭和迁移[12,16-17]。课题组前期研究显示,ENO1 在肝癌组织中高表达,且具有促进肝癌细胞侵袭转移的作用[18]。这些结果表明ENO1 在肿瘤发生发展中具有重要作用。
本研究通过生物信息学数据库分析,发现ENO1在NSCLC 组织中高表达,TNM 分期结果显示ENO1在肺腺癌中与患者分期有关,且仅与淋巴结转移有关,ENO1 的高表达与肺腺癌及肺鳞癌患者的预后不良有关,ENO1 的表达水平与患者组织学分型及是否复发显著相关。但课题组前期研究结果显示肺癌患者血清和组织中ENO1 的表达与性别、组织学分型无关,且Ⅰ~Ⅱ期肺癌患者ENO1 表达也高于Ⅲ~Ⅳ期患者,两者结论不符,分析原因可能是课题组前期检测样本量较少,且以Ⅰ~Ⅱ期肺癌患者为主,病理类型大多为肺腺癌,缺少其他病理类型的样本,还有待加大样本量进一步证实。本研究利用CCK-8实验、划痕实验、Transwell 实验证实,干扰ENO1表达后NSCLC 细胞增殖、迁移、侵袭能力减弱,提示ENO1 具有促进肿瘤侵袭转移的作用。
本研究也存在不足之处。NSCLC 是除小细胞肺癌以外、所有来源于肺上皮的各种类型癌症的集合体,常见类型有鳞状细胞癌、腺癌和大细胞癌。但本实验使用的A549、H460 细胞株分别为肺腺癌和大细胞肺癌,对于肺鳞癌及其他少见类型的NSCLC 细胞系尚未验证ENO1 的生物学功能,未来将进一步增加相应的细胞系进行研究。另外,对ENO1 促进NSCLC 侵袭转移的作用机制研究不够深入,ENO1在肿瘤免疫方面充当何种角色,是否能作为NSCLC的一种新型免疫治疗位点,其具体作用机制又是如何,这也是未来研究的主要方向。
综上所述,ENO1在NSCLC中高表达,且其表达水平与患者预后相关,ENO1具有促进NSCLC侵袭转移的作用,有可能成为新的NSCLC生物标志物及治疗靶点。

