腐蚀微生物种类及腐蚀机理研究进展
邱丽娜,张玮玮,弓爱君✉,郑书佳,赵丹丹,赵伟宇,范荣荣
1) 北京科技大学化学与化学工程学院,北京 100083 2) 北京科技大学功能分子与晶态材料科学与应用北京市重点实验室,北京 100083 3) 北京科技大学自然科学基础实验中心,北京 100083 4) 昆山禾信质谱技术有限公司,昆山 215300
金属腐蚀是全球性的问题,它制约着建筑业、水处理、航运、石油化工业和海洋工业等众多行业的发展.据2016 年报道美国腐蚀成本每年高达2.5~4 万亿美元[1],在中国,腐蚀造成的年损失约为国内生产总值的3%~5%[2].材料腐蚀失效不仅造成重大的经济损失,还可能造成严重的环境污染,危害人类健康[3].导致腐蚀的因素有很多,如温度、湿度、酸碱度、土壤性质和微生物等,其中微生物腐蚀(MIC),即由微生物活动引起的腐蚀,是最常见的,也是一种被公认的、极具破坏性的腐蚀行为.MIC 会导致塑料、石头、混凝土、木材等材料的破坏[4],在石油天然气、海洋工业、(废)水处理系统等工业系统中无处不在[5-7].据统计全球每年约20%的腐蚀损失是由微生物腐蚀引起的[8].在过去20 年中,由微生物腐蚀引起的管道泄漏、设施故障以及环境破坏等事件屡屡发生[8-9].杀菌剂、增强剂、抗菌不锈钢和抗菌涂层等防腐技术的研究受到人们越来越多的关注[10],而这些处理方法所涉及到的化学物质基本都是有毒有害的,这些化学物质会不断释放到环境中,其毒性、致癌性不仅导致环境污染及细菌耐药性增加[11-12],并且能够产生生物累积[13].此外采用海水注入来提高原油采收率的方法,导致微生物腐蚀和蓄水池酸化问题越来越严重,这就意味着微生物腐蚀问题在原油采收中也日益普遍[14].因此,随着人们对微生物腐蚀的认识和对人类健康和环境问题的关注加深,越来越多的微生物腐蚀受到研究者的关注.
微生物腐蚀是由金属表面微生物群落和腐蚀环境的相互作用而发生的腐蚀行为[15].一些工业生产使用的管道、储罐等基础设施中的微生物会造成生物淤积和腐蚀,甚至造成人员伤亡或财产损失及环境破坏等.许多工业部门如石油和天然气工业及核电厂[16-17]、燃料加工厂、发电厂、下水道[18]、地下储罐及管道[19]、石油回收系统、冷却水塔、消防喷淋系统[20-21]、铁路系统[22-23],油田及其相关区域如泵、阀门和容器[24-25]、船舶[26]、医疗设备[27]和放射性元素储存设施[28-29]等设备都会被微生物腐蚀.因此,可以说许多大型事故是由MIC直接或间接导致的,如2015 年墨西哥石油巨头PEMEX 公司海上钻井平台大火事件[16]、阿拉斯加北坡Prudhoe 湾漏油事件[30]和美国新墨西哥州卡尔斯巴德天然气管道泄漏引起的大爆炸事件[31].
MIC 涉及的微生物种类较多,按照需氧量的不同可以分为:厌氧菌、好氧菌和兼性厌氧菌.通常这几类菌同时吸附在金属材料表面形成生物膜.好氧菌和兼性厌氧菌在生长过程中消耗掉环境中的氧气,为厌氧菌提供生长的局部条件.常见腐蚀菌包括细菌、古菌和真菌等,如硫酸盐还原菌(SRB)[32]、硫酸盐还原古菌(SRA)[33]、硝酸盐还原菌(NRB)[34]、产甲烷菌[35]、产酸菌(APB)[36]、铁还原菌(IRB)[37]、铁氧化菌(IOB)[38]、硫氧化菌(SOB)[39]、锰氧化细菌(MOB)[40]和多种真菌[41]等.由于硫酸盐广泛分布在如海水、微咸水和农业径流水[42]等环境中,SRB 和SRA 作为微生物系统中的主要致腐蚀微生物已被广泛研究.SRB 和SRA 经常存在于石油和天然气等开采场所腐蚀运输管道[43].SRB存在时,在金属表面会发生点蚀,并且会有硫化物生成以及硫酸盐消耗等现象[44].当细菌附着在金属表面时,会形成薄膜,称为生物膜.生物膜主要由水、蛋白质和碳水化合物等组成[45],存在于潮湿物体的表面,如工业设备、医疗设备、河石、船体、管道及其他设备等.
生物膜本质上是附着在不同基质(通常是金属材料)表面的几种微生物,含有蛋白质、核酸、脂类和多糖等细胞外聚合物质(EPSs),有时会形成凝胶状粘液[46-47].EPSs 在生物膜的形成、成熟和维持中发挥着重要作用[48].Alabbas 等[49]和Castaneda 等[50]研究表明,由于不同生物之间的协同作用,生物膜的形成诱导并加速了MIC 过程.这些微生物在金属表面上以联合体的形式粘合在一起共同发挥作用,如SRB 和SOB 的共生增殖会导致2205 双相不锈钢更严重的腐蚀[51].当然,不是所有生物膜都会加速金属的腐蚀速率,铜绿假单胞菌生物膜会提高镍铜合金的腐蚀速率,但能减弱镍锌合金的腐蚀速率[52].大肠杆菌和硫还原杆菌组成的生物膜可以在不锈钢表面形成保护屏障,提高不锈钢的耐腐蚀能力[53].好氧生物膜可以作为氧屏障,减缓氧的渗透,从而起到减缓腐蚀的作用.生物膜在每个阶段对腐蚀的影响都是不同的.从饮用水系统中分离出来的生物膜样品在最初7 d 的孵育期间会加速腐蚀,但孵育30 d 后,它对管道反而起到保护作用.因此,应该对微生物群落和其对不同材料的腐蚀行为之间建立一个清晰的联系[54].由于与MIC 相关的微生物种类比较多,且该过程受到许多因素的影响,对此研究者们提出了各种各样的机理来解释MIC 现象.如微生物可以改变局部金属所处的环境(氧浓度或酸碱度),从而在铁表面形成浓度差电池导致局部腐蚀[55];微生物代谢会改变腐蚀材料的理化性质[56].在经典的阴极去极化理论(CDT)中,SRB 利用氢化酶降低H 原子脱附[57]过程的活化能,但CDT 只能解释氢化酶阳性的SRB 引起的微生物腐蚀,却不能解释缺少该酶的SRB 引起的微生物腐蚀[58].由于缺乏对生物膜与金属基质界面上发生的生物电化学过程的清晰认识,人们对微生物腐蚀的理解仍然存在很多问题.本文介绍了MIC 的微生物种类及特征,总结了微生物腐蚀机理的研究进展,以期对MIC 的诊断、预测及防治提供理论指导.
1 腐蚀性微生物种类
微生物如细菌、古菌和真菌对材料都有腐蚀性,而目前研究关注较多的是细菌的微生物腐蚀.在细菌中,SRB 对腐蚀影响最大,因为硫酸盐广泛分布于厌氧环境中[59];在极端环境,如70 ℃或更高温度的油箱中,古生菌在腐蚀方面影响较大[60];在气候温暖湿润的热带雨林环境中,真菌则成为影响微生物腐蚀的主要原因[61].细菌和真菌会产生有机酸,导致碳钢的腐蚀.据报道,这些酸不仅仅腐蚀碳钢,还会腐蚀多种金属[62],如304 不锈钢、X80 管线钢、双相不锈钢、超双相不锈钢、超级奥氏体不锈钢、高氮不锈钢、镁材料、铜和铜合金以及铝合金等.此外,微生物腐蚀还会与其他腐蚀过程相互作用,例如,应力腐蚀开裂、缝隙腐蚀、疲劳裂纹尖端脆化和沉积腐蚀[16,54]等.
通常无腐蚀性的生物膜本身不会引起腐蚀,然而,当二氧化碳或其他非生物性腐蚀剂存在时,无腐蚀性的生物膜在新陈代谢过程中也会损坏或破坏钢表面的FeCO3保护膜,加速二氧化碳导致的材料腐蚀[63].
1.1 硫酸盐还原菌(SRB)
SRB 是微生物腐蚀领域中被研究的最多的细菌之一.SRB 可以在pH 值为4.0~8.0 的宽酸碱度范围内、10~40 ℃的温度下以及高达5.07×106Pa 的压力下存活[64].常见的菌株如:Desulfovibrio Sp.、Clostridium Sp.、Desulfobacterium Sp.、Desulfotomaculum Sp.、Desulfobacter sp.和Desulfotomaculum sp.等.硫元素的价态可以从-2 到+6.有文献报道,根据SRB 所处环境的酸碱性的不同,可以将SRB 分为嗜酸、嗜碱和嗜中性菌3 类.嗜酸SRB 能够在pH为2.9~6.6 的环境下生长,而嗜碱SRB 在pH 为6.9~9.9 的极端碱性环境下生长最佳[65].除了硫酸盐,SRB 还可以利用其他硫化物,以高于-2 的价态作为终端电子受体,包括亚硫酸氢盐(HSO3-),硫代硫酸盐()和单质硫等[66].SRB 虽然是严格厌氧菌,但它也可以在有氧情况下存活一定时间[67].研究发现,SRB 培养基中溶解氧质量浓度低于40 μg·L-1时,可有效避免微生物的氧化或在氧化硫化物的过程中引入新的腐蚀剂如单质硫等[68].在一个开放体系中,SRB 倾向于生存在混合生物膜的底部,上层需氧和兼性微生物可以为SRB 生长提供局部的厌氧环境.仅有很少数SRB 菌株如Desulfovibrio vulgaris和Desulfovibrio desulfuricans等能耐受氧,它们可以利用氧作为终端电子受体,有一定的有氧呼吸能力,但并不能生长[69].在研究腐蚀机理时,通常采用纯的SRB,即使这样,在研究过程中由于H2S 和FeS 等硫化物的产生,腐蚀机理仍然会非常复杂.H2S 虽然是一种腐蚀剂,但它又可以形成铁系硫化物保护膜从而抑制腐蚀的发生[70].铁系硫化物保护膜包括四方硫铁、磁黄铁、硫复铁、黄铁和白铁等,可提供不同程度的钝化[71].相同的SRB,对于不同的金属(铜和铁),微生物腐蚀行为和机理都有很大的差异.
1.2 硝酸盐还原菌(NRB)
相对于SRB,NRB 在微生物腐蚀中的研究起步较晚.在石油和天然气工业中,为了解决SRB引起的油藏酸化问题,常常利用生物竞争排斥技术人为注入硝酸盐以促进NRB 的增长来抑制SRB的增长,NRB 通过与SRB 竞争硫酸盐来减缓蓄水池酸化[72].然而,研究表明铁的氧化对微生物催化硝酸还原反应在热力学上是有利的.NRB 从生物催化下的氧化还原反应中获得生物能,比SRB 导致的铁氧化和硫酸盐还原更有效率,说明NRB 比SRB 更容易引起金属腐蚀.实验结果表明,在碳钢表面发现了一种作为NBR 生长的Bacillus licheniformis生物膜,在7 d 内比硫酸盐还原D.vulgaris生物膜腐蚀性更强,C1018 碳钢的最大坑深为14.5 μm,标准失重0.89 mg·cm-2[34].硝酸还原菌Pseudomonas aeruginosa对304 不锈钢的腐蚀也有报道[73].因此,硝酸盐的注入应严格定量,以防止硝酸盐进入管道,造成更大的腐蚀.未受污染的海水不会含有硝酸盐,然而,农业径流会将硝酸盐带入水和土壤中[74].近年来,研究人员已经认识到在土壤中NRB的微生物腐蚀与SRB 同样重要,目前主要的NRB菌株有Octadecabacter jejudonensis和Alcaligenes aquatilis等.
1.3 产酸细菌(APB)
质子和有机酸是厌氧发酵过程中分泌的具有腐蚀性的物质.在没有硫酸盐和硝酸盐等外部氧化剂的情况下,质子和有机酸也会引起MIC,APB腐蚀就属于这一类.这种MIC 不需要跨细胞膜的电子传递,因为质子在金属表面的细胞外被还原.由于有机酸的产生,生物膜下的pH 值降低,APB很早就被认为能引起微生物腐蚀[75].APB 生物膜下的pH 值远低于开放系统中的液体.Vroom 等[76]发现,即使在相同的生物膜内,相邻两个位置pH值可以相差2 或更高.pH 值足够低时,就会发生质子攻击同时伴随铁氧化的发生.与硫酸盐还原不同,质子还原发生在细胞外的金属表面上,不需要生物催化.游离细胞可以通过产生质子来帮助维护酸性环境,促进腐蚀.虽然有机酸是典型的弱酸,但在相同的pH 值下,有机酸的腐蚀性远高于硫酸等强酸,因为有机酸有缓冲能力可供应额外的质子[77].APB 生物膜下面的pH 值比开放系统要低2 个单位.这是因为生物膜中固着细胞的体积密度比相应的游离细胞密度高100 倍[76].酸性环境也会抑制其形成防腐膜.在无氧条件下,APB 通常可以进行厌氧发酵,并产生有机酸.
有部分好氧APB,如酸化硫杆菌常用于生物浸矿,因为它们自身在生长过程中会使培养环境pH 值降低至1,非常适合从金属氧化物或硫化物中浸出金属离子[78].最近,研究人员发现Acidithiobacillus caldus对优质不锈钢的腐蚀较严重[79],也就意味着必须采取有效措施来防止APB 腐蚀生物浸矿的反应器.
1.4 铁氧化细菌(IOB)
铁氧化细菌(IOB)是好氧腐蚀细菌的典型代表之一.普遍存在于自然环境中并腐蚀钢结构[80].铁氧化细菌(IOB)通过氧化Fe2+为Fe3+产生能量来促进IOB 生长,这改变了铁氧化反应的平衡,导致在金属表面产生氧浓度差电池,引起局部腐蚀.IOB氧化Fe2+的速率比非生物化学反应要快得多[81].与Fe2+相比,Fe3+的氧化物或氢氧化物在管道等金属表面更容易沉积,形成锈瘤,可能会造成缝隙腐蚀、氧浓差电池或电偶腐蚀等.在生物膜中,IOB还可以为厌氧菌生长提供适宜的环境从而加速腐蚀.最具有侵略性的MIC 发生在包含多个细菌物种的环境而不是单一物种的环境[82].人们发现IOB和SRB 的混合培养比纯菌株IOB 或纯菌株SRB对铁的腐蚀更严重,这可能是由于好氧IOB 对氧气的消耗,生物膜内区域容易形成厌氧环境,使得SRB在生物膜下局部厌氧条件下增殖,加速腐蚀[83].金属氧化微生物还可以利用除铁之外的其他金属,如锰作为电子供体进行腐蚀.
1.5 产甲烷菌
1987 年,Daniels 等[84]就发现厌氧环境中产甲烷菌对含铁物质有腐蚀作用.随后Dinh 等[85]观察到产甲烷菌在铁作为唯一电子来源时,能够直接从铁表面获取电子,从而刺激自身生长并促进铁腐蚀.Okoro 等[86]发现在35~40 ℃,pH 值6~7,低盐度的油层环境中,产甲烷菌造成的腐蚀速率最高.一般认为产甲烷菌的腐蚀机理是阴极去极化理论.产甲烷菌使用氢作为电子供体,在呼吸作用过程中CO2减少.H2的利用可以引起阴极去极化,从而加速二氧化碳的腐蚀.当氢气供应有限时,产甲烷菌的生物膜可以将铁作为电子供体从而造成更严重的腐蚀.如M.deltae,M.thermolithotrophicus和M.barkeri这3 种菌在氢气供应比较足时可优先反应产生甲烷,如果可利用的氢气有限时,它们可以利用氢化酶自己产酸或者在金属生物膜界面处使用其他微生物产生的质子进行反应[87].目前关于产甲烷菌通过自身氧化还原蛋白膜或电导性鞭毛传导方式直接获取电子的机制尚未见报道.
1.6 铁还原菌(IRB)
铁还原菌(IRB)是将铁离子还原为亚铁离子的微生物统称,是一类严格厌氧或兼性厌氧菌.铁还原菌的种类多且分布广泛,但目前关于IRB 腐蚀研究多数集中在海水环境中.近年来,随着不同种类的IRB 被陆续从海水、海泥或深海热液区等水域中分离提取出来,其对金属材料的腐蚀作用也引起了人们的关注.微生物代谢过程中,通过氧化电子供体获得电子,以胞外Fe(III)作为电子末端受体,将Fe(Ⅲ)还原为Fe(Ⅱ),同时获得能量.不同种类的IRB 在不同的环境下对电子受体的选择不同,其中氧气是影响电子受体选择的重要因素之一.氧气的氧化还原电位高于Fe(III),理论上有氧条件下,兼性IRB 趋向于以O2作为电子受体.无氧条件下,则以Fe(III)等金属氧化物为电子受体[88].海洋环境是复杂多样的,MIC 在多数情况下是不同微生物协同作用的结果,Black 等[89]对铜绿假单胞菌和IRB 共存的腐蚀情况做了研究,结果显示IRB 导致铜绿假单胞菌阳极极化,腐蚀加剧.目前关于IRB 对金属材料腐蚀的影响的研究还不够系统,腐蚀机理及腐蚀防护、IRB 与其他微生物协同作用等还有待进一步研究.
1.7 硫氧化菌(SOB)
硫氧化菌可以将硫化物、单质硫、亚硫酸盐和硫代硫酸盐等还原态硫化物氧化为硫酸,从而获得能量.SOB 通过产酸加速材料的腐蚀,其代谢产生的硫酸能够降低pH,且不利于某些保护性腐蚀产物的沉积,从而促进腐蚀的发生.目前,对SOB在腐蚀方面的研究主要集中于加速低水位金属材料的腐蚀和混凝土的加速腐蚀上[90].
1.8 真菌
真菌属于真核微生物,在自然界中普遍存在.微生物腐蚀文献中关于真菌的报道较少,主要是因为真菌本身就生长在温暖和潮湿的环境中.真菌与铜、碳钢、不锈钢和铝等的微生物腐蚀有一定关系[91].有文献报道关于Aspergillus niger(一种兼性丝状真菌)引起的镁合金的微生物点蚀[92].在自然环境中,真菌生物膜可以消耗氧气,这有助于像SRB 这样的厌氧微生物生存.真菌还能降解碳氢化合物产生有机酸,这些有机酸可以引起腐蚀致使管道破裂或作为其他腐蚀性微生物比如SRB的营养物质.Dai 等[28]发现黑曲霉的主要代谢产物草酸是造成金属点腐蚀的主要原因.
1.9 古生菌
近几十年来,人们逐渐意识到自然界中的古生菌比之前认识的更加丰富.与细菌相同的是,古生菌没有细胞器和细胞核;但不同的是,古生菌的细胞壁不含有肽聚糖.有些古生菌是硫酸盐或硝酸盐的还原菌[93],有些是产甲烷菌.大多数极端条件下生长的古生菌可以耐受高温、高压或高盐等环境.Sulfate reducing archaea (SRA)在意大利的北海海洋热液系统和阿拉斯加油储系统等[94]许多极端环境中都能生存.与SRB 一样,SRA 也会导致微生物腐蚀和储层酸化,它们在新陈代谢过程中都使用硫酸盐,SRA 通过呼吸作用利用硫酸盐产生能量.因此,SRA 就像SRB 一样具有腐蚀性[68].
2 微生物腐蚀机理
MIC 自发现以来,国内外学者提出了各种机制来解释微生物腐蚀机理,包括硫酸盐还原菌的经典阴极去极化理论、浓差电极作用理论、胞外电子传递理论和腐蚀性代谢产物理论等.目前研究表明,MIC 过程可分为4 种:微生物生长过程中产生的具有腐蚀性的代谢产物,如酸、硫化物等腐蚀金属表面或者影响金属腐蚀的环境;微生物生命活动过程中影响电极反应的动力学过程;环境中氧浓度、盐浓度和酸性等的改变影响金属周围环境,使金属表面形成局部腐蚀电池而导致腐蚀;破坏金属表面的保护膜等.微生物腐蚀的过程中,很多时候并不一定只有一种机理.不同的微生物在不同环境中生长,代谢过程也会有所不同,因此很难有统一的腐蚀机理,只能根据具体情况判断是哪些机理起主要作用.
2.1 厌氧型微生物腐蚀机理
在厌氧条件下,Gu[95]对微生物引起的腐蚀进行了分类,主要分成3 种不同类型:I 型为微生物通过直接接触导电菌丝或电子载体等从金属表面获取电子;II 型为异养型微生物通过分泌有机酸等代谢产物侵蚀金属;III 型为异养微生物可以降解有机涂层造成金属腐蚀.
2.1.1 细胞外电子传递微生物腐蚀(EET-MIC)
在I 型微生物腐蚀中,细胞能够利用含能金属如铁元素作为电子供体,以不含氧的氧化剂,如硫酸盐和硝酸盐作为电子受体,这种氧化剂的还原反应需要胞内酶的生物催化,因此发生在细胞内部.然而,氧化反应如铁氧化反应发生在细胞外,电子必须被运送到细胞质中进行还原反应.这种跨膜的电子传递称为EET.I 型微生物腐蚀又称EET-MIC[96].碳钢中SRB 和NRB 引起的MIC 都是典型的EET-MIC.微生物EET 依赖于一个复杂的电子传递系统,需要通过细胞膜传送电子.细胞外金属氧化释放的电子,首先从金属表面通过直接电子传递(DET)或电子载体传递(MET)方式转移给细胞膜上的细胞色素C,然后传递到SRB 的电子呼吸传递链上,以此用于还原硫酸盐.铁氧化和硫酸盐还原结合的氧化还原反应具有正的细胞电位,这也就意味着有能量释放[97].胞外电子传递的方式见图1[98].Huang 等[99]敲除Pseudomonas aeruginosa的phzM和phzS基因,抑制绿脓菌素(pyocyanin)的分泌,有效抑制了EET,进而证实绿脓菌素为EET 的电子传递介质.利用延胡索酸作为终点电子接受体的Shewanella sp.引起的碳钢腐蚀也属于EET-MIC[100].
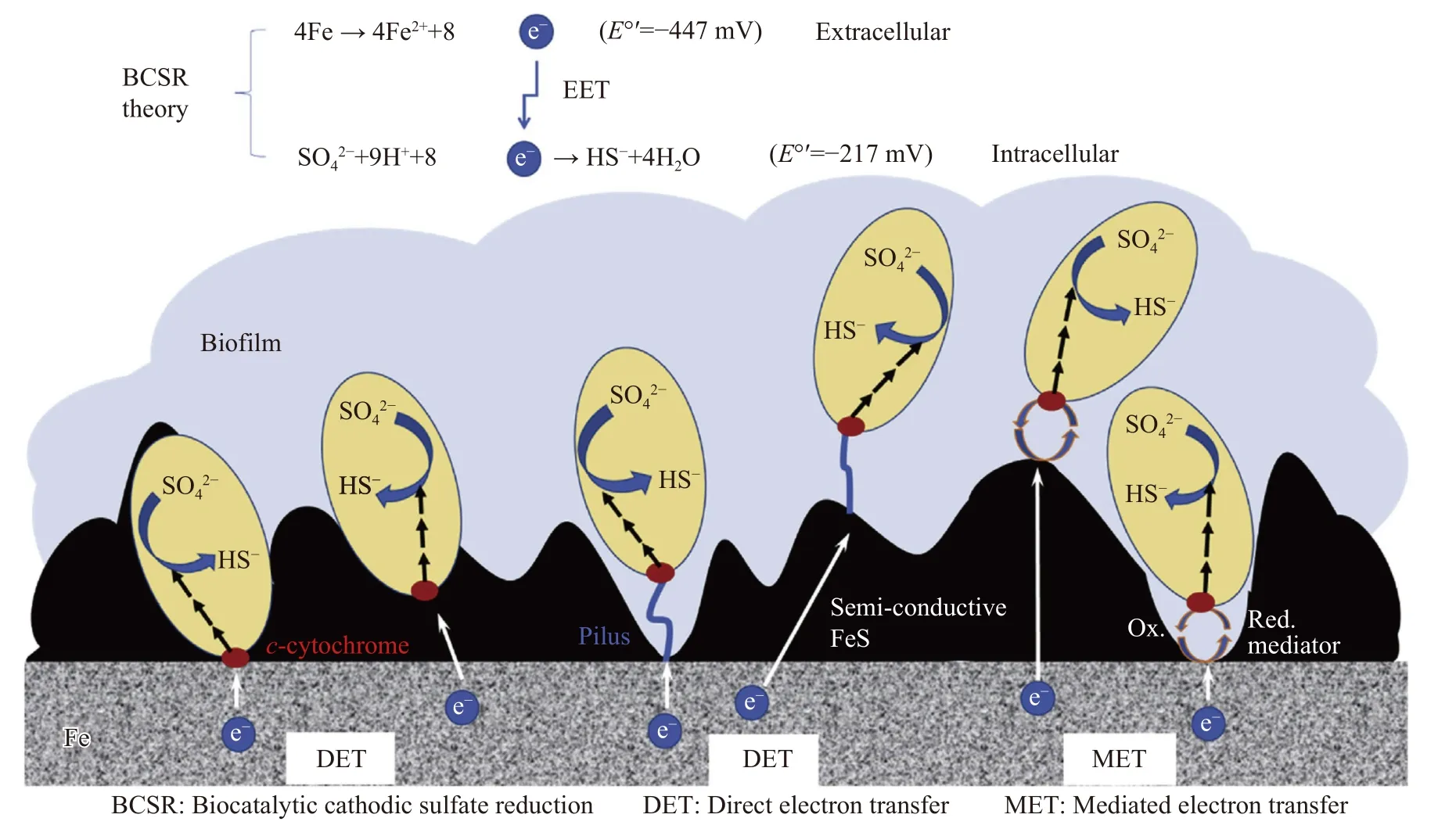
图1 SRB 从金属到细胞表面电子传递的方法.(a)外膜结合的氧化还原活性蛋白与基体导体表面直接接触;(b)导电菌毛与导体表面接触;(c)通过氧化和还原循环的氧化还原活性电子介质介导的氧化电子转移Fig. 1 Methods of electron transfer of SRB from metal to cell surface: (a) outer membrane-bound REDOX active protein in direct contact with substrate conductor surface,such as cytochrome C;(b) conductive pili in contact with conductor surface;(c) oxidation electron transfer mediated by REDOX active electron media through oxidation and reduction cycles
在DET 中,细胞膜与金属表面(包括覆盖有半导体腐蚀产物膜的金属表面,如硫化亚铁膜)直接接触或者通过导电菌毛将细胞膜与金属表面连接起来进行电子转移.对IS4 型SRB 腐蚀的研究表明细菌也能够在阴极上获取电子,通过电化学方法证实细胞色素C 是与外膜相关的氧化还原活性物质,并直接参与到IS4 细菌从基体表面直接获取电子的过程中[101].同时依赖于导电菌毛进行的DET也有大量研究,Reguera 等[102]对菌毛缺失的突变体做了研究,结果显示细菌菌毛缺失的突变体不能还原Fe(III)氧化物,但能吸附在铁氧化物表面,电子探针原子力显微镜也显示该菌毛具有良好的导电性.Sherar 等[103]在缺乏有机碳源的培养基中发现SRB 细胞表面会出现大量菌毛附着在铁表面,而在富含有机碳的培养基中则未观察到菌毛,表明SRB 细胞利用这些菌毛从碳钢表面获取电子进行硫酸盐还原.
在MET 中,可溶电子传递介质从金属表面吸收电子并将其释放至细胞膜,从而与细胞膜中的细胞色素C 结合.通过对两个“通用”电子转移介质核黄素和黄素腺嘌呤二核苷酸(FAD)的测试发现,D.vulgaris生物膜会加速对304 不锈钢和碳钢的腐蚀[97],也证实核黄素和FAD 通过硝酸盐还原P.aeruginosa生物膜对C1018 碳钢的腐蚀有加速作用[75].
随着对MIC 机理研究中生物膜重要性的认识更加全面,人们对相界面反应过程有了更深入的了解.徐大可等[104]研究SRB 生物催化阴极硫酸盐还原(BCSR)的机理时发现,当有充足的碳源时,SRB 细胞优先利用有机碳作为电子供体,它不需要进行EET,因为氧化有机碳释放电子是在SRB细胞质中进行的,同时发生硫酸盐的还原.然而,当介质中缺少碳源时,单质铁就会被利用,则会进行EET.图2 是有机碳-硫酸盐还原和以铁为电子供体的BCSR 之间的差异.
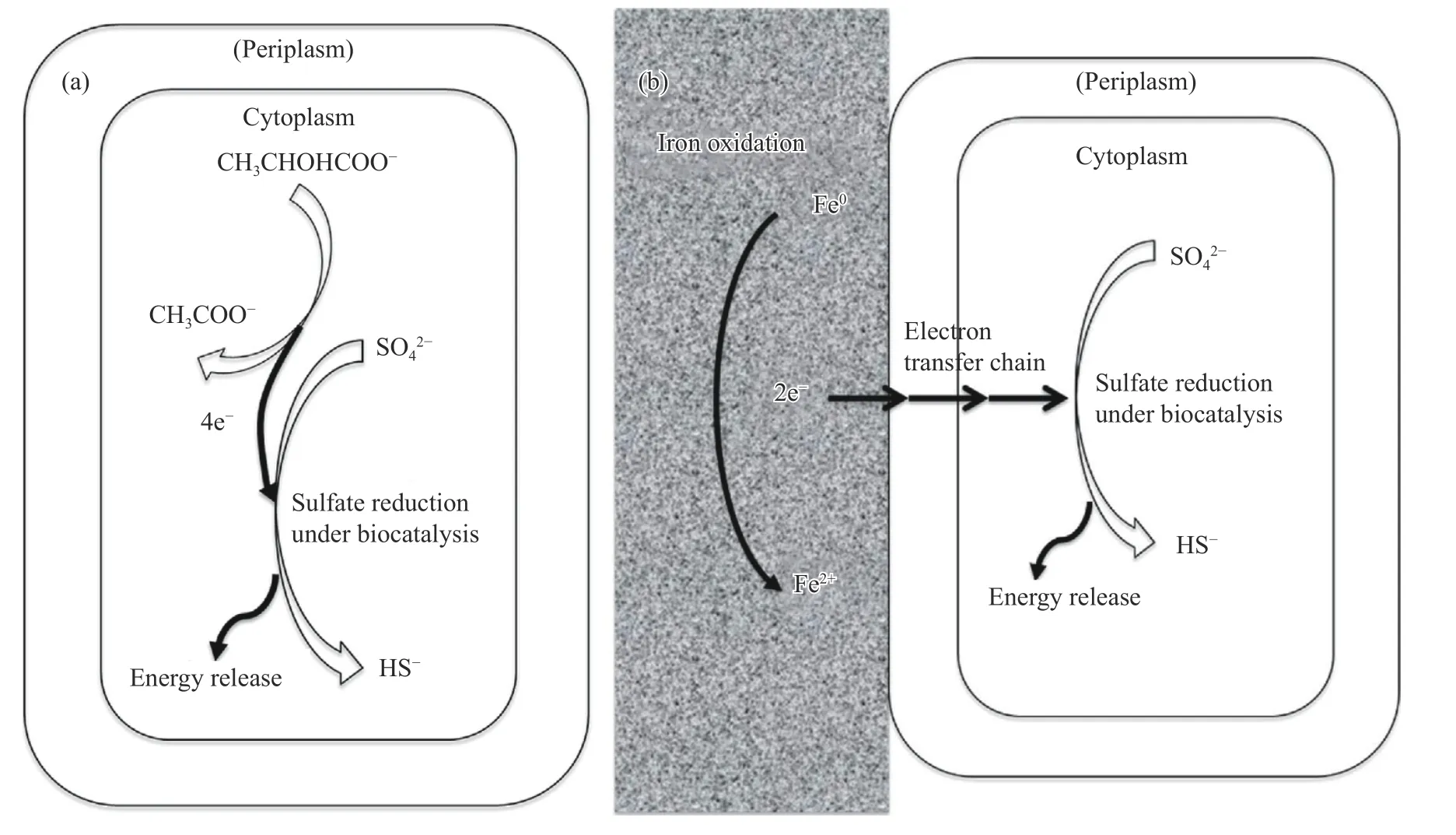
图2 D.vulgaris 细胞进行呼吸作用的示意图.(a) 有机碳-硫酸盐;(b) 铁-硫酸盐[54]Fig. 2 Schematic diagram of D.vulgaris cells: (a) organic carbon-sulfate;(b) iron-sulfate[54]
当铁被SRB 腐蚀时,单质铁可用作SRB 的电子供体或能源,发生细胞外的氧化反应:
式中:Eo′为标准还原电位校正(pH 值为7),在生物电化学中通常代替标准还原电位Eo(pH 值为 0).为保证电中性并提供能量,SRB 通过细胞质中的腺苷酰硫酸,利用硫酸盐作为最终电子的受体进行还原反应[105]:
在25 ℃,pH值为7,1 mol·L-1溶质中,两个时进行硫酸盐还原.吉布斯自由能变化值ΔGo′=Eo′值产生的细胞电位为230mV,表示铁氧化同-178 kJ·mol-1,即腐蚀过程中释放能量.除此之外,Han 等[106]分析在严格无氧的SRB 培养基中铝的腐蚀行为和机理时,也证实碳源充足的情况下,由于形成生物膜的导电性差甚至会抑制腐蚀,但在缺少碳源的情况下,SRB 将铝作为呼吸作用的电子供体,进而使铝的腐蚀显著增加.在这项突破性的工作之前,研究人员调整了培养基组成,得到优化后的培养基培养出的SRB 生物膜比营养缺乏的培养基培养出来的SRB 生物膜的腐蚀更严重,因此SRB 的生物能学提出“生物催化阴极硫酸盐还原”理论(BCSR),它借用了微生物燃料电池(MFC)研究中的生物电极概念.由于生物膜和细胞的代谢活动导致溶解氧的传质受到影响,由此形成特殊的还原性条件,例如形成贫氧区,引发厌氧菌的吸附与大量生长.生物电极上的SRB 生物膜含有带羧酸官能团的多糖,易捕获金属离子,而生物膜本身具有良好的电子传导能力,可以吸收阳极铁溶解释放的电子,因此,BCSR 理论也被称为生物阴极理论[34].Dou 等[107]则首次通过电化学测试来支持BCSR 理论.Liu 等[108]模拟含SRB 海水对7075铝合金的应力腐蚀行为时发现,SRB 代谢物及细胞共同组成分布不均的生物膜,形成浓差电池,加快氢向合金内部的扩散速度,增加合金氢脆敏感性,从而使腐蚀行为向氢致开裂转变.除了解释SRB腐蚀机理外,最近有研究表明该理论也可以用来解释在80 ℃,缺少碳源的情况下,古球藻加剧了碳钢腐蚀的原因.
SRB 生物膜会引起点蚀.点蚀是钢铁发生局部腐蚀的一种主要形式,点蚀导致了不锈钢表面形成针状坑点且从表面向内扩展形成孔穴,这种腐蚀的危害性在于材料会在均匀腐蚀很不明显的情况下腐蚀穿孔[109].King 和Millers 的电偶合理论解释了氢化酶呈阳性或者阴性时SRB 生物膜引起的点蚀的原因.在SRB 薄膜下面,碳钢表面的一些斑点是由于硫化铁或硫化铁覆盖薄膜面积较小的部分作为阳极所引起的铁溶解,而阴极为硫化铁覆盖面积大,覆盖率好的表面.SRB 的细胞在阴极表面通过半导体硫化铁薄膜进行直接电子转移或间接电子转移来获得电子,从而导致阳极的点蚀.氢化酶阳性的SRB 可以利用H+/H2的电子移动进行电子转移.氢化酶阴性的SRB 可以直接进行电子转移或依靠其他电子介质[54].
2.1.2 代谢产物腐蚀理论 (M-MIC)
与EET-MIC 中硫酸或硝酸还原不同,II 型MIC是由微生物分泌的腐蚀性代谢物引起的.这被称为M-MIC[110].在M-MIC 中,腐蚀通常不是由微生物对能量的需求驱动的,而是取决于腐蚀性代谢物如H2S、有机酸和质子等的分泌量[111].这些氧化剂(电子受体)在细胞外氧化金属,例如,铜不是通过硫酸盐的直接还原作用被腐蚀,而是被SRB 呼吸产生的硫化物腐蚀.这可能是因为硫酸盐还原电势(Eo′=-217 mV)低于Cu+/Cu (Eo′=+520 mV)和Cu2+/Cu (Eo′=+340 mV)的还原电势,使得铜在硫酸盐还原反应中不活泼.但是,在中性溶液中,HS-可以与Cu 发生式(3)的反应,且产物Cu2S 基本不溶于水.实际反应(3)的ΔG为-86.20 kJ·mol-1,在热力学上有利于腐蚀反应的发生[112].Dou 等[113]发现铜的SRB 微生物腐蚀比碳钢弱,与EET-MIC相比,M-MIC 的腐蚀会更加均匀.
微生物如APB 可以产生有机酸[98],在APB 生物膜下面能够产生一个足够的酸性环境,质子还原本身就不需要生物催化,因此典型的M-MIC 在非生物腐蚀中有对应物.除了细菌,真菌也会导致M-MIC.例如,A.niger生物膜中的有机酸会对2024 铝合金产生M-MIC.产酸微生物通常是发酵微生物,好氧和厌氧微生物都可以产生足够的有机酸导致MIC[28].上面的M-MIC 例子以及SRB 引起的铜腐蚀都属于电化学腐蚀,因为阳极和阴极反应可以被鉴别和区分.
2.1.3 生物降解微生物腐蚀(BD-MIC)
III 型MIC 是由微生物攻击有机材料造成的.之所以称为生物降解,是因为生物降解属于广泛定义上的腐蚀.在BD-MIC 中,微生物分泌酶(如氢化酶、氧化还原酶、裂解酶、过氧化氢酶和磷酸酶等)来降解有机物质(如增塑剂和聚合物),以获得小的有机分子作为营养物.生物降解电气系统中的绝缘聚合物也属于BD-MIC[98].此过程中,厌氧菌或好氧菌均可引起生物降解,但目前这些酶对于腐蚀的影响还没有统一的结论.其中,那些带有铁活性的氢化酶能够催化H2的氧化或H+的还原,从而可能会通过从金属表面转移电子或者所谓的阴极去极化作用促进金属腐蚀.即使细胞死亡,生物膜里面的酶也会被释放出来继续影响腐蚀[114].
2.2 在氧气存在下的MIC 机理
MIC 在有氧存在的环境中比较复杂,因为终端电子受体通常是氧.如果好氧生物膜能够为厌氧微生物提供一个无氧生长环境,那么好氧微生物在金属表面的腐蚀机理本质上将会与厌氧MIC相同.在氧气充足或占优势的环境中,好氧菌在材料腐蚀过程中占据主导地位,如在海水中,腐蚀前期扮演重要角色的假单胞菌、铁氧化菌等.氧是好氧菌腐蚀过程中的终端电子受体,如式(4).
2.2.1 好氧金属氧化细菌引起微生物腐蚀
好氧金属氧化细菌可分为铁氧化菌(IOB)和锰氧化菌(MOB)两类.这些微生物将氧作为终端电子受体将二价铁氧化为三价铁,以进行呼吸作用并产生能量.Wang 等[80]发现Acidithiobacillus ferrooxidans加速了碳钢的腐蚀,并提出了“由氧化铁引起的缝隙腐蚀”机理.图3 是有氧条件下氢氧化铁层引发的裂缝腐蚀机理示意图.A.ferrooxidans可以利用Fe2+氧化为Fe3+时得到的电子来固定二氧化碳,产生有机碳.在较高的浓度下,溶液中的Fe3+因为快速的氧化反应(比IOB 存在下快50 万倍)在金属表面析出形成Fe(OH)3沉淀层,这导致Fe(OH)3层下方阳极电子被直接从Fe0转移到阴极位置上,使得氧形成OH-,从而使碳钢表面形成凹坑.Sun 等[115]在模拟含SRB、IOB 土壤溶液对X100 管线钢腐蚀作用的研究中也证实了这一机理的合理性.
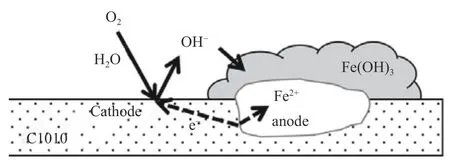
图3 有氧条件下由氢氧化铁层引发的缝隙腐蚀示意图Fig. 3 Schematic diagram of gap corrosion induced by the iron hydroxide layer under aerobic condition
MOB 的特点是能够催化氧化锰(II)为锰(IV),具有沉积二氧化锰的能力.Rajasekar 等[116]揭示了Bacillus cereusACE4 细胞分别将Fe2+和Mn2+氧化为Fe3+和Mn3+的过程,通过能量代谢获得电子,同时生成氧化铁(Fe2O3)和氧化锰(MnO2),在有氧环境下加速对钢的点蚀.Ashassii 等[117]认为Pseudoxanthomonas sp.在细胞外壁或其他细胞外表面催化氧化Mn2+,导致MnO2沉积在生物膜的黏液层,加速了对碳钢的腐蚀.
2.2.2 氧浓差电池理论
1958 年,Starkey[118]首次提出了浓差电池理论,也就是金属表面被腐蚀产物或其他污垢覆盖后,在金属表面与介质界面处会形成浓差电池.之后的研究进一步表明浓差电池的形成与生物膜的结构和形成有关.好氧细菌通常存在于海洋及其相关环境中,由这些细菌形成的生物膜在金属表面呈斑片状分布.好氧细菌通过呼吸将氧气从生物膜下方区域清除,从而导致了低氧环境的形成,那么这些区域成为阳极区,进而导致了局部的氧腐蚀.生物膜覆盖率较低或无生物膜覆盖的具有较高的氧浓度的区域,作为氧还原的阴极区,由于氧浓度差异而引起的局部腐蚀称为氧浓度差电池[119-120].生物膜下氧耗竭形成氧浓差电池导致的金属点蚀示意图见图4[121].生物膜的研究对于氧浓差电池理论的认识至关重要.
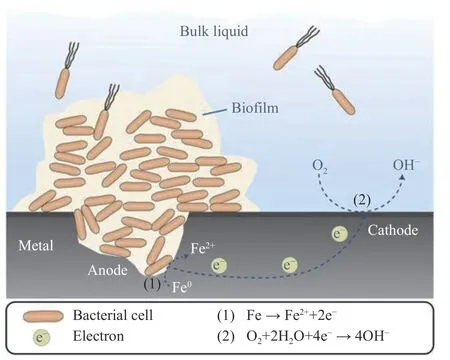
图4 生物膜下氧耗竭形成氧浓差电池导致的金属点蚀示意图Fig. 4 Schematic diagram of metal pitting caused by oxygen concentration cells formed by oxygen depletion under biofilm
2.2.3 腐蚀性代谢物的分泌
有些微生物在生命活动的过程中会产生一些酸性代谢产物,包括无机酸和有机酸(甲酸、乳酸及草酸等),这些酸会使周围环境中的pH 值降低,造成钢的严重腐蚀[122].用于生物浸矿的APB 是好氧菌,它们分泌的有机酸会加速腐蚀[98].有些材料如不锈钢由于其表面致密的氧化物薄膜的存在可以耐受一定的氧腐蚀,然而这层氧化物薄膜很容易被生物膜中产生的有机酸破坏,如Acetobacter spp.是一种好氧产酸细菌,能将乙醇氧化成醋酸,醋酸溶解在溶液中会加重钢和铜合金的点蚀[19].除此之外,硫氧化菌可以氧化环境中的硫、硫代硫酸盐和亚硫酸盐等,产生硫酸对材料造成腐蚀.Acidithiobacillus菌[123]通过硫代硫酸盐的氧化作用产生大量硫酸等无机酸,加快金属或合金的腐蚀速率.Qu 等[124]研究表明Bacillus subtilis产生有机酸会降低pH 值,从而加速冷轧钢材的腐蚀.产酸菌群例如EPS 产生的葡萄糖酸也会导致局部pH值下降,加快腐蚀速率.Blake 等[125]对B20 生物柴油储罐的微生物腐蚀研究表明,丝状真菌菌落在储罐内大量增殖同时混杂产酸细菌形成生物膜,这种混合菌群通过新陈代谢降解生物柴油产生有机酸,从而造成生物膜覆盖区域储罐的点蚀.
其他微生物也可能引起或诱发腐蚀.例如,藻类可以通过光合作用在生物膜内产生氧气,并将其在夜间转化为二氧化碳.藻类通过改变金属表面氧浓度和pH 值来加速腐蚀过程[126].事实上,许多微生物都能损伤金属表面的矿物钝化层而导致腐蚀,因为环境中已经存在氧化剂,如质子,二氧化碳和氧气等,这些微生物不需要自身分泌氧化剂.生物膜对钝化膜的损伤是一个非常重要的问题,在微生物腐蚀研究过程中值得被给予更多的关注.
3 MIC 防护与监测
材料腐蚀与防护一直是科学家们关注的热点.目前常用的方法有材料的选择、利用抑菌药物及微生物种间竞争等.但由于自然环境错综复杂,尤其是生物膜内适宜SRB 生长代谢的内环境的保护,使得完全杀灭腐蚀菌变得较为困难.生物杀虫剂是一个比较传统的用来缓解生物腐蚀的方法.在油气行业利用氧化剂如氯气可以释放自由基来攻击微生物细胞[127].长时间使用杀虫剂会使得微生物产生耐受性,因此出现了一些复合杀虫剂,如使用氯等杀虫剂时同时使用D-氨基酸,可以对生物膜有较好的抑制作用[68].螯合剂如EDTA 也可以作为杀虫剂的增强剂来抑制生物膜的形成[128].噬菌体及噬菌体与其他药物的复配也对微生物防腐起到非常好的效果,Qiu 等[129]发现蛭弧菌对SRB诱导的X70 管道钢腐蚀有较好的抑制作用.采用紫外线、磁场、喷涂防护涂层等物理防护也是目前工业中常用到的防治方法.尽管人们已经对MIC防护进行了大量研究,并取得了一些重要的进展,但主要集中在机理与抗菌材料开发.微生物监测技术的研究目前仍然是整个腐蚀领域中的一个薄弱环节.20 世纪50 年代末,国家科学技术委员会组织并建立了全国大气、海水、土壤腐蚀试验站网,开始了我国材料自然环境腐蚀试验工作.目前腐蚀监测智能化较低及环境生物多样性的变化规律与MIC 之间关系依然是存在的主要问题.随着国家腐蚀野外观测站监测网络观测点的增多及生物信息技术的发展,将建立更完善的微生物多样性与材料腐蚀之间的模型,为MIC 监测及防护研究提供更科学的依据.
4 结论
MIC 的研究已经有100 多年历史且取得了很多优秀成果.自然界中大量的微生物如SRB、NRB、APB、IOB 等均可引起各类材料腐蚀.从电化学、生物能量学、生物电化学、化学物质分析等角度,研究人员通过对厌氧及好氧型微生物腐蚀机理研究,提出了阴极去极化、生物催化阴极硫酸盐还原(BCSR)、生物降解微生物腐蚀(BD-MIC)、氧浓差电极和腐蚀性代谢产物等理论.BCSR 理论的提出解决了微生物腐蚀为什么要腐蚀金属和微生物怎么腐蚀金属两个困扰微生物腐蚀的重要问题.根据BCSR 理论,微生物通过电子传递链来获取金属腐蚀释放的电子,为更好地预防和抑制SRB 对材料的腐蚀提供新的思路.可以通过化学杀虫剂、生物杀虫剂、生物信号分子D-氨基酸等破坏细菌细胞膜来防治MIC.
随着分子生物学技术以及现代分析技术的发展,监测分析生物膜中微生物腐蚀过程,从微观上阐明SRB 的腐蚀机理.尽管对生物膜与金属界面间电化学过程已经有了一定的研究成果,但由于环境的复杂性,微生物腐蚀仍然存在巨大挑战,未来还需要进一步对MIC 过程中的电子传递、电子在细胞内外传递途径、生物和非生物因素的协同作用等方面进行深入探究,开发利用更微观的实验分析方法和更强大的计算工具,实现对复杂动态环境中的腐蚀过程精确预测.如跟踪电子在细胞内外的传递途径、通过基因工程手段研究特定基因或蛋白的表达、探究腐蚀过程中电子传递载体,结合MIC 的机理及微生物信息、环境特征、材料性质等,可以建立一个涵盖相关信息的MIC 数据库,充分发挥大数据与人工智能的优势,为MIC的预测与控制提供基础,实现面向服役环境需求的耐蚀材料的定制化、高效化设计研发.

