SMAD3对消化道恶性肿瘤调控作用的研究进展
李西沙 唐慧 刘中建 郭强
【摘要】 消化道恶性肿瘤的发生及进展机制一直是国内外研究的热点。SMAD3作为一种受体调节型蛋白,参与了癌症信号通路,对多数消化道恶性肿瘤的增殖、迁移及侵袭等起着重要的调控作用,与肿瘤患者的预后密切相关。本文就SMAD3的结构功能、其在消化道恶性肿瘤中的作用机制的最新研究做一综述,以对SMAD3有更全面的了解。
【关键词】 SMAD3 消化道恶性肿瘤 癌基因
Research Progress on the Regulatory Effect of SMAD3 on Gastrointestinal Malignant Tumor/LI Xisha, TANG Hui, LIU Zhongjian, GUO Qiang. //Medical Innovation of China, 2023, 20(36): -164
[Abstract] The occurrence and progression mechanism of gastrointestinal malignant tumor have been the focus of research at home and abroad. As a receptor regulated protein, SMAD3 is involved in cancer signaling pathway and plays an important regulatory role in the proliferation, migration and invasion of most gastrointestinal malignant tumor, which is closely related to the prognosis of tumor patients. In this paper, the structure and function of SMAD3 and its mechanism of action in gastrointestinal malignant tumor are reviewed, so as to have a more comprehensive understanding of SMAD3.
[Key words] SMAD3 Gastrointestinal malignant tumor Oncogene
First-author's address: School of Medicine, Kunming University of Science and Technology, Kunming 650500, China
doi:10.3969/j.issn.1674-4985.2023.36.036
肿瘤的发生发展是一个复杂多步骤的生物学过程,多基因参与了肿瘤的调控,在肿瘤的调控网络中存在着一些关键基因。SMAD3是SMADs蛋白家族的成员之一,属于受体调节型SMADs[1]。SMAD3在多种肿瘤中异常表达,调控诸多肿瘤恶性生物学行为,SMAD3在不同肿瘤的发生发展中发挥重要作用。由于SMAD3在不同类型消化道肿瘤扮演不同的角色,以及其作用机制的复杂性,其与消化道恶性肿瘤之间的关系已逐渐成为研究的热点。因此,本文以SMAD3在不同类型的消化道恶性肿瘤作用机制的复杂性为切入点,深入探讨SMAD3的结构、生物学功能及其在消化道恶性肿瘤中的作用机制,就最新的研究做一综述。
1 SMAD3的分子结构
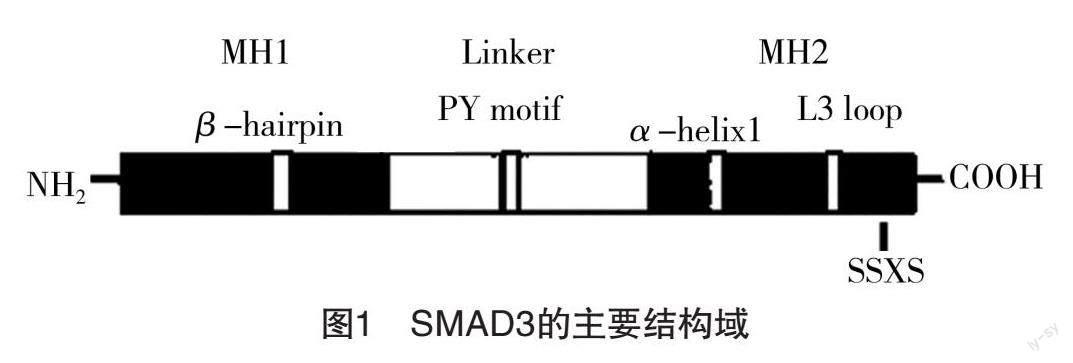
SMAD3基因定位于核染色体15q21-22,其编码的蛋白由425个氨基酸组成,在其N-末端和C-末端具有高度相似的氨基酸序列,分别称为DNA结合区的MAD同源1(MH1)结构域、具有细胞质锚点SARA(用于受体激活的SMAD锚点)的MH2结构域[2-3](图1)。MH1功能域X射线晶体结构的分析显示,在MH1的N-末端存在1个保守的11个残基构成的β发夹,该β发夹序列特异性决定了DNA上CACA盒的特异性;MH2的C-末端存在一个保守的磷酸化SSXS基序(即ser-ser-x-ser序列)和L3loop结构,SSXS基序是SMAD3蛋白活化的关键,L3loop结构决定着SMAD蛋白与转化生长因子-β(TGF-β)受体特异性相互作用及稳定异源寡聚复合物作用,在N端还有一高度保守的核定位信号(nuclear localization signal,NLS)基序,含有NLS基序的孤立的SMAD3的MH1结构域可发生持续的核向转位,NLS的任何突变都会中止这一转位过程[4]。SMAD3的MH1区具有DNA结合活性;MH2结构域负责SMAD3的核出口,主要作用是抑制SSXS基序与其他SMAD蛋白、DNA结合蛋白和协同活化因子或协同抑制因子结合,具有转录活化作用,所以主要是信号转导的功能性结构域[5]。在非活性状态下MH1区和MH2区彼此相互作用,形成自我抑制,当受体被激活后,SMAD3形成异源寡聚体,并转移至细胞核,当MH2区的C-末端SSXS基序被磷酸化后可以除去MH1的抑制作用[6-7]。
2 SMAD3的分子功能
SMAD3是TGF-β信号通路中重要的转录调控因子,可将TGF-β信号从细胞表面受体传至细胞核,激活或抑制下游靶基因的转录[8],参与调节各种生理和病理过程,如炎症、分化、凋亡、免疫、纤维和致癌等[9]。SMAD3信号传导可以抑制并分离巨噬细胞中促炎基因iNOS和基质金属蛋白酶(MMP)-12的表达,抑制趋化因子MCP-1/CCL2的合成,進而减弱细胞凋亡和抑制蛋白酶驱动性发挥保护细胞的作用[10]。B淋巴细胞瘤-2(Bcl-2)具有明显抑制细胞凋亡的作用,其上调是癌细胞逃避细胞凋亡最主要的原因,SMAD3可以直接与Bcl-2启动子中富含GC的元件结合,可以抑制体内Bcl-2的转录状态,诱导细胞凋亡[11]。周期蛋白依赖性激酶(Cdk)2和Cdk4可使SMAD3磷酸化,从而使其失活,进而导致细胞周期停滞[12]。免疫相关的MMP是细胞外基质(ECM)内的重要成分,能够降解ECM的各种成分,是反映肿瘤侵袭转移的重要指标[13]。SMAD3特异性抑制剂(SIS3)是一种合成的化学物质,它能够减缓肿瘤的生长并且降低肿瘤内MMP的含量[14]。SMAD3磷酸化抑制后能够降低MMP-9的表达,抑制肿瘤的生长。相关研究表明,SMAD3与MMP-9在肿瘤细胞中具有一定的有相关性,SMAD3磷酸化程度越高,MMP-9的表达越高[15]。
3 SMAD3在消化道恶性肿瘤中的作用
SMAD3的表达受到不同肿瘤组织和细胞类型的限制,发挥促癌或抑癌的作用。SMAD3在消化道恶性肿瘤中的研究结果有所差异,一些研究发现,其在多种消化道恶性肿瘤中起促进肿瘤生长转移的作用,然而,一些研究发现SMAD3在消化道恶性肿瘤的生长转移中起抑制作用。
3.1 SMAD3与胃癌
胃癌是世界范围内的恶性肿瘤,其发病率和死亡率分别居于恶性肿瘤第五位和第四位[16]。胃癌在中国的发病率和死亡率均居于恶性肿瘤第三位[17]。有文献报道,SMAD3的过表达可以减弱褪黑激素在胃癌细胞中的抑制作用,诱导胃癌的发生[16],这表明SMAD3在促进胃癌方面有潜在的作用。Kim等[18]对442例胃癌术后组织进行免疫组化法检查,发现SMAD3在胃癌组织中高表达,在癌旁组织中低表达;同时,单因素变量分析显示,SMAD3过表达与5年无病生存率和总生存时间(OS)具有相关性;多因素变量分析显示,SMAD3过表达与肿瘤类型、分化、分期、生存具有相关性,SMAD3过表达的患者具有较高的复发率和死亡率(P=0.003、0.005)。Wei等[19]发现SMAD3是miR-424-5p的直接靶標,体外研究表明SMAD3的过度表达可部分逆转miR-424-5p对胃癌细胞增殖的影响。师艾丽等[20]通过30例胃癌和50例胃息肉患者的对照研究,发现在肿瘤组织中SMAD3表达水平降低,SMAD3的高表达有利于胃癌患者预后。体内试验发现,在SMAD3基因缺陷的胃癌细胞系中转染SMAD3基因可诱导肿瘤抑制活性。然而,有学者发现SMAD3在胃癌患者组织中低表达,且与生存率成负相关,进一步体外细胞实验表明,(E)-SIS3可以通过下调SMAD3的表达来诱导AGS和MGC803细胞凋亡、抑制AGS和MGC803细胞的增殖和迁移[21]。这与SMAD3作为抑癌基因的作用是矛盾的,可能是因为SMAD3所参与的信号通路或合作的伙伴不同,因此所发挥的功能不同。该研究尚未进一步探讨其具体发生机制,但也表明SMAD3是治疗胃癌的重要靶点。
3.2 SMAD3与结直肠癌
结直肠癌是世界上最常见的癌症之一,结直肠癌的发展是一个复杂的多步骤过程,包括从正常上皮进展为腺瘤性息肉,最后发展为恶性肿瘤[22-24]。汪发勇等[24]利用110例结肠息肉患者的息肉组织、40例结直肠癌组织及20例正常结直肠黏膜组织,通过免疫组化法,发现SMAD3在息肉组、结直肠癌组和健康对照组的阳性表达率分别为67.3%、35%、17%(P=0.000);进一步研究发现,SMAD3在高危型腺瘤和Dukes A期结直肠癌的阳性表达率分别为68.0%、30%(P=0.024),表明SMAD3在结直肠腺瘤及癌变的演变中发挥重要作用,其具体机制未能有待更深一步的研究。Anasr等[25]对TCGA数据库分析的结果报道,SMAD3在结直肠癌组织中显示出低甲基化水平,其利用548例结直肠癌组织及癌旁组织,通过定量甲基化特异性聚合酶链反应(QMSP)测定,证实了结直肠癌组织中SMAD3出现的低甲基化发生率为91.4%(501/548),且出现SMAD3低甲基化的患者总生存率较低。同时其通过对15例结直肠癌患者及健康对照组的血浆进行QMSP检测,进一步证实了结直肠癌患者SMAD3低甲基化水平。上述研究表明,SMAD3可作为早期预测结直肠癌的潜在生物标志物。
3.3 SMAD3与肝细胞癌(HCC)
有文献报道,SMAD3参与抑制HCC的发生、发展,SMAD3是miR-17的直接靶点,miR-17靶向SMAD3后使HCC癌细胞阻滞在G1期,下调miR-17后促进肝癌的发展,其机制为miR-17通过与SMAD3的3UTR结合,在基因和蛋白质水平上抑制SMAD3的表达[26]。有文献报道,HCC患者的5年总生存率为60%,5年复发率为80%~100%,为降低复发率,目前化疗仍是抑制HCC复发的有效的治疗方法。但是,随着肝癌耐药性的发生,化疗的效果较之前降低,有研究发现,在肝癌细胞株中SMAD3转录激活可引起顺铂失去耐药性,抑制肝癌细胞增殖、克隆形成及促进细胞凋亡,通过在Balb/c-顺铂治疗的裸鼠中进行肿瘤形成测定,与对照组相比,皮下植入过表达的SMAD3小鼠显示出肿瘤体积减小和重量减轻(P<0.05);相反,植入缺失的SMAD3的肝癌细胞株的小鼠显示出了相反的结果(P<0.05),体内实验证明SMAD3过表达可促进顺铂对肝癌肿瘤的敏感性,而SMAD3缺失可抑制顺铂对肝癌治疗的敏感性。其机制是SMAD3可通过诱导p21和抑制c-myc和bcl2来促进HCC细胞凋亡[27]。因此该研究表明,SMAD3可能是识别患者是否适合顺铂作为辅助治疗的生物标志物。
3.4 SMAD3与胰腺癌
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PADC)属于胰腺癌最常见的一种病理亚型,病死率极高,预后极差,5年总体生存率约为8%[28-30]。Yamazaki等[31]对12例PADC术后组织样本表达谱进行了研究,发现SMAD3基因上调,可促进PADC的发生发展;同时该实验还利用113例患者的术后组织,进行免疫组化分析,显示SMAD3在PADC术后组织样本高表达,进一步研究发现,通过添加外源的靶向SMAD3基因的小干扰RNA(siRNA),可改变癌细胞形态,降低癌细胞迁移和侵袭的能力(P<0.05),而SMAD3过表达则出现相反的效果(P<0.05)。该实验还发现SMAD3基本积聚在肿瘤细胞核中,然而,在大多数胰管中的上皮细胞中未检测到该基因表达,多因素回归分析显示SMAD3高表达是PADC预后不良的独立事件。以上研究表明,SMAD3可作为PADC诊断及不良预后的潜在生物标志物。
3.5 SMAD3与其他肿瘤
SMAD3除与以上消化道肿瘤的发生、发展有关,还与其他一些恶性肿瘤密切相关。有文献报道,SMAD3在肺癌组织和癌细胞中高表达,SMAD3低表达可抑制肺癌细胞株的迁移、侵袭、增殖和活力,其机制可能是SMAD3基因通过与其启动子结合来促进PAX6转录活性[32]。Niu等[9]通过体内、体外实验研究发现,敲低的SMAD3基因的表达,并与CDK抑制剂1(p21)的启动子结合可下调p21的转录,增加G2/M期,增强肺癌放疗的敏感性。在乳腺癌组织中,HPV16 E7基因可与SMAD2等相互作用阻断SMAD3的转录活性,发挥抑癌作用[33]。Jia等[34]研究发现,抑制SMAD3基因表达可抑制Bcl-2的表达水平,进而抑制前列腺癌细胞的增殖和侵袭,促进细胞凋亡。Xia等[35]研究表明,SMAD3磷酸化可抑制MMP-9,抑制前列腺癌细胞的侵袭,进一步研究发现SMAD3的高表达与前列腺癌的复发和预后密切相关。有文献报道,SMAD3是miR-195的直接靶点,miR-195在一定程度上通过直接靶向并下调SMAD3来促进子宫颈癌的进展[36]。Chen等[37]研究发现,SMAD3在子宫颈癌组织和细胞株中表达明显增强,敲低SMAD3可抑制癌細胞数量、生存能力、迁移和侵袭,表明SMAD3可参与促进子宫颈癌发生和发展。
4 展望
在过去几年中,有关SMAD3的信号网络和生物功能在致癌过程中的认识有了长足的进步,SMAD3与消化道肿瘤的发生、发展密切相关。现有文献显示,SMAD3在消化道恶性肿瘤中更多地扮演着抑制肿瘤基因的角色,仅在少数肿瘤组织中,扮演着促癌的角色,在某些肿瘤中还表现出抑癌和促癌的双重作用。已有的研究认为,SMAD3在不同类型的肿瘤中,甚至同一类型的肿瘤中表现出相反的调控作用,据推测,TGF-β/SMAD3介导的促转移反应途径一旦与肿瘤抑制作用脱钩,就会发生促转移反应,但其具体的分子机制尚无定论。目前关于SMAD3在肿瘤中的作用机制的研究相对单一浅显。SMAD3的作用机制,以及SMAD3对消化道肿瘤发生和发展的信号调控网络的完善,后续还需要大量的研究来深入揭示。通过综述SMAD3在消化道恶性肿瘤方面的研究进展,以期随着SMAD3在消化道恶性肿瘤方面的深入研究,SMAD3被更多的学者所了解,为基因诊断和治疗消化道恶性肿瘤提供更广阔的前景。
参考文献
[1] ZHANG Y E.Non-smad signaling pathways of the TGF-β family[J].Cold Spring Harb Perspect Biol,2017,9(2):a022129.
[2] MOTIZUKI M,KOINUMA D,YOKOYAMA T,et al.TGF-β-induced cell motility requires downregulation of ARHGAPs to sustain Rac1 activity[J].J Biol Chem,2021,296:100545.
[3] ZAKRZEWSKI P K.Canonical TGFβ signaling and its contribution to endometrial cancer development and progression-underestimated target of anticancer strategies[J].J Clin Med,2021,10(17):3900.
[4] DUAN M,WANG Q,LIU Y,et al.The role of TGF-β2 in cartilage development and diseases[J].Bone Joint Res,2021,10(8):474-487.
[5] GOMES T,MARTIN-MALPARTIDA P,RUIZ L,et al.
Conformational landscape of multidomain SMAD proteins[J].Comput Struct Biotechnol,2021,19:5210-5224.
[6] MASSAGUE J,WOTTON D.Transcriptional control by the TGF-beta/Smad signaling system[J].EMBO J,2000,19(8):1745-1754.
[7]陈琳,魏路清.Smad家族在肺纤维化中作用的研究进展[J].中外健康文摘·医药月刊,2008,5(3):259-263.
[8] HU H H,CHEN D Q,WANG Y N,et al.New insights into TGF-β/Smad signaling in tissue fibrosis[J].Chem Biol Interact,2018,292:76-83.
[9] NIU H,HUANG Y,YAN L,et al.Knockdown of SMAD3 inhibits the growth and enhances the radiosensitivity of lung adenocarcinoma via p21 in vitro and in vivo[J].Int J Biol Sci,2020,16(6):1010-1022.
[10] KONG P,SHINDE A V,SU Y,et al.Opposing actions of fibroblast and cardiomyocyte Smad3 signaling in the infarcted myocardium[J].Circulation,2018,137(7):707-724.
[11] JIN Y,ZHANG J,PAN Y,et al.Berberine suppressed the progression of human glioma cells by inhibiting the TGF-β1/SMAD2/3 signaling pathway[J].Integr Cancer Ther,2022,21:15347354221130303.
[12] MATSUURA I,DENISSOVA N G,WANG G,et al.Cyclin-dependent kinases regulate the antiproliferative function of Smads[J].Nature,2004,430(6996):226-231.
[13]童瀟,周爽.SMAD3与乳腺癌免疫相关基因关系研究[J].甘肃科学学报,2022,34(2):49-55.
[14] KIM S,LEE J,JEON M,et al.Zerumbone suppresses the motility and tumorigenecity of triple negative breast cancer cells via the inhibition of TGF-β1 signaling pathway[J].Oncotarget,2016,7(2):1544-1558.
[15] HUANG D,LIU Y,HUANG Y,et al.Mechanical compression upregulates MMP9 through SMAD3 but not SMAD2 modulation in hypertrophic scar fibroblasts[J].Connect Tissue Res,2014,55(5-6):391-396.
[16] SUNG H,FERLAY J,SIEGEL R L,et al.Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[17] 2020年全球癌症统计报告[J].中华预防医学杂志,2021,55(3):398.
[18] KIM S H,KIM K H,AHN S,et al.Smad3 and Smad3 phosphoisoforms are prognostic markers of gastric carcinoma[J].Dig Dis Sci,2013,58(4):989-997.
[19] WEI S,LI Q,LI Z,et al.miR-424-5p promotes proliferation of gastric cancer by targeting SMAD3 through TGF-β signaling pathway[J].Oncotarget,2016,7(46):75185-75196.
[20]师艾丽,李菲,陈启龙,等.胃息肉中TGF-β1、SMAD3的表达及其与胃息肉癌变之间的相关性[J].当代医学,2018,24(4):12-14.
[21] ZHANG H W,GUO Y,SUN L X,et al.Prognostic value of small mother against decapentaplegic expression in human gastric cancer[J].Bioengineered,2021,12(1):2534-2549.
[22] YANG Z,LU S,WANG Y,et al.A novel defined necroptosis-related miRNAs signature for predicting the prognosis of colon cancer[J].Int J Gen Med,2022,15:555-565.
[23] LIU Z,TANG H,ZHANG W,et al.Coupling of serum CK20 and hyper-methylated CLIP4 as promising biomarker for colorectal cancer diagnosis: from bioinformatics screening to clinical validation[J].Aging (Albany NY),2021,13(24):26161-26179.
[24]汪发勇,许建明,梅俏,等.转化生长因子-β1、Smad3、Smad4和Smad7在结直肠癌发生中的作用[J].胃肠病学,2008,13(5):281-284.
[25] ANASR M,WANG C J,WANG Y H,et al.SMAD3 Hypomethylation as a biomarker for early prediction of colorectal cancer[J].Int J Mol Sci,2020,21(19):7395.
[26] LU Z,LI X,XU Y,et al.microRNA-17 functions as an oncogene by downregulating Smad3 expression in hepatocellular carcinoma[J].Cell Death Dis,2019,10(10):723.
[27] ZHOU H H,CHEN L,LIANG H F,et al.Smad3 sensitizes hepatocelluar carcinoma cells to cisplatin by repressing phosphorylation of AKT[J].Int J Mol Sci,2016,17(4):610.
[28]周洪浩.SMAD3通过抑制AKT磷酸化增加肝癌细胞对顺铂的化疗敏感性[D].武汉:华中科技大学,2016.
[29] WU J.Pancreatic cancer-derived exosomes promote the proliferation, invasion, and metastasis of pancreatic cancer by the miR-3960/TFAP2A axis[J].J Oncol,2022:3590326.
[30] XIE Y,SHI X,SHENG K,et al.PI3K/Akt signaling transduction pathway, erythropoiesis and glycolysis in hypoxia (review)[J].Mol Med Rep,2019,19(2):783-791.
[31] YAMAZAKI K,MASUGI Y,EFFENDI K,et al.Upregulated SMAD3 promotes epithelial-mesenchymal transition and predicts poor prognosis in pancreatic ductal adenocarcinoma[J].Lab Invest,2014,94(6):683-691.
[32] QIAN Z,ZHANG Q,HU Y,et al.Investigating the mechanism by which SMAD3 induces PAX6 transcription to promote the development of non-small cell lung cancer[J].Respir Res,2018,19(1):262.
[33]田媛,吳鹏,罗爱月,等.子宫颈上皮内瘤样病变和子宫颈癌组织中Smad2/3和HPV16 E7的表达及意义[J].癌症,2007,26(9):967-971.
[34] JIA Y,GAO Y,DOU J.Effects of miR-129-3p on biological functions of prostate cancer cells through targeted regulation of Smad3[J].Oncol Lett,2020,19(2):1195-1202.
[35] XIA Q,LI C,BIAN P,et al.Targeting SMAD3 for inhibiting prostate cancer metastasis[J].Tumour Biol,2014,35(9):8537-8541.
[36] ZHOU Q,HAN L R,ZHOU Y X,et al.MiR-195 suppresses cervical cancer migration and invasion through targeting Smad3[J].Int J Gynecol Cancer,2016,26(5):817-824.
[37] CHEN X,XIONG D,YANG H,et al.Long noncoding RNA OPA-interacting protein 5 antisense transcript 1 upregulated SMAD3 expression to contribute to metastasis of cervical cancer by sponging miR-143-3p[J].Cell Physiol,2019,234(4):5264-5275.
(收稿日期:2023-03-24) (本文编辑:陈韵)

