多原发性肺癌的诊断和治疗研究概况
谢超宇 张庆广

【摘要】 肺癌的发病率在我国位居前列,也是导致死亡的主要癌症之一。CT的广泛应用提高了早期肺癌的诊出率,包括肺部多发结节尤其是多发磨玻璃结节的检出。多原发性肺癌(multiple primary lung cancer,MPLC)是指患者存在两个或多于两个的肺原发病灶。近年来由于CT的普及及医疗水平的提升,MPLC在临床中的检出率越来越高。目前我国对于MPLC的鉴别诊断、外科手术治疗方式、非手术治疗仍无统一标准,笔者就现今MPLC的诊断、外科手术方式、非手术治疗等进行系统综述。
【关键词】 多原发性肺癌 鉴别诊断 肺叶切除术 靶向治疗
Research Profile on Diagnosis and Treatment of Multiple Primary Lung Cancer/XIE Chaoyu, ZHANG Qingguang. //Medical Innovation of China, 2023, 20(36): -184
[Abstract] The incidence of lung cancer is forefront in China, and it is also one of the main cancers leading to death. The widespread use of CT has improved the detection rate of early lung cancer, including the detection of multiple pulmonary nodules, especially multiple ground-glass nodules. Multiple primary lung cancer (MPLC) is defined as the presence of two or more primary lung lesions. In recent years, due to the popularity of CT and the improvement of medical level, the detection rate of MPLC in clinic is getting higher and higher. At present, there is no uniform standard for the differential diagnosis, surgical treatment methods and non-surgical treatment of MPLC in China. The author systematically reviews the current diagnosis, surgical methods and non-surgical treatment of MPLC and so on.
[Key words] Multiple primary lung cancer Differential diagnosis Pulmonary lobectomy Targeted therapy
First-author's address: Binzhou Medical University Hospital, Binzhou 256603, China
doi:10.3969/j.issn.1674-4985.2023.36.040
多原發性肺癌(multiple primary lung cancer,MPLC)指患者的肺内存在2个或2个以上原发病灶,根据不同病灶发病时间,又可将MPLC分为同时性MPLC(sMPLC)和异时性MPLC(mMPLC)[1]。目前临床医生较为认可的是将sMPLC定义为不同的原发性肺癌出现时间不超过6个月,mMPLC定义为不同的原发性肺癌出现时间大于6个月。由于CT的普及和临床诊疗水平的提升,MPLC的发现率逐步提高。现阶段我国在MPLC诊疗规范的讨论上仍然存在不同争议,关于MPLC与肺转移癌(肺癌患者原发灶出现肺内转移)的鉴别诊断仍没有明确的金标准。本文就MPLC的诊断及治疗研究概况综述如下。
1 MPLC的诊断标准
1.1 M&M标准
目前被大部分临床医生使用的MPLC诊断标准是1975年Martini和Melamed提出的,其标准包括,(1)sMPLC:①各原发病灶位于不同位置且互为独立病灶;②各原发病灶有不同的组织学类型;③如果不同病灶拥有同样的组织学类型:要求各病灶的起源不同且无相关解剖位置关系,无共同的淋巴引流且无肺外转移。(2)mMPLC:①各原发病灶互为不同的组织学类型;②如果不同病灶有同样的组织学类型:要求不同病灶出现时间间隔不少于2年,或起源不同,或第二病灶位置在同侧不同肺叶或对侧肺,且无共同的淋巴引流,无肺外转移[2]。
1.2 美国胸科医师协会(American college of chest physicians,ACCP)标准
ACCP在M&M标准的基础上提出新的诊断MPLC的标准,并两次进行了对诊断标准的修改更新,在保留了M&M标准的基础上,补充和完善了分子生物学方面的检测,进一步提出了更为详细的评估方案,并将mMPLC不同原发灶出现间隔时间修改至4年[3-5]。
1.3 国际肺癌研究协会(international association for the study of lung cancer,IASLC)标准
IASLC于2016年就MPLC的诊断提出了更进一步的建议:综合组织学评估在鉴别MPLC与肺癌的肺内转移时可作为病理学标准的可靠途径,比较基因组杂交(comparative genomic hybridization,CGH)可作为取得同一克隆起源的唯一分子生物学证据,其他如驱动基因突变、临床表现及影像学提示,则只能起到辅助的作用[6]。因此在诊断MPLC时应结合分子证据、影像学提示、细胞形态结构等进一步分析。
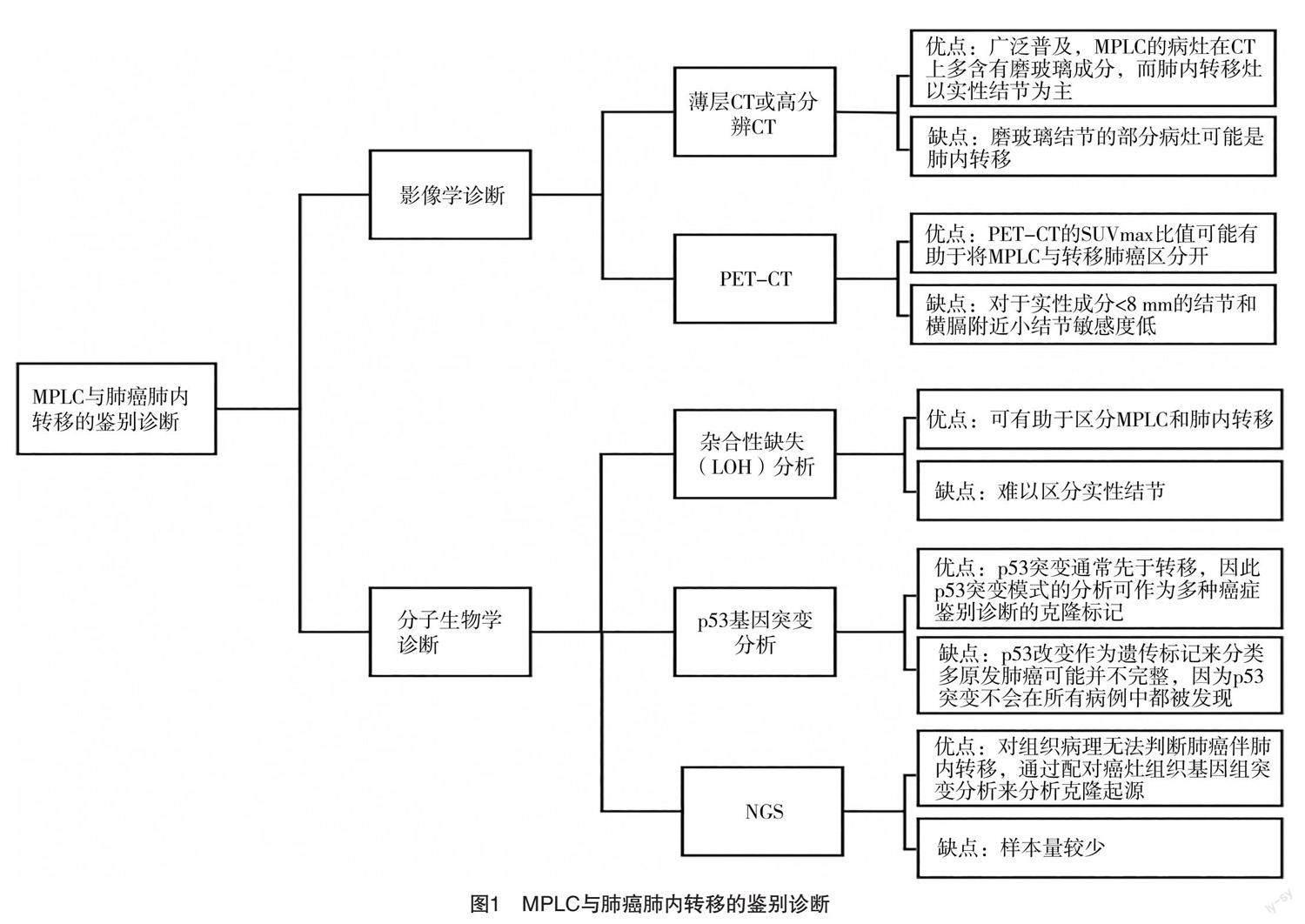
2 MPLC与肺癌肺内转移的鉴别诊断
2.1 影像学诊断
薄层CT或高分辨CT是诊断过程中不可或缺的辅助检查。MPLC的病灶在CT观察时多是含有磨玻璃成分的结节,而肺癌的肺内转移病灶则多是表现为实性成分,影像上,磨玻璃或实性成分是鉴别MPLC与肺癌肺内转移的一个重要表现[7]。但需要特别提醒的是部分表现为磨玻璃结节的病灶也可能是肺癌的肺内转移。在对两例多病灶肺腺癌的研究中,CT影像均呈现为磨玻璃结节,但可发现不同病灶拥有相同的起源,并有证据支持是肺内转移[8]。正电子发射计算机体层显像仪/X射线计算机体层摄影(positron emission computed tomography/X-ray computed tomography,PET/CT)也可作为鉴别MPLC与肺癌肺内转移的一个辅助措施。Dijkman等[9]提出利用标准摄取值(SUV)诊断sMPLC,共搜集37例患者资料,研究结果显示sMPLC患者第二原发灶的SUV明显高于肺转移癌患者(两者SUV分别是58%、28%,P<0.001)。Suh等[10]研究出一种算法模型,在CT病变类型,CT病变形态,CT最大SUV(SUVmax)的差异及存在N2/3淋巴结转移或远处转移的基础上,结合临床及影像数据,建立了具有四个连续决策步骤的新算法用于辅助诊断。研究显示该模型在Suh等试验的总病例数中可完成鉴别的病例数达到93.7%,在此基础上,诊断结果准确度仍有88.9%。Liu等[11]通过比较每个肿瘤在PET-CT的SUVmax比值,指出其可能有助于将MPLC与肺转移区分开。另外,需要注意的是,PET-CT对于实性成分<8 mm的结节和横膈附近小结节的敏感度较低,仅作为鉴别诊断时的一个参考因素[12]。有研究显示,筛查PET-CT和/或头颅增强MRI对多发纯磨玻璃结节(pure ground-grass nodule,pGGN)患者无显著增益[13]。
2.2 分子生物学诊断
2.2.1 杂合性缺失(loss of heterozygosity,LOH)分析 LOH是指一个多态位点的生殖系杂合性转变为体细胞纯合性,表示等位基因的缺失[1]。有研究使用由六颗微卫星(D7S1824、D15S822、D2S1363、D10S1239、D6S1056和D22S689)分析的基因组DNA和PCR来鉴定来自12例患者的不一致等位基因变异,结果认为有助于区分MPLC和肺内转移[14]。
2.2.2 p53基因突变分析 转移性结节是由高度选择性和进展的细胞产生的,它们更具侵袭性和高度转移性。它们包含了基因的改变,包括p53基因的突变,这是维持在进展过程中获得的恶性表型所必需的。p53基因突变通常先于转移,因此p53基因突变模式的分析可作为多种癌症鉴别诊断的克隆标记。Matsuzoe等[15]利用p53基因的基因改变作为MPLC和单个伴有肺内转移的肺癌的鉴别标志物。861例接受肺切除术的原发性肺癌患者中有20例被选为研究对象,结果证明一部分的肺癌可能通过p53基因突变得以区分MPLC和肺内转移。但需要注意的是,使用p53基因突变作为遗传标记来分类MPLC可能并不完整,因为p53基因突变不会在所有病例中都被发现。
2.2.3 二代测序(next-generation sequencing,
NGS) NGS具有通量高、速度快、样本量少、敏感度高等优点[16],是近几年来最有价值的分子诊断技术之一。NGS在通过检测基因突变的基础上来分析组织病理学难以评估的活检标本是否有共同的起源。在鉴别多病灶肺癌是否为MPLC时,学者通过NGS检测每个病灶的基因突变,发现原位癌、微浸润或贴壁型肺腺癌的组织学类型相似,驱动突变的仍是不同主干,因此认为该类多病灶肺癌为MPLC[7]。Zheng等[17]采纳了19例多处病变非小细胞肺癌患者,利用NGS对患者的组织标本进行了基因突变检测,包括EGFR、KRAS、BRAF和NRAS,发现关键驱动突变可帮助鉴别MPLC和肺癌肺内转移。
综上所述,CT可较早发现肺内多发结节,MPLC的原发病灶在CT影像上多表现为磨玻璃成分为主的结节,而肺癌的肺内转移在影像上则表现为以实性成分结节为主,但不排除肺内转移也有部分可表现为磨玻璃结节。PET-CT的SUVmax比值可能有助于将MPLC与肺转移癌区分开,但对于实性成分<8 mm的结节和横膈附近小结节的敏感度较低。LOH及p53基因突变分析可辅助鉴别诊断MPLC及肺内转移,但仍存在其局限性,难以区分实性结节,且使用p53基因突变作为遗传标记来分类MPLC可能并不完整,因为p53基因突变不会在所有病例中都被发现。NGS可以作为传统病理诊断有益的补充,通过对病变组织基因组突变进行配对来分析起源,通过判断是否存在多个相同突变的基因诊断是否是肺癌的肺内转移,对传统组织病理手段无法判断是否为MPLC亦或是肺癌肺内转移时起重要辅助作用。因此,应通过影像学提示、病理特征、分子生物特征等方式综合鉴别诊断MPLC和肺癌的肺内转移。尽管鉴别困难,但由于这两种类型肺癌的长期生存率明显不同,区分MPLC和肺内转移在临床中仍然十分重要。肺内转移,尤其是多发性转移癌,预后极差,不宜行外科手术切除,而同期MPLC术后5年生存率则可达75.8%[18]。因此,在临床中正确诊断MPLC是合理治疗的基础和关键。见图1。
3 MPLC的外科手术方式
2013年ACCP提出應优先将多个以磨玻璃成分为主疑似肺癌的病灶考虑为MPLC,且治疗方式应以手术为主[5]。我国对于MPLC的诊疗,目前仍无明确的指南,临床上普遍接受MPLC以外科手术治疗为主。关于MPLC手术方式(全肺切除、肺叶切除、肺段切除、楔形切除)的选择目前仍存在争议,治疗MPLC的手术标准仍在研究中。在对mMPLC患者的研究中,有学者认为应以单侧乃至双侧肺叶切除作为第二原发灶的手术方式,而非优先考虑肺段或楔形切除。但也有研究认为应以局部切除的手术方式为主。在为肺功能较差的患者选择手术方式时,因为肺叶局部切除术和肺叶切除术后总生存率并无明显不同,即使选择肺叶局部切除作为手术方式可能导致术后复发率高于肺叶切除,但肺叶局部切除仍然是综合考虑下可选择的手术方案,且局部切除能为患者术后保留更多的肺功能,在已经切除第一原发灶所在肺叶的情况下,这一手术方案不仅改善患者术后生活质量,同时降低了术后并发症及术后死亡率[19]。由于sMPLC患者的心肺功能较差,在临床手术方案决策中常选择有限切除(肺段切除术、亚肺叶切除术)。有研究选取了26例接受手术治疗的sMPLC患者,发现选择有限切除术后的患者的生存质量较行全肺切除术后的患者的生存质量更好[20]。
3.1 sMPLC手术治疗
如果sMPLC病灶位于同一肺叶,可优先选择给予肺叶切除术[21]。如果sMPLC患者的病灶位于同侧不同肺叶或双侧肺,有研究认为应对主病灶行解剖性切除后以局部切除的方式处理次要病灶[22-23],若各处病灶都较小可都行楔形切除。Qu等[24]认为对于≥3个病变的同时性多原发性肺腺癌,一期切除可能是安全可行的,手术操作尽量以亚肺叶切除为主,可产生满意的预后。也有研究者提出分期手术治疗sMPLC的策略,将sMPLC作为单独的原发性肺癌进行治疗,若次要病灶位于主病灶的对侧肺,且临床考虑为恶性程度较低,可将主要病灶切除后,定期密切随访次要病灶,若次要病灶出现新进展,再进行手术治疗,结果证明,sMPLC的手术结果与作为单独的原发性肺癌进行治疗的手术结果一致且可接受,肿瘤大小是手术干预后sMPLC患者的唯一独立预后因素[25]。有研究认为对于sMPLC患者,建议对至少一个病变(如果技术上可行)采用肺保留切除术(楔形切除或节段切除术)[26]。大多数研究没有显示两次都行解剖切除相较于一次采取部分切除对短期或长期生存有任何差异。只有在不担心术后肺储备的情况下,才应以肺叶切除术的形式进行肺解剖性切除术,且应避免进行全肺切除术,特别是对于双侧同步病变,除非有绝对必要。Yu等[25]统计了97例sMPLC患者术后生存率,发现行肺叶切除术和亚肺叶切除术的患者的5年生存率没有明显差异,并且研究结果没有发现扩大切除比肺叶切除术有更好的预后,因此认为有限切除并不是影响生存的重要预后因素。
3.2 mMPLC手术治疗
对于mMPLC,首选的治疗方式仍然是手术,研究显示第二次手术并没有显著增加术后并发症和围手术期死亡的风险,术后5年总体生存率为50%~94%[27-28]。肿瘤直径大小和患者身体情况应作为二次手术方式选择的参考,若第二原发灶肿瘤直径小于1 cm可选择亚肺叶切除,直径1~2 cm的第二肿瘤可依据患者心肺储备功能决定手术方式,研究显示选择肺叶或亚肺叶切除的效果无显著差异,当肿瘤直径大于2 cm则推荐行肺叶切除术[29]。有研究结果表明,在接受手术切除的143例mMPLC患者中,对于肿瘤分期为I期的,肺叶切除术比亚肺叶切除术有更好的生存率,尽管差异并不十分显著[30]。mMPLC患者如果已是全肺切除术后,对其进行二次手术时应更严谨地做好心肺储备的评估,术前超声心动图排除肺动脉高压和右心衰竭,通过术前测定肺功能来预计术后肺一氧化碳弥散量和第1秒用力呼气容积可超过40%,心肺运动功能试验最大摄氧量(VO2max)>10 mL/(kg·min),可考虑外科手术方式,但仍推荐行较为保留肺功能的亚肺叶切除;对于mMPLC患者已行全肺切除后,特别是切除右全肺后需行对侧肺叶切除,或者存在呼吸衰竭风险者,则不推荐行外科手术治疗[29]。
值得注意的是,有学者指出对于气道播散(STAS)的早期肺癌,肺叶切除术预后效果优于亚肺叶切除术,Eguchi等[31]调查了1 497例接受肺叶切除术(n=970)或亚肺叶切除术(n=527)的T1N0M0肺腺癌患者,结果发现在T1期肺腺癌合并STAS的患者中,肺叶切除术的预后优于亚肺叶切除术。因此在治疗T1期肺腺癌合并气道播散的患者时,应尽可能选择解剖性肺叶切除。
综上所述,MPLC首先还是考虑手术治疗为主,如非必要,尽量避免全肺切除,以肺叶切除术和亚肺叶切除术为首选。对于sMPLC,可选择肺叶切除位于同一肺叶内的多处病灶;位于同侧不同肺叶或双侧肺的病变,较合理的手术方式应是解剖性切除主病灶后再以局部切除的方式处理次要病灶,多处较小病灶可都行楔形切除。也有研究表明,有限切除并不是生存的一个重要预后因素,肺叶切除术和亚肺叶切除术无明显差异。对于mMPLC,若第二原发灶肿瘤直径<1 cm可选择亚肺叶切除病灶,直径1~2 cm的第二原发灶肿瘤行肺叶或亚肺叶切除效果无明显差异,临床中可依据患者心肺功能做决策,肿瘤直径>2 cm建议行肺叶切除术,若患者先前已接受全肺切除术,则需更加谨慎评估患者心肺储备,决定是否可行手术治疗及确定手术范围。需要注意的是,T1期肺腺癌合并STAS的患者中,肺叶切除术预后优于亚肺叶切除术。因此在对这一类型患者进行手术方式选择时,应尽可能以解剖性肺叶切除为主。见图2。
4 MPLC的非手术治疗
4.1 立体定向放射治疗(stereotactic radiotherapy,SRT)
是早期非小细胞肺癌患者无法行外科手术治疗时有效的治疗方法[32],有研究表明在Ⅰ期非小细胞肺癌患者中行SRT和外科手术治疗的总生存期无显著差异[33]。目前作为标准治疗方案用于不适合进行外科手术的患者。
4.2 免疫治疗
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)可作为主要的治疗方法用于无驱动基因突变的晚期非小细胞肺癌患者[34]。然而也有研究指出,由于不同病灶基因突变和免疫微环境异质性的存在,免疫新辅助治疗应用于MPLC可能不是最佳选择[35]。
4.3 靶向治疗
具有驅动基因突变的肺癌患者可应用靶向治疗[36]。亚洲患者中EGFR突变率为45.8%~76.0%,有研究表明MPLC驱动基因突变的发生率较高,这表示靶向治疗可以有效应用于MPLC患者中[37]。但有小样本研究报道,MPLC最常见的EGFR突变不一致率为92.1%[36],加之MPLC患者往往不能通过一次手术获取所有病灶的分子病理,因此单一靶向药物理论上不能兼顾所有病灶的治疗[12]。
5 小结和展望
综上所述,由于薄层CT及高分辨CT的广泛应用,越来越多的MPLC被发现,但MPLC与肺内转移的鉴别依旧是临床上的重点及难点,本文概述了临床上常用的鉴别手段,包括影像学诊断、分子生物学诊断(LOH、p53基因突变分析、NGS)。对于MPLC,目前临床普遍认为以手术治疗为首选,但手术范围仍存在争议,本文对MPLC不同情况下的手术范围的选择进行了概述。而对于非手术治疗的MPLC患者,可选择SRT、免疫、靶向等治疗方法。值得注意的是,对于合并STAS的MPLC患者,手术方式可能有所不同,这一发现值得临床医生重视并进一步研究。
参考文献
[1]肖建峰,余红梅,张勇.多原发性肺癌诊断与治疗的研究进展[J].山东医药,2021,61(17):104-107.
[2] MARTINI N,MELAMED M R.Multiple primary lung cancers[J].
J Thorac Cardiovasc Surg,1975,70(4):606-612.
[3] DETTERBECK F C,JONES D R,KERNSTINE K H,et al.
Lung cancer. Special treatment issues[J].Chest,2003,123(1 Suppl):244S-258S.
[4] SHEN K R,MEYERS B F,LARNER J M,et al.Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)[J].Chest,2007,132(3 Suppl):290S-305S.
[5] KOZOWER B D,LARNER J M,DETTERBECK F C,et al.
Special treatment issues in non-small cell lung cancer: diagnosis and management of lung cancer, 3rd ed: American college of chest physicians evidence-based clinical practice guidelines[J/OL].Chest,2013,143(5 Suppl):e369S-e399S.https://pubmed.ncbi.nlm.nih.gov/23649447/.
[6] DETTERBECK F C,FRANKLIN W A,NICHOLSON A G,et al.
The IASLC lung cancer staging project: background data and proposed criteria to distinguish separate primary lung cancers from metastatic foci in patients with two lung tumors in the forthcoming eighth edition of the TNM classification for lung cancer[J].J Thorac Oncol,2016,11(5):651-665.
[7]余业锋,杨林.多原发性肺癌的诊治新进展[J].临床肺科杂志,2021,26(5):796-800.
[8] LI R,LI X,XUE R,et al.Early metastasis detected in patients with multifocal pulmonary ground-glass opacities (GGOs)[J].Thorax,2018,73(3):290-292.
[9] DIJKMAN B G,SCHUURBIERS O C,VRIENS D,et al.The role of 18F-FDG PET in the differentiation between lung metastases and synchronous second primary lung tumours[J].Eur J Nucl Med Mol Imaging,2010,37(11):2037-2047.
[10] SUH Y J,LEE H J,SUNG P,et al.A novel algorithm to differentiate between multiple primary lung cancers and intrapulmonary metastasis in multiple lung cancers with multiple pulmonary sites of involvement[J].J Thorac Oncol,2020,15(2):203-215.
[11] LIU Y,TANG Y,XUE Z,et al.SUVmax ratio on PET/CT may differentiate between lung metastases and synchronous multiple primary lung cancer[J].Acad Radiol,2020,27(5):618-623.
[12]鐘华,姚烽,陈群慧,等.肺部多发结节的诊断和治疗[J].中华肿瘤杂志,2023,45(6):455-463.
[13] LI M,WAN Y,ZHANG L,et al.Synchronous multiple lung cancers presenting as multifocal pure ground glass nodules: are whole-body positron emission tomography/computed tomography and brain enhanced magnetic resonance imaging necessary?[J] Transl Lung Cancer Res,2019,8(5):649-657.
[14] SHEN C,WANG X,TIAN L,et al."Different trend" in multiple primary lung cancer and intrapulmonary metastasis[J].Eur J Med Res,2015,20(1):17.
[15] MATSUZOE D,HIDESHIMA T,OHSHIMA K,et al.
Discrimination of double primary lung cancer from intrapulmonary metastasis by p53 gene mutation[J].Br J Cancer,1999,79(9-10):1549-1552.
[16] DEL VECCHIO F,MASTROIACO V,DI MARCO A,et al.
Next-generation sequencing: recent applications to the analysis of colorectal cancer[J].J Transl Med,2017,15(1):246.
[17] ZHENG R,SHEN Q,MARDEKIAN S,et al.Molecular profiling of key driver genes improves staging accuracy in multifocal non-small cell lung cancer[J/OL].J Thorac Cardiovasc Surg,2020,160(2):e71-e79.https://pubmed.ncbi.nlm.nih.gov/32007245/.
[18] MUN M, KOHNO T.Single-stage surgical treatment of synchronous bilateral multiple lung cancers[J].Ann Thorac Surg,2007,83(3):1146-1151.
[19]譚黎杰,尹俊.多原发肺癌的诊疗[J].中国肺癌杂志,2018,21(3):185-189.
[20] KOCATURK C I,GUNLUOGLU M Z,CANSEVER L,et al.Survival and prognostic factors in surgically resected synchronous multiple primary lung cancers[J].Eur J Cardiothorac Surg,2011,39(2):160-166.
[21]韩连奎,高树庚,谭锋维,等.同时性多原发肺癌的诊治体会及处理策略新进展[J].中国肺癌杂志,2018,21(3):180-184.
[22] ZHANG Z,GAO S,MAO Y,et al.Surgical outcomes of synchronous multiple primary non-small cell lung cancers[J].Sci Rep,2016,6:23252.
[23] DAI L,YANG H L,YAN W P,et al.The equivalent efficacy of multiple operations for multiple primary lung cancer and a single operation for single primary lung cancer[J].J Thorac Dis,2016,8(5):855-861.
[24] QU R,TU D,PING W,et al.Surgical outcomes of one-stage resection for synchronous multiple primary lung adenocarcinomas with no less than three lesions[J].J Cardiothorac Surg,2021,16(1):265.
[25] YU Y C,HSU P K,YEH Y C, et al.Surgical results of synchronous multiple primary lung cancers: similar to the stage-matched solitary primary lung cancers?[J]Ann Thorac Surg,2013,96(6):1966-1974.
[26] TOUFEKTZIAN L,ATTIA R,VERES L.Does the extent of resection affect survival in patients with synchronous multiple primary lung cancers undergoing curative surgery?[J]Interact Cardiovasc Thorac Surg,2014,19(6):1059-1064.
[27] ZHOU H,KANG X,DAI L,et al.Efficacy of repeated surgery is superior to that of non-surgery for recurrent/second primary lung cancer after initial operation for primary lung cancer[J].Thorac Cancer,2018,9(8):1062-1068.
[28] MURANISHI Y,SONOBE M,HAMAJI M,et al.Surgery for metachronous second primary lung cancer versus surgery for primary lung cancer: a propensity score-matched comparison of postoperative complications and survival outcomes[J].Interact Cardiovasc Thorac Surg,2018,26(4):631-637.
[29]戴洁,姜格宁.肺部多发结节的诊断、分期和治疗现状[J].中华胸心血管外科杂志,2020,36(9):562-568.
[30] YANG J,LIU M,FAN J,et al.Surgical treatment of metachronous second primary lung cancer[J].Ann Thorac Surg,2014,98(4):1192-1198.
[31] EGUCHI T,KAMEDA K,LU S,et al.Lobectomy is associated with better outcomes than sublobar resection in spread through air spaces (STAS)-positive T1 lung adenocarcinoma: a propensity score-matched analysis[J].J Thorac Oncol,2019,14(1):87-98.
[32] CHANG J Y,LIU Y H,ZHU Z,et al.Stereotactic ablative radiotherapy: a potentially curable approach to early stage multiple primary lung cancer[J].Cancer,2013,119(18):3402-3410.
[33] VARLOTTO J,FAKIRIS A,FLICKINGER J,et al.Matched-pair and propensity score comparisons of outcomes of patients with clinical stage Ⅰ non-small cell lung cancer treated with resection or stereotactic radiosurgery[J].Cancer,2013,119(15):2683-2691.
[34] WANG M,HERBST R S,BOSHOFF C.Toward personalized treatment approaches for non-small-cell lung cancer[J].Nat Med,2021,27(8):1345-1356.
[35] ZHANG C,YIN K,LIU S Y,et al.Multiomics analysis reveals a distinct response mechanism in multiple primary lung adenocarcinoma after neoadjuvant immunotherapy[J/OL].
J Immunother Cancer,2021,9(4):e002312.https://pubmed.ncbi.nlm.nih.gov/33820821/.
[36]洪子強,金大成,白向豆,等.多原发肺癌诊断与治疗的最新研究进展[J].中国全科医学,2022,25(27):3435-3442.
[37] LIU M,HE W X,SONG N,et al.Discrepancy of epidermal growth factor receptor mutation in lung adenocarcinoma presenting as multiple ground-glass opacities[J].Eur J Cardiothorac Surg,2016,50(5):909-913.
(收稿日期:2023-11-25) (本文编辑:陈韵)

